Recientes estudios han sugerido que los niños con múltiples exposiciones anestésicas tienen un mayor riesgo de deterioro neurocognitivo.
ObjetivoAnalizar los efectos neurodegenerativos a nivel histológico, cognitivo y del comportamiento posterior a exposiciones repetidas al sevoflurano a dosis inferiores a la concentración alveolar minina en ratas neonatales.
MétodosSe expusieron ratas Wistar de 5-7días durante una hora a sevoflurano al 2,3%; una, 2 o 3 veces con intervalos de 24h entre exposición. Posteriormente se determinó el efecto del anestésico en la neuroapoptosis mediante marcación inmunohistoquímica con caspasa-3, Fox-3 y CD95. El aprendizaje fue evaluado con el laberinto acuático de Morris, y el comportamiento relacionado a ansiedad, con laberinto elevado en cruz.
ResultadosEn todos los grupos experimentales se evidenció apoptosis neuronal medida por caspasa-3, siendo más marcada en el grupo de sevoflurano y en grupos de primera exposición. En laberinto elevado en cruz se encontró un tiempo total de permanencia en brazos abiertos (t test p=0,113) estadísticamente no significativo con respecto al grupo control. En el laberinto acuático de Morris se encontró diferencia estadísticamente significativa (t test p<0,001) cuando se compara el tiempo de realización de la prueba con respecto al grupo control.
ConclusionesLa exposición a sevoflurano en ratas neonatales durante periodos cortos y repetidos induce muerte neuronal posiblemente por apoptosis a través de la activación de caspasa-3. Como consecuencia produce déficit de aprendizaje, principalmente en la adquisición de memoria espacial.
Recent studies have suggested that children who are exposed multiple times to anesthesia have an increased risk of neurocognitive impairment.
ObjectiveTo analyze at a histological level the neurodegenerative, cognitive and behavioral effects following repeated exposures to sevoflurane at doses below the minimum alveolar concentration in neonatal rats.
MethodsWistar rats were exposed to 2.3% sevoflurane, one, two or three times for 1 h, in the course of 5–7 days, with 24-h intervals between each exposure. The neuroapoptotic effect of the anesthetic agent was subsequently determined using immunohistochemical labeling with caspase-3, Fox-3 and CD95. Learning was assessed with the Morris Water Maze, and the anxiety-related behavior was assessed with the Elevated Plus-Maze.
ResultsEvery experimental group showed evidence of neuronal apoptosis measured withcaspase-3; however, the apoptosis was more evident in the sevoflurane group and in the first exposure groups. The total time spent in the open arms of the Elevated Plus-Maze (t test p = 0.113) was not statistically significant as compared to the control group. When comparing the test time vs. the control group, the Morris Water Maze showed a statistically significant difference (t test p < 0.001).
ConclusionsSevoflurane exposure of neonate rats for short and repeated time intervals induces neuronal death probably due to apoptosis, through caspase-3 activation. This results in learning deficit, particularly in terms of spatial memory acquisition.
Los numerosos avances en procedimientos quirúrgicos, diagnósticos y terapéuticos han abierto en los niños nuevas posibilidades de repetidas intervenciones que requieren para su realización la administración de anestesia general1. En consecuencia, fetos y niños cuyas etapas del desarrollo neuronal se inicia en el tercer trimestre de gestación y continúa hasta los 2 a 3años2 se exponen en varias y repetidas oportunidades a diferentes anestésicos en un periodo muy vulnerable.
Dentro de los anestésicos inhalados el sevoflurano ha sido el más frecuentemente usado en la población pediátrica. Debido a sus propiedades, como menor pungencia y bajo coeficiente de partición sangre-gas, permite realizar una inducción anestésica inhalatoria rápida, sin necesidad de un acceso venoso de entrada, en el mantenimiento conserva la ventilación espontánea del paciente durante el acto anestésico y permite una rápida recuperación, características que son muy llamativas en dicha población1,3.
Esta técnica ha permitido realizar múltiples procedimientos en pacientes pediátricos para cirugía general, neurocirugía, urología, oftalmología, gastroenterología, odontología, cirugía ortopédica, cirugía cardiovascular, toma de imágenes diagnósticas etc.
Diferentes estudios han sugerido que la exposición a diferentes anestésicos en etapas tempranas del neurodesarrollo puede ser un factor de riesgo para la aparición de alteraciones en el aprendizaje, en el comportamiento4–7 y en la inducción de neuroapoptosis8. Adicionalmente, se ha evidenciado que estos efectos se incrementan con tiempos prolongados y acumulados de exposición6,9.
Concretamente, se ha encontrado que los niños que tienen múltiples exposiciones anestésicas a temprana edad tienen mayor riesgo de generar trastornos del aprendizaje5,6,10. Estos datos sugieren que los niños expuestos a anestésicos en etapas de neurodesarrollo pueden no lograr todo su potencial cognitivo en comparación con niños no expuestos a anestesia y cirugía, convirtiéndose recientemente estos hallazgos en interés de investigación en salud pública.
Teniendo en cuenta que en la práctica clínica actual es frecuente la exposición corta y el uso de dosis sub-CAM para anestesia general balanceada, este estudio pretende analizar la relación entre exposiciones repetidas a sevoflurano a dosis sub-CAM y la aparición de cambios neurodegenerativos a nivel histopatológico, cognitivo y del comportamiento, y ello mediante el uso de técnicas de inmunohistoquímica, detección de caspasa-3, Fox 3 y CD95 en tejido neuronal y aplicación de pruebas del comportamiento en ratas neonatales expuestas a este anestésico.
Materiales y métodosTratamiento animal y anestesiaEste fue un estudio experimental prospectivo controlado con protocolos basados en procesos operacionales estandarizados. Se utilizaron ratas Wistar de día5 a 7 postnatal (5P-7P) (Charles Rivers, EE.UU.), y el tamaño de muestra se calculó utilizando la ecuación de Snedecor y Cochran, resultando un n=30 ratas para cada grupo. Siguiendo las recomendaciones 3R de Russell y Burch y las recomendaciones del Internacional Laboratory Animal Research (ILAR) se redujo el número a n=25 para el grupo expuestos y a n=11 para los grupos controles. El protocolo fue aprobado por los Comités de Ética del Hospital Universitario La Samaritana y La Universidad de La Sabana. Los animales se alojaron en el Bioterio de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional y recibieron agua y comida ad líbitum.
Las ratas neonatales recibieron distintas exposiciones de una hora con sevoflurano al 2,3% (aproximadamente 0,7 concentración alveolar mínima), más una concentración de oxígeno al 40%, mientras que los grupos control recibieron únicamente oxígeno al 40%. Las concentraciones de oxígeno y de sevoflurano se midieron continuamente mediante analizador de gases (GE Datex-Ohmeda, Tewksbury, MA, EE.UU.). La temperatura de la cámara de anestesia se mantuvo mediante cobija térmica (37±0,5°C). Para todos los modelos animales se instauró monitorización de saturación, frecuencia cardiaca y frecuencia respiratoria con el equipo de vigilancia de signos vitales (Milti-parameter patient monitor Model TR900A, XuzhounTianrong Medical & Communication Equipment Co., Ltd, China) mediante un pulsioxímetro neonatal sobre el tórax del modelo animal y capnógrafo nasal.
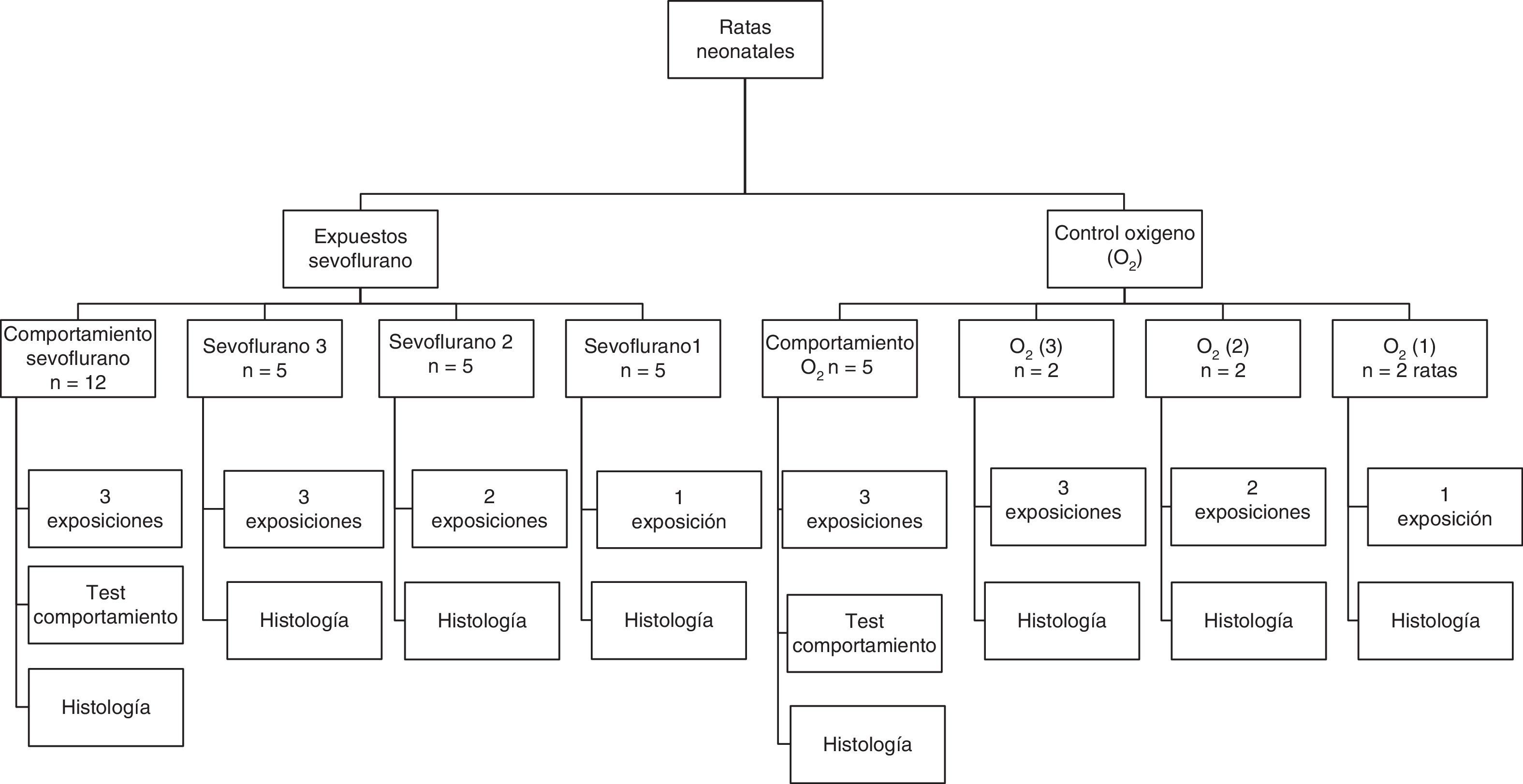
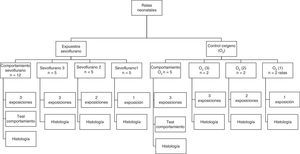
La distribución y el número de animales de los grupos experimentales para las distintas exposiciones se muestran en la figura 1. Grupos expuestos: las ratas se distribuyeron en 3 grupos, con una, 2 o 3 exposiciones a sevoflurano con intervalos de 24h entre exposición. Grupos controles: fueron distribuidos de igual manera pero se expusieron a oxígeno al 40%. Al finalizar los animales fueron sacrificados para estudios inmunohistoquímicos con los diferentes marcadores.
Flujograma de grupos expuestos y controles. Se detalla el número (n) de animales dispuestos para cada experimento. Los grupos llamados Sevoflurano fueron ratas expuestas a sevoflurano 2,3% por una hora. Los grupos llamados O2 fueron ratas expuestas a oxígeno 40% por una hora.
Adicionalmente se conformaron grupos de comportamiento, que consistían en ratas que recibieron 3 secciones en el periodo neonatal de sevoflurano con sus respectivos controles y que fueron llevadas a pruebas de comportamiento en el día 60 posnatal (60P), cuando fueron sacrificadas para estudios inmunohistoquímicos.
Se determinó pH y presión parcial de oxígeno (PO2) y dióxido de carbono (PCO2), glucosa, hemoglobina, sodio, potasio, cloro y nitrógeno ureico en las ratas neonatales mediante muestras transcardiacas de sangre arterial. Al finalizar los ensayos se analizaron las muestras sanguíneas usando un analizador de gases en sangre (i-STAT Protable Clinical Analyzar; i-STAT Corp., East Windor, NJ, EE.UU.) con cartuchos CG8+ (Abbott Point of Care Inc., Abbott Park, IL, EE.UU.).
Histología e inmunohistoquímicaPosterior al sacrificio se disecaron los cerebros y se fijaron en paraformaldehído al 4% y luego se mantuvieron en formalina tamponada al 3,7% hasta su procesamiento inmunohistoquímico. Los cerebros se cortaron coronalmente y se incluyeron en parafina para coloración de hematoxilina-eosina de rutina y de inmunohistoquímica. Para esta última, las láminas se trataron para el desenmascaramiento de antígenos con buffer Tris-EDTA y se bloquearon sitios inespecíficos con albúmina sérica bovina al 10% en tris buffer salino por 2h a temperatura ambiente y se aplicaron anticuerpos primarios anti caspasa-3 en ratón 1:50 (Sigma), anti CD-95 en ratón 1:50 (Sigma) y anti-Fox-3 1:1000 (Sigma), con una incubacion por 8h a 4°C; como anticuerpo secundario se utilizó anti-IgG de ratón biotinilado, y finalmente el conjugado Streptavidin-HRP (Vector). Se hizo coloración de contraste con hematoxilina de Harris.
Se realizó análisis morfológico en los cortes de hematoxilina-eosina y se tomaron fotografías de los hallazgos importantes. Para la técnica de inmunohistoquímica se analizaron el hipocampo, la corteza prefrontal y el tálamo, ubicando 5 campos para cada una de las áreas en cada modelo animal experimental y control. Para la tabulación de la inmunotinción de cada uno de los marcadores (anti-caspasa-3, anti-CD95, anti-Fox-3) se utilizó una escala semicuantitativa en donde cero es negativo para tinción, 1 leve tinción, 2 moderada tinción y 3 severa tinción.
Pruebas de comportamientoSe realizaron pruebas de comportamiento en las ratas de 60P que habían recibido sevoflurano en su periodo neonatal, y en sus controles. Las funciones de memoria y aprendizaje fueron determinadas por el laberinto acuático de Morris, y el comportamiento social, por el laberinto elevado en cruz.
Laberinto acuático de MorrisEvalúa la memoria espacial mediante la colocación de una rata en una piscina (150cm de diámetro y 60cm de altura) con agua hasta una altura de 1,0cm arriba de la cima de una plataforma de 10cm de diámetro. Cada rata fue colocada en la piscina para la búsqueda de dicha plataforma durante 60-120s, realizando un entrenamiento una vez al día por 7días. Las distancias recorridas y el tiempo en localizar la plataforma se registraron mediante el sistema de videograbación continua, y los datos fueron analizados usando el software de detección de movimiento ANY-maze versión 4.84.
Laberinto elevado en CruzEs un dispositivo con 4 brazos distribuidos en forma de cruz; cada brazo mide 50×12cm y están elevados 50cm sobre el suelo. Dos de sus brazos (brazos cerrados [BC]), están colocados uno al frente del otro y tienen paredes laterales de 40cm de altura. Los otros dos brazos (brazos abiertos [BA]) son de iguales dimensiones y con igual orientación, pero carecen de paredes laterales. Con esta herramienta se evalúa la exploración de la rata en un nuevo ambiente que presenta 2 zonas diferentes: una potencialmente aversiva (BA) y otra segura (BC), basado en el miedo incondicionado que tiene los roedores a los espacios abiertos. Se calculó para cada rata la actividad exploratoria, midiendo los diferentes parámetros como el número de entradas en los brazos abiertos y cerrados, tiempo que permanecen en los brazos abiertos y cerrados, número total de entradas, que son índices de diferentes componentes como ansiedad y actividad motora. El porcentaje de tiempo que permanece en los brazos abiertos se usó como índice de ansiedad relacionada con el comportamiento. Igualmente todos los procedimientos fueron filmados y grabados en vídeo para su análisis en ANY-maze versión 4.84.
Análisis estadísticoSe describieron los datos según su naturaleza: variables cuantitativas en medias y desviaciones estándar, y variables cualitativas en frecuencias y porcentajes; se describieron tanto variables independientes como desenlace. Se evalúo la distribución de las variables cuantitativas mediante test no paramétrico de Kolmogorov-Smirnov, y según su resultado se decidió la realización de t test para muestras independientes (de contar con 2 grupos de muestras) o test ANOVA (para análisis de varios grupos con distribución normal a la vez); de ser necesario para inspeccionar el origen de la diferencia, se ejecutó análisis post hoc-test de Scheffe. Para análisis de variables cuantitativas sin distribución normal se recurrió al test no paramétrico de U Mann-Whitney. Para variables cualitativas, como nominales dicotómicas y el análisis de menos de 25 datos, se realizó test exacto de Fischer. Se consideraron diferencias estadísticamente significativas las que presentaran una p<0,05 para cada contraste de hipótesis. Para el análisis inmunohistoquímico se realizó un recuento semicuantitativo con grados leve, moderado y severo.
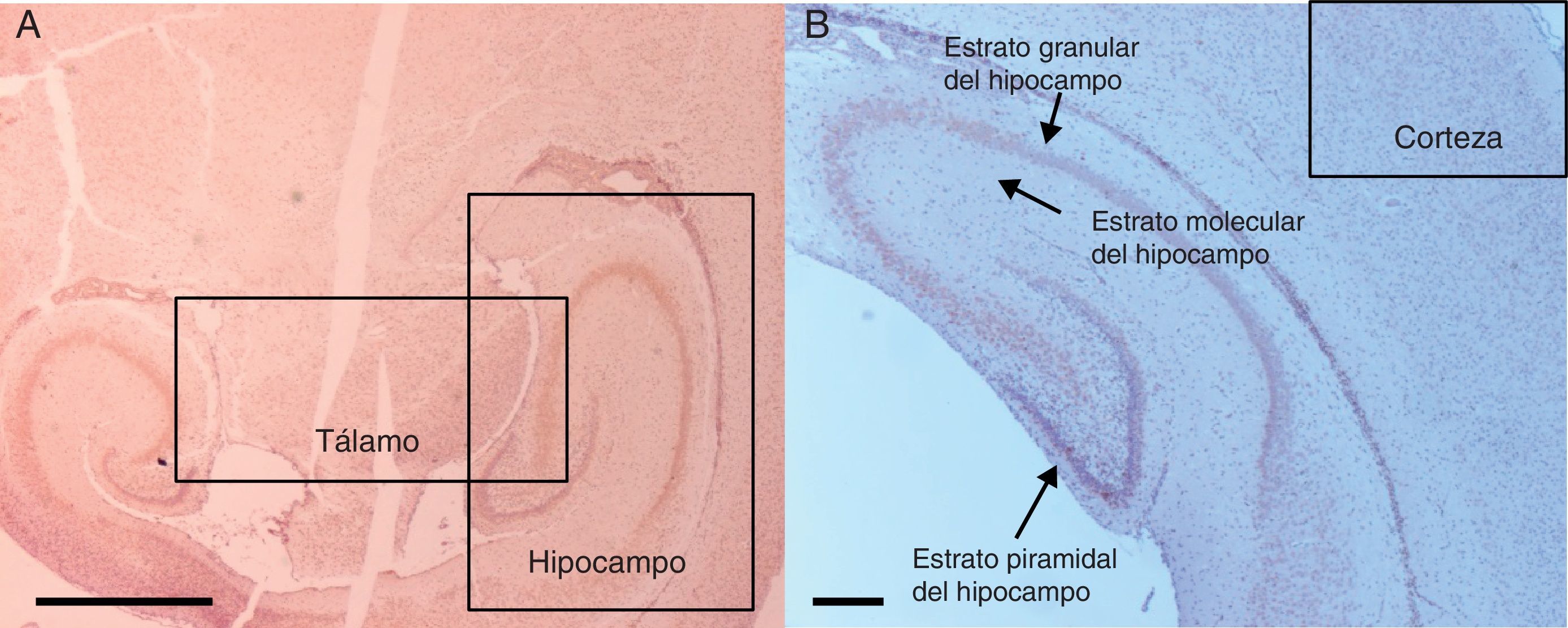
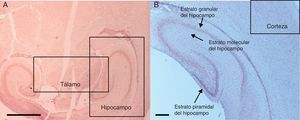
ResultadosInmunohistoquímica para caspasa-3Para el análisis de los tejidos se hizo énfasis en 3 áreas del cerebro: el hipocampo, la corteza prefrontal y el tálamo (fig. 2). Se ubicaron 5 campos en cada área. Se utilizó una escala semicuantitativa y los promedios se aproximaron al número entero.
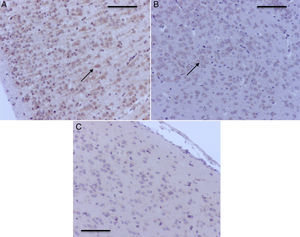
Microfotografías de histología de zonas encefálicas evaluadas en un cerebro de rata neonatal expuesto a sevoflurano. Se muestran las distintas áreas estudiadas. 2A) Tálamo e hipocampo, corte transversal. Barra escala 1mm. 2B) Corteza prefrontal y estratos del hipocampo, corte coronal. Barra escala 100μm. Las secciones se tiñeron para inmunoquímicamente revelar la activación de caspasa-3.
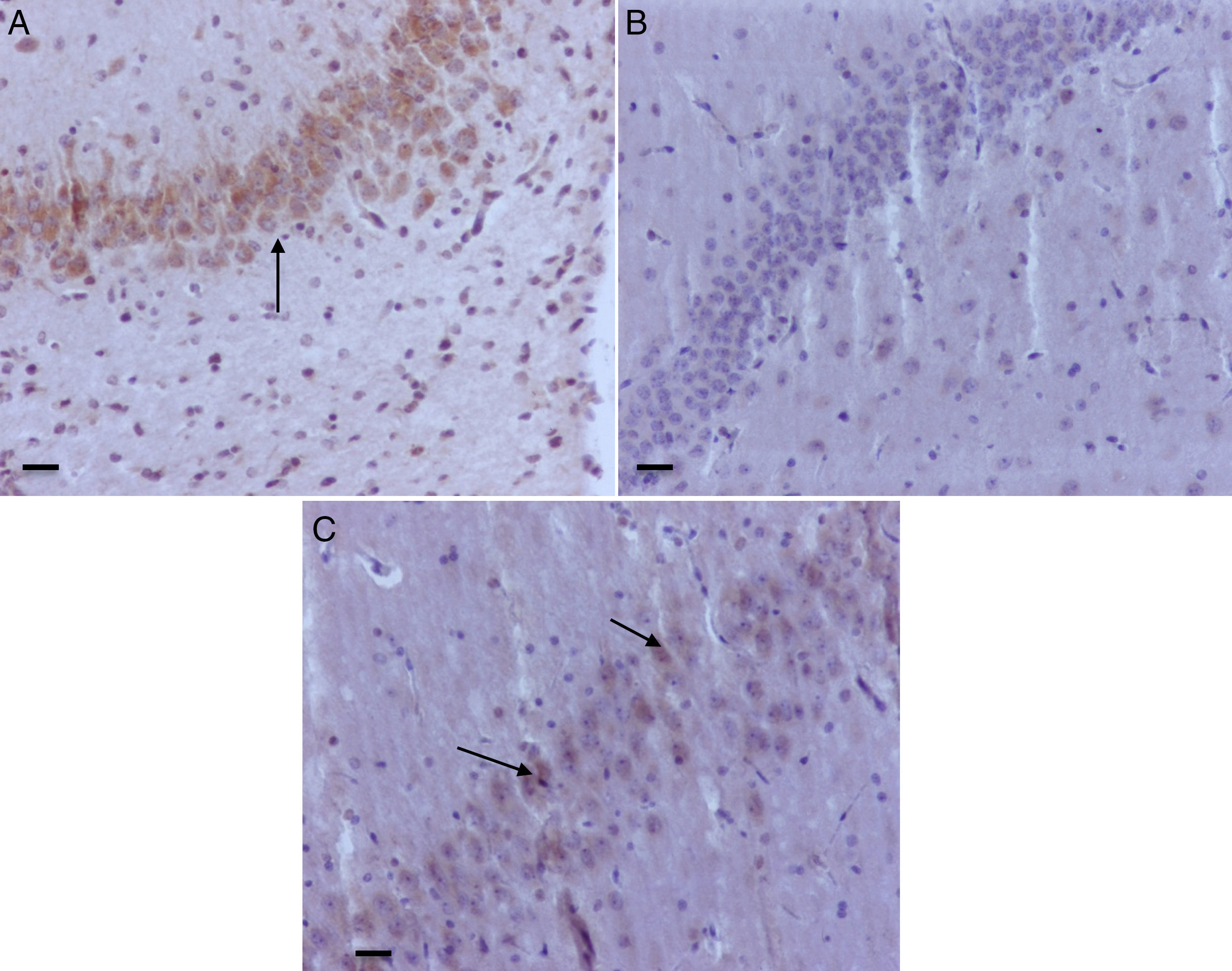
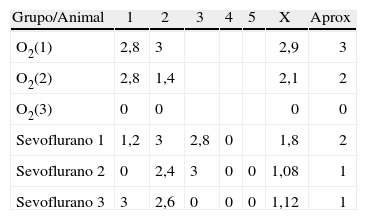
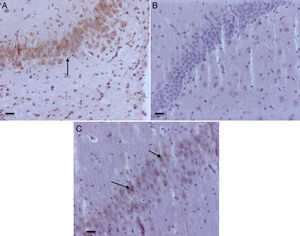
Como se observa en la tabla 1, en el hipocampo 2 de los grupos control, O2(1) y O2(2), tuvieron marcación positiva en intensidad severa y moderada, respectivamente, específicamente en los estratos granular y piramidal (fig. 3A), y el grupo control O2(3) no mostró marcación. Los grupos expuestos a sevofluorano fueron positivos en intensidad moderada para el grupo sevoflurano1, y leve para los grupos sevoflurano2 y sevoflurano3. En los grupos de comportamiento (que se evaluaron 2meses después de las exposiciones) se observó marcación negativa en el grupo de comportamiento oxígeno y marcación leve para comportamiento sevoflurano (fig. 3B y C).
Datos de inmunotinción en hipocampo por grupos. Se utilizó una escala semicuantitativa en la que 0 es negativo para tinción, 1 leve tinción, 2 moderada tinción y 3 severa tinción
| Grupo/Animal | 1 | 2 | 3 | 4 | 5 | X | Aprox |
| O2(1) | 2,8 | 3 | 2,9 | 3 | |||
| O2(2) | 2,8 | 1,4 | 2,1 | 2 | |||
| O2(3) | 0 | 0 | 0 | 0 | |||
| Sevoflurano 1 | 1,2 | 3 | 2,8 | 0 | 1,8 | 2 | |
| Sevoflurano 2 | 0 | 2,4 | 3 | 0 | 0 | 1,08 | 1 |
| Sevoflurano 3 | 3 | 2,6 | 0 | 0 | 0 | 1,12 | 1 |
| Comportamiento oxígeno | 0 | 0 | 0 | 0 | 0 | 0 | ||||||
| Comportamiento sevoflurano | 1,4 | 0 | 1,8 | 0 | 0 | 0,8 | 0 | 2 | 0 | 0,4 | 0,64 | 1 |
Aprox: aproximación a número entero; X: promedio.
Estratos granulares de hipocampo de diferentes grupos. A) Rata neonatal del grupo control O2; obsérvese la positividad del marcador anti-caspasa-3 (fecha). B) Rata adulta del grupo comportamiento-oxígeno, sin positividad para el marcador anti-caspasa-3 C) Rata adulta del grupo comportamiento-sevoflurano; presenta leve positividad para anti-caspasa-3 en el estrato granular (flechas). Barra escala 100μm.
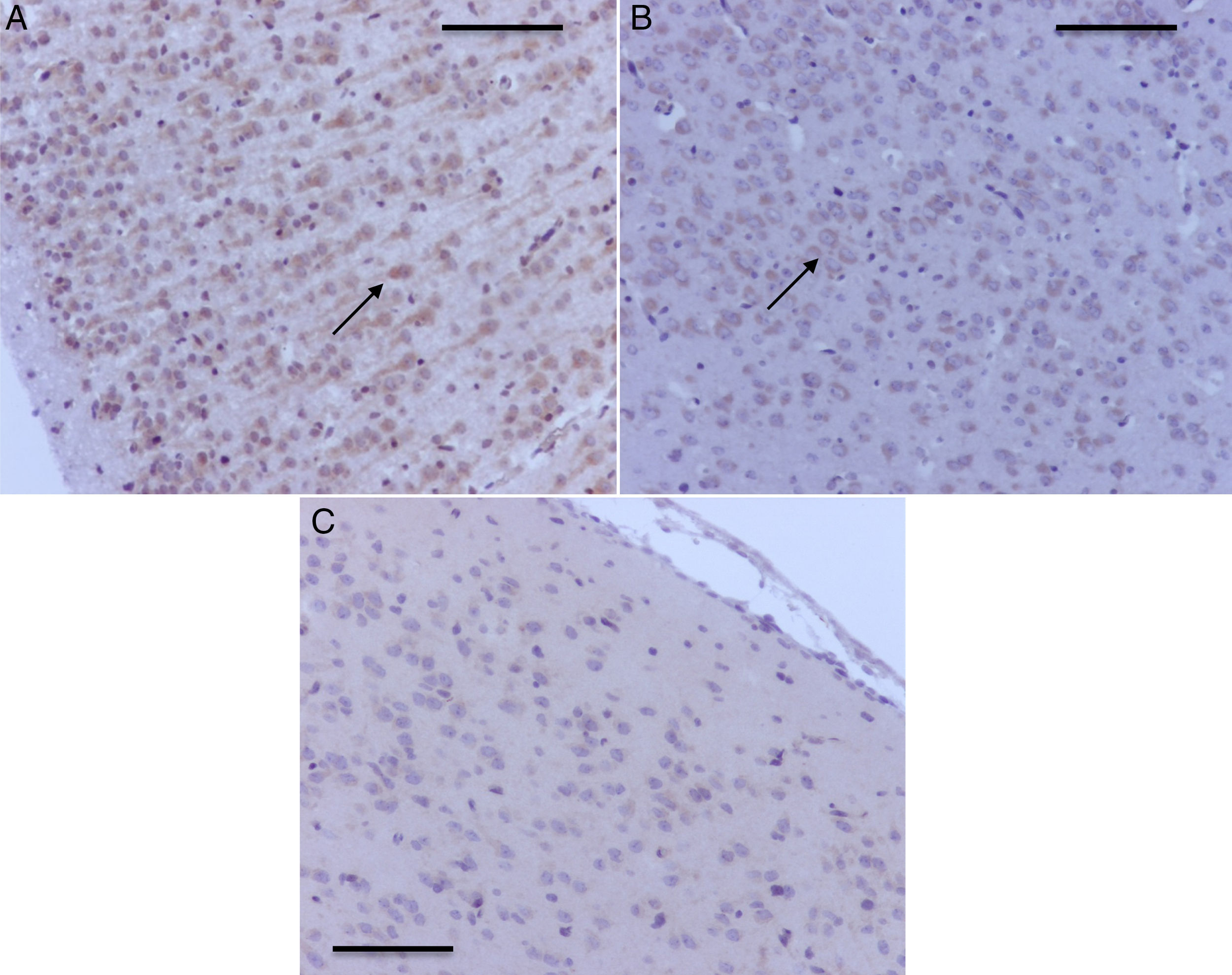
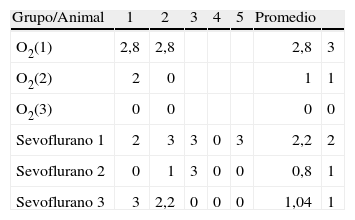
En la tabla 2 se verifica que en la corteza también hubo marcación positiva en los grupos O2(1) y O2(2) (fig. 4A). En los grupos expuestos hubo marcación positiva en intensidad moderada en sevoflurano1 y leve en sevoflurano2 y sevoflurano3 (fig. 4 B y C). En los grupos de comportamiento los resultados fueron iguales a los encontrados en el hipocampo: negativo para el comportamiento, las distancias recorridas y el tiempo en localizar la plataforma de oxígeno, y leve para el comportamiento sevoflurano.
Datos de inmunotinción en corteza prefrontal por grupos
| Grupo/Animal | 1 | 2 | 3 | 4 | 5 | Promedio | |
| O2(1) | 2,8 | 2,8 | 2,8 | 3 | |||
| O2(2) | 2 | 0 | 1 | 1 | |||
| O2(3) | 0 | 0 | 0 | 0 | |||
| Sevoflurano 1 | 2 | 3 | 3 | 0 | 3 | 2,2 | 2 |
| Sevoflurano 2 | 0 | 1 | 3 | 0 | 0 | 0,8 | 1 |
| Sevoflurano 3 | 3 | 2,2 | 0 | 0 | 0 | 1,04 | 1 |
| Comportamiento oxígeno | 0 | 0 | 0 | 0 | 0 | 0 | ||||||
| Comportamiento | 0,76 | 1 | ||||||||||
| sevoflurano | 0,8 | 0 | 1,6 | 0 | 0 | 1,6 | 0,8 | 2,4 | 0 | 0,4 |
Microfotografías representativas de corteza prefrontal con activación para caspasa-3. A) Rata del grupo O2(1) con una exposición. Nótese la marcación positiva severa en las neuronas corticales B) Rata del grupo sevoflurano1. Obsérvese la marcación positiva moderada en las neuronas de la corteza prefrontal (flecha) C) Rata del grupo sevoflurano2, con la marcación positiva leve en las neuronas (flechas). Barra escala 50μm.
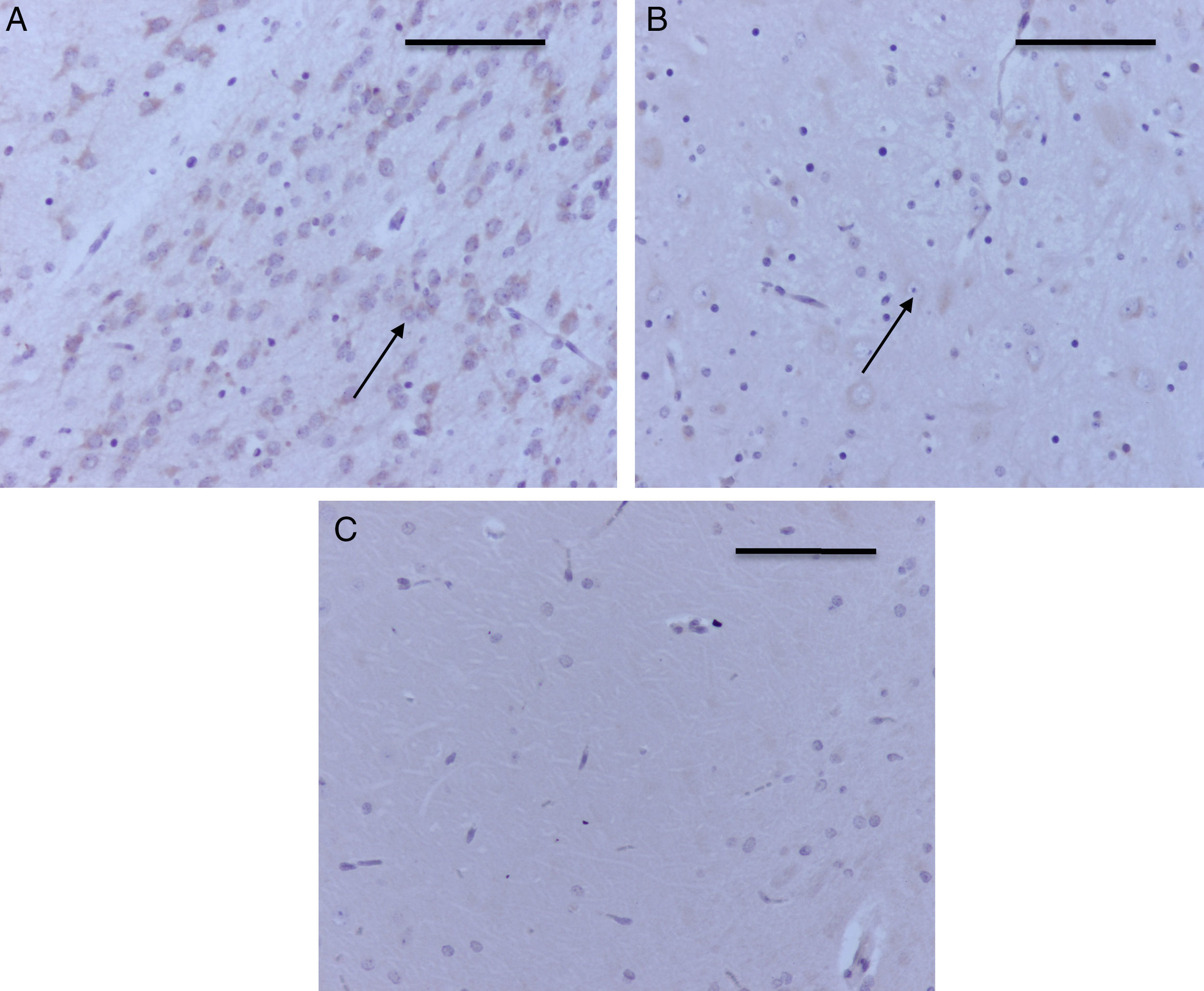
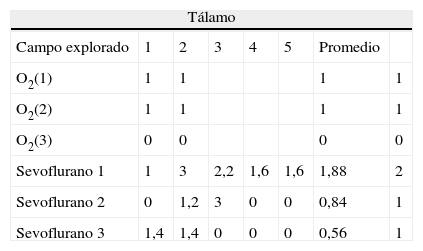
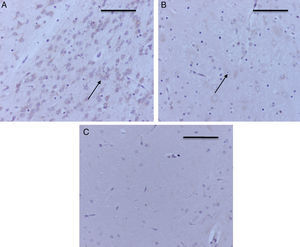
En la tabla 3 se observa que, al igual que en el hipocampo y la corteza prefrontal, 2 de los grupos control marcaron positivo para caspasa-3, O2(1) y O2(2) (intensidad leve para cada uno de los grupos). En los grupos expuestos todos dieron marcación positiva, moderada para el grupo sevoflurano1 (fig. 5A) y leve para los otros 2 grupos expuestos (fig. 5B). En los grupos de comportamiento el marcador fue negativo en esta zona tanto para comportamiento oxígeno como para comportamiento sevoflurano (fig. 5C).
Datos de inmunotinción en tálamo por grupos
| Tálamo | |||||||
| Campo explorado | 1 | 2 | 3 | 4 | 5 | Promedio | |
| O2(1) | 1 | 1 | 1 | 1 | |||
| O2(2) | 1 | 1 | 1 | 1 | |||
| O2(3) | 0 | 0 | 0 | 0 | |||
| Sevoflurano 1 | 1 | 3 | 2,2 | 1,6 | 1,6 | 1,88 | 2 |
| Sevoflurano 2 | 0 | 1,2 | 3 | 0 | 0 | 0,84 | 1 |
| Sevoflurano 3 | 1,4 | 1,4 | 0 | 0 | 0 | 0,56 | 1 |
| Comportamiento oxígeno | 0 | 0 | 0 | 0 | 0 | 0 | ||||
| Comportamiento sevoflurano | 1 | 0 | 0 | 0 | 1 | 0,2 | 0 | 0 | 0,275 | 0 |
Inmunoperoxidasa para caspasa-3 en tálamo. A) Rata del grupo sevoflurano1; obsérvese la marcación positiva moderada en las neuronas del tálamo (flechas). B) Rata del grupo sevoflurano2; obsérvese la marcación positiva leve en las neuronas del tálamo (flecha). C) Rata del grupo comportamiento-sevoflurano; obsérvese la ausencia de marcación en las neuronas. Barra escala 50μm.
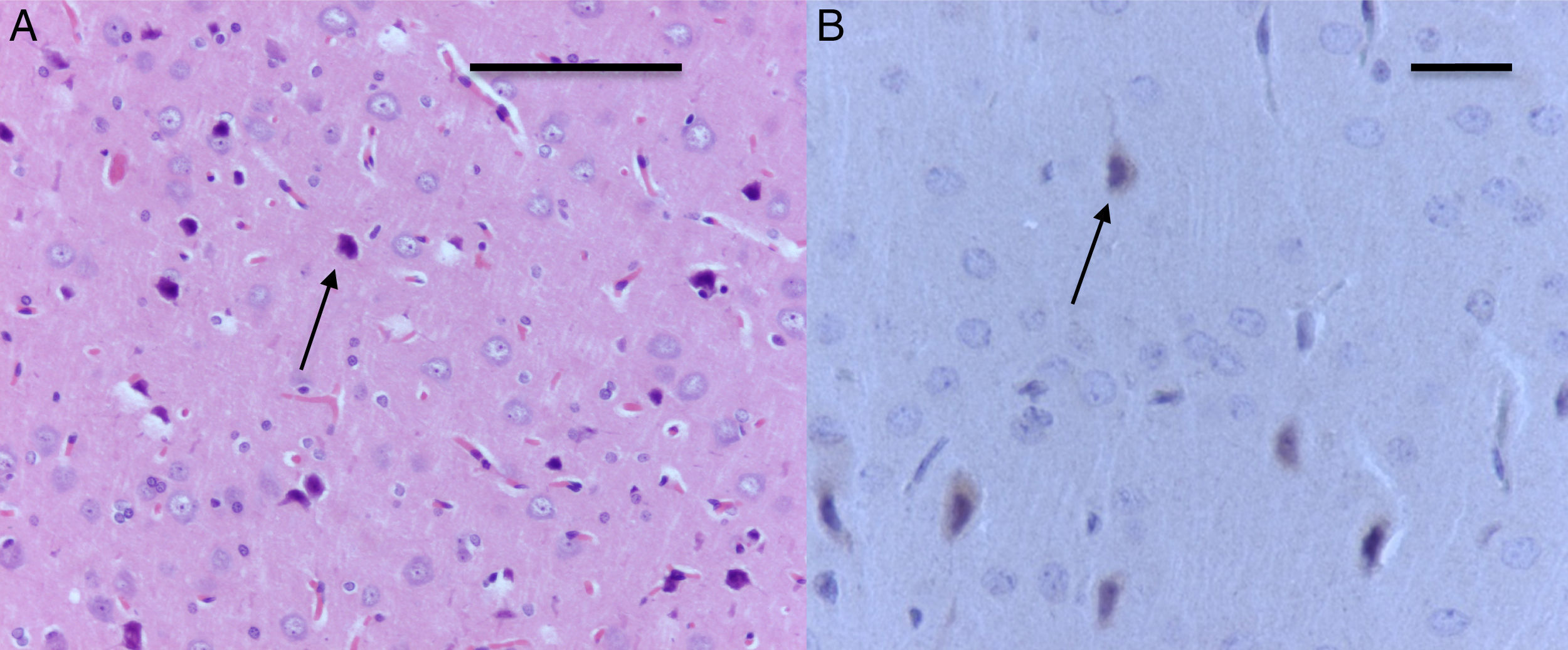
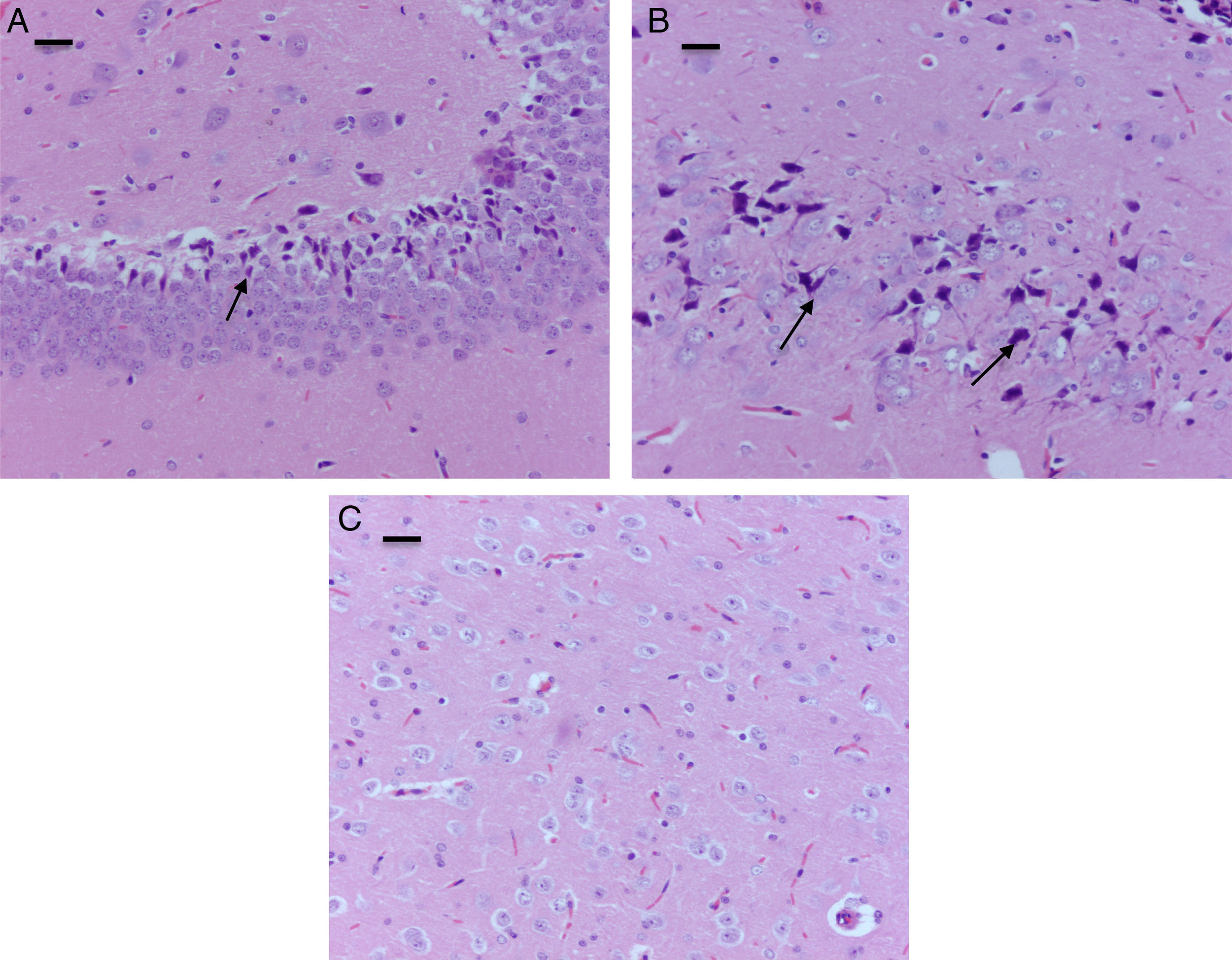
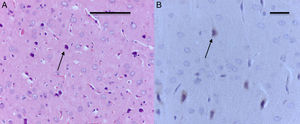
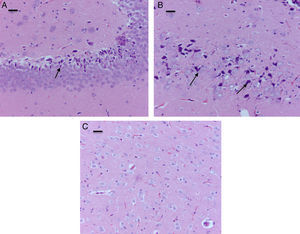
El análisis morfológico de las ratas neonatales no reveló lesiones en neuronas ni células de glía. En contraste, en las ratas adultas (expuestas a oxígeno o sevofluorano y a las cuales se les realizaron pruebas de comportamiento 60días después) se observaron lesiones en neuronas principalmente en la corteza y en el hipocampo. En las ratas adultas control (comportamiento oxígeno) se observaron focos pequeños de muerte neuronal en la corteza (fig. 6A), y allí se observaron neuronas con marcación positiva para caspasa-3 (fig. 6B).
Corte de corteza de rata del grupo comportamiento-oxígeno. A) Se observan focos pequeños de muerte neuronal (flecha) (H-E). Barra escala 50μm. B) Inmunohistoquímica para anti-caspasa-3; obsérvese las neuronas necróticas y la marcación positiva leve para el marcador (flecha). Barra escala 20μm (H-E).
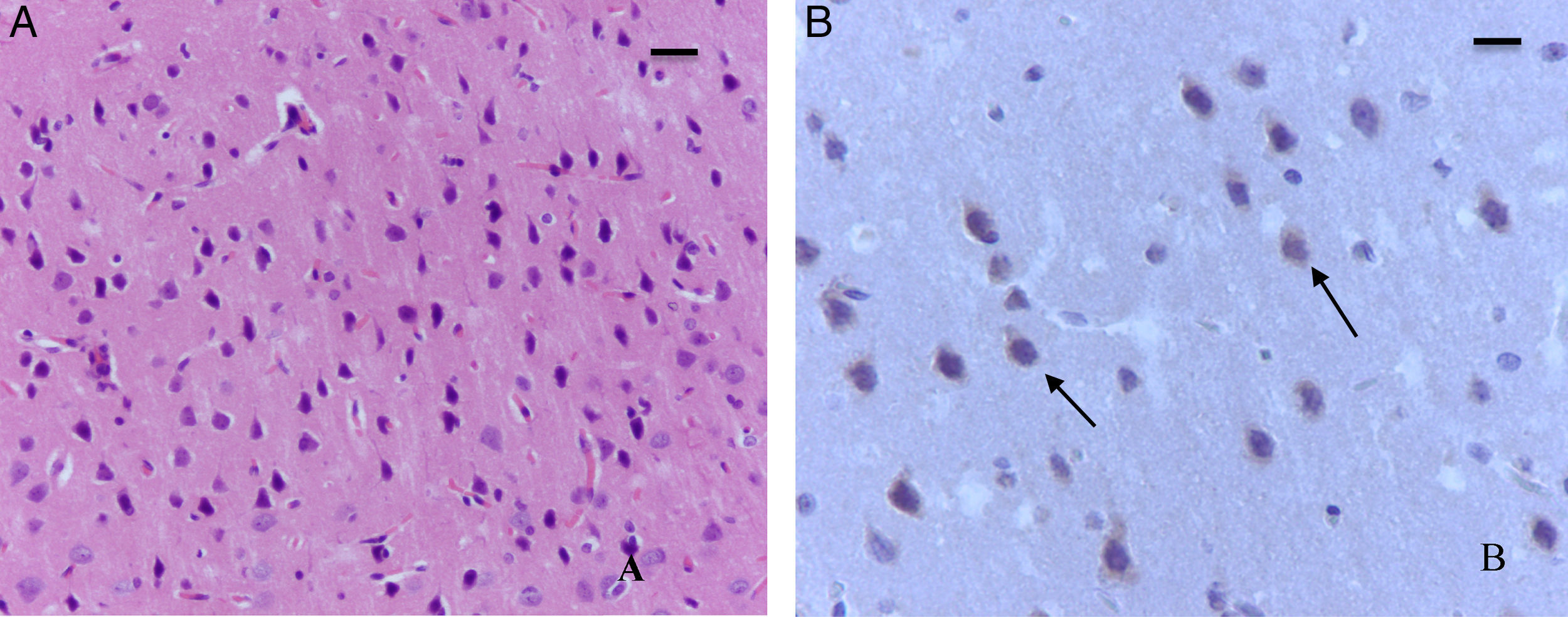
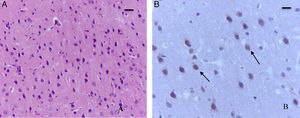
En el grupo de ratas adultas expuestas a sevofluorano se observaron focos de muerte neuronal en corteza pero más extensos que los de los animales control. Allí también se observaron neuronas con marcación positiva para caspasa-3 (fig. 7A y B). Igualmente en el hipocampo se observaron focos moderados de muerte neuronal en el estrato piramidal, en los animales de comportamiento oxígeno y severos en los de comportamiento sevoflurano (fig. 8A y B). En el tálamo no se observaron focos de muerte neuronal en ninguno de los grupos de animales (fig. 8C).
Corte de corteza de rata del grupo comportamiento-sevofluorano. A) Coloración de HE. Se observan focos extensos de muerte neuronal (flechas). Barra escala 25μm. B) Inmunohistoquímica para caspasa-3. Se detallan las neuronas necróticas y la marcación positiva leve para el marcador (flechas). Barra escala 15μm.
Focos moderados de muerte neuronal en el estrato piramidal. A) Coloración de H-E. Corte de hipocampo de rata del grupo comportamiento-sevoflurano. Se observan focos moderados de muerte neuronal en el estrato piramidal. B) Coloración de H-E. Corte de hipocampo de rata del grupo comportamiento-sevoflurano. Se observan focos de moderados de muerte neuronal (flechas). C) Coloración de H-E. Corte de tálamo de un animal del grupo comportamiento-sevoflurano; no se observan focos de muerte neuronal. Barra escala 25μm.
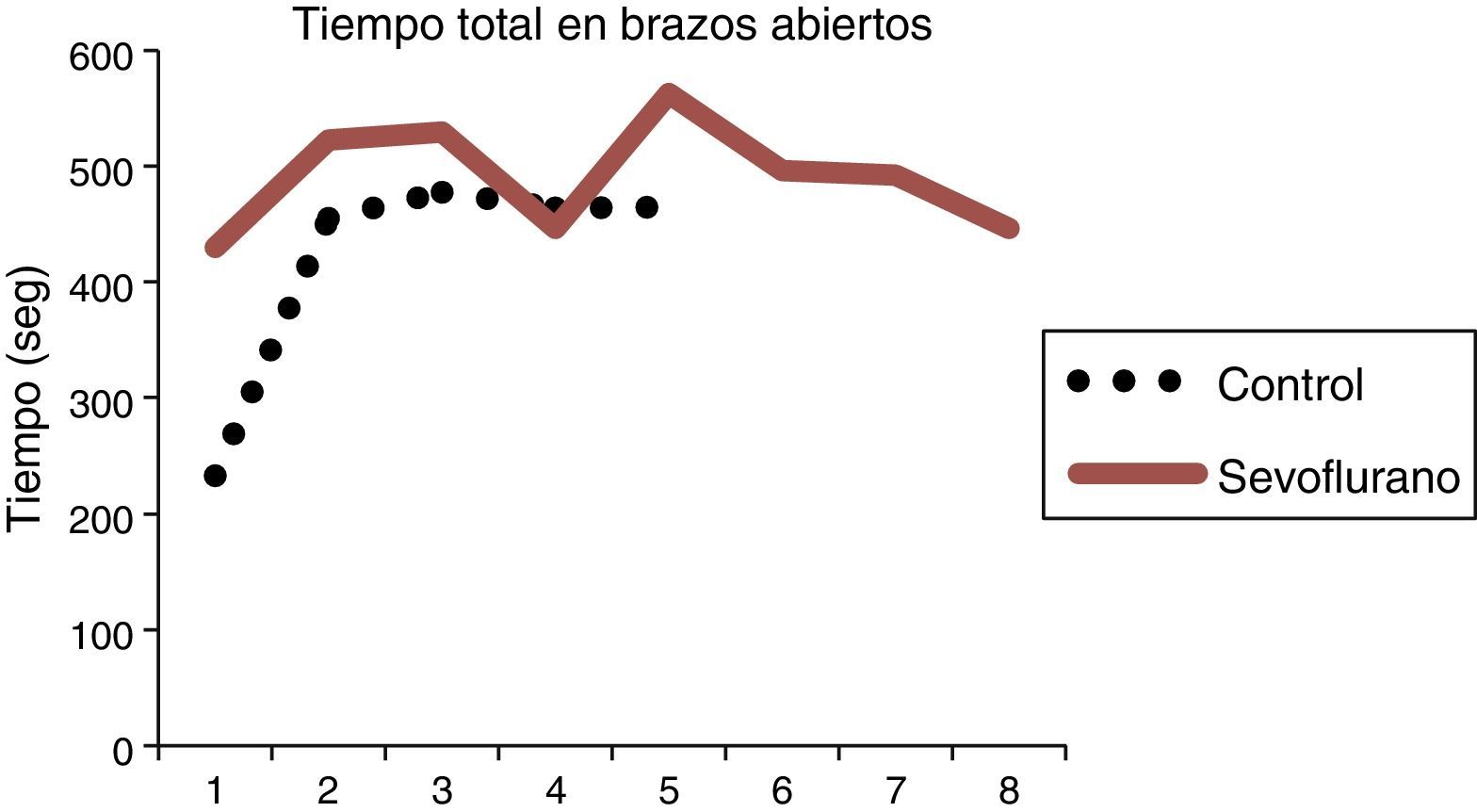
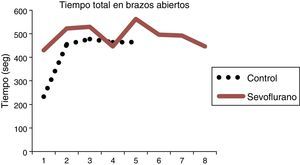
En general, se observa diferencia entre el tiempo de permanencia en los brazos abiertos entre los sujetos del grupo expuesto y el de los controles, mostrando que permanecen más tiempo en los brazos cerrados los no expuestos a sevoflurano, coincidiendo con el comportamiento normal de las ratas, que muestran preferencia por los brazos cerrados.
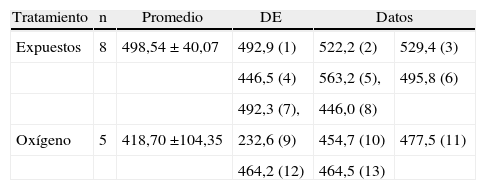
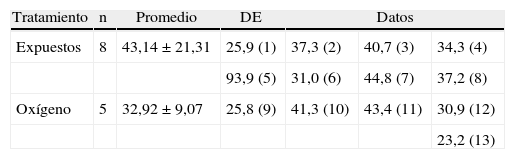
Las ratas expuestas a sevofluorano permanecieron más tiempo en los brazos abiertos (43,14±21,31s), en comparación con las del grupo control (32,92±9,07) (tabla 4 y fig. 9). Las ratas no expuestas a sevoflurano permanecieron más tiempo en los brazos cerrados (13±3,94s), coincidiendo con el comportamiento normal de las ratas, quienes normalmente muestran preferencia por los brazos cerrados (tabla 5 y fig. 9).
Tiempo en brazos abiertos, en segundos
| Tratamiento | n | Promedio | DE | Datos | |
| Expuestos | 8 | 498,54 ± 40,07 | 492,9 (1) | 522,2 (2) | 529,4 (3) |
| 446,5 (4) | 563,2 (5), | 495,8 (6) | |||
| 492,3 (7), | 446,0 (8) | ||||
| Oxígeno | 5 | 418,70 ±104,35 | 232,6 (9) | 454,7 (10) | 477,5 (11) |
| 464,2 (12) | 464,5 (13) | ||||
DE: desviación estándar.
Los números entre paréntesis a continuación de los datos son el número de cada animal.
Promedio duración en brazos abiertos, en segundos
| Tratamiento | n | Promedio | DE | Datos | ||
| Expuestos | 8 | 43,14±21,31 | 25,9 (1) | 37,3 (2) | 40,7 (3) | 34,3 (4) |
| 93,9 (5) | 31,0 (6) | 44,8 (7) | 37,2 (8) | |||
| Oxígeno | 5 | 32,92±9,07 | 25,8 (9) | 41,3 (10) | 43,4 (11) | 30,9 (12) |
| 23,2 (13) | ||||||
DE: desviación estándar.
Los números entre paréntesis a continuación de los datos son el número de cada animal.
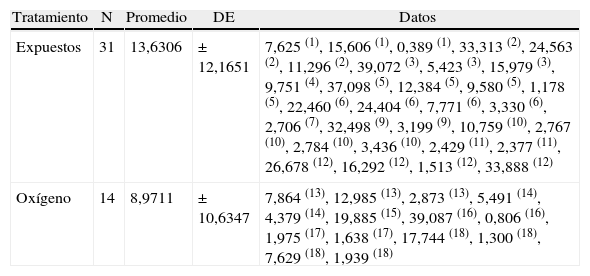
Al evaluar la distancia total atravesada, el número de entradas a la zona de la isla, los tiempos en la zona de la isla y la distancia recorrida hasta la primera entrada a la isla no se vieron diferencias estadísticas significativas. Sin embargo, los ratones expuestos recorrieron una mayor distancia antes de llegar a la plataforma y encontraron más veces la plataforma (tablas 6 y 7).
Distancia recorrida hasta la primera entrada a la plataforma (metros)
| Tratamiento | N | Promedio | DE | Datos |
| Expuestos | 31 | 13,6306 | ± 12,1651 | 7,625 (1), 15,606 (1), 0,389 (1), 33,313 (2), 24,563 (2), 11,296 (2), 39,072 (3), 5,423 (3), 15,979 (3), 9,751 (4), 37,098 (5), 12,384 (5), 9,580 (5), 1,178 (5), 22,460 (6), 24,404 (6), 7,771 (6), 3,330 (6), 2,706 (7), 32,498 (9), 3,199 (9), 10,759 (10), 2,767 (10), 2,784 (10), 3,436 (10), 2,429 (11), 2,377 (11), 26,678 (12), 16,292 (12), 1,513 (12), 33,888 (12) |
| Oxígeno | 14 | 8,9711 | ± 10,6347 | 7,864 (13), 12,985 (13), 2,873 (13), 5,491 (14), 4,379 (14), 19,885 (15), 39,087 (16), 0,806 (16), 1,975 (17), 1,638 (17), 17,744 (18), 1,300 (18), 7,629 (18), 1,939 (18) |
DE: desviación estándar.
Los números en paréntesis seguidos a los valores corresponden al número de animales.
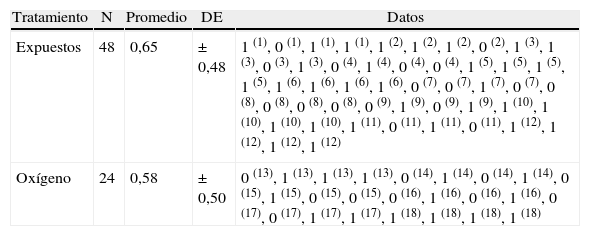
Número de entradas a la zona de la plataforma
| Tratamiento | N | Promedio | DE | Datos |
| Expuestos | 48 | 0,65 | ± 0,48 | 1 (1), 0 (1), 1 (1), 1 (1), 1 (2), 1 (2), 1 (2), 0 (2), 1 (3), 1 (3), 0 (3), 1 (3), 0 (4), 1 (4), 0 (4), 0 (4), 1 (5), 1 (5), 1 (5), 1 (5), 1 (6), 1 (6), 1 (6), 1 (6), 0 (7), 0 (7), 1 (7), 0 (7), 0 (8), 0 (8), 0 (8), 0 (8), 0 (9), 1 (9), 0 (9), 1 (9), 1 (10), 1 (10), 1 (10), 1 (10), 1 (11), 0 (11), 1 (11), 0 (11), 1 (12), 1 (12), 1 (12), 1 (12) |
| Oxígeno | 24 | 0,58 | ± 0,50 | 0 (13), 1 (13), 1 (13), 1 (13), 0 (14), 1 (14), 0 (14), 1 (14), 0 (15), 1 (15), 0 (15), 0 (15), 0 (16), 1 (16), 0 (16), 1 (16), 0 (17), 0 (17), 1 (17), 1 (17), 1 (18), 1 (18), 1 (18), 1 (18) |
DE: desviación estándar.
Los números en paréntesis seguidos a los valores corresponden al número de animales.
Frecuentemente prematuros, recién nacidos a término, lactantes y mujeres en gestación deben ser llevados en repetidas ocasiones a procedimientos quirúrgicos o diagnósticos bajo anestesia general o sedación.
Durante la práctica diaria mundial, la anestesia inhalatoria ha sido la técnica más común de la anestesia pediátrica, y debido a sus propiedades, como menor pungencia y bajo coeficiente de partición sangre-gas. Dentro de los anestésicos inhalados el sevoflurano es el más frecuentemente usado en la población pediátrica actualmente.
Nuestros resultados muestran que en ratas neonatas expuestas a sevoflurano, independientemente del régimen anestésico, se produjo muerte neuronal, aun en bajas dosis. Existe fuerte evidencia en modelos animales que la exposición a diferentes anestésicos induce daños morfológicos en células del cerebro y déficit cognitivo11,12. En el desarrollo del cerebro se observó en diferentes animales experimentales un daño dependiendo de la dosis y la duración, siendo estas últimas relevantes en la clínica y mostrando déficit cognitivo a largo plazo13. En cuanto a los mecanismos potenciales involucrados, se conoce que los anestésicos interactúan con los receptores de GABA y con los del NMDA, dando como resultado neuroapoptosis y otros mecanismos de daño. En esta investigación observamos un aumento en el número de células apoptóticas (caspasa-3 positivas) en el hipocampo, la corteza prefrontal y el tálamo, confirmando que una de las vías de muerte neuronal es la apoptosis a través de la activación de caspasa-3. Se ha reportado que los anestésicos pueden inducir apoptosis por daño en la mitocondria y salida del citocromoC al citosol en el citoplasma celular14, disparando cambios celulares que culminan en la activación de caspasa-315,16. Otras investigaciones en esta línea sugieren que los anestésicos aumentan las señales que promueven la muerte celular programada y activan Bax y p5314, y al mismo tiempo disminuyen las cascadas de señalización de sobrevivencia tales como pERK, Bclx y Bcl-215,17. Además, muestran que la exposición de anestésicos en un cerebro en desarrollo puede producir daños excitotóxicos asociados a la expresión de la proteína transportadora de iones13.
En cuanto a las regiones del cerebro estudiadas (hipocampo, corteza prefrontal y tálamo), mostraron afectación, como lo reporta la literatura y corresponden a las zonas que reciben e integran información sensorial, que son críticas en la función neurocognitiva. A nivel celular se afectan las neuronas y las células gliales con daños en la oligodendroglia con consecuencias en el neurocomportamiento13.
Es importante destacar que las ratas expuestas a oxígeno mostraron también marcación positiva a este marcador, lo que puede significar que el oxígeno puede ser neurotóxico e inducir muerte neuronal por apoptosis en este estado de desarrollo.
De otra parte, es necesario tener en cuenta la edad de exposición, el rango de vulnerabilidad de los diferentes tipos celulares neuronales, el anestésico y la dosis aplicada13. Un ejemplo es el trabajo de Zhan et al.18, en el que encontraron en láminas de hipocampo un incremento del calcio intracelular de ratas adultas expuestas a isoflurano, indicando un mecanismo independiente que resulta en un déficit cognitivo. Xie et al.19 exponen que las ratas con anestesia (isoflurano) desarrollan un incremento de la activación de caspasa.
En ratas adultas que fueron sometidas durante su etapa neonatal se presentaron focos extensos de muerte neuronal en la corteza y el hipocampo. En las ratas adultas expuestas únicamente a oxígeno también se observaron focos de muerte neuronal leve, mucho menos extensos en estas mismas ubicaciones. Estas lesiones se vieron reflejadas en cambios de comportamiento al hacer las pruebas de memoria y ansiedad, en las que tanto la corteza como el hipocampo están comprometidos. En relación con la memoria espacial, los animales expuestos a sevoflurano recorrieron, en el laberinto acuático de Morris, una mayor distancia antes de llegar a la plataforma, en comparación con los expuestos a oxígeno, mostrando dificultades en la memoria. En cuanto a la ansiedad, las ratas expuestas a sevoflurano mostraron más ansiedad al permanecer más tiempo en los brazos abiertos en comparación con los controles. Estos hallazgos son similares a otros previos. Es así como se ha comprobada que el uso de sevoflurano con exposiciones al 3% durante 6h en ratones neonatales (C57BL/6) de 6días mostraron aumento en el número de células apoptóticas, causando déficit de aprendizaje en los adultos20. Los estudios de Stratmann et al.21 muestran que el uso de anestésicos como el isoflurano en ratas de 7 y 60días expuestas 4h da como resultado una disminución de la proliferación en ratas de 7días y un aumento en la diferenciación en ratas de 60días, sosteniendo la hipótesis de que el isoflurano afecta la función de neurocognición a largo plazo en relación con la neurogénesis del hipocampo en el giro dentado21.
También se ha comprobado que los anestésicos, además de producir neuroapoptosis, intervienen en la sinaptogénesis durante el desarrollo del cerebro; esto se realizó en ratas de 16días con exposiciones de 2h, y este periodo de desarrollo se caracteriza por intensa sinaptogénesis en la corteza cerebral, dando como resultado muerte celular y cambios significativos en el patrón dendrítico de las 5 capas de la corteza. Pero en el caso del sevoflurano hay un aumento significativo en la densidad de las espinas dendríticas, revelando diferencias con los otros anestésicos22.
Kodama et al.23 demostraron que los ratones adultos tratados con anestésicos inhalados presentan deterioro de la memoria a largo plazo, sin anormalidades significativas detectadas por pruebas de campo abierto y laberinto elevado en cruz en la actividad y ansiedad relacionada con el comportamiento, respectivamente.
Investigaciones recientes sugieren que la anestesia con 3% de sevoflurano por 2h diarias durante 3días induce problemas cognitivos y neuroinflamación que dependen del estado de desarrollo, del agente anestésico y del número de exposiciones, y que juegan un papel en la disfunción cognitiva10.
Zhang et al.24 muestran resultados que sugieren que la anestesia con sevoflurano en animales prenatales induce activación de caspasa y pérdida de sinapsis, llevando a daños en el aprendizaje y la memoria.
Los resultados de nuestro estudio se correlacionan ampliamente con la literatura descrita. Respecto a la monitorización de signos vitales durante la exposición anestésica y su control, podemos observar en nuestro estudio que las ratas expuestas a sevoflurano tuvieron una tendencia a presentar menores valores de saturaciones de oxígeno y frecuencia cardiaca, que fueron no estadísticamente significativos para la saturación de oxígeno (t test p=0,86) y estadísticamente significativos para la frecuencia cardiaca (p<0,001) cuando se compara el grupo de exposición a sevoflurano y el grupo control.
Estos resultados corresponden a la depresión del sistema nervioso y cardiorrespiratorio esperada por la exposición anestésica. Sin embargo, es importante aclarar que no presentaron hipoxemia (valor mínimo de 90%) ni bradicardia durante la exposición (valor mínimo de 151latidos/min).
En resumen, se puede decir que el sevoflurano a dosis sub-CAM y en tiempos cortos de exposición induce neurodegeneración y que el comportamiento en adultos parece estar asociados a susceptibilidad del cerebro pero no afecta el funcionamiento del sistema nervioso. Además, la memoria espacial de ratas adultas expuestas tiene una respuesta baja que se correlaciona con el análisis de los estudios de comportamiento. Es necesario continuar la investigación enfocados en la prevención de la neurotoxicidad anestésica y poder establecer los límites de seguridad con mayor precisión, buscando el mejor beneficio para nuestros pacientes pediátricos25.
ConclusionesLa exposición repetida a sevoflurano a dosis sub-CAM durante periodos cortos en la edad neonatal no altera significativamente el comportamiento asociado a ansiedad en la edad adulta en ratas. Sin embargo, puede causar déficit de aprendizaje, principalmente en la adquisición de memoria espacial.
En ratas adultas que fueron sometidas durante su etapa neonatal se presentaron focos extensos de muerte neuronal en la corteza y en el hipocampo.
En las ratas adultas expuestas únicamente a oxígeno también se observaron focos de muerte neuronal leve, mucho menos extensos en estas mismas ubicaciones.
Estas lesiones se vieron reflejadas en cambios de comportamiento al hacer las pruebas de memoria y ansiedad, en las cuales tanto la corteza prefrontal como el hipocampo están comprometidos.
FinanciaciónEste trabajo fue financiado por la Universidad de La Sabana, Sociedad Colombiana de Anestesiología y Reanimación, Premio en Investigación 2011, XXIXCongreso de Anestesiología y Reanimación y el Hospital Universitario La Samaritana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Facultad de Medicina Universidad de La Sabana, Hospital Universitario La Samaritana, Universidad Nacional de Colombia, Facultad de Medicina Veterinaria y Zootecnia, Dra. Lucía Botero, S.C.A.R.E. y Myriam Leguizamón.