La expansión de la quimioterapia neoadyuvante en cáncer de mama ha dado lugar a nuevos dilemas clínicos en el manejo de pacientes con axila metastásica al diagnóstico. La linfadenectomía axilar es el estándar en su estadificación y tratamiento, pese a tasas de respuesta axilar completa de 40-60%. Estudios prospectivos recientes han demostrado una buena precisión de los métodos mínimamente invasivos de estadificación axilar, por lo que su práctica se está extendiendo entre grupos de expertos. Presentamos nuestros primeros resultados en la evaluación axilar postneoadyuvancia de pacientes con metástasis ganglionares al diagnóstico (cN1) mediante biopsia selectiva de ganglio centinela (BSGC) y disección axilar dirigida guiada con semilla de iodo-125.
The expansion of neoadjuvant chemotherapy (NACT) in breast cancer has led to new clinical dilemmas in the management of node-positive cancers at diagnosis. Axillary lymphadenectomy is the standard approach for the staging and treatment, despite complete axillary response rates up to 40-60%. Recent prospective studies have shown good accuracy of non-invasive methods for axillary staging in cN1 patients post-NACT, and have led to the spreading of this practice among expert groups. The first results are presented with post-neoadjuvant axillary re-evaluation of cN1 patients using Sentinel Lymph node biopsy (SLNB) and targeted axillary dissection with iodine-125 seed.
El manejo del cáncer de mama mediante un tratamiento sistémico neoadyuvante ha aumentado de manera radical en las últimas décadas. Este abordaje permite una evaluación in vivo de la respuesta tumoral a la terapia sistémica, y su efecto reductor sobre el tumor primario favorece la cirugía conservadora y la disminución de la carga de enfermedad axilar1. Esto ha abierto nuevos dilemas clínicos respecto al manejo de la estadificación ganglionar en pacientes con metástasis ganglionares al diagnóstico. Sobre todo, en aquellas pacientes con ganglios positivos al diagnóstico con una excelente respuesta al tratamiento en las que el tratamiento indicado es la linfadenectomía axilar (LA). Si bien la biopsia selectiva del ganglio centinela (BSGC) en pacientes con axila negativa (cN0) es una técnica precisa y con una tasa de falsos negativos aceptable para guiar la estadificación ganglionar, no sucede de la misma forma en pacientes con metástasis ganglionares al diagnóstico (cN1) que se hayan sometido a un tratamiento neoadyuvante, independientemente de que exista una respuesta clínica o radiológica excelente.
Series recientes han demostrado una tasa de respuesta completa de la enfermedad metastásica ganglionar de entre un 40-60%2. En la última década, múltiples estudios han analizado la precisión de la BSGC en este subgrupo de pacientes con resultados contradictorios respecto a su validez, pues varias series publicadas han descrito tasas de falsos negativos (TFN) de hasta un 15%3.
Varios ensayos clínicos (ASCOSOG Z10714, SENTINA5 y SN FNAC6) exploraron la precisión de la BSGC en pacientes sometidas a neoadyuvancia, demostrando TNF aceptablemente buenas, pero aun así superiores al 10%, el máximo aceptado para la BSGC. Sin embargo, cuando se extraían más de dos ganglios centinelas y se utilizaba doble trazador, la TFN descendía hasta un 4-5%, similar a la de la técnica en axila no metastásica. Otro método mínimamente invasivo de reestadificación axilar post-neoadyuvancia fue planteado por el grupo del MD Anderson7 y el grupo holandés Netherland Cancer Institute, en los estudios MARI y RISAS8 (tabla 1). Esta técnica denominada disección axilar dirigida consistiría en el marcaje de los ganglios positivos al diagnóstico con un clip, para, terminada la neoadyuvancia, extirpar los ganglios metastásicos marcados y localizados con semilla de iodo-125 (I125), y analizar la respuesta patológica que presentaban. Se evidenció que hasta en el 25% de los casos el ganglio marcado no coincidía con el centinela. La TFN fue extraordinariamente baja, y actualmente se propone que en los estudios clínicos de reestadificación axilar en pacientes sometidas a neoadyuvancia con metástasis ganglionares se proceda al marcaje de los ganglios positivos, para asegurar que son resecados y analizar la respuesta patológica que presentan.
Estudios comparando técnicas mínimamente invasivas de evaluación axilar en pacientes pN+ al diagnóstico sometidas a quimioterapia neoadyuvante
| ESTUDIOS | ASCOSOG Z1071,SENTINA,Canadian SN FNAC | MARI | TAD (MD Anderson) | RISAS |
|---|---|---|---|---|
| PROCEDIMIENTO | Ganglio centinela | Marcaje con semilla I125 | G. centinela + marcaje con I125 de ganglio clipado después de NAC | G. centinela + marcaje con I125 de ganglio clipado antes de NAC |
| TASA FALSOS NEGATIVOS | 13-14% | 7% | 2% | Pendiente |
NAC: quimioterapia neoadyuvante.
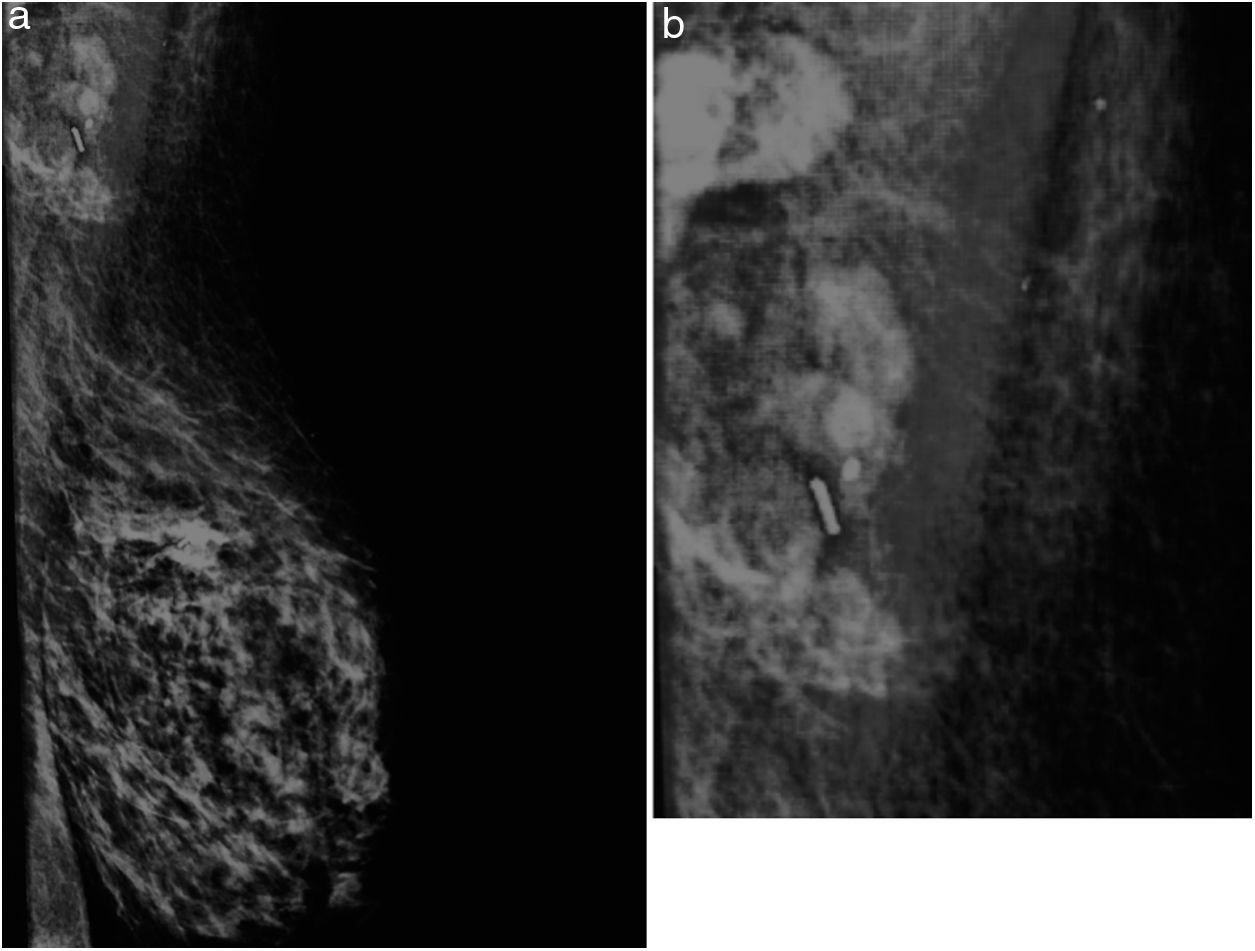
En nuestro centro llevamos a cabo un estudio piloto de BSGC post-neoadyuvancia y disección axilar dirigida en pacientes con cáncer de mama con metástasis ganglionares al diagnóstico. Se seleccionaron pacientes con afectación axilar (cN1), confirmada por biopsia con aguja gruesa (BAG) y limitada a una o dos adenopatías, que hubiesen presentado respuesta radiológica completa o parcial a neoadyuvancia. El perfil molecular de los casos fue: 3/6 Her2+, 2/6 Luminal B tipo Her2+, 1/6 Luminal B. En el momento del diagnóstico se procedió al marcaje con un clip de las adenopatías metastásicas. El día de la cirugía se marcaron las adenopatías clipadas con semilla I125 junto con la inyección de Tc99 para la BSGC (figs. 1A y 1B).
Durante la cirugía se extirparon los ganglios marcados con semilla, los centinelas y cualquier ganglio de aspecto patológico, tal y como exige nuestro protocolo.
Tras el estudio intraoperatorio, mediante estudio histológico se decidió omitir la LA en caso de ausencia total de enfermedad: no células tumorales aisladas, no micro/macrometástasis. Dichas pacientes recibieron radioterapia axilar posteriormente, tal y como recomiendan las guías europeas actuales9.
En un paciente no fue posible la identificación del ganglio marcado por migración del coil, realizándose LA. El estudio intraoperatorio de las otras pacientes mostró ausencia de tumor en cuatro casos, omitiéndose la LA, y en un caso con micrometástasis se completó la LA (tabla 2). Tras 20 meses de seguimiento ninguna paciente ha experimentado recidiva.
Resultados de estudio piloto de evaluación axilar post-neoadyuvancia con BSGC + disección axilar dirigida con semilla I125
| Marcados / Rescatados | Concordancia GC/semilla | AP intraoperatoria | Cirugía | |
|---|---|---|---|---|
| 1 | 1/2 | Sí | ypN0 | No LA |
| 2 | 1/7 | No localizado | LA | |
| 3 | 1/3 | Sí | Micrometástasis | LA |
| 4 | 1/3 | Sí | ypN0 | No LA |
| 5 | 1/4 | Sí | ypN0 | No LA |
| 6 | 1/5 | Sí | ypN0 | No LA |
GC: ganglio centinela; AP: anatomía patológica.
La expansión del tratamiento neoadyuvante en el cáncer de mama ha llevado a cirujanos y radioterapeutas al dilema del manejo óptimo de las pacientes con axila metastásica al diagnóstico y buena respuesta al tratamiento. Se persigue el objetivo de un tratamiento oncológicamente adecuado pero que reduzca la morbilidad de posibles cirugías innecesarias. Los resultados publicados sobre la precisión de procedimientos mínimamente invasivos de reestadificación axilar post-neoadyuvancia son alentadores, por lo que su práctica se está extendiendo en muchos centros especializados. En un artículo reciente publicado por J.M. Simons, coordinadora del estudio RISAS, se recogen los estándares de manejo de la axila cN+ entre especialistas en cáncer de mama europeos, el cual refleja que más del 70% de los encuestados estarían relanzando BSGC o BSGC + TAD en aquellas pacientes que presentasen una respuesta clínica y radiológica completa10. Las últimas guías europeas y americanas publicadas comienzan a protocolizar este paso natural de extender la cirugía conservadora de la mama a la axila en este subgrupo de pacientes, estandarizando la reevaluación de la enfermedad axilar y del manejo de la axila cN+ con respuesta patológica completa, y defendiendo la BSGC como un método seguro de reestadificación mínimamente invasivo de las pacientes cN1 cuando se cumplen las siguientes premisas11,12:
- 1)
Realización de BSGC con doble trazador (radiotrazador + colorante)
- 2)
Extirpar más de dos ganglios centinelas
- 3)
Marcaje del ganglio patológico al diagnóstico y extirpación y evaluación de ese ganglio.
- 4)
Si BSGC muestra pCR, puede obviarse linfadenectomía axilar y administrar radioterapia axilar.
- 5)
Completar la LA ante cualquier carga tumoral (células tumorales aisladas/micrometástasis)
- 6)
Análisis de ganglio centinela (GC) con método histológico. El método One-Step Nucleic Acid Amplification (OSNA) no detectaría cambios en el tratamiento y es menos sensible para la detección de células tumorales aisladas.
Siguiendo las premisas europeas y tras un análisis retrospectivo de los últimos cinco años de nuestras pacientes cN+ sometidas a neoadyuvancia, evidenciamos hasta un 40% de pCR, por lo que comenzamos un estudio piloto de reestadificación axilar en pacientes con buena respuesta clínica y radiológica. Nuestros resultados con BSGC y disección axilar dirigida en pacientes cN1 demuestran la reproducibilidad del abordaje, y su seguridad oncológica a corto plazo. Resulta fundamental para la validación definitiva de este abordaje llevar a cabo estudios clínicos estandarizados y multicéntricos que nos aporten resultados de seguridad oncológica a largo plazo y ayuden a la selección adecuada de pacientes en función de sus características clínicas, moleculares y de respuesta al tratamiento, identificando variables que tras la reestadificación axilar permitan ofrecer el tratamiento locoregional más seguro a cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicaci´n de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.