La ingesta inadecuada de minerales y vitaminas durante el crecimiento se ha convertido en un problema de salud importante en los países desarrollados y en vías de desarrollo, particularmente en mujeres embarazadas, lactantes y niños que tienen una dieta desequilibrada.
MétodosEstudios realizados en humanos y animales demostraron una relación entre la deficiencia de micronutrientes durante el desarrollo y la programación in utero de enfermedades cardiovasculares y renales en la vida adulta, como la obesidad, la diabetes y la hipertensión arterial. Dentro de los mecanismos involucrados se encuentran cambios epigenéticos, alteración de la organogénesis, remodelación por procesos apoptóticos y alteraciones hormonales y metabólicas.
ResultadosSe ha realizado una revisión actualizada de la asociación entre la deficiencia de micronutrientes durante la vida fetal y posnatal, el desarrollo de enfermedades cardiovasculares en la vida adulta y las alteraciones observadas en ellas.
ConclusionesSe discuten los beneficios de la suplementación de micronutrientes durante el embarazo.
Inadequate intake of minerals and vitamins during growth has become a major health problem in developed and developing countries, particularly in pregnant women, infants and children who have an unbalanced diet.
MethodsStudies in humans and animals have shown that micronutrient deficiency during development may be responsible for in utero programming of cardiovascular and renal diseases in adulthood, such as obesity, diabetes and hypertension. Among the mechanisms involved are epigenetic changes, alteration in organogenesis, apoptotic remodelling processes and metabolic and hormonal alterations.
ResultsThis work is an updated review of the association between micronutrient deficiencies during foetal and post-natal life, the development of cardiovascular disease in adulthood, and the alterations observed in these.
ConclusionsThe benefits of micronutrient supplementation during pregnancy are discussed.
La ingesta inadecuada de micronutrientes durante los períodos críticos del crecimiento se ha convertido en un problema de salud importante en los países desarrollados y en vías de desarrollo, particularmente en las mujeres embarazadas, los lactantes y los niños, que tienen una dieta desequilibrada. Este trastorno nutricional incluye la deficiencia de minerales y vitaminas, como cinc, hierro, calcio, vitamina A y vitamina D, que son necesarios en pequeñas cantidades para procesos bioquímicos y metabólicos. La deficiencia de micronutrientes, conocida también como desnutrición oculta, no solo se presenta en individuos malnutridos, sino también en aquellos con un peso corporal adecuado o alto1-3.
Las vitaminas y los minerales son esenciales para la salud humana y el desarrollo, dado que cumplen diversas funciones bioquímicas. Los elementos trazas, como el cinc y el selenio, forman parte de factores de transcripción y también están involucrados en la modulación de la actividad enzimática como cofactores o formando parte de grupos prostéticos. Por otra parte, las vitaminas y sus metabolitos intervienen en reacciones bioquímicas complejas que son críticas para el metabolismo intermedio y aseguran la utilización de los nutrientes para obtener energía. Por último, muchas vitaminas (vitamina E, A, C, β-carotenos) y minerales (cinc, cobre, manganeso y selenio) presentan propiedades antioxidantes al estar involucrados en la actividad de enzimas antioxidantes como la superóxido dismutasa y la glutatión peroxidasa, al inducir la síntesis de metalotioneínas, al proteger a los grupos sulfhidrilos de las proteínas y del glutatión de la oxidación y al inhibir a las NADPH oxidasas4.
Teniendo en cuenta estos antecedentes, es de esperar que las deficiencias de vitaminas y minerales durante periodos críticos del desarrollo puedan tener consecuencias en la salud durante la vida adulta. En los últimos años, numerosos estudios epidemiológicos y experimentales han proporcionado pruebas suficientes que sugieren que trastornos metabólicos y desequilibrios nutricionales durante una ventana de tiempo crítica en el desarrollo tienen efectos persistentes sobre la salud de la descendencia y pueden ser responsables de la programación in utero de enfermedades como la obesidad, la diabetes y la hipertensión arterial en la vida adulta5-7.
Es por ello que el objetivo de este trabajo es realizar una revisión actualizada de la asociación entre la deficiencia de micronutrientes durante la vida fetal y posnatal, el desarrollo de enfermedades cardiovasculares en la vida adulta y las alteraciones observadas en ellas. Además, se discuten los beneficios de la suplementación de micronutrientes durante el embarazo.
Programación fetal de enfermedades cardiovascularesBarker et al. fueron los primeros en describir que el bajo peso al nacer se asociaba con un mayor riesgo de muerte por enfermedades cardiovasculares8,9. Múltiples estudios epidemiológicos y experimentales ampliaron estos estudios preliminares y encontraron asociaciones entre la calidad del crecimiento pre y/o posnatal y el mayor riesgo de desarrollar enfermedades crónicas como la diabetes tipo 2, la hipertensión arterial, la obesidad, la resistencia a la insulina y el síndrome metabólico en la edad adulta5,6,10,11.
La hipótesis de la programación fetal sugiere que una lesión durante la vida fetal, que conduce a un crecimiento intrauterino restringido, no solo resulta en un bajo peso al nacer sino que también pone en marcha respuestas adaptativas que pueden llevar a la pérdida de unidades estructurales (nefrones, cardiomiocitos, células pancreáticas β, células de músculo esquelético) a expensas de mantener el desarrollo de otros órganos, como el cerebro. Estos cambios adaptativos pueden traer ventajas inmediatas al aumentar la supervivencia perinatal en un ambiente nutricional pobre, pero programan en el individuo una menor capacidad funcional para su vida. Más aún, se propuso que estas respuestas adaptativas podrían ser más perjudiciales para los individuos que durante la vida posnatal se enfrentan a ambientes con aportes nutricionales abundantes y que requieren una mayor capacidad funcional y metabólica que la que recibieron en la vida prenatal. Esto está sustentado por estudios realizados en humanos que sugieren que el bajo peso al nacer seguido de un crecimiento posnatal acelerado se asocia con un mayor riesgo de muerte por enfermedades cardiovasculares10,12.
Diferentes modelos experimentales realizados en ratas, ovejas, conejos y cerdos han sido usados para inducir un ambiente fetal adverso y simular las condiciones de restricción de crecimiento intrauterino en humanos. Dentro de ellos se encuentran la restricción dietaria global, la restricción proteica, la hipoxia crónica, la insuficiencia placentaria, el tratamiento prenatal con glucocorticoides, la deficiencia de micronutrientes como el hierro y el cinc, y la alta ingesta de grasas10,13-16.
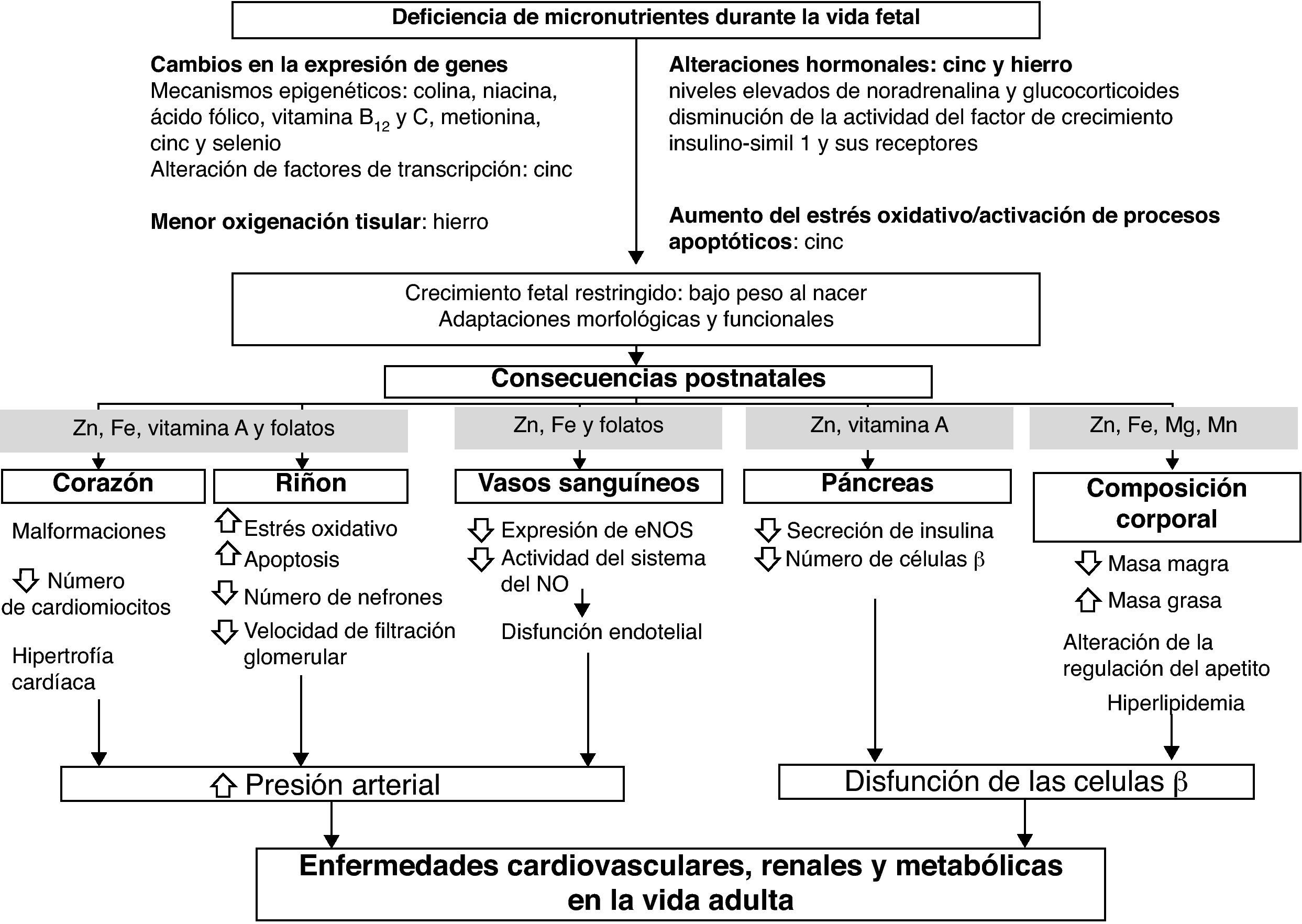
La deficiencia de micronutrientes durante la gestación puede afectar el desarrollo fetal mediante múltiples mecanismos e inducir adaptaciones fetales durante periodos críticos de la organogénesis, que determinan la capacidad funcional de los sistemas cardiovascular, renal y metabólico. Dentro de estos mecanismos se encuentran cambios epigenéticos, alteraciones morfológicas, activación de procesos apoptóticos y alteraciones hormonales y metabólicas7 (fig. 1).
Los cambios epigenéticos del ADN son inducidos por la metilación de nucleótidos de citosina en secuencias citosina-guanina (CpG). Dichas secuencias generalmente se encuentran en regiones promotoras que regulan la transcripción de genes. Determinados nutrientes que son cofactores y dadores de grupos metilos, como la colina, la niacina, el ácido fólico, la vitamina B12, la vitamina C, la metionina, el glutatión, el cinc y el selenio, regulan la expresión génica al controlar reacciones de metilación o al ser componentes estructurales de enzimas que epigenéticamente modifican el ADN y las histonas. Por lo tanto, la deficiencia de estos micronutrientes durante el desarrollo temprano puede causar cambios epigenéticos que persisten en la vida adulta e inducen factores de riesgo para el desarrollo de enfermedades cardiovasculares en la vida adulta17,18. Por ejemplo, alteraciones en los patrones de metilación del ADN han resultado en individuos adultos con mayor peso, mayor porcentaje de grasa corporal, aumento de la resistencia a la insulina y elevados valores de presión arterial19. Además, se ha demostrado que una dieta suplementada en ácido fólico, vitamina B12, betaina y colina puede prevenir la amplificación transgeneracional de la obesidad entre ratones agouti, sugiriendo que la dieta rica en dadores de metilos resulta protectora en animales con una tendencia genética a la obesidad20.
Las deficiencias severas de micronutrientes pueden generar efectos teratogénicos en el feto, mientras que las restricciones moderadas de aquellos pueden causar daños más leves, entre los que podrían encontrarse una menor oxigenación tisular como resultado de una anemia, un incremento del estrés oxidativo, una mayor activación apoptótica o alteraciones en el desarrollo de los órganos21,22.
Por otra parte, algunos trabajos han demostrado que la deficiencia de micronutrientes durante la gestación y la lactancia puede inducir cambios hormonales y metabólicos en la vida posnatal. Por ejemplo, la restricción del 50% de minerales o vitaminas durante la preñez de ratas Wistar/NIN indujo en las crías de 180 días de vida posnatal un incremento de la grasa corporal y de la concentración de triglicéridos, sin afectar la homeostasis de la glucosa y la resistencia a la insulina23,24. Por otra parte, la restricción materna y perinatal de magnesio incrementó el porcentaje de grasa corporal, redujo el de masa magra, aumentó la resistencia a la insulina y disminuyó la tolerancia a la glucosa25. También se observaron alteraciones del metabolismo lipídico y glucídico por restricción materna de manganeso y cromo, especialmente cuando los animales fueron expuestos a una dieta rica en grasas durante la vida posnatal26,27. Estas evidencias demuestran que la deficiencia de micronutrientes puede predisponer al desarrollo del síndrome metabólico en la vida adulta.
Po otra parte, los niveles de otros factores, como el factor de crecimiento insulino-símil 1, pueden verse también afectados por la restricción de micronutrientes. Se ha comunicado que la deficiencia de cinc y hierro puede inhibir el crecimiento fetal al reducir la actividad del factor de crecimiento insulino-símil 1 y sus receptores28,29. Esto resulta importante, dado que el crecimiento fetal restringido se asocia con el desarrollo de enfermedades cardiovasculares y renales en la vida adulta30,31.
La activación del sistema nervioso simpático podría también contribuir a la hipertensión asociada con el crecimiento fetal restringido, dado que en niños con bajo peso al nacer32,33 y en modelos animales de programación fetal por restricción proteica uterina, hipoxia prenatal y deficiencia de hierro34-36 se han observado niveles elevados de catecolaminas. La activación del sistema nervioso simpático renal, observada en modelos de insuficiencia placentaria, exposición fetal a glucocorticoides y restricción proteica, podría contribuir al desarrollo de la hipertensión al aumentar la expresión de transportadores de sodio e incrementar su reabsorción37-40. Si bien el mecanismo por el cual se produce la estimulación del sistema nervioso simpático aún no se conoce, dicha estimulación podría deberse a la activación del sistema renina angiotensina central en regiones críticas para la regulación de la función cardiovascular41,42.
Por otra parte, la alteración del eje hipotálamo-pituitario-adrenal participa en la programación de enfermedades crónicas en el estadio adulto. La deficiencia de hierro no solo mostró que incrementaba los niveles de noradrenalina circulante, sino también la liberación de cortisol y la hormona liberadora de corticotropina36. Los glucocorticoides son importantes reguladores del crecimiento y del desarrollo fetal, ya que pueden modificar la expresión de muchas proteínas a nivel molecular. Durante el desarrollo normal, los niveles circulantes de glucocorticoides en el feto son relativamente bajos en comparación con los maternos, debido a la expresión de la enzima 11β-dehidroxiesteroide deshidrogenasa 2 (11βHSD2) placentaria, que convierte la corticosterona en la rata y el cortisol en el hombre, en metabolitos no activos43. Esta enzima es sensible al estatus nutricional materno y su actividad se encontró reducida en un modelo de restricción dietaria materna de cobre, cinc y vitamina E en ratones Swiss Albino44. El incremento de los niveles de glucocorticoides se ha asociado con el crecimiento intrauterino restringido, con alteraciones en los procesos de nefrogénesis, con elevados niveles de presión arterial, con modificaciones del metabolismo de las grasas, con resistencia a la insulina y con variaciones del eje hipotálamo-hipófisis-adrenal en la vida adulta43,45.
Efectos cardiovasculares, renales y metabólicos inducidos por la deficiencia prenatal de diferentes micronutrientesVarios estudios realizados en humanos y animales han relacionado los niveles de los micronutrientes maternos con la programación de alteraciones del sistema cardiovascular en los hijos. Las evidencias más relevantes respecto a algunos de los micronutrientes se detallan a continuación.
CincLa deficiencia moderada de cinc en ratas durante la vida intrauterina y el crecimiento posnatal constituye un modelo de programación fetal de enfermedades cardiovasculares y renales en la vida adulta. En trabajos previos mostramos que la restricción dietaria de cinc durante la vida fetal y la lactancia induce un incremento de la presión arterial y altera la función renal en la adultez. Entre las alteraciones renales causadas por esta deficiencia se encontró una disminución de la velocidad de filtración glomerular asociada a una reducción en el número de nefrones y de la superficie de filtración glomerular, un incremento del estrés oxidativo renal, activación de los procesos apoptóticos y fibróticos, proteinuria y una disminución en la actividad del sistema del óxido nítrico (NO) renal. Además, la restitución del contenido de cinc en la dieta luego del destete no logró corregir muchas de las alteraciones observadas, como los valores de presión arterial, la velocidad de filtración glomerular y la actividad del sistema del NO, así como las alteraciones morfológicas renales46,47. Esto nos indica que la deficiencia de este micronutriente altera la función y la morfología renal, lo cual puede contribuir al desarrollo de hipertensión en la vida adulta.
Por otra parte, como en otros modelos de programación fetal, los animales expuestos a una deficiencia moderada de cinc durante la vida fetal presentan menor peso al nacer, lo cual se correlaciona negativamente con el número de nefrones y la presión arterial sistólica en la vida adulta46,47.
Estudios experimentales y realizados en humanos han encontrado también una asociación entre el bajo peso al nacer y la disfunción endotelial6,48. De acuerdo con estos reportes, la restricción de cinc durante la vida fetal y la lactancia indujo alteraciones del sistema del NO vascular en la vida adulta. La reducción en la actividad de la NO sintasa (NOS) en arterias de conducción, como la aorta torácica, estuvo asociada con una menor expresión proteica de la isoforma endotelial de la NOS (eNOS) y una menor capacidad de relajación del músculo liso vascular46.
Por otra parte, el desarrollo cardíaco puede ser particularmente sensible a la deficiencia de cinc. En ratas, la alta incidencia de anormalidades cardíacas fetales se ha asociado a la deficiencia severa de este micronutriente. Estas alteraciones podrían deberse, al menos en parte, a la disminución en la expresión de genes específicos cardíacos que contienen factores de transcripción zinc-finger49,50. Más aún, la apoptosis constituye un mecanismo importante durante el desarrollo embrionario. Sin embargo, la deficiencia de cinc puede inducir cambios en los patrones de apoptosis que pueden resultar en alteraciones de la morfogénesis. Lopez et al.50 han reportado que la deficiencia materna de cinc induce una excesiva muerte embrionaria en regiones y tejidos poblados por células de la cresta neural que son esenciales para la morfogénesis normal del corazón.
La deficiencia de cinc durante el embarazo y la lactancia jugaría un papel importante también en la programación de alteraciones en el metabolismo de lípidos e hidratos de carbono y de la composición corporal de los hijos. Padmavathi et al.51 han mostrado que, en ratas Wistar/NIN, la restricción materna de cinc incrementa el porcentaje de grasa corporal y disminuye la masa magra ósea y muscular en las crías machos y hembras de 6 meses de edad que presentan un bajo peso corporal. La relevancia de esta desnutrición materna radica en que estas alteraciones no fueron revertidas cuando se restableció el adecuado aporte de cinc a partir de la lactancia o el destete.
Por otra parte, los efectos de la deficiencia materna de cinc sobre el metabolismo de lípidos son controvertidos. En trabajos previos hemos mostrado que las ratas expuestas a una deficiencia de cinc durante la vida fetal, la lactancia y el crecimiento presentan un incremento de las concentraciones de triglicéridos séricos sin cambios en las concentraciones de colesterol total, colesterol-HDL y colesterol no HDL en la vida adulta (81 días)46. Sin embargo, otros trabajos han reportado que esta malnutrición materna induce una disminución de las concentraciones de colesterol total, triglicéridos y ácidos grasos libres en las crías a los 90, pero no a los 180, días de vida51. Las diferencias encontradas sugieren que los efectos sobre el metabolismo lipídico serían efímeros y dependientes de la duración y de los periodos de la vida en los que se realizó la restricción de cinc.
El cinc es un elemento traza esencial directamente involucrado en la fisiología y en la acción de la insulina, dado que se ha demostrado que ésta se almacena en la células β del páncreas formando complejos con el cinc52. En este sentido, trabajos previos han demostrado que la restricción materna de cinc puede modular de manera irreversible la síntesis de insulina en la vida adulta. Padmavathi et al.51 reportaron una disminución de los niveles de insulina plasmática en ayunas y luego de una sobrecarga de glucosa, sin cambios en la tolerancia a la glucosa, en ratas adultas sometidas a una deficiencia de cinc durante la vida fetal. Por su parte, Rosario et al.44 han demostrado que la restricción dietaria del 50% de cinc durante la vida prenatal y posnatal de ratones Swiss albino genera intolerancia a la glucosa e hiperinsulinismo, acompañados de hiperlipidemia y aumento de la presión arterial en la vida adulta. Teniendo en cuenta que la insulina es también requerida para el normal crecimiento y desarrollo, es factible que las alteraciones en el metabolismo de la insulina puedan conducir a un crecimiento deficiente y a alteraciones de la composición corporal.
HierroLa deficiencia de hierro durante el embarazo es frecuente en países desarrollados y en desarrollo. Se asocia con una menor edad gestacional para la edad, nacimientos pretérmino y retraso en el desarrollo neurológico de los recién nacidos, principalmente si esta deficiencia se produce durante la primera mitad del embarazo53-55.
La suplementación de hierro se encuentra ampliamente recomendada y utilizada en todo el mundo durante el embarazo. El beneficio de la suplementación de hierro en las mujeres con insuficientes reservas está bien documentado Durante el primer trimestre del embarazo se encontró una relación positiva entre la ingesta total de hierro y de hierro no hemo, proveniente de alimentos y suplementos, y el peso al nacer, pero no con la frecuencia de partos prematuros56,57.
Sin embargo, hay pruebas contradictorias sobre el efecto de su suplementación durante la gestación en mujeres que no tienen deficiencia de hierro. Mientras que algunos autores han observado que la suplementación con hierro en estas mujeres es beneficiosa para el recién nacido58,59, otros han indicado que el exceso de hierro puede inducir estrés oxidativo y hemoconcentración, dos factores que pueden influir negativamente en la salud de la madre y en el desarrollo del feto56,60,61.
Por otra parte, los pocos estudios realizados en humanos han demostrado una relación directa62,63, inversa64,65 o nula66,67 entre los niveles de hemoglobina o hierro maternos y los valores de la presión arterial de sus hijos. Por ejemplo, el estudio longitudinal Avon demostró que los niños de 7 años cuyas madres consumieron suplementos de hierro durante el embarazo presentaron menores cifras de presión arterial65. Sin embargo, la suplementación conjunta de hierro, ácido fólico y cinc en mujeres embarazadas con deficiencia de hierro no modificó los niveles de presión arterial de los hijos a los 6-8 años de edad66. Contrariamente, el proyecto Viva y un estudio realizado en Argentina descubrieron que la suplementación de hierro durante el primer trimestre del embarazo induce un incremento de la presión arterial en los niños62,63.
Mientras tanto, los estudios realizados en animales demostraron que las crías nacidas de madres expuestas a una restricción de hierro durante el embarazo presentan bajos pesos al nacer pero mayor porcentaje de tejido graso visceral y corporal, así como un aumento de la presión arterial y obesidad en la adultez. Más aún, se ha comunicado que el incremento de la presión arterial persiste aun cuando se restituye el adecuado aporte de hierro a partir del nacimiento68-72.
Los resultados controvertidos entre los estudios clínicos y los realizados en animales podrían deberse a varias razones. Por un lado, la deficiencia de hierro y la anemia materna resultan ser más severas en los modelos animales que en algunos estudios clínicos. Por otra parte, los estudios realizados en animales mostraron cambios en la presión arterial a partir de la pubertad, mientras que los estudios clínicos se realizaron en niños de edad preescolar. Es por ello que sería necesario realizar un seguimiento de los niños hasta que alcanzaran mayores edades.
El desarrollo y el funcionamiento adecuados del sistema cardiovascular y renal son críticos para el mantenimiento de la presión arterial dentro de valores normales. Trabajos previos realizados en modelos murinos demostraron que la hipoxia generada como consecuencia de la deficiencia de hierro durante el periodo embrionario resulta en un crecimiento embrionario reducido, un retraso en el desarrollo vascular, una disminución del número de cardiomiocitos y capilares cardíacos que conduce a un incremento compensatorio del tamaño del corazón68,73,74.
Por otra parte, el aumento de la presión arterial que se ha observado en las crías adultas nacidas de madres deficientes en hierro estaría asociado con una reducción del número de nefrones y una mayor sensibilidad al sodio75–77. Trabajos previos reportaron que las crías expuestas a una restricción prenatal de hierro presentaban una mayor respuesta de la presión arterial a la ingesta de sodio en la vida adulta68,76.
Finalmente, los estudios realizados en animales muestran resultados inconsistentes acerca de los efectos de la deficiencia de este mineral sobre la resistencia a la insulina. En estudios realizados en ratas Wistar, la tolerancia a la glucosa mejoró en las crías nacidas de madres expuestas a la deficiencia de hierro a los 3 meses72 pero no a los 14 meses de edad71. Por el contrario, otro estudio no encontró efectos de la deficiencia materna de hierro sobre la tolerancia a la glucosa en las crías a los 10 meses de edad70. Por otra parte, la suplementación prenatal de ácido fólico y hierro o de cinc, ácido fólico y hierro no modificó las concentraciones de insulina, la glucemia y el parámetro HOMA en ayunas en niños de 6 a 8 años de edad71.
CalcioEl consumo materno de calcio durante el embarazo puede influir en el desarrollo de los sistemas cardiovascular y renal, y por lo tanto impactar en los niveles de la presión arterial de los niños y de los individuos adultos. Un estudio realizado en ratas Wistar-Kyoto demostró que tanto la deficiencia como el exceso de calcio están asociados con un incremento progresivo de la presión arterial de las crías hasta la adultez77. Si bien los mecanismos no se han esclarecido hasta el momento, se ha sugerido que la restricción prenatal de calcio puede afectar la secreción de hormonas reguladas por este mineral, como la 1,25 dihidroxivitamina D y la hormona paratiroidea77,78.
Estos resultados son sustentados por varios estudios clínicos que encontraron una asociación entre las concentraciones prenatales de calcio y los niveles de presión arterial que los individuos desarrollan en la vida posnatal79-81. Un estudio mostró que la ingesta de calcio durante el embarazo está inversamente relacionada con la presión arterial sistólica de los niños al mes de vida y con la presión arterial diastólica a los 6 y 12 meses de edad79. En el proyecto Viva, la ingesta dietaria de calcio durante el embarazo también se asoció inversamente con la presión arterial sistólica a los 6 meses de edad (–1,1mmHg/500mg de calcio consumido), pero no a los 3 años, sugiriendo que este efecto no persiste en el tiempo80,81.
Por otra parte, otros estudios han demostrado que la suplementación de calcio durante el embarazo produce efectos sobre la presión arterial de los niños. En Argentina, la suplementación materna de calcio indujo una reducción de la presión arterial media en niños de 7 años82, mientras que en Portland (Oregón, EE. UU.) disminuyó la presión arterial diastólica en 2,2 y 4,8mmHg a los 3 meses y a los 2 años de edad, respectivamente83. Por el contrario, otros estudios mostraron que la suplementación prenatal de calcio no genera cambios en la presión arterial en los niños a los 4 y 10 años de edad84-86. Por lo tanto, se requieren más estudios epidemiológicos y experimentales para determinar si el adecuado aporte de este elemento durante el embarazo puede prevenir el desarrollo de hipertensión en las nuevas generaciones.
Vitamina AExisten importantes evidencias de que el ácido retinoico, la forma biológicamente activa de la vitamina A, es una importante molécula de señalización para el desarrollo cardiovascular y renal durante los periodos embrionarios y fetales. El mismo ácido, al interactuar con receptores nucleares, regula las acciones de diferentes factores de crecimiento que son esenciales para el desarrollo de los órganos87-89.
Este micronutriente se requiere en concentraciones precisas para cada etapa del desarrollo cardíaco embrionario y fetal. Se ha demostrado que es esencial para una población de células precursoras pluripotentes cardíacas denominadas campo del segundo corazón, dado que modula la actividad del factor de crecimiento de fibroblastos 890,91. Dichas células son importantes para el desarrollo del tubo cardíaco, ya que dan origen al ventrículo derecho y al tracto de salida y permiten una correcta alineación de las grandes arterias. Además, se ha reportado la participación de esta vitamina en la formación del epicardio, en la maduración ventricular, en la génesis de las arterias coronarias y en la separación de las cámaras cardíacas. Estudios realizados en humanos y en animales demostraron que tanto la deficiencia de ácido retinoico como su exceso se asocian con malformaciones congénitas, principalmente en la región del tracto de salida, como por ejemplo la doble salida del ventrículo derecho, la transposición de las grandes arterias y la persistencia del tronco arterioso92,93.
Por otra parte, la deficiencia de vitamina A durante la vida fetal programa alteraciones renales en ratas. Trabajos previos reportaron que la restricción moderada de esta vitamina durante la preñez (descenso del 50% de sus concentraciones en circulación) induce una reducción del 20% en el número de nefrones en ratas de 21 días de edad94. Por otra parte, la administración de retinol pudo restablecer el normal desarrollo de los nefrones en las crías nacidas de madres expuestas a una deficiencia de proteínas95.
Además de determinar el número de nefrones en el riñón en desarrollo, se demostró la participación del ácido retinoico en la formación de los túbulos renales en cultivos celulares. El papel de este micronutriente durante la nefrogénesis estaría mediado por el protooncogén c-ret y múltiples factores de transcripción89,96.
Teniendo en cuenta la relación entre la restricción del crecimiento intrauterino y el bajo número de nefrones, se ha enfatizado la importancia de la vitamina A durante la vida fetal en la programación de la morfología y la función renales en los humanos97. Esto se sustenta en trabajos previos que muestran bajas concentraciones de vitamina A en sangre materna y de cordón umbilical de niños con un retraso en el crecimiento intrauterino98. Finalmente, la deficiencia materna de vitamina A se ha asociado también con el desarrollo de hipoplasia renal en niños recién nacidos99.
Si bien se describieron los efectos de la deficiencia de vitamina A durante la vida prenatal sobre la morfología cardíaca y renal, no existen suficientes estudios que evalúen su acción sobre la presión arterial. La suplementación materna con vitamina A no generó cambios en la presión arterial de niños entre los 11 y los 13 años100.
La deficiencia de vitamina A, como la de otros nutrientes (folato, cinc, hierro), puede alterar el desarrollo pancreático o inducir resistencia a la insulina. Existen evidencias de que la vitamina A promueve la generación de células progenitoras endocrinas del páncreas y su posterior diferenciación a células-β101,102. Un estudio realizado en ratas Sprague-Dawley mostró que la deficiencia de vitamina A durante la vida fetal y el crecimiento posdestete causó una reducción del tamaño y del número de células-β por islote en un 50% y disminuyó la tasa de replicación de estas células en las crías. Por otra parte, la deficiencia de vitamina A puede generar intolerancia a la glucosa en la vida adulta, dado que crías de 35 y 65 días de edad alimentadas con una dieta deficiente presentaron una concentración plasmática de insulina un 55% menor y una concentración de glucosa un 76% mayor con respecto al grupo control103. Sin embargo, se requieren más estudios en humanos y en animales que confirmen estos resultados.
Ácido fólicoLas concentraciones bajas de folatos y altas de homocisteína, conjuntamente o independientemente, se consideran un factor de riesgo para el desarrollo de la disfunción endotelial y las enfermedades cardiovasculares. El ácido fólico es un sustrato esencial para la división y la diferenciación celular y constituye un dador de grupos metilos para la metilación de proteínas, lípidos y ADN. Además, interviene en el metabolismo de la homocisteína. El folato de la dieta puede estimular la vasodilatación dependiente del endotelio mediante diferentes mecanismos. Por un lado, este nutriente estimula reacciones de metilación del ADN y la expresión del ARNm de la NOSe. En segundo lugar, aumenta la biodisponibilidad del NO liberado por el endotelio al actuar como un agente antioxidante y al disminuir los niveles de homocisteína, que es un atrapador de NO104-106.
Durante el embarazo, la diminución de ácido fólico y el incremento de homocisteína se asocian con complicaciones vasculares de la madre, como abortos espontáneos, preeclampsia, desprendimientos de la placenta y bajo peso al nacer. Por su parte, la suplementación de folatos durante el embarazo reduce la prevalencia de niños con bajo peso al nacer, y también los trastornos hipertensivos en el embarazo al inducir una reducción de la resistencia vascular uteroplacentaria107,108.
Por otra parte, se ha demostrado que la deficiencia de folatos durante el embarazo también puede inducir disfunción del endotelio vascular en el recién nacido, independientemente del peso al nacer, al disminuir la síntesis o la biodisponibilidad de NO endotelial109,110.
Trabajos realizados en animales sustentan estos resultados. Un estudio realizado en ratas demostró que los niveles maternos de folato pueden atenuar algunas de las alteraciones cardiovasculares generadas por la restricción proteica. Las crías expuestas a una restricción proteica durante la vida prenatal experimentan una vasodilatación atenuada en respuesta al factor de crecimiento del endotelio vascular (VEGF), un aumento de la presión arterial sistólica y menor expresión del ARNm de la NOSe. La suplementación de ácido fólico restableció la respuesta vasodilatadora al VEGF y redujo los niveles de la presión arterial sistólica pero no modificó los niveles de ARNm de la NOSe111.
Por otra parte, un estudio realizado en la región rural de Nepal evaluó cómo la suplementación prenatal con micronutrientes influye sobre marcadores tempranos de enfermedades cardiovasculares en niños de 6 a 8 años de edad. A pesar de que la suplementación de ácido fólico y hierro incrementó el peso al nacer en 45-60g, no afectó la presión arterial, los niveles de lípidos plasmáticos o la resistencia a la insulina de los niños cuyas madres participaron en el estudio. Este trabajo también demostró un efecto protector del ácido fólico sobre la función renal, dado que se observó una disminución del riesgo de padecer microalbuminuria en los niños cuyas madres habían recibido ácido fólico solo o junto con hierro y cinc durante el embarazo66.
Vitamina DTrabajos previos han demostrado que la deficiencia materna de vitamina D puede disminuir el desarrollo metabólico y contráctil del corazón. La deficiencia de vitamina D en ratas hembras Sprague-Dawley durante la lactancia indujo una reducción del 15% de las proteínas miofibrilares del corazón de las crías112. Sin embargo, un estudio realizado en humanos no encontró una fuerte asociación entre los niveles de vitamina D maternos y la función cardiovascular de los hijos, incluyendo la presión arterial sistólica y diastólica, el grosor íntima-media de la carótida, la velocidad de la onda de pulso y varios aspectos de la estructura cardíaca113.
Por otra parte, la deficiencia de este micronutriente durante la vida fetal puede alterar el desarrollo renal. En un experimento usando ratas hembra Sprague-Dawley, la deficiencia de vitamina D durante la vida fetal y la lactancia resultó en un aumento del 20% en el número de nefrones, acompañado de una disminución en el tamaño del corpúsculo renal en las crías114.
ConclusiónEn la actualidad, un nuevo tipo de desnutrición se ha convertido en un problema prevalente: la desnutrición oculta. La crisis económica actual, el estilo de vida poco saludable y el mayor consumo de alimentos elaborados a base de harinas, azúcares y grasas de los países desarrollados han sido el principal impulso para esta afección que permite tener un buen peso corporal o sobrepeso pero presentar al mismo tiempo carencia de micronutrientes fundamentales para el cuerpo humano, como diversas vitaminas, cinc, hierro, calcio y ácido fólico.
La presente recopilación de evidencias clínicas y experimentales demuestra que la deficiencia de micronutrientes en niños y en embarazadas constituye una causa de morbimortalidad importante, dado que induce un menor peso al nacer y programa enfermedades cardiovasculares, renales, metabólicas y endocrinas en la vida adulta. En este sentido, el cinc, la vitamina A, el ácido fólico, el calcio y el hierro son los micronutrientes más estudiados hasta el momento en cuanto a los mecanismos y a los efectos a largo plazo involucrados en el desarrollo de estas enfermedades crónicas. Por ejemplo, se han encontrado relaciones inversas entre el consumo materno de cinc, calcio y hierro y los valores de presión arterial que presentan posteriormente los hijos. Además, las deficiencias maternas de cinc, hierro y vitamina A demostraron afectar el desarrollo renal y cardíaco fetal, dado que se observa una reducción del número de nefrones y diversas anomalías cardíacas que programan una menor capacidad funcional de estos tejidos en el adulto. Por otra parte, la deficiencia de cinc y de folatos durante el embarazo puede inducir disfunción endotelial de los hijos al disminuir la síntesis o la biodisponibilidad de NO. Finalmente, algunos de estos micronutrientes, como el cinc, el hierro y la vitamina A, han demostrado también generar alteraciones en el metabolismo de la insulina y en la composición corporal.
Dadas estas evidencias, se requiere una mayor contribución de la investigación biomédica básica y clínica para dilucidar los mecanismos involucrados en el desarrollo de patologías cardiovasculares en el adulto asociadas con estas deficiencias. Esto permitirá concienciar a la sociedad y al área médico-asistencial sobre la importancia de una dieta equilibrada, especialmente durante el embarazo y el crecimiento.
AutoríaLos autores Cristina Arranz, María Ángeles Costa, Analia Lorena Tomat contribuyeron con las siguientes condiciones de autoría: 1) aportaciones a la idea y diseño o recogida de datos o análisis e interpretación de estos; 2) redacción del borrador del artículo o revisión crítica de su contenido, y 3) aprobación final de la versión para publicar.
Conflicto de interesesNo existe relación financiera o personal que pudiera dar lugar a un conflicto de intereses en relación con el artículo publicado.