El objetivo de este capítulo es presentar información básica sobre la fisiología de las lipoproteínas. La fracción proteica de las lipoproteínas consta de varias apolipoproteínas y enzimas cuyas funciones son el transporte y la metabolización de los lípidos. La clasificación de las lipoproteínas se basa en su densidad y se pueden aislar por ultracentrifugación quilomicrones, VLDL, IDL, LDL y HDL. Los quilomicrones y las VLDL transportan los triglicéridos desde el intestino e hígado, respectivamente, hasta los tejidos periféricos. La metabolización de las VLDL origina las IDL y LDL. Las LDL transportan la mayoría del colesterol plasmático a los tejidos extrahepáticos. La HDL moviliza el colesterol de los tejidos periféricos hacia el hígado, donde se elimina en forma de colesterol libre o sales biliares, proceso conocido como transporte reverso de colesterol. El metabolismo de las lipoproteínas puede ser regulado por receptores nucleares que regulan la expresión de genes del metabolismo de triglicéridos y de las apolipoproteínas.
The aim of this work is to present basic information on the lipoprotein physiology. The protein fraction of lipoproteins consists of several apolipoproteins and enzymes whose functions are lipid transport and metabolism. Classification of lipoproteins is based on their density. Chylomicrons, VLDL, IDL, LDL and HDL can be isolated by ultracentrifugation. Both chylomicrons- and VLDL-triglycerides are transported from the intestine and liver, respectively, to the peripheral tissues. The metabolism of VLDL originates IDL and LDL. LDL is the main transporter of cholesterol to extrahepatic tissues. HDL mobilizes cholesterol from peripheral tissues to the liver where it is secreted to bile as free cholesterol or bile salts, a process termed reverse cholesterol transport. Lipoprotein metabolism can be regulated by nuclear receptors that regulate the expression of genes involved in triglyceride and apolipoprotein metabolism.
El objetivo de este capítulo, dirigido al lector interesado en las dislipidemias, es presentar la información básica sobre la estructura, el metabolismo y la función de las lipoproteínas. Esta información es necesaria para: a)entender el significado de las mediciones habituales del laboratorio clínico que se utilizan en la evaluación del metabolismo lipoproteico, y que son necesarias para establecer el riesgo cardiovascular de los pacientes; b)conocer la base molecular de algunas dislipidemias (lo que permite el diagnóstico molecular de las dislipidemias de herencia monogénica), y c)identificar las dianas terapéuticas sobre las que actúan algunas de las terapias farmacológicas que se utilizan en la actualidad.
Las lipoproteínas son complejos de lípidos y proteínas específicas, que se denominan apolipoproteínas, que tienen como función el transporte de lípidos en un medio acuoso como es la sangre. Las apolipoproteínas (apo) son proteínas que tienen la capacidad de solubilizar los lípidos en la sangre. Las apolipoproteínas se denominan en función de una letra y un número y van desde la apoA-I hasta la apoM. Hay varias decenas de apolipoproteínas descritas, aunque en este capítulo solo comentaremos la función de las mejor conocidas. Los principales lípidos transportados por las lipoproteínas incluyen como elementos mayoritarios el colesterol no esterificado, el colesterol esterificado, los triglicéridos y los fosfolípidos.
En el estudio de la estructura de las lipoproteínas se suelen distinguir 2partes: núcleo y corteza. En el núcleo se encuentran los lípidos más hidrófobos (ésteres de colesterol y triglicéridos), mientras que forman parte de la corteza los dominios más polares de los fosfolípidos y el colesterol no esterificado, además de los dominios más polares de las apolipoproteínas.
Las lipoproteínas se clasifican en función de su densidad, ya que en base a este criterio pueden ser aisladas por ultracentrifugación. Este método separativo permite después la determinación de su contenido apolipoproteico y lipídico. La densidad de las diferentes lipoproteínas viene en buena parte condicionada por su tamaño y por su relación lípido-proteína. Así, las lipoproteínas menos densas son las más grandes y con mayor contenido en lípidos. De mayor a menor tamaño tenemos, pues, quilomicrones, VLDL, IDL, LDL y HDL. Conviene, sin embargo, tener presente que se han definido diferentes tamaños y densidades de diferentes subtipos de VLDL, LDL y HDL y, por tanto, cada clase de lipoproteínas está constituida a su vez por diferentes subpoblaciones de partículas con un interés clínico aún por definir.
Quilomicrones(Para más información, ver referencias 1,2.)
Constituyen las partículas lipoproteicas más grandes y menos densas (d<1,000g/ml), con menos proporción proteica y con un gran componente lipídico, muy enriquecido en triglicéridos. Estas lipoproteínas contienen diversas apolipoproteínas, incluyendo apoB-48, apoA-I, apoC-II, apoC-III y apoE. En humanos, la forma molecular de apoB presente en los quilomicrones es la apoB-48, indicándose de esta forma que solo se expresa el 48% de la longitud de la proteína (que se denomina apoB-100). Ello es debido a una enzima editora de la apoB, que es activa en el intestino humano y que después de la maduración del ARNm introduce un cambio de citosina por uracilo en el codón 2153, lo que induce el cambio de CAA (Gln) a UAA (señal de stop). Por tanto, la traducción de apoB no continuará más allá del aminoácido 2152. La apoB-48 es una proteína necesaria tanto para la estructura como para la función de los quilomicrones, y un marcador proteico específico de este tipo de lipoproteínas.
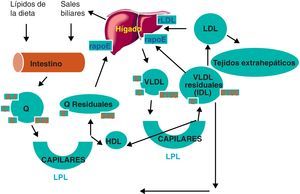
La principal función de los quilomicrones es aportar a los tejidos los lípidos obtenidos de la ingesta, principalmente triglicéridos. Estos últimos, después de su hidrólisis en la luz intestinal, serán absorbidos como ácidos grasos y reesterificados de nuevo en forma de triglicéridos, para ser empaquetados en forma de quilomicrones y luego secretados a la linfa desde los enterocitos, pasando después de la sangre a los tejidos que más los necesitan para su uso (tejido muscular) o almacenamiento (tejido adiposo). Para el catabolismo de quilomicrones se necesita la acción de la lipoproteína lipasa (LPL), una enzima que se encuentra anclada en los capilares de los tejidos antes mencionados y que cataliza la hidrólisis de los triglicéridos de los quilomicrones liberando ácidos grasos. La LPL necesita para ser activa la presencia de apoC-II como cofactor. Esta apolipoproteína se encuentra en los quilomicrones y otras partículas ricas en triglicéridos como son las VLDL, que experimentarán un proceso de lipólisis similar. Como consecuencia de este proceso, los quilomicrones ven reducido su tamaño y pasan a ser denominados quilomicrones residuales, que son captados en cuestión de minutos por receptores hepáticos que reconocen apoE.
La reducción del tamaño de los quilomicrones que se produce por la acción de la LPL reduce fundamentalmente el núcleo de estas lipoproteínas e inestabiliza su estructura, que, para equilibrarse, desprende espontáneamente porciones de su superficie. Estas vesículas discoidales que se desprenden contienen fosfolípidos, colesterol no esterificado y algunas apolipoproteínas, constituyendo uno de los orígenes de las HDL.
Existen diferentes enfermedades hereditarias que afectan a los quilomicrones, de forma aislada a conjunta con las otras lipoproteínas que contienen apoB, bien sea por deficiencia de LPL o de su cofactor, la apoC-II, o de algunas proteínas implicadas en la estructura, procesamiento intracelular y empaquetamiento de los quilomicrones, como son la apoB, la proteína microsómica transferidora de triglicéridos (MTP) y la proteína homóloga al SAR1 de S. cerevisiae (SAR1a).
Lipoproteínas de muy baja densidad(Para más información, ver referencias1,2.)
Las lipoproteínas de muy baja densidad, que suelen denominarse por sus iniciales en inglés, VLDL, son también partículas grandes, poco densas (d<1,006g/ml) y muy ricas en triglicéridos. También tienen una composición apolipoproteica similar a los quilomicrones, salvo en 2aspectos esenciales: no contienen apoA-I y presentan la forma completa de apoB (apoB-100) porque en el hígado, lugar de síntesis de VLDL, no se expresa la enzima editora de la apoB. La apoB-100 es la proteína estructural de VLDL y de las lipoproteínas que se sintetizan en buena parte a partir de su catabolismo: IDL y LDL y Lp(a). El principal estímulo para la síntesis de VLDL parece ser la captación y el catabolismo de quilomicrones residuales por parte del hígado.
La principal función de las VLDL es, de forma análoga a la de los quilomicrones, el transporte de triglicéridos y su suministro (en forma de ácidos grasos) a los tejidos muscular y adiposo. El proceso por el cual se generan los ácidos grasos a partir de los triglicéridos es básicamente idéntico al ya explicado en el caso de los quilomicrones y, por tanto, depende fundamentalmente de la actividad de la enzima LPL y de su cofactor apoC-II. El resultado de esta acción es que las VLDL se hacen más pequeñas, con una relación más pareja en su contenido en colesterol y triglicéridos y con una mayor densidad, flotando en la ultracentrifugación como IDL. También, a semejanza de lo que ocurre en el catabolismo de los quilomicrones, el catabolismo de las VLDL es una de las vías de síntesis de HDL.
Lipoproteínas de densidad intermedia(Para más información, ver referencia3.)
Las lipoproteínas de densidad intermedia, o IDL (d<1,019g/ml, >1,006g/ml) son un grupo minoritario de lipoproteínas que, como se ha mencionado, tienen una composición apolipoproteica similar a las de VLDL. Estas lipoproteínas son, sin embargo, más pequeñas y densas que aquellas, presentando una menor proporción relativa de triglicéridos respecto al colesterol, como corresponde a su origen mayoritario como producto de la lipólisis de las VLDL.
Se cree que aproximadamente la mitad de las partículas de IDL son capturadas a nivel hepático por receptores que reconocen apoE, mientras que la otra mitad son convertidas en LDL mediante un proceso complejo en el que interviene la lipasa hepática (LH).
Como se ha mencionado, en una situación de ayunas como en la que se realizan la mayoría de análisis clínicos, las IDL proceden mayoritariamente de las VLDL. Sin embargo, en una situación posprandial o en algunas situaciones patológicas pueden producirse e incluso acumularse partículas de IDL que correspondan a quilomicrones residuales.
La enfermedad prototipo de acumulación de IDL es la disbetalipoproteinemia familiar, que es debida en parte a la presencia de variantes genéticas específicas de apoE (lo que se conoce como genotipo apoE2/E2) que parecen tener una menor afinidad por los receptores apoE-específicos hepáticos
Lipoproteínas de baja densidad(Para más información, ver referencias 4,5.)
Las lipoproteínas de baja densidad, o LDL (d<1,063g/ml, >1,019g/ml), se caracterizan por su contenido en apoB-100 y tienen como componente lipídico mayoritario los ésteres de colesterol.
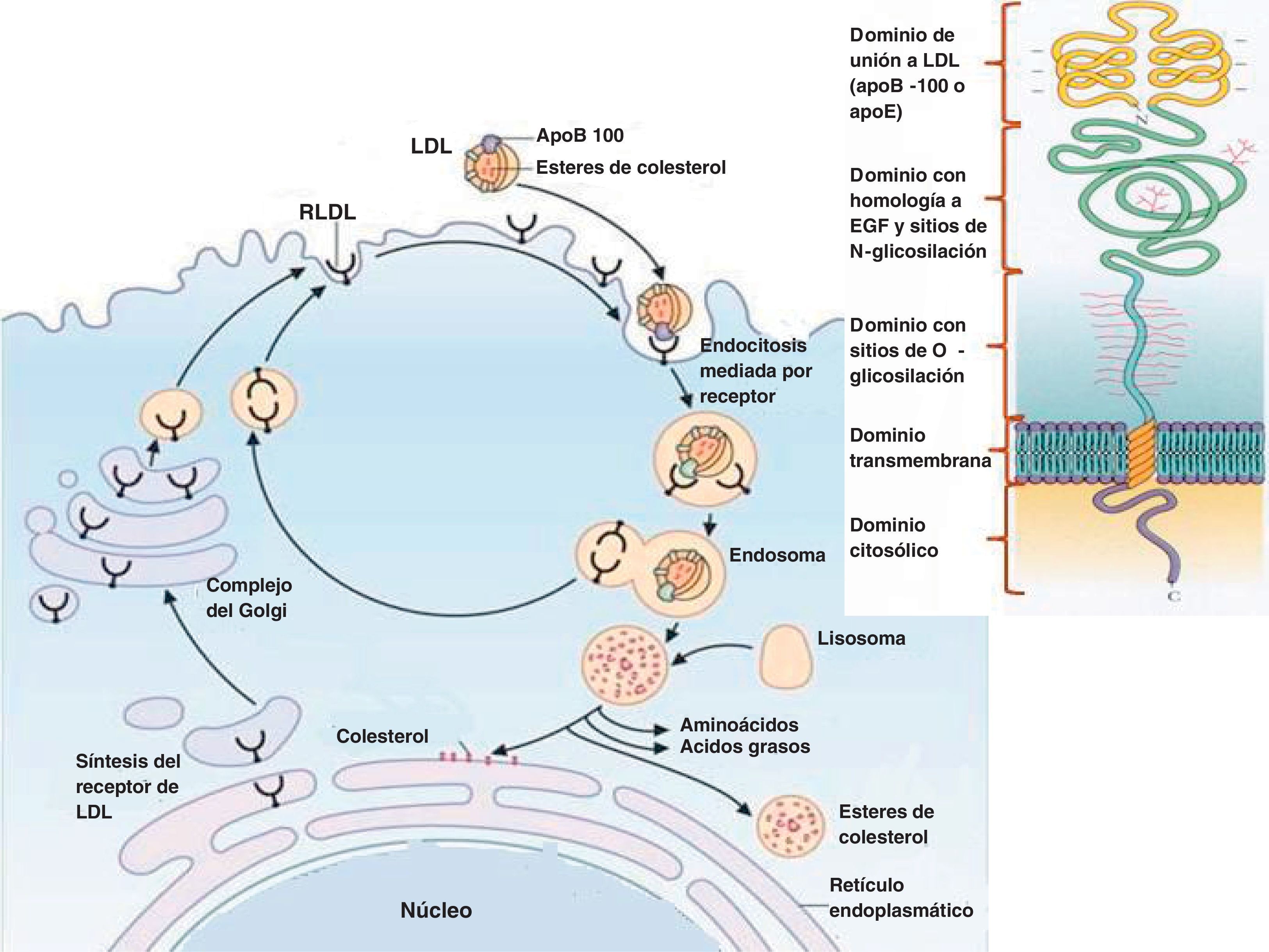
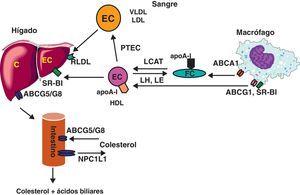
La función de las LDL es el transporte y entrega de colesterol a las células, incluyendo tejidos periféricos e hígado. Las LDL son reconocidas por los receptores de LDL situados en la membrana plasmática que reconocen apoB-100 y apoE (fig. 1). El receptor de LDL es sintetizado por múltiples estirpes celulares y viaja hacia la membrana plasmática quedando fijado por una proteína, denominada clatrina, en unas zonas específicas que se denominan hoyos revestidos. Aproximadamente cada 5min, hayan unido o no LDL, estos hoyos revestidos experimentan endocitosis y son transportados hacia el citoplasma en forma de endosomas. En el caso de que contengan LDL unidas al receptor, el contenido proteico y lipídico de las mismas es hidrolizado hasta formar aminoácidos y colesterol no esterificado. El colesterol no esterificado es tóxico para las células por encima de una cierta concentración y, por tanto, debe ser o bien utilizado (para síntesis de membranas o de hormonas esteroideas, por ejemplo), o bien convertido por enzimas del tipo acil:colesterol aciltransferasa (ACAT) en ésteres de colesterol, forma en que pueden ser guardados como reservorio celular de colesterol. El receptor de LDL, una vez completado su ciclo celular, puede ser degradado por la PCSK9 o bien reciclado para volver a comenzar el ciclo.
Las células pueden también sintetizar de novo colesterol a través de una larga vía de síntesis (endógena) que tiene como punto crítico de regulación el paso de hidroximetilglutarilCoA (HMCoA) a mevalonato, paso catalizado por la HMGCoA reductasa. Sin embargo, la mayor eficiencia de la vía de síntesis del receptor de LDL hace que predomine sobre la activación de la vía de síntesis endógena de colesterol, ya que mediante la síntesis de menos proteínas consiguen acceso a un mayor número de moléculas de colesterol. Los niveles de colesterol no esterificado intracelular regulan de forma coordinada los 2sistemas de síntesis de colesterol, asegurando así su coordinación y evitando un exceso de colesterol intracelular.
La expresión y la funcionalidad adecuadas de los receptores de LDL son un determinante importante de la concentración de LDL sérico. Como prueba, la hipercolesterolemia familiar, que es una enfermedad autosómica dominante causada por mutaciones en el gen del receptor de LDL o, menos frecuentemente, del dominio de ligando de apoB-100 o de PCSK9, presenta concentraciones séricas elevadas de LDL. En este contexto es importante conocer que el tipo de medicamentos hipocolesterolemiantes más usados en clínica, las estatinas, funcionan inhibiendo la HMGCoA reductasa, ya que de esta forma se consigue un aumento de la síntesis de receptor de LDL celular, lo que disminuye la concentración sérica de LDL y, por tanto, de colesterol.
Lipoproteínas de alta densidad(Para más información, ver referencias 6,7.)
Las lipoproteínas de alta densidad, o HDL (d<1,21g/ml, >1,063g/ml), se caracterizan por su contenido en apoA-I, teniendo también como componente principal los ésteres de colesterol. Su síntesis depende, por una parte, del catabolismo de las partículas ricas en triglicéridos (quilomicrones y VLDL) y, por otra parte, de la síntesis de apoA-I, en un principio no asociada a lípidos, por parte del hígado y del intestino.
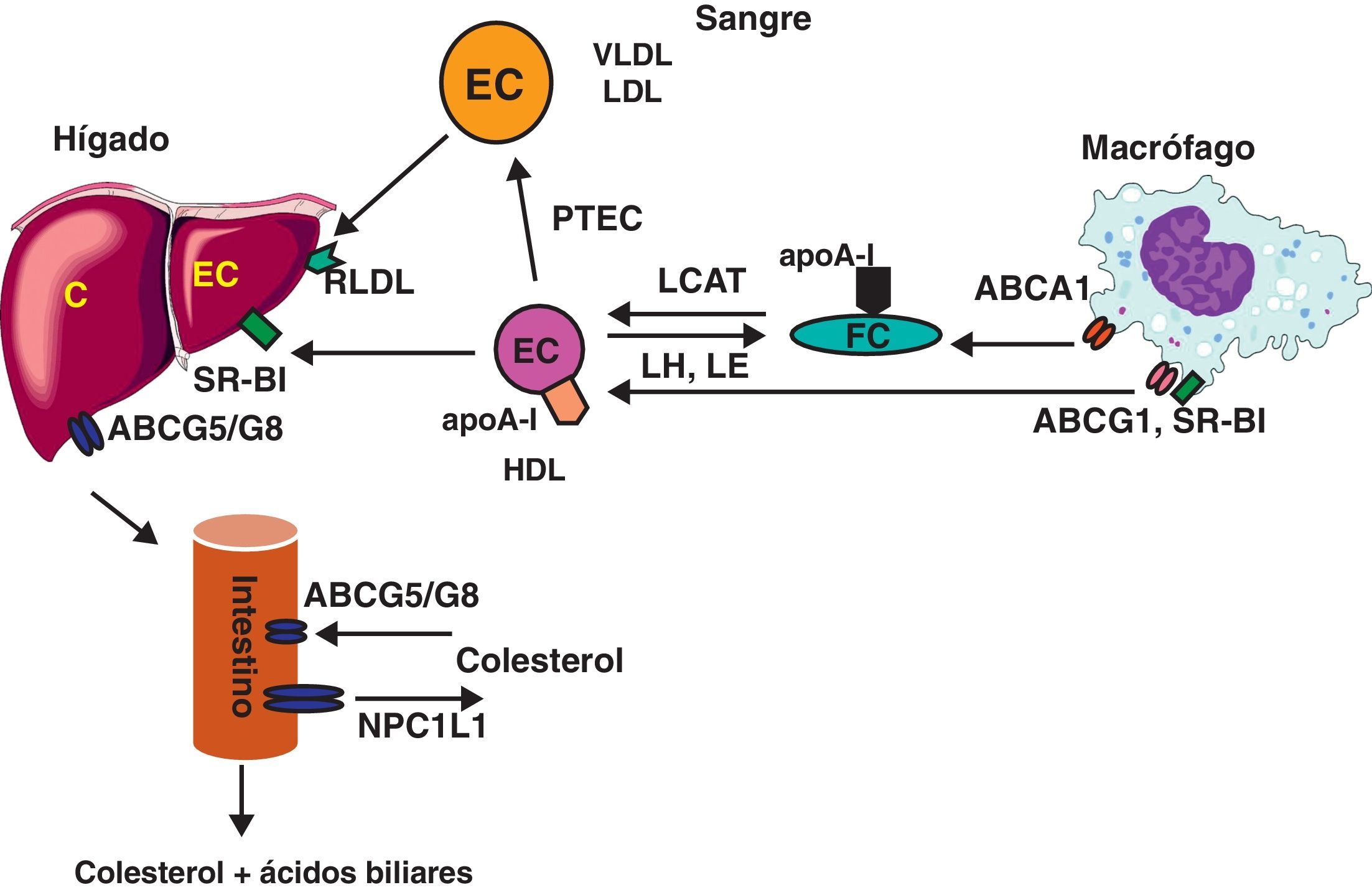
La más conocida de las funciones de las HDL es el transporte reverso de colesterol (fig. 2), aunque otras, como la inhibición de la modificación oxidativa de las LDL o su capacidad antiinflamatoria y antitrombótica, parecen también altamente relevantes. La función de las HDL depende en buena parte de su contenido en apoA-I, su apolipoproteína principal. Esta apolipoproteína facilita la salida del exceso de fosfolípidos y colesterol intracelular a través de mecanismos específicos que requieren consumo de energía. Este paso, conocido como eflujo, depende de su interacción con transportadores de tipo ATP-binding cassette A1 y G1 (ABCA1 y ABCG1). También existe, en menor grado, eflujo de colesterol de células periféricas a través del receptor scavenger receptor B-I (SR-BI). Posteriormente, el colesterol HDL obtenido del eflujo celular pasará a ser esterificado por el enzima lecitin:colesterol aciltransferasa (LCAT), que también necesita de la presencia de apoA-I como cofactor. El aumento de colesterol esterificado en el núcleo de las HDL irá aumentando el tamaño y redondeando la forma de las HDL, hasta que finalmente su contenido en ésteres de colesterol será liberado a los hepatocitos tras interaccionar con SR-BI. El colesterol captado de esta forma puede llegar a ser eliminado por la bilis y las heces, tras secreción hepática e intestinal mediada por un heterodímero de ABCG5/ABCG8. Alternativamente, el colesterol puede ser convertido, a nivel hepático, en ácidos biliares, siendo estos eliminados por vía biliar y fecal si no son antes reabsorbidos a nivel intestinal. Dado que el colesterol no puede ser degradado por el organismo, el transporte reverso de colesterol (y ácidos biliares) es la única vía conocida de eliminación de colesterol de nuestro organismo. Esto explica que algunos fármacos hipocolesterolemiantes, como las resinas de intercambio catiónico (p.ej., la colestiramina) y los inhibidores de la absorción intestinal de colesterol (como la ezetimiba) actúen a este nivel inhibiendo, respectivamente, la absorción intestinal de ácidos biliares y de colesterol.
Es importante señalar que en los seres humanos la lipoproteína mayoritaria es la LDL; también se produce una transferencia no específica de colesterol entre diversos tipos de lipoproteínas, en un proceso que es catalizado por la proteína transferidora de ésteres de colesterol (PTEC). El resultado final de su acción depende de la concentración de las diferentes lipoproteínas y de su tiempo de vida media, y es la transferencia de colesterol de HDL a LDL y VLDL, y de triglicéridos de VLDL a HDL. Aunque no se conoce bien el significado fisiológico de estos intercambios, los animales con menor actividad PTEC (como los roedores) no presentan susceptibilidad a la arteriosclerosis y tienen la HDL como lipoproteína mayoritaria.
La entrega de colesterol por parte de HDL a través del receptor SR-BI, así como la acción de la lipasa endotelial (LE) y de la PTEC, tienden a disminuir el tamaño de las partículas de HDL, lo que parece ser importante para que dichas partículas puedan seguir funcionando en nuevos ciclos de transporte reverso de colesterol. Sin embargo, en estos procesos de lipólisis y transferencia se pierden lípidos hidrófobos y se desprende de la superficie de la HDL apoA-I (que es catabolizada a nivel renal), lo que disminuye el tamaño de HDL. Existe una clara relación de tipo directo, a nivel poblacional, entre el tamaño de las partículas de HDL y la concentración de colesterol HDL.
Existen diferentes enfermedades hereditarias por deficiencia de HDL que son debidas a mutaciones en algunos de los genes siguientes: ABCA1, APOA1 y LCAT. También existen alteraciones hereditarias que causan aumento de HDL, como son las debidas a mutaciones en el gen de la PTEC, LH o LE.
Lipoproteína (a)(Para más información, ver referencia 8.)
Las lipoproteína(a), o Lp(a), es el único tipo de lipoproteínas que en vez de ser definido por su densidad (similar a las LDL) lo es por la presencia de una apolipoproteína específica, la apo(a), que se une a la apoB-100 por diversos tipos de enlaces químicos, entre ellos un puente disulfuro.
La concentración sérica de Lp(a) está mayoritariamente determinada de forma hereditaria. Esta heredabilidad está ligada al número de repeticiones que presenta una de sus subunidades, denominadas kringles. Así, el número de copias presentes del kringle4, subtipo2, se asocia directamente con el tamaño molecular de la apo(a) e inversamente con la concentración plasmática de Lp(a). Se cree que la base de esta asociación inversa se encuentra a nivel de la síntesis de Lp(a) más que a nivel de su catabolismo.
La función o funciones de la Lp(a) no son bien conocidas. Se ha postulado que podría regular a la baja la fibrinólisis al competir por la activación del plasminógeno. La concentración de Lp(a) se correlaciona de forma directa con el riesgo de aterotrombosis.
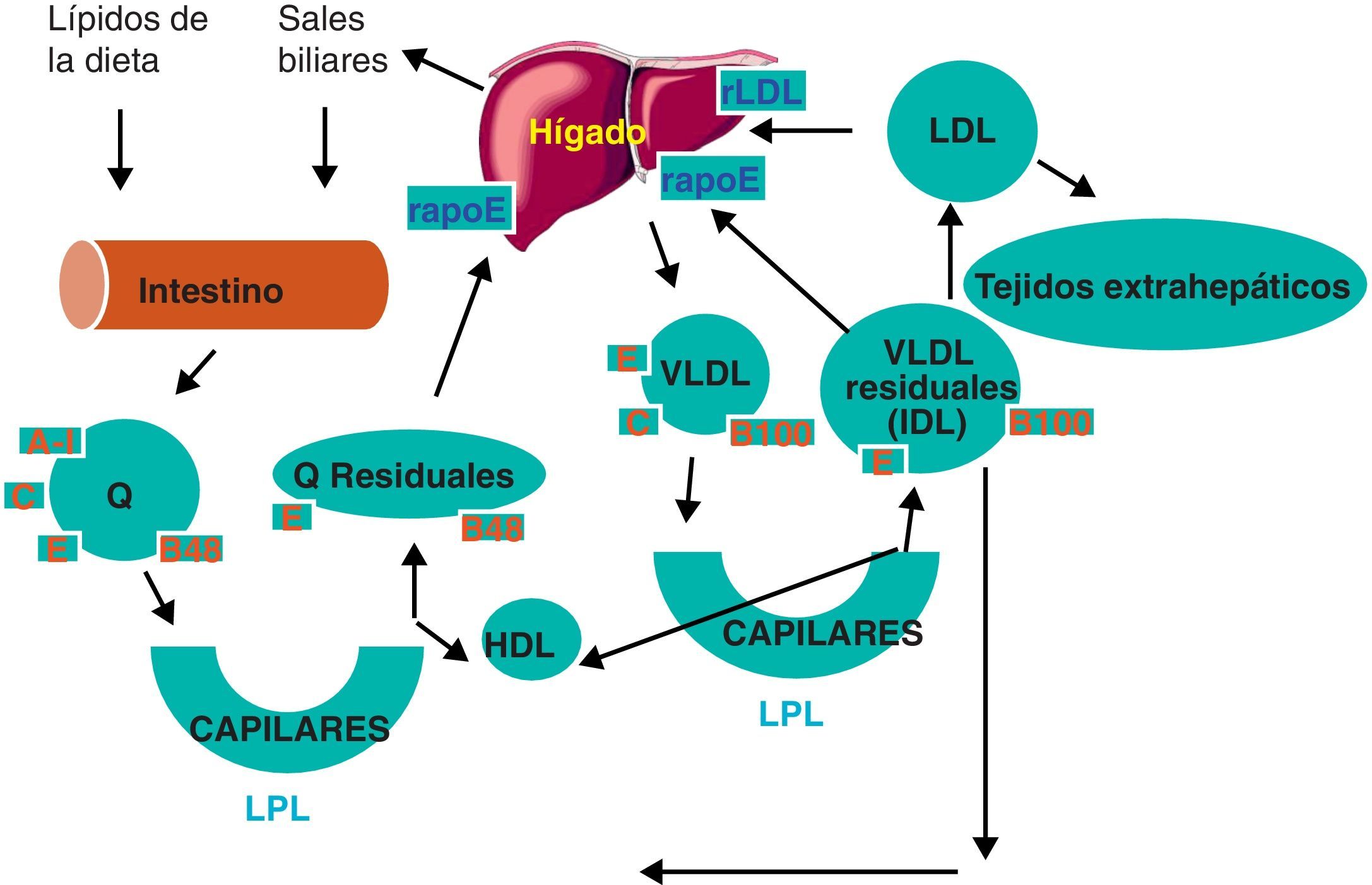
Metabolismo integrado de las lipoproteínasEn la figura 3 se presenta una visión integrada del metabolismo lipoproteico, mostrando la muy alta interrelación entre el metabolismo de las diferentes lipoproteínas. En este sentido hay varios aspectos especialmente destacables. El primero, la relación entre el eficiente catabolismo de quilomicrones y VLDL y la síntesis de HDL. Este hecho, ya mencionado previamente, explica parcialmente la relación inversa que se suele encontrar entre concentración de triglicéridos y colesterol HDL en pacientes y poblaciones. El segundo, es que esta estrecha interrelación entre metabolismo y función es debida a que diversas vías metabólicas y funcionales, ya tratadas previamente, son controladas a nivel de factores de transcripción activables por ligandos, siendo algunos de estos ligandos ácidos grasos no esterificados y eicosanoides. Así, los receptores nucleares PPARalfa, PPARdelta, PPARgamma y LXR, que regulan simultáneamente la expresión de genes del metabolismo de triglicéridos y de las apolipoproteínas de HDL (caso de PPARalfa) o diversas proteínas involucradas en el transporte reverso de colesterol (caso de LXR). En este sentido, es de interés conocer que los fibratos que se utilizan para disminuir la concentración de triglicéridos y aumentar el colesterol HDL son agonistas artificiales de PPARalfa. El tercero y último es la ya mencionada existencia de diversas lipasas (como la hepática) o proteínas de transporte de lípidos (como la PTEC) en el suero que modulan simultáneamente diferentes lipoproteínas.
La evolución global del metabolismo lipoproteico mediante el uso de marcadores de uso clínico suele incluir la determinación bioquímica del colesterol total y su distribución en las diferentes lipopoproteínas (VLDL, LDL, HDL), triglicéridos y, en algunos casos, apoB-100 y Lp(a).