Los linfomas primarios de la glándula mamaria son un raro subtipo de linfoma no Hodgkin que representan del 0.04 al 0.5% de los tumores malignos mamarios, del 0.38 al 0.7% de todos los linfomas y del 1.7 al 2.2% de los linfomas extranodales. El tratamiento de elección está basado en la quimioterapia que contenga antraciclinas y rituximab. La cirugía está limitada a ser lo menos invasiva, y únicamente con propósitos diagnósticos; la radioterapia tiene un importante rol como terapia de consolidación, particularmente en pacientes con ganglios negativos.
Caso clínicoMujer de 70 años con un nódulo mamario izquierdo en el cuadrante superoexterno de crecimiento lento, expansivo, indoloro, acompañado de cambios cutáneos, con ataque al estado general, pérdida de peso, fatiga, calosfrío y diaforesis. Tiene sustitución tumoral de la glándula mamaria, con cambios por invasión en la piel; axila con adenopatía de 5cm. En la mastografía se observa engrosamiento de la piel y un patrón denso que sustituye el 80% del tejido mamario, así como adenopatías con pérdida del centro radiolúcido e invasión en tejidos blandos. Una biopsia corrobora linfoma no Hodgkin difuso de células grandes de alto grado. Recibe quimioterapia con esquema tipo Rituximab (R-CHOP) y radioterapia con campos tangenciales y axilo/supraclaviculares. Una vez finalizado el tratamiento, la paciente queda en vigilancia médica por el Servicio de Oncología y, a 15 meses, se encuentra viva sin actividad de la enfermedad.
ConclusionesLos linfomas primarios de la glándula mamaria son una entidad rara. El tratamiento suele ser multimodal, donde la quimiorradioterapia combinada es la piedra angular; la cirugía está reservada con fines de diagnóstico.
Primary breast lymphomas, a rare subtype of non-Hodgkin's lymphoma, represent 0.04 to 0.5% of all breast cancers, 0.38 to 0.7% of all lymphomas, and 1.7 to 2.2% of extranodal lymphomas. The treatment choice is based on chemotherapy containing anthracycline and rituximab. Surgery is limited to being less invasive and only for diagnostic purposes. Radiotherapy has an important role as consolidation therapy, particularly in patients with negative nodes.
Clinical caseA 70 year old woman with a breast nodule in the left upper outer quadrant, with slow growth, expansive, painless, and accompanied by skin changes, malaise, weight loss, fatigue, chill, and sweating. There was tissue replacement by the mammary gland tumour, skin changes due to invasion, and a 5cm axillary lymphadenopathy. The mammography showed skin thickening and a dense pattern of 80% of breast tissue replacement, and the lymphadenopathy with loss of radiolucent centre and soft tissue invasion. The biopsy confirmed a diffuse high grade large cell lymphoma. She received an Rituximab (R-CHOP) chemotherapy scheme and radiotherapy with tangential and supraclavicular and axillary fields. After completing the chemotherapy, the patient is on follow-up, and at 15 months she is alive without disease activity.
ConclusionsPrimary lymphoma of the breast is a rare entity. Multimodal treatment with combined chemo-radiotherapy is the cornerstone. Surgery is reserved only for diagnostic purposes.
Los linfomas primarios de la glándula mamaria son un raro pero bien definido subtipo de linfoma no Hodgkin, que representan del 0.04 al 0.5% de los tumores malignos de la glándula mamaria, del 1.7 al 2.2% de los linfomas no Hodgkin extranodales y del 0.38 al 0.7% de todos los linfomas no Hodgkin1–3.
El término de linfoma de la glándula mamaria hace referencia a linfomas primarios que ocurren en la glándula mamaria, en ausencia de otras localizaciones previamente detectadas de linfoma1.
Son 4 los criterios diagnósticos de esta entidad establecidos por Wiseman y Liao4 desde 1972. Consisten, el primero, en la evaluación patológica adecuada de la enfermedad esencial en el diagnóstico; el segundo, en la asociación en la proximidad del tejido mamario con la infiltración linfomatosa en la glándula mamaria; el tercero es un criterio de exclusión que corresponde a las pacientes con enfermedad diseminada concurrente o a aquellas con diagnóstico previo de linfoma extramamario; finalmente, el cuarto criterio se refiere a la invasión ganglionar homolateral que es considerada aceptable, siempre y cuando ambas lesiones se hayan desarrollado de manera simultánea.
El tratamiento de elección posterior al diagnóstico y estadificación debe basarse en el uso de quimioterapia con regímenes que contengan antraciclinas y rituximab (R-CHOP). La cirugía está limitada a ser lo menos invasiva y únicamente con propósitos de diagnóstico. El empleo de radioterapia tiene un importante rol como terapia de consolidación, particularmente en las pacientes con ganglios negativos1–3.
El caso que se presenta es el de una paciente con linfoma no Hodgkin de la glándula mamaria izquierda que fue manejada con biopsia de la lesión confirmatoria de la enfermedad y recibió quimioterapia con esquema a base del anticuerpo monoclonal rituximab junto con ciclofosfamida, doxorrubicina, vincristina y prednisona (R-CHOP) por 8 ciclos, seguida de radioterapia a la glándula mamaria y campo axilo/supraclavicular, además de rituximab de mantenimiento por 12 meses; a 15 meses de seguimiento se mantiene viva y sin evidencia de actividad de la enfermedad.
Caso clínicoMujer de 70 años de edad, enviada al Servicio de Oncología del Hospital de Ginecopediatría No. 48 del Instituto Mexicano del Seguro Social, con el diagnóstico de referencia de cáncer de mama izquierda.
Es diabética y está en tratamiento con hipoglucemiantes orales; además es hipertensa, por lo que toma enalapril.Inició su padecimiento 4 meses antes de su consulta con autodetección de un nódulo mamario izquierdo. La lesión inicial se ubicó en el cuadrante superoexterno de la glándula mamaria izquierda, el crecimiento fue lento, expansivo e indoloro; acompañado de cambios cutáneos locales y ataque al estado general, pérdida de peso, fatiga, calosfrío y diaforesis. Por lo que acudió a su Unidad de Medicina Familiar, en el que se diagnosticó como mastitis y se le indicó tratamiento con antibióticos y debido a que no presentó mejoría de la lesión mamaria ni de las lesiones cutáneas, por lo que fue enviada al Servicio de Oncología del Hospital de Ginecopediatría. No. 48.
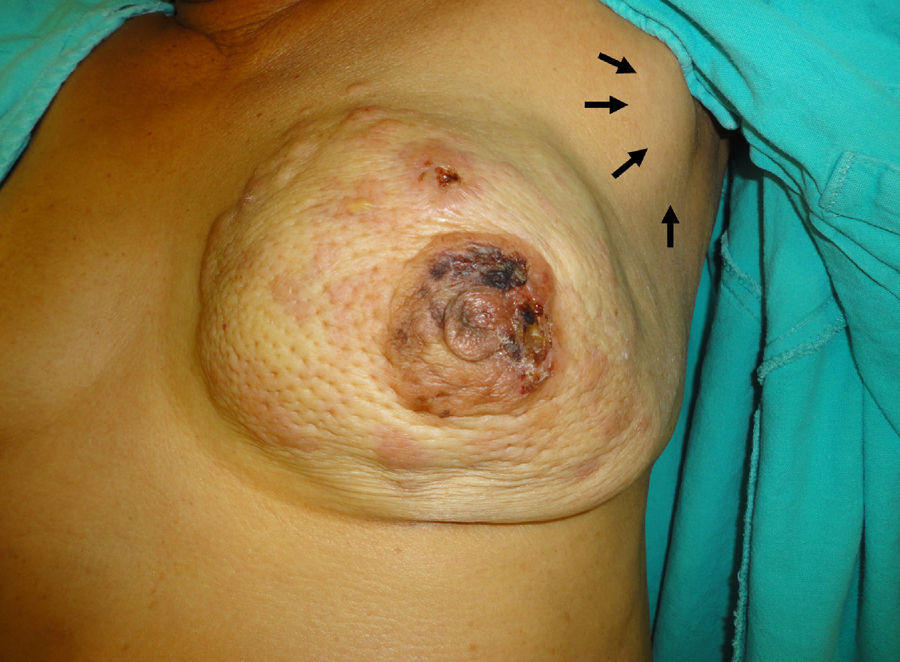
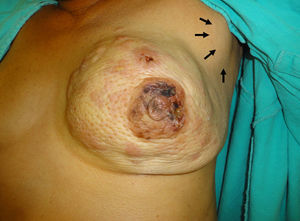
Se presenta a consulta con asimetría por sustitución tumoral de la glándula mamaria izquierda, la cual tiene aumento de volumen y un tumor que abarca los 4 cuadrantes, libre con relación al pectoral; cambios cutáneos por invasión, piel de naranja, cutánides, retracción del complejo aréola-pezón con invasión, áreas de isquemia en la superficie de la aréola, a la expresión del pezón no hay salida de material alguno. La axila ipsilateral con un conglomerado de 5 cm de diámetro en nivel II, móvil. Supraclavicular sin adenopatías cervicales, y el resto de la exploración sin cambios relevantes (fig. 1).
Imagen clínica de la glándula mamaria izquierda en la que se puede apreciar claramente asimetría por sustitución tumoral con aumento de volumen, que abarca los 4 cuadrantes, cambios cutáneos por invasión, piel de naranja, cutánides, retracción del complejo aréola-pezón con invasión de áreas de isquemia en la superficie de la aréola, en la axila se puede apreciar un conglomerado ganglionar (flechas).
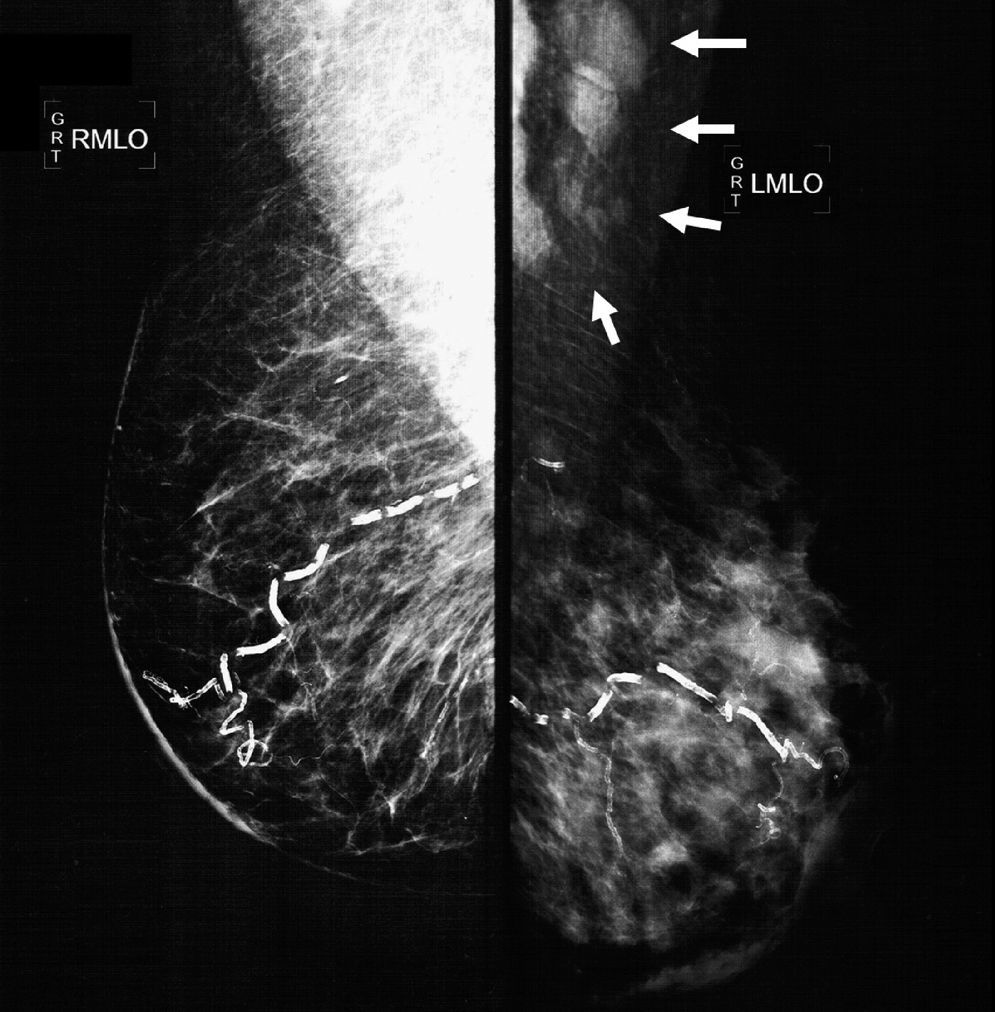
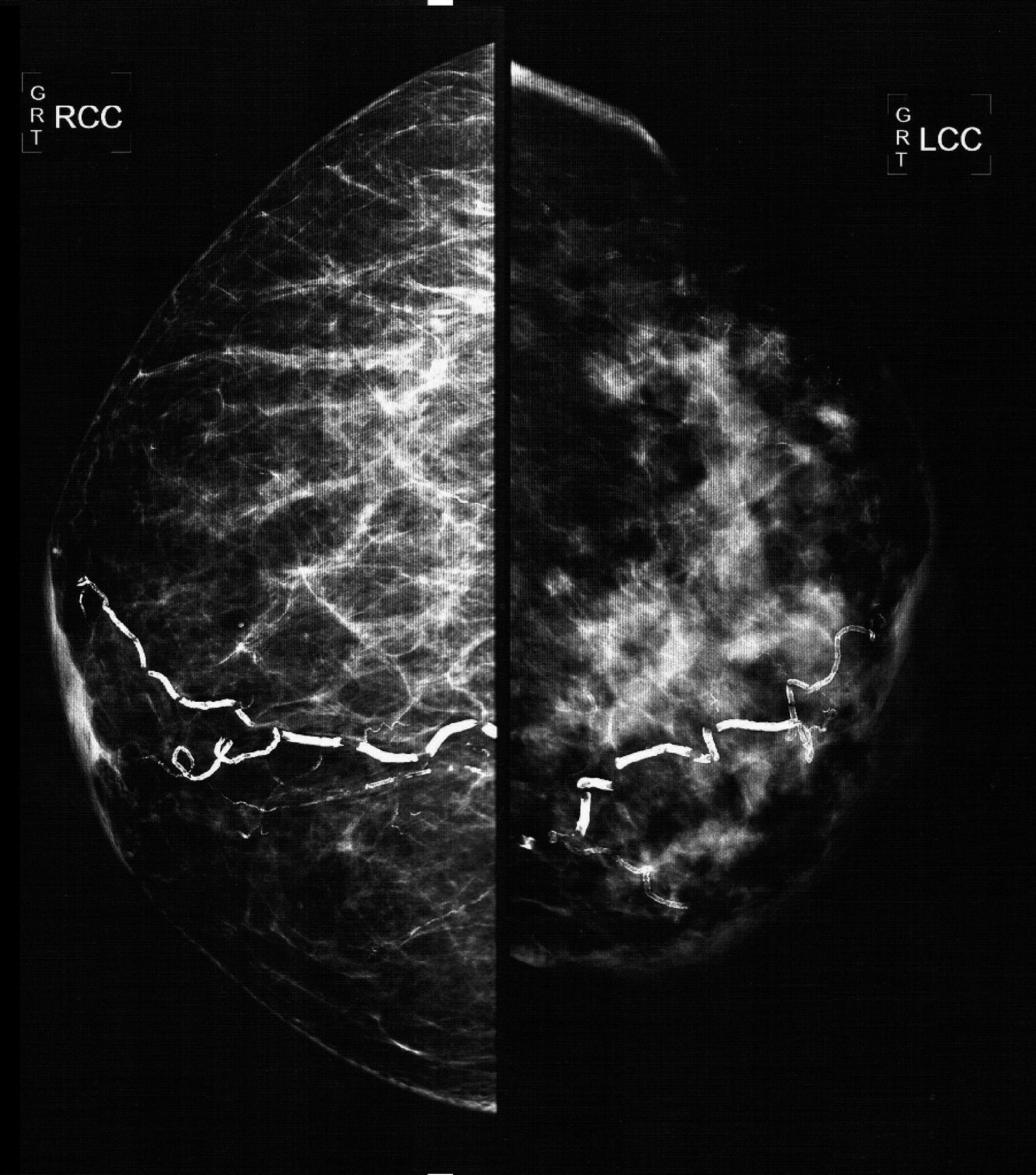
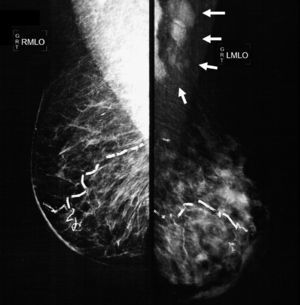
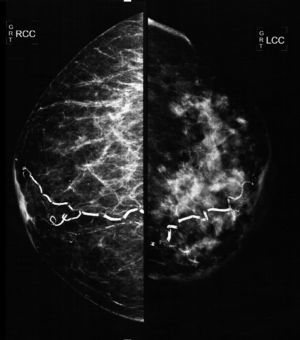
El estudio mastográfico reveló: engrosamiento difuso de la piel de la glándula mamaria izquierda, con patrón denso que sustituye el 80% del tejido mamario y se extiende en forma irregular al plano graso pre- y retromamario; los trayectos vasculares se encontraron parcialmente calcificados. En las regiones axilares se identifican múltiples adenopatías densas con pérdida del centro radiolúcido e invasión en tejidos blandos adyacentes (figs. 2 y 3).
Mastografía en posición oblicuo-lateral en la que se aprecia un engrosamiento difuso de la piel de la glándula mamaria izquierda, un patrón denso que sustituye el 80% del tejido mamario y se extiende en forma irregular al plano graso pre- y retromamario. Los trayectos vasculares se encuentran parcialmente calcificados. En la región axilar izquierda se identifican múltiples adenopatías densas con pérdida del centro radiolúcido e invasión en tejidos blandos adyacentes (flechas).
Mastografía en posición cefalocaudal en la que se aprecia un engrosamiento difuso de la piel de la glándula mamaria izquierda, un patrón denso que sustituye el 80% del tejido mamario y se extiende en forma irregular al plano graso pre- y retromamario. Los trayectos vasculares se encuentran parcialmente calcificados.
El ultrasonido complementario confirmó el engrosamiento difuso de la piel; el tejido glandular mostró áreas sólidas, irregulares, vascularizadas en distribución en forma concéntrica en las líneas A y B, las cuales se comunican entre sí relacionadas con áreas de infiltración difusa. En la axila se encuentran adenopatías múltiples de hasta 3.3cm, con pérdida del hilio graso.
Se establece el diagnóstico clínico de probable cáncer de mama. Por la extensión local de la lesión se estadifica como cT4b vs. cT4d por la presencia de cutánides o infiltración linfática en la piel de la glándula mamaria y cN2 por un conglomerado axilar ipsilateral, etapa clínica IIIB. Se toma una biopsia de la glándula mamaria con huso de piel para documentar la infiltración dérmica y se solicitan en ese mismo instante estudios de extensión tumoral; el reporte histopatológico de la biopsia corrobora la infiltración por un linfoma no Hodgkin difuso de células grandes de alto grado histológico.
El perfil inmunohistoquímico de la lesión da como resultado CD20 positivo, CD10 positivo, BCL-2 positivo, Ki-67 positivo en el 100% de las células tumorales, CD5, ciclinas y MUM-1 negativos. Se confirma un linfoma no Hodgkin difuso inmunofenotipo B con un índice de proliferación del 100%.
Una tomografía computada toraco-abdomino-pélvica se reporta sin actividad tumoral en otros órganos, a excepción de la lesión mamaria y la adenopatía axilar. La radiografía simple de tórax es normal. La deshidrogenasa láctica se encontró casi al doble del valor normal en 1,146 U, la beta-2 microglobulina con valor normal de 3.34 mg.; el resto de los parámetros de laboratorio son normales. En el aspirado de la médula ósea no se encontró infiltración alguna.
Se estadifica como linfoma no Hodgkin etapa IIE, tanto por afección local en la glándula mamaria como por la infiltración axilar ipsilateral.
Recibió quimioterapia de inducción con esquema R-CHOP, 8 ciclos en total, un ciclo cada 3 semanas. Al término de este esquema recibió rituximab de mantenimiento como terapia monofármaco un ciclo cada 8 semanas durante 12 meses. Al término del esquema de R-CHOP recibió radioterapia con campos tangenciales y axilo/supraclavicular 50.4Gy en 25 fracciones.
Después del segundo ciclo de tratamiento, los cambios cutáneos en la glándula mamaria disminuyeron, al igual que la adenopatía axilar; los niveles séricos de deshidrogenasa láctica retornaron a su valor normal.
Un estudio mastográfico de control a los 6 meses mostró cambios asociados a fibrosis mamaria sin evidencia de actividad de la enfermedad.
Una vez finalizado el tratamiento, la paciente queda en vigilancia: a 15 meses se encuentra viva y libre de actividad de la enfermedad.
DiscusiónLos linfomas primarios de la glándula mamaria son afecciones inusuales que comparten similitudes clínicas y radiográficas que comúnmente se aprecian en el cáncer de mama.
Los criterios diagnósticos del linfoma primario de la glándula mamaria fueros establecidos por Wiseman y Liao4 en 1972 y se revisaron posteriormente por Hugh et al.5 en 1990 y consisten en una evaluación patológica adecuada de la enfermedad; en la asociación en proximidad del tejido mamario con la infiltración linfomatosa en la glándula mamaria; en la ausencia de enfermedad diseminada concurrente, aunque la invasión ganglionar homolateral es considerada aceptable siempre y cuando ambas lesiones se hayan desarrollado de manera simultánea. Hugh et al.5 consideraron a aquellas pacientes en las que la glándula mamaria fuera el sitio de presentación de la enfermedad o el más voluminoso, aunque en los estudios de extensión se demuestren sitios de invasión ganglionar a distancia (etapa III) o en la médula ósea. Se excluye, además, a todos los pacientes que tengan el diagnóstico previo de linfoma extramamario.
Las manifestaciones clínicas asociadas al linfoma no Hodgkin son variadas y el síntoma más frecuente asociado a la enfermedad es una masa palpable, la cual se localiza más comúnmente hacia el cuadrante superoexterno de la glándula mamaria que puede ser o no dolorosa y esta manifestación se presenta en el 60.7% de los casos, las adenopatías axilares se presentan en el 25% de los pacientes, el dolor mamario en el 11.9% y la inflamación local en el 10.7%1,3,6. Otras manifestaciones menos frecuentes son retracción o descarga a través del pezón, retracción de la piel, eritema y apariencia de piel de naranja3,6.
Debido a la baja frecuencia de los linfomas no Hodgkin de la glándula mamaria, las manifestaciones de la enfermedad pueden ser indistinguibles de las que se presentan en las pacientes con cáncer de mama, por lo que el diagnóstico de la entidad suele establecerse en el momento de la biopsia3.
La evaluación por imagen del linfoma de la glándula mamaria puede ser llevada mediante el empleo del estudio de mastografía, el ultrasonido mamario, la resonancia magnética nuclear o la tomografía por emisión de positrones (PET-CT).
Los cambios mastográficos asociados a esta entidad incluyen la infiltración de depósitos linfomatosos en la forma de opacidades difusas incrementadas o asimetrías globales en el 16% y los patrones mastográficos densos, que pueden ocurrir en el 56% de las pacientes. Es posible identificar nódulos mamarios en el 76%; estos son solitarios (72%) o múltiples (3%) y de márgenes indistintos en el 72%, no calcificados y lobulares en el 56%7. Llegan a ser bilaterales hasta en un 28%; metástasis axilares ipsilaterales pueden apreciarse en más del 40% de las pacientes; el tamaño del tumor habitualmente oscila entre 1 y 5 cm6–8.
En el estudio ultrasonográfico, una masa tumoral es visible hasta en el 90% de los casos y en el 10% es posible apreciar distorsión de la arquitectura mamaria. El hallazgo más común es la existencia de masas solitarias e irregulares. Esta imagen se aprecia casi en la mitad de las pacientes, los márgenes son indistintos en el 59%, y hasta el 64% de los casos no presentan fenómenos acústicos posteriores. Los tumores son predominantemente hipoecoicos en el 59%, mixtos hipo- e hiperecoicos en el 23% y pseudoquísticos en el 18%. A la aplicación de doppler color, la vascularidad se encuentra incrementada en el 64% y las lesiones avasculares aparecen solamente en el 9%, y en el 32% de los casos puede haber adenopatías axilares ipsilaterales6–8.
Las imágenes de resonancia magnética nuclear de la glándula mamaria en la evaluación del linfoma primario muestran largas masas lobulares heterogéneamente hipointensas en imágenes en T1 y heterogéneamente hiperintensas en T2 con un intenso, heterogéneo y rápido realce y un lavado cinético típico de malignidad6,8.
El reciente empleo de la PET-CT ha demostrado lesiones intensas y con actividad metabólica incrementada entre el 92 y casi el 100% de los casos con un valor de captación estandarizado de 16-fluorodeoxiglucosa de 10.6. La utilidad de la PET-CT es tanto para el diagnóstico como para el seguimiento de las pacientes, ya que este estudio evalúa la respuesta al tratamiento, demostrando actividad tumoral metabólica residual o áreas de necrosis o fibrosis7,8. La PET-CT puede ser utilizada también en mujeres con sospecha de linfoma con mamas densas, que pueden oscurecer la imagen de la mastografía8. El cáncer de mama inflamatorio y las metástasis a la glándula mamaria, principalmente del melanoma, pueden dificultar la diferenciación de las neoplasias hematológicas; igualmente las lesiones menores de 1cm pueden dar falsos negativos a la PET-CT8.
El estudio histopatológico es esencial en el linfoma primario de la glándula mamaria tanto para fines diagnósticos como para establecer el tratamiento y pronóstico de la enfermedad.
La variedad de linfoma más frecuente que se presenta en la glándula mamaria es el linfoma no Hodgkin difuso de células grandes que aparece del 40 al 70% de los casos. Los linfomas asociados a mucosas suelen presentarse en el 0 al 44% de las series3,9. Las mujeres jóvenes embarazadas suelen tener linfoma de tipo Burkitt. Además, se han reportado casos de otras variantes de linfoma como el folicular, el linfoma linfoblástico, el linfoma linfoplasmático, el linfoma periférico de células T y el linfoma histiocítico verdadero3; el linfoma anaplásico de células grandes es un subtipo de linfomas de células T, que es una variedad rara de linfoma mamario que se presenta en las mujeres portadoras de implantes mamarios10,11.
El tratamiento del linfoma de la glándula mamaria suele ser multimodal, donde la quimioterapia es la piedra angular.
Varios autores1,3,9,12–15 han establecido el papel de la cirugía, el cual habitualmente está reservado con fines diagnósticos y solamente para obtener la cantidad de material suficiente para establecer el diagnóstico histológico de la enfermedad. Algunos de ellos han encontrado la cirugía como un factor adverso de pronóstico, ya que esta retrasa el inicio de la quimioterapia, lo que disminuye el periodo libre de enfermedad e incrementa la tasa de recurrencia3,9,12,15.
El tratamiento óptimo de los linfomas extranodales implica el empleo de la quimioterapia. El esquema CHOP con o sin rituximab es el esquema terapéutico más usado para este tipo de neoplasias.
El único estudio prospectivo de linfomas de la glándula mamaria llevado por Avilés et al.16 incluyó a 96 pacientes con linfoma no Hodgkin y los dividió en 3 grupos de tratamiento; el primer grupo incluyó a pacientes con radioterapia como único tratamiento, las pacientes recibieron 45 Gy en 20 fracciones con campos tangenciales y axilo/supraclavicular e incluyó a 30 pacientes; el segundo grupo incluyó a pacientes con quimioterapia como único tratamiento, recibiendo esquema de CHOP durante 6 ciclos e incluyó a 32 pacientes, y el tercer grupo fue de manejo multimodal conformado por 34 pacientes que recibieron la misma dosis de radioterapia y los mismos ciclos de quimioterapia que los grupos previos. La respuesta completa fue obtenida en el 66% de las pacientes del grupo de radioterapia, en el 59% de las del grupo de quimioterapia y en el 88% de las del grupo de tratamiento combinado, con un valor de p de 0.01. La tasa de recaídas fue del 50% en el grupo de radioterapia, del 43% en el de quimioterapia, y solamente del 19% en el grupo de terapia combinada. En el análisis univariado, a 10 años, la sobrevida libre de eventos fue del 50% en el grupo de radioterapia, 56% en el de quimioterapia y 83% en el de terapia combinada. Igualmente, la sobrevida global a 10 años fue del 50% para los grupos de radioterapia y quimioterapia y del 76% para el grupo de tratamiento combinado. Ambos resultados son estadísticamente significativos en favor del grupo de tratamiento multimodal, sin beneficiar a los otros 2 grupos de tratamiento. El sitio más común de recaída fue el sistema nervioso central en el 9.4% de las pacientes, independientemente del grupo de tratamiento. Este hallazgo indica evaluar la necesidad del uso de radioterapia profiláctica al sistema nervioso central.
Otra importante revisión retrospectiva del Grupo de Estudio Internacional del Linfoma Extranodal9, en 204 pacientes elegibles, encontró en el análisis multivariado que los factores pronósticos asociados a la sobrevida global del linfoma difuso de células grandes están relacionados con el índice pronóstico internacional (IPI), el empleo de quimioterapia basada en antraciclinas y la radioterapia. La sobrevida libre de progresión está influida por el IPI y el empleo de quimioterapia basada en antraciclinas. Para la sobrevida de causa específica, el único factor con significado estadístico fue el IPI. Hubo una asociación negativa en todos los resultados medidos de acuerdo con la extensión de la cirugía, las pacientes tratadas mediante mastectomía radical tuvieron el peor pronóstico para la sobrevida de causa específica. Factores como síntomas B, diámetro tumoral, invasión ganglionar, bilateralidad y época del tratamiento no tuvieron mayor significado estadístico. La sobrevida global para las pacientes que recibieron antraciclinas fue del 73% a 5 años y del 58% a 10 años; la combinación con radioterapia fue la que dio mejores resultados.
ConclusionesLos linfomas no Hodgkin primarios de la glándula mamaria son una rara entidad. Las manifestaciones clínicas y radiográficas de esta enfermedad comparten similitudes tanto con el cáncer de mama como con otras enfermedades benignas que suelen afectar la glándula mamaria. La confirmación de la enfermedad requiere de la evaluación histopatológica así como de estudios de inmunohistoquímica. El tratamiento es similar al de otros linfomas extranodales y al de su contraparte nodal. El tratamiento combinado con quimioterapia con o sin rituximab y radioterapia optimiza el control local, disminuyendo la tasa de recurrencia local y sistémica de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.