Se ha aceptado a través del tiempo que la bilis en condiciones normales es estéril. La bactobilia es un hallazgo común en individuos de alto riesgo o con cuadros de colecistolitiasis complicados, sin embargo, hay pocos datos con respecto a la prevalencia de bactibilia en pacientes sometidos a colecistectomía por colecistolitiasis no complicada. Es común el uso de agentes antibióticos preoperatorios y postoperatorios en los diferentes pacientes que son sometidos a colecistectomía laparoscópica, sin que exista una base bacteriológica y epidemiológica demostrada sobre el predominio bacteriano determinado, su resistencia y sensibilidad en nuestro medio.
Material y métodosPacientes con diagnóstico de colecistitis litiásica, a quienes se realizó CL con una muestra calculada por proporciones de 183 unidades (IC 95%).
ResultadosSe identificó bactibilia en el 31.95% de los cultivos de colecistitis leve y en el 35.71% de los cultivos de pacientes con colecistitis moderada (p<0.0001). Se recolectaron un total de 125 cultivos negativos (68.3%) y 58 positivos (31.69%) con un claro predominio del grupo de enterobacterias (43.10%) y Enterococcus (27.58%).
ConclusionesComparando los grupos de acuerdo al grado de severidad, hay una diferencia significativa en relación a la presencia de bactibilia, así como en el tipo de agentes aislados. Las fluoroquinolonas asociadas a metronidazol son una opción de tratamiento en pacientes en los que se sospecha bactobilia. Actualmente no está justificado el uso de antibioticoterapia en pacientes de bajo riesgo.
Through experience it has been accepted that bile in normal conditions remains sterile. Bactibilia is a common finding in individuals at high risk or with complicated cholecystolithiasis, however few data prevails about the prevalence of bactibilia in patients operated on for uncomplicated laparoscopic cholecystectomy. There is s common usage of preoperative and postoperative antibiotics in the different patients without the existence of any actual bacteriologic and epidemiologic evidence.
Material and methods183 patients with diagnosis of cholecystolithiasis postoperated of laparoscopic cholecystectomy had their bile sent to bacteriology.
ResultsBactibilia was identified in 31.95% of the cultures of mild cholecystitis and in 35.71% for moderate (p<.0001). A total of 125 negative cultures were obtained (68.3) and 58 positive (31.69%) with a prevalence of enterobacteria group (43.10%) and Enterococcus (27.58).
ConclusionsComparing the groups according to severity there is a significant difference with regard to the presence of bactibilia, in addition to the bacterial groups cultivated. Fluoroquinolones and metronidazole is an option for the treatment of patients with the suspicion of bactibilia. The use of antibiotics is not justified in patients at low risk.
La patología de vesícula biliar y vías biliares es motivo de interés permanente debido a que es una de las causas más frecuentes de ingreso en las instituciones hospitalarias de nuestro medio. La prevalencia de litiasis vesicular es muy alta, en Estados Unidos la padecen 20.5 millones de personas, es decir 6.3 millones de hombres y 14.2 millones de mujeres. El 20% de las personas mayores de 65 años son portadores de litos vesiculares, y un millón de nuevos casos son diagnosticados cada año. Diversos estudios realizados en nuestro país, demuestran que la prevalencia de esta entidad es de aproximadamente un 14.3%1.
Se ha aceptado a través del tiempo que la bilis en condiciones normales es estéril. Así mismo, es bien conocido que la bactibilia es un hallazgo común en individuos de alto riesgo o con cuadros de colecistolitiasis complicados, incluyendo aquellos con obstrucción de la vía biliar, coledocolitiasis, edad >70 años, colecistitis aguda litiásica, colangitis, vesículas afuncionales y uso de prótesis biliares. Sin embargo, hay pocos datos con respecto a la prevalencia de bactibilia en pacientes sometidos a colecistectomía por colecistolitiasis no complicada2. Gutiérrez Banda et al., reportan en su serie de casos (72 pacientes) de población mexicana una incidencia de cultivos positivos de 13.9% (9.7% en colecistitis crónica y 4.2% en aguda), con predominio del grupo coliforme entérico.
Esta entidad nosológica puede presentarse con sintomatología que sugiere una enfermedad inflamatoria con o sin infección sobreagregada. Sin embargo llama la atención que muchos pacientes sin antecedentes de cirugía biliar y sin cuadro infeccioso aparente al momento de la cirugía, presentan modificaciones histológicas de las paredes vesiculares compatibles con procesos infecciosos.
Existen en la literatura distintas guías respecto al uso correcto de la profilaxis antimicrobiana en cirugía y aunque coinciden en la mayoría de sus recomendaciones aún existen inconsistencias. Ninguna de ellas propone el uso de antibióticos profilácticos antes de colecistectomía laparoscópica (CL) en pacientes de bajo riesgo3.
Es común el uso de agentes antibióticos preoperatorios y postoperatorios en los diferentes pacientes que son sometidos a CL, sin que exista una base bacteriológica y epidemiológica demostrada sobre el predominio bacteriano determinado, su resistencia y sensibilidad en nuestro medio.
La resistencia microbiana es un problema de salud pública creciente que se asocia con un aumento de la morbimortalidad de los pacientes y que de alguna manera repercute en la economía del paciente y la institución. El uso inapropiado de antibióticos es la principal causa del desarrollo de resistencia microbiana. Es por ello que surge la necesidad de determinar la frecuencia de infección biliar en pacientes sometidos a CL, reducir el gasto terapéutico antibiótico al conocer la sensibilidad bacteriana específica e identificar el tipo o tipos de bacterias más frecuentes en la bilis y su espectro de sensibilidad a los antibióticos. Esta información será de utilidad para la elaboración de guías para la profilaxis antibiótica en CL.
Objetivos- A)
Objetivo general: identificar la flora bacteriana presente en cultivos de bilis y pared vesicular de pacientes sometidos a CL por colecistolitiasis simple o complicada en el Hospital Universitario «Dr. José Eleuterio González».
- B)
Objetivos específicos: determinar género y especie de las bacterias aisladas con más frecuencia en muestras de bilis, pared vesicular o ambos de pacientes sometidos a CL. Determinar la frecuencia de infección biliar en muestras de bilis, pared vesicular o ambos, de pacientes sometidos a CL. Evaluar el papel del empleo de antibióticos profilácticos en la CL. Determinar el perfil de sensibilidad y resistencia a antimicrobianos de las especies aisladas.
Estudio con diseño metodológico observacional, transversal, descriptivo y prospectivo, en el cual se incluyeron pacientes con diagnóstico de colecistitis litiásica leve, moderada o severa clasificados de acuerdo a las guías de Tokio, a quienes se realizó CL en el Hospital Universitario «Dr. José Eleuterio González», incluyendo ambos géneros, con edad entre 13-85 años. Utilizando una fórmula para cálculo de proporciones, con un valor zα de 1.96 con nivel de significación del 95% para dos colas, y una prevalencia esperada de 14% se obtuvo una muestra de 183 unidades.
Los hallazgos clínicos y datos relacionados al diagnóstico de colecistitis aguda fueron recabados mediante las siguientes variables: genero, edad, comorbilidades, cuadro clínico, hallazgos ultrasonográficos de vesícula y vías biliares, resultados de estudios de laboratorio y clasificación de grado de severidad.
Las muestras para cultivo fueron recolectadas con técnica estéril durante el procedimiento quirúrgico mediante punción laparoscópica o durante la extracción de la vesícula biliar microbiológico inmediatamente y enviadas para análisis.
La selección de antibióticos para el antibiograma se brinda mediante informe selectivo de acuerdo al Departamento de Infectología del hospital, clasificados en bloques A, B y C. Para la familia de Enterobacteriaceae el bloque A: penicilina, ampicilina y gentamicina; el bloque B: amikacina, amoxicilina/ácido clavulánico, cefuroxima, cefotaxima, ceftazidime, ciprofloxacino, levofloxacino, meropenem y trimetoprim/sulfametoxazol. Para Acinetobacter spp. el bloque A: ampicilina/sulbactam, ceftazidime y ciprofloxacino y el bloque B: amikacina, cefepime, doxicilina, tigeciclina, colistina, fosfomicina y meropenem. Para Pseudomonas spp.el bloque A: ceftazidime y gentamicina y bloque B: amikacina, cefepime, ciprofloxacino, meropenem piperacilina/tazobactam. Para Staphylococcus spp./Streptococcus spp. el bloque A: penicilina, eritromicina, clindamicina, cefoxitina y trimetoprim/sulfametoxazol; el bloque B: doxicilina, vancomicina y levofloxacino y el bloque C: daptomicina, linezolid y rifampicina. Para Enterococcus spp. el bloque A: ampicilina y penicilina; el bloque B: vancomicina y gentamicina y el bloque C: linezolid y tetracilina.
El análisis estadístico se llevó a cabo a través de medidas de frecuencia, chi cuadrado de Pearson y prueba exacta de Fisher para variables categóricas y medidas de tendencia central o dispersión y t de Student para variables cuantitativas con IBM SPSS versión 20 (SPSS, Inc. Armon, NY). La significación estadística se definió como p<0.05.
ResultadosSe estudiaron 183 pacientes, 151 mujeres (82.5%) y 32 hombres (17.5%), con una mediana de edad de 35 años (RIC 27-45 años) en los cuales se realizó análisis bacteriológico aleatorizado de bilis y pared vesicular. Se incluyeron 112 cultivos de pared (61.2%) y 71 cultivos de bilis (38.8%).
De los 183 pacientes estudiados, el 100% presentaron como sintomatología inicial dolor tipo cólico en hipocondrio derecho y epigastrio, se asoció náuseas y vómito en 74 pacientes (40.4%) y solo 3 pacientes (1.63%) refirieron episodios de ictericia. Las comorbilidades más prevalentes fueron: hipertensión arterial sistémica (13.1%), diabetes mellitus (9.2%), pancreatitis biliar resuelta (4.9%), y riesgo intermedio-alto para coledocolitiasis (7.1%). Mientras que 117 pacientes (63%) no presentaron comorbilidades asociadas al momento del estudio.
Se clasificaron 169 pacientes (92.34%) con diagnóstico de colecistitis leve y 14 pacientes (7.65%) como colecistitis moderada, no se reclutaron pacientes con colecistitis severa. De las colecistitis leves el 85.7% es representado por mujeres y de las moderadas el género femenino corresponde al 85.7% (p=0.999).
La mediana del grosor de la pared vesicular fue de 0.30cm (RIC de 0.2-0.38cm, DE±0.35), así mismo la medida del conducto colédoco fue de 0.40cm (RIC 0.2-0.38cm, DE±0.24).
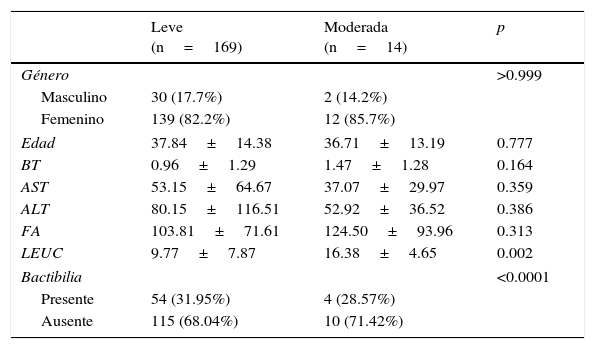
Las características de los pacientes reclutados son mencionadas en la tabla 1, donde se reporta un claro predominio del género femenino en ambos grupos de acuerdo a la severidad. Media de edad de 37.84 DE±14.38 para pacientes con colecistitis leve y 36.71 DE±13.19 para colecistitis moderada (p=0.777). Diferencia estadísticamente representativa (p=0.002) en relación a la leucocitosis presentada en el grupo de colecistitis moderada, con media de 16.38 DE±4.65. Se identificó bactibilia en el 31.95% de los cultivos de colecistitis leve y en el 35.71% de los cultivos de pacientes con colecistitis moderada (p<0.0001).
Características de pacientes de acuerdo al grado de severidad
| Leve (n=169) | Moderada (n=14) | p | |
|---|---|---|---|
| Género | >0.999 | ||
| Masculino | 30 (17.7%) | 2 (14.2%) | |
| Femenino | 139 (82.2%) | 12 (85.7%) | |
| Edad | 37.84±14.38 | 36.71±13.19 | 0.777 |
| BT | 0.96±1.29 | 1.47±1.28 | 0.164 |
| AST | 53.15±64.67 | 37.07±29.97 | 0.359 |
| ALT | 80.15±116.51 | 52.92±36.52 | 0.386 |
| FA | 103.81±71.61 | 124.50±93.96 | 0.313 |
| LEUC | 9.77±7.87 | 16.38±4.65 | 0.002 |
| Bactibilia | <0.0001 | ||
| Presente | 54 (31.95%) | 4 (28.57%) | |
| Ausente | 115 (68.04%) | 10 (71.42%) | |
ALT: alanino aminotransferasa; AST: aspartato alaninotransferasa; BT: bilirrubina total; FA: fosfatasa alcalina; LEUC: leucocitos.
Se recolectaron un total de 125 negativos (68.3%) (68 cultivos de pared y 57 cultivos de bilis) y 58 positivos (31.69%) (44 cultivos de pared y 14 de bilis). Del total de cultivos positivos (58 cultivos), el 67.24% reportaron un solo agente microbiológico, mientras que el 32.75% mostraron actividad polimicrobiana. De 151 pacientes femeninos, 31.7% tuvieron cultivos positivos. De los 32 pacientes masculinos, 31.25% presentaron cultivos positivos (p=0.999).
De 183 sujetos de estudio, 144 (78%) presentaron una pared vesicular menor de 0.4cm, de los cuales 94 (65.3%) tuvieron cultivo negativo y 50 (34.7%) cultivo positivo. Treinta y nueve (21.31%) presentaron una pared vesicular mayor a 0.4cm, de los cuales 31(16.93%) tuvieron cultivo negativo y 8 (4.3%) cultivo positivo (p=0.120). De los 58 cultivos positivos el 75.9% son de pared vesicular, mientras que el 24.1% son de bilis (p=0.006).
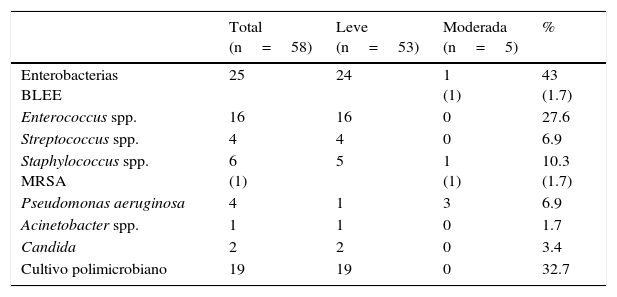
Los hallazgos del análisis bacteriológico se muestran en la tabla 2. Los agentes aislados en los cultivos positivos fueron enterobacterias (25 cultivos, 43%) (Enterobacter cloacae (E. cloacae), Enterobacter aerogenes, Enterobacter faecium, Klebsiella pneumoniae, Escherichia coli, Proteus mirabilis, Citrobacter diversus, Morganela morgani), entre las cuales la más prevalente fue E. cloacae con 11 cultivos (19%) y 2 cultivos (12%) de Klebsiella presentaron aislamiento de tipo betalactamasa de espectro extendido, Enterococcus spp. (16 cultivos, 27.6%) (Enterococcus faecalis), Streptococcus spp. (4 cultivos, 6.9%), Staphylococcus coagulasa negativo (5 cultivos, 8.6%) Staphylococcus aureus MRSA (un cultivo, 1.7%), Pseudomonas spp. (4 cultivos, 6.9%) (Pseudomonas aeruginosa [P. aeruginosa]), Acinetobacter spp. (un cultivo, 1.7%) (Acinetobacter baumanii), Candida spp. (2 cultivos, 3.4%). Diecinueve cultivos con actividad polimicrobiana mostraron diversas asociaciones bacterianas: enterobacterias con Enterococcus (12 cultivos, 63%), enterobacterias de diferentes géneros (2 cultivos, 10.52%), Pseudomonas con Staphylococcus (2 cultivos, 10.52%), Enterococcus con Staphylococcus (2 cultivos, 10.52%). Acinetobacter con Staphylococcus (un cultivo, 5.2%).
Perfil bacteriológico de acuerdo al grado de severidad
| Total (n=58) | Leve (n=53) | Moderada (n=5) | % | |
|---|---|---|---|---|
| Enterobacterias BLEE | 25 | 24 | 1 (1) | 43 (1.7) |
| Enterococcus spp. | 16 | 16 | 0 | 27.6 |
| Streptococcus spp. | 4 | 4 | 0 | 6.9 |
| Staphylococcus spp. MRSA | 6 (1) | 5 | 1 (1) | 10.3 (1.7) |
| Pseudomonas aeruginosa | 4 | 1 | 3 | 6.9 |
| Acinetobacter spp. | 1 | 1 | 0 | 1.7 |
| Candida | 2 | 2 | 0 | 3.4 |
| Cultivo polimicrobiano | 19 | 19 | 0 | 32.7 |
BLEE: betalactamasa de espectro extendido; MRSA: Staphylococcus aureus resistente a meticilina.
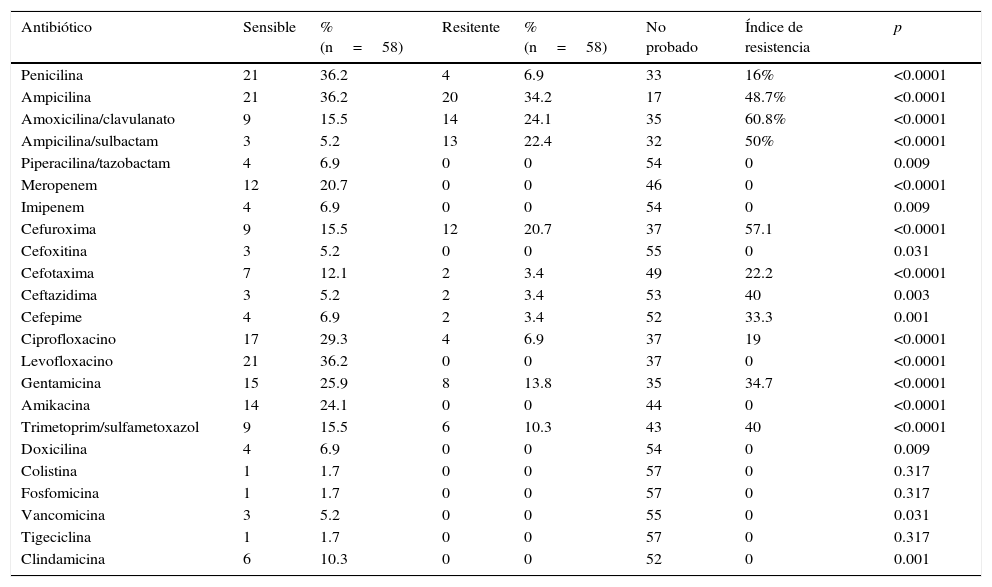
De los 25 cultivos positivos para enterobacterias la penicilina fue probada en 8%, los cuales resultaron resistentes. De los 16 cultivos de Enterococcus el 87.5% fue sensible a penicilina. El 100% de los Streptococcus y el 50% de los Staphylococcus también resultaron sensibles a penicilina. De los 58 cultivos positivos se obtuvo antibiograma con informe selectivo el cual mostró un perfil de resistencia de acuerdo a la tabla 3. En el grupo de los betalactámicos, la asociación de piperacilina con tazobactam, mostró el índice de resistencia más bajo, seguido por la penicilina con un 16%, siendo probado en hasta el 43.1% de los cultivos positivos. La ampicilina, amoxicilina/clavulanato y ampicilina/sulbactam, presentaron los índices de resistencia más altos, 48.7, 60.8 y 50% respectivamente. Los carbapenémicos, representados en el antibiograma local por el imipenem y el meropenem, mostraron nula resistencia en los cultivos positivos en que fueron probados (27.6%). En la familia de las cefalosporinas, la segunda generación mostró un índice de resistencia de 57.1%; para la tercera generación, representada por cefotaxima y ceftazidima, los índices de resistencia fueron de 22.2 y 40% respectivamente, en conjunto se probaron hasta en el 20% de los cultivos positivos; el cefepime se probó en el 10.3% de los cultivos positivos y se encontró un índice de resistencia de hasta 33.3%. Las quinolonas (ciprofloxacino y levofloxacino) fueron probadas en el 72.4% de los cultivos positivos con un índice de resistencia de 19%. Los aminoglucósidos (gentamicina y amikacina) se probaron en conjunto en el 63.8% de los cultivos, sus índices de resistencia fueron 34.7 y 0% respectivamente. El trimetoprim/sulfamatoxazol presentó una resistencia de hasta 40% de los cultivos en que se probó. El resto de los antibióticos (doxiciclina, colistina, fosfomicina, eritromicina, vancomicina, tigeciclina, clindamicina) de antibiograma local no mostraron índice de resistencia, en conjunto fueron probados en el 30% de los cultivos positivos.
Índice de resistencia por antibiótico
| Antibiótico | Sensible | % (n=58) | Resitente | % (n=58) | No probado | Índice de resistencia | p |
|---|---|---|---|---|---|---|---|
| Penicilina | 21 | 36.2 | 4 | 6.9 | 33 | 16% | <0.0001 |
| Ampicilina | 21 | 36.2 | 20 | 34.2 | 17 | 48.7% | <0.0001 |
| Amoxicilina/clavulanato | 9 | 15.5 | 14 | 24.1 | 35 | 60.8% | <0.0001 |
| Ampicilina/sulbactam | 3 | 5.2 | 13 | 22.4 | 32 | 50% | <0.0001 |
| Piperacilina/tazobactam | 4 | 6.9 | 0 | 0 | 54 | 0 | 0.009 |
| Meropenem | 12 | 20.7 | 0 | 0 | 46 | 0 | <0.0001 |
| Imipenem | 4 | 6.9 | 0 | 0 | 54 | 0 | 0.009 |
| Cefuroxima | 9 | 15.5 | 12 | 20.7 | 37 | 57.1 | <0.0001 |
| Cefoxitina | 3 | 5.2 | 0 | 0 | 55 | 0 | 0.031 |
| Cefotaxima | 7 | 12.1 | 2 | 3.4 | 49 | 22.2 | <0.0001 |
| Ceftazidima | 3 | 5.2 | 2 | 3.4 | 53 | 40 | 0.003 |
| Cefepime | 4 | 6.9 | 2 | 3.4 | 52 | 33.3 | 0.001 |
| Ciprofloxacino | 17 | 29.3 | 4 | 6.9 | 37 | 19 | <0.0001 |
| Levofloxacino | 21 | 36.2 | 0 | 0 | 37 | 0 | <0.0001 |
| Gentamicina | 15 | 25.9 | 8 | 13.8 | 35 | 34.7 | <0.0001 |
| Amikacina | 14 | 24.1 | 0 | 0 | 44 | 0 | <0.0001 |
| Trimetoprim/sulfametoxazol | 9 | 15.5 | 6 | 10.3 | 43 | 40 | <0.0001 |
| Doxicilina | 4 | 6.9 | 0 | 0 | 54 | 0 | 0.009 |
| Colistina | 1 | 1.7 | 0 | 0 | 57 | 0 | 0.317 |
| Fosfomicina | 1 | 1.7 | 0 | 0 | 57 | 0 | 0.317 |
| Vancomicina | 3 | 5.2 | 0 | 0 | 55 | 0 | 0.031 |
| Tigeciclina | 1 | 1.7 | 0 | 0 | 57 | 0 | 0.317 |
| Clindamicina | 6 | 10.3 | 0 | 0 | 52 | 0 | 0.001 |
En la tabla 4 se muestra el índice de sensibilidad por grupo bacteriano. Se identifica en el grupo de enterobacterias una sensibilidad del 100% para levofloxacino, aminoglucósidos, carbapenémicos y vancomicina. Las Pseudomonas resultaron con excelente sensibilidad entre los agentes a los que fue probado durante su cultivo. Para los gram positivos del grupo de Streptococcus y Enterococcus la ampicilina mostró una completa sensibilidad cuando se utilizó. El cultivo reportado con Acinetobacter no mostró resistencia a ninguno de los antibióticos a los que fue probado.
Índice de sensibilidad por género
| Índice de sensibilidad (%) | |
|---|---|
| Enterobacterias (25) | AMP:4, AX/CL:36, AMP/SB:8, MRP:44, CFU:36, CFO:28, CFT:4, CIP:48, LEV:72, GEN:44, AMI:36, TMP/S:24, VAN:4, |
| Pseudomonas (4) | PIP/TZ:100, MRP:25, IMI:75, CFT:25,CFE:75, CIP:100, GEN:100, AMI:100, |
| Acinetobacter (1) | AMP/SB:100, IMI:100, CFT:100, CFE:100, CIP:100, AMI:100, DOXI:100, COL:100, FOS:100, TIG:100 |
| Staphylococcus (6) | CFX:50, LEV:50, TMP/S:50, DOXI:50, CLIN:100 |
| Streptococcus (4) | AMP:100, ERI:100, |
| Enterococcus (16) | AMP:100, VAN:12.5 |
AMI: amikacina; AMP: ampicilina; AMP/SL: ampicilina sulbactam; AX/CL: amoxicilina/clavulanato; CFE: cefepime; CFO: cefoxitina; CFT: ceftazidima; CFU: cefuroxima; CFX: cefotaxima; CIP: ciprofloxacino; CLIN: clindamicina; COL: colistina; DOXI: doxicilina; ERI: eritromicina; FOS: fosfomicina; GEN: gentamicina; IMI: imipenem; LEV: levofloxacino; MRP: meropenem; PIP/TZ: piperacilina/tazobactam; TIG: tigeciclina; TMP/S: trimetoprim/sulfametoxazol; VAN: vancomicina.
A pesar de que las guías de Tokio de clasificación para colecistitis aguda recomiendan terapia antimicrobiana de acuerdo al grado de severidad, no se incluye una descripción detallada del perfil bacteriológico de la bilis en relación al grado de severidad4. Es por eso que consideramos de imperante utilidad para el médico tratante el tener conocimiento y entendimiento del tipo de bacterias, perfiles de resistencia y frecuencia de cultivos polimicrobianos de acuerdo al grado de severidad y así seleccionar la terapia antimicrobiana más apropiada.
Es bien sabido que la bactibilia es un hallazgo común en pacientes de alto riesgo, con obstrucción de la vía biliar, cirugía de vías biliares, edad avanzada y colangitis5–7. Las guías de Tokio recomiendan que se debería obtener cultivos de bilis cada vez que se tenga la oportunidad, especialmente en los casos severos8. En algunas series se reporta que la edad avanzada9,10 género masculino y el valor de bilirrubina total elevado11 pueden ser también factores predictivos de cultivos positivos. En este estudio se reclutó una muestra de 183 pacientes, de los cuales el 92% fue clasificado como colecistitis leve, y el resto como moderada. Se demostró una diferencia estadísticamente significativa en relación al grado de severidad y la presencia de cultivos positivos (31.9 vs. 35.71%; p<0.0001), sin embargo, en nuestro estudio no mostraron ser estadísticamente significativas las diferencias entre grupos de acuerdo al nivel de bilirrubina total, edad y género como factores asociados a la presencia de bactibilia en este estudio. De los pacientes que presentaron entre su sintomatología ictericia, el 100% reportó cultivos positivos sin haber sido sometidos a procedimientos invasivos previos. Se ha reportado en la literatura que la proteína C reactiva sérica es un importante marcador de severidad e incluso de mortalidad12,13, incluido en el diagnóstico definitivo de colecistitis aguda14, pero no en la clasificación del grado de severidad en las guías de Tokio. En nuestro medio no se solicita como parte del diagnóstico habitualmente, pero consideramos que al ser un importante predictor de bactibilia y pronóstico, debe ser incluido como parte del abordaje integral del paciente con colecistitis.
En las guías de Tokio, se incluyen las características de inflamación local como leve o moderados cambios inflamatorios para diferenciar entre grados de severidad, lo que no permite una clara clasificación15. En nuestro estudio se incluyeron los hallazgos ultrasonográficos de la pared vesicular y vinculándolos con los resultados de estudios de laboratorio, no se encontró una diferencia significativa en relación a la severidad y los hallazgos de inflamación local o a la presencia de cultivos polimicrobianos, solamente la leucocitosis mostró ser un factor predictivo de bactibilia con significación estadística (p=0.002). Sin embargo, se identificó diferencia en relación al tipo de agente aislado, en colecistitis moderada el agente más prevalente fue P. aeruginosa y los demás fueron una Klebsiella betalactamasa de espectro extendido y un Staphylococcus MRSA. El 32% de los cultivos positivos resultó con actividad polimicrobiana, de los cuales el 100% pertenecía al grupo de pacientes con colecistitis leve. Además el 34.7% de los pacientes con colecistitis leve sin engrosamiento de pared vesicular presentaron cultivos positivos, contra un 4.3% de cultivos positivos en pacientes con pared vesicular mayor a 4 milímetros. No hay una diferencia estadísticamente significativa (p=0.120) entre grupos de acuerdo al grado de severidad o alteraciones locales de la pared vesicular que indique que se obtendrá un cultivo positivo.
La prevalencia de cultivos positivos en la literatura es ambigua, figura entre el 14-72%. En nuestro estudio, la prevalencia de cultivos fue de 31.69% el doble de la esperada. Con un claro predominio del grupo de enterobacterias (43.10%) y Enterococcus spp. (27.58%). Estos hallazgos son compatibles con lo reportado en la literatura16–19 y confirmando la hipótesis principal de este estudio. En algunas series el predominio es del grupo de Enterococcus spp. con hasta un 36.7% y enterobacterias 29.5%. En relación al grupo de Pseudomonas spp. (6.89%) y Acinetobacter spp. (1.72%), se presentó una incidencia relativamente alta en comparación a lo reportado comúnmente20,21 y en concordancia al estudio de Asai et al. El 75% de los cultivos positivos para Pseudomonas spp. fueron recolectados de pacientes con diagnóstico de colecistitis moderada, representando el 6.9% del total de cultivos positivos. Por lo anterior, no se justifica de inicio el manejo empírico con terapia antipseudomonas en pacientes de bajo riesgo.
La información que proporciona el antibiograma tiene una gran repercusión clínica y epidemiológica. Es una herramienta de gran importancia en las estrategias organizativas de apoyo a la mejor utilización de antibióticos. La selección de los antimicrobianos más apropiados para informar es una decisión que debe tomar cada laboratorio clínico, previa consulta con los especialistas más implicados en el manejo de las enfermedades infecciosas. Debe prevalecer el interés clínico de los mismos. Los antibióticos informados deben tener demostrada eficacia clínica. También hay que valorar la prevalencia de resistencia en el hospital y el área extrahospitalaria, el costo, las indicaciones clínicas aprobadas de uso y las recomendaciones más actualizadas de consenso sobre primera elección y alternativas. El informe selectivo consiste en que algunos antibióticos solo se informan en circunstancias determinadas (selectivamente), que cada laboratorio debería protocolizar teniendo en cuenta las condiciones de su medio. De acuerdo a los resultados obtenidos, la amoxicilina/clavulanato tiene el mayor índice de resistencia (60.8%), seguido por la cefuroxima (57.1%), ampicilina/sulbactam (50%) y ampicilina sin inhibidor de betalactamasa (48.7%). Del mismo modo, las cefalosporinas de tercera generación mostraron índices de resistencia de hasta el 40%. La penicilina fue probada en el 32.4% de los cultivos positivos mostrando un índice de resistencia del 16%, representando una opción de manejo. El grupo de las fluoroquinolonas, delimitado en el informe selectivo por el ciprofloxacino y levofloxacino, con índices de resistencia de 19 y 0% respectivamente, parecen ser una excelente opción para el manejo inicial de pacientes con riesgo de presentar bactibilia. La amikacina fue probada en el 24% de los cultivos positivos y no se evidenció resistencia. En contraparte, la gentamicina fue probada en el 25% de los cultivos positivos mostrando un índice de resistencia de hasta el 37.7%. Los regímenes de antibioticoterapia más frecuentemente usados en la actualidad son piperacilina/tazobactam, ceftriaxona más metronidazol y levofloxacino con metronidazol22. Delimitando el espectro antibiótico, de acuerdo al grupo de bacterias encontradas en los cultivos de nuestro estudio, se encontró que el grupo de enterobacterias, como agentes más frecuentemente aislados, presentan una alta tasa de resistencia a cefalosporinas de 3.a generación, motivo por el cual sugerimos optar por una restructuración del tratamiento de primera línea. Las fluoroquinolonas asociadas a metronidazol pueden ser una excelente opción de manejo en pacientes en los que se sospecha bactibilia (leucocitosis, ictericia, grado de severidad moderado). Sin embargo, no se justifica el empleo de antibioticoterapia en pacientes de bajo riesgo.
ConclusiónResulta de imperante utilidad para el médico tratante el tener conocimiento y entendimiento del tipo de bacterias, perfiles de resistencia y frecuencia de cultivos polimicrobianos de acuerdo al grado de severidad y así seleccionar la terapia antimicrobiana más apropiada. Se identificó una prevalencia superior a la esperada de cultivos positivos con un claro predominio de enterobacterias en los cultivos analizados. Comparando los grupos de acuerdo al grado de severidad, hay una diferencia significativa en relación a la presencia de bactibilia, así como en el tipo de agentes aislados. Se debe establecer un consenso acerca de los criterios de clasificación de severidad. La proteína C reactiva en suero, al ser un importante predictor de bactibilia y pronóstico, debe ser incluida como parte del abordaje integral del paciente con colecistitis.
Los perfiles de resistencia y sensibilidad de las bacterias aisladas con mayor frecuencia requieren un ajuste en las guías de manejo de pacientes con riesgo de bactibilia y de acuerdo al grado de severidad. Las fluoroquinolonas asociadas a metronidazol son una opción de tratamiento en pacientes en los que se sospecha bactibilia (leucocitosis, ictericia, grado de severidad moderado) considerando que siempre debe prevalecer el juicio clínico. Actualmente no está justificado el uso de antibioticoterapia en pacientes de bajo riesgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.