Desde la introducción de la biopsia selectiva del ganglio centinela, su utilización en pacientes con melanoma cutáneo y ganglios clínicamente negativos permanece controvertido. Hemos evaluado nuestra experiencia en biopsia selectiva del ganglio centinela en pacientes con melanoma.
Material y métodosEstudio retrospectivo observacional, en el que hemos estudiado una muestra de 69 pacientes diagnosticados de melanoma cutáneo primario sin evidencia clínica de afectación metastásica, a los que se realizó biopsia selectiva del ganglio centinela desde octubre de 2005 hasta diciembre de 2013. El ganglio centinela fue identificado mediante una linfogammagrafía preoperatoria y posterior detección intraoperatoria con sonda gammadetectora.
ResultadosLa tasa de identificación del ganglio centinela fue del 98.5%. El ganglio centinela fue positivo en 23 pacientes (33.8%). Las complicaciones postoperatorias después de la biopsia selectiva del ganglio centinela fueron observadas en el 4.4%, frente al 38% de los pacientes sometidos a linfadenectomía.
ConclusiónLa biopsia selectiva del ganglio centinela en pacientes con melanoma proporciona valiosa información sobre las vías de diseminación linfática del tumor, y también permite una aproximación a la estadificación regional del mismo, evitando los efectos secundarios de la linfadenectomía. No obstante, serían necesarios estudios de mayor tamaño muestral y tiempo de seguimiento para confirmar la validez de la técnica de la biopsia selectiva del ganglio centinela en pacientes con melanoma, y especialmente de la linfadenectomía en casos de ganglio centinela positivo.
Since the introduction of sentinel lymph node biopsy, its use as a standard of care for patients with clinically node-negative cutaneous melanoma remains controversial. Our experience of sentinel lymph node biopsy for melanoma is presented and evaluated.
Material and methodsA cohort study was conducted on 69 patients with a primary cutaneous melanoma and with no clinical evidence of metastasis, who had sentinel lymph node biopsy from October-2005 to December-2013. Sentinel lymph node biopsy was identified using preoperative lymphoscintigraphy and subsequent intraoperative detection with gamma probe.
ResultsThe sentinel lymph node biopsy identification rate was 98.5%. The sentinel lymph node biopsy was positive for metastases in 23 patients (33.8%). Postoperative complications after sentinel lymph node biopsy were observed in 4.4% compared to 38% of complications in patients who had complete lymphadenectomy.
ConclusionThe sentinel lymph node biopsy in melanoma offers useful information about the lymphatic dissemination of melanoma and allows an approximation to the regional staging, sparing the secondary effects of lymphadenectomy. More studies with larger number of patients and long term follow-up will be necessary to confirm the validity of sentinel lymph node biopsy in melanoma patients, and especially of lymphadenectomy in patients with positive sentinel lymph node biopsy.
En los últimos 50 años la incidencia de melanoma se ha incrementado de forma importante, en el año 2012 se produjeron 160,000 nuevos casos de melanoma en todo el mundo (de los cuales 3,600 en España) y alrededor de 41,000 pacientes fallecieron como consecuencia de esta enfermedad en el mundo (de los cuales 710 en España)1.
Desde su introducción en 19922 el papel de la biopsia selectiva del ganglio centinela en el melanoma es controvertido y de hecho, no está incluida en la mayoría de las guías clínicas europeas para el manejo del melanoma3. No obstante, este procedimiento se ha convertido en una práctica habitual para la estadificación y el tratamiento del melanoma≥1mm con ganglios clínicamente negativos o melanomas<1mm de grosor asociados a factores de peor pronóstico. Más allá de este umbral, el número esperado de ganglios centinela positivos es demasiado pequeño para justificar el uso de esta técnica.
El objetivo principal de la biopsia selectiva del ganglio centinela en el melanoma es la identificación precoz de pacientes con metástasis linfáticas no detectadas clínicamente, que podrían beneficiarse de una linfadenectomía. Numerosos estudios han demostrado que el estado del ganglio centinela es un factor pronóstico independiente en relación con la supervivencia global y la supervivencia libre de enfermedad de los pacientes con melanoma4–6. Presenta un mayor valor predictivo que los factores pronósticos habituales, como el grosor de Breslow, el nivel de Clark, la presencia de ulceración, el sexo y la edad7. Además, la información obtenida acerca del estado ganglionar es fundamental tanto para una adecuada estadificación AJCC6 como para decidir la posibilidad de tratamientos adyuvantes. No obstante, muchos autores no recomiendan el uso rutinario de esta técnica, en base a resultados como el del Multicenter Selective Lymphadenectomy Trial (MSLT),8 que no demostró diferencias significativas en la supervivencia entre los pacientes con biopsia selectiva del ganglio centinela (e inmediata linfadenectomía si el resultado era positivo para metástasis) y los pacientes evaluados solo mediante observación y linfadenectomía si se producía recurrencia ganglionar. Otros estudios retrospectivos han mostrado resultados similares y el resultado de la biopsia selectiva del ganglio centinela y la linfadenectomía en la supervivencia a largo plazo de los pacientes así como su contribución terapéutica son actualmente motivo de debate9.
En nuestro hospital, disponemos de un equipo multidisciplinario para el manejo del melanoma en el que están incluidas las Unidades de Medicina Nuclear, Dermatología, Cirugía General, Anatomía Patológica y Oncología. Realizamos entre 5 y 10 casos de biopsias selectivas del ganglio centinela en melanoma al año y hemos acumulado experiencia durante 8 años, usando esta técnica. En aquellos pacientes en los que el ganglio centinela presenta metástasis se lleva a cabo la linfadenectomía de la zona linfática afectada.
El objetivo de nuestro estudio es evaluar a todos los pacientes con melanoma tratados mediante biopsia selectiva del ganglio centinela en nuestro centro hospitalario.
Material y métodosSe ha realizado un estudio retrospectivo observacional, en el que se han incluido todos los pacientes con melanoma en los que se llevó a cabo la técnica de biopsia selectiva del ganglio centinela en el Hospital Universitario Fundación Alcorcón desde el 1 de octubre de 2005 hasta el 1 de diciembre de 2013.
El criterio de selección para la realización de la biopsia selectiva del ganglio centinela fue: todos los pacientes con melanoma≥1 mm sin ganglios linfáticos palpables ni metástasis a distancia. También se incluyeron pacientes con melanomas<1mm si presentaban factores pronósticos desfavorables como nivel de Clark V o presencia de ulceración/regresión en el análisis anatomopatológico.
Se recolectaron los siguientes datos de cada uno de los pacientes: sexo, edad, localización y tipo histológico de la lesión primaria, grosor de Breslow, nivel de Clark, localización, número y estado del ganglio centinela, resultado de linfadenectomía si fue preciso, presencia de ulceración, índice mitótico, presencia de invasión perineural o vascular, presencia de infiltrado inflamatorio, tratamiento adyuvante, efectos secundarios del ganglio centinela o linfadenectomía, presencia de recidiva (local o a distancia) y supervivencia.
Linfogammagrafía y técnica quirúrgica del ganglio centinelaLa mañana de la cirugía se realizó una linfogammagrafía mediante la inyección de 37MBq de Tc-99m-nanocoloide de albumina sérica humana (Nanocoll®) en 0.4ml repartidos en 4 puntos de inyección intradérmicos en la periferia de la lesión o la cicatriz de biopsia.
En la adquisición de imágenes se utilizó una gammacámara convencional de 2 cabezales modelo Philips Skylight con colimadores de baja energía y alta resolución. Se obtuvieron imágenes dinámicas y estáticas, comenzando con el estudio dinámico a los 5-10min de la inyección del radiotrazador y obteniendo imágenes estáticas cada 20-30min hasta la visualización del ganglio centinela.
La cirugía se llevó a cabo esa misma mañana y para la localización intraoperatoria del ganglio centinela se utilizó una sonda gammadetectora (Europrobe®, Eurorad, Estrasburgo, Francia), manejada por un médico nuclear experimentado. Se extirparon todos los ganglios que presentasen actividad radiactiva medida con la sonda gammadetectora mayor del 10% del ganglio que presentase mayor actividad ex-vivo; todo ello medido en cuentas por segundo. Todos los ganglios extirpados fueron recogidos en recipientes separados para su estudio individualizado. Para finalizar el procedimiento se realizó una búsqueda minuciosa de cualquier actividad radiactiva presente en el lecho quirúrgico y, una vez se hubo comprobado que ningún depósito superaba el 10% del ganglio centinela de mayor actividad, se procedió a dar por finalizada la técnica.
Análisis anatomopatológico del ganglio centinelaEl análisis histológico consistió en seccionar el ganglio en su totalidad mediante cortes transversales de 1-2mm que fueron teñidos mediante hematoxilina-eosina, así como tinción inmunohistoquímica (S100, HMB45, MelanA).
Tratamiento quirúrgico y adyuvanteLos pacientes con ganglio centinela positivo fueron sometidos a linfadenectomía si las condiciones basales del paciente lo permitían. El tratamiento adyuvante con interferón fue ofrecido a los pacientes con melanoma estadio IIB o con ganglio centinela resecado positivo.
SeguimientoEl seguimiento de los pacientes se realizó mediante examen clínico en el servicio de Dermatología al mes, 3 meses y posteriormente cada 6 a 12 meses, según el estado del paciente, de forma indefinida. La presencia de recidiva y el estado de supervivencia fue obtenida de los registros clínicos del sistema informático del Hospital Universitario Fundación Alcorcón.
Análisis estadísticoSe utilizó para el análisis estadístico se usó la prueba de χ2 de Pearson o el test exacto de Fisher para el análisis cualitativo de los datos, y basado en el test de Student para el análisis cuantitativo, y análisis de log-rank. Se realizó un análisis de regresión logística por pasos. La gestión de datos se ha llevado a cabo con Access 7.0 y los cálculos matemáticos con el programa estadístico SPSS 20.0 para Windows. Se consideraron diferencias estadísticamente significativas aquellas con p<0.05.
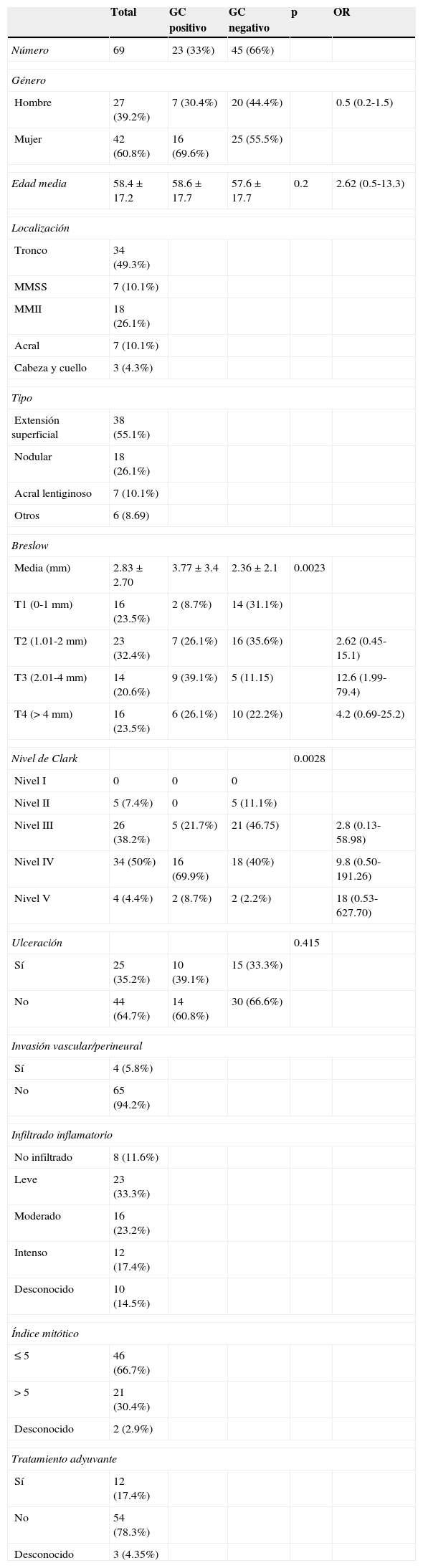
ResultadosDesde octubre de 2005 hasta diciembre de 2013, 69 pacientes con melanoma se sometieron a biopsia selectiva del ganglio centinela, 42 mujeres (60.8%) y 27 hombres (39.2%). La edad media de los pacientes fue 58.4 años. Las características clínicas y patológicas están reflejadas en la tabla 1.
Factores clínico-patológicos de la muestra
| Total | GC positivo | GC negativo | p | OR | |
|---|---|---|---|---|---|
| Número | 69 | 23 (33%) | 45 (66%) | ||
| Género | |||||
| Hombre | 27 (39.2%) | 7 (30.4%) | 20 (44.4%) | 0.5 (0.2-1.5) | |
| Mujer | 42 (60.8%) | 16 (69.6%) | 25 (55.5%) | ||
| Edad media | 58.4±17.2 | 58.6±17.7 | 57.6±17.7 | 0.2 | 2.62 (0.5-13.3) |
| Localización | |||||
| Tronco | 34 (49.3%) | ||||
| MMSS | 7 (10.1%) | ||||
| MMII | 18 (26.1%) | ||||
| Acral | 7 (10.1%) | ||||
| Cabeza y cuello | 3 (4.3%) | ||||
| Tipo | |||||
| Extensión superficial | 38 (55.1%) | ||||
| Nodular | 18 (26.1%) | ||||
| Acral lentiginoso | 7 (10.1%) | ||||
| Otros | 6 (8.69) | ||||
| Breslow | |||||
| Media (mm) | 2.83±2.70 | 3.77±3.4 | 2.36±2.1 | 0.0023 | |
| T1 (0-1mm) | 16 (23.5%) | 2 (8.7%) | 14 (31.1%) | ||
| T2 (1.01-2mm) | 23 (32.4%) | 7 (26.1%) | 16 (35.6%) | 2.62 (0.45-15.1) | |
| T3 (2.01-4mm) | 14 (20.6%) | 9 (39.1%) | 5 (11.15) | 12.6 (1.99-79.4) | |
| T4 (>4mm) | 16 (23.5%) | 6 (26.1%) | 10 (22.2%) | 4.2 (0.69-25.2) | |
| Nivel de Clark | 0.0028 | ||||
| Nivel I | 0 | 0 | 0 | ||
| Nivel II | 5 (7.4%) | 0 | 5 (11.1%) | ||
| Nivel III | 26 (38.2%) | 5 (21.7%) | 21 (46.75) | 2.8 (0.13-58.98) | |
| Nivel IV | 34 (50%) | 16 (69.9%) | 18 (40%) | 9.8 (0.50-191.26) | |
| Nivel V | 4 (4.4%) | 2 (8.7%) | 2 (2.2%) | 18 (0.53-627.70) | |
| Ulceración | 0.415 | ||||
| Sí | 25 (35.2%) | 10 (39.1%) | 15 (33.3%) | ||
| No | 44 (64.7%) | 14 (60.8%) | 30 (66.6%) | ||
| Invasión vascular/perineural | |||||
| Sí | 4 (5.8%) | ||||
| No | 65 (94.2%) | ||||
| Infiltrado inflamatorio | |||||
| No infiltrado | 8 (11.6%) | ||||
| Leve | 23 (33.3%) | ||||
| Moderado | 16 (23.2%) | ||||
| Intenso | 12 (17.4%) | ||||
| Desconocido | 10 (14.5%) | ||||
| Índice mitótico | |||||
| ≤5 | 46 (66.7%) | ||||
| >5 | 21 (30.4%) | ||||
| Desconocido | 2 (2.9%) | ||||
| Tratamiento adyuvante | |||||
| Sí | 12 (17.4%) | ||||
| No | 54 (78.3%) | ||||
| Desconocido | 3 (4.35%) | ||||
GC: ganglio centinela; MMII: miembros inferiores; MMSS: miembros superiores; OR: odds ratio; p: valor estadístico.
La tasa de identificación global del ganglio centinela fue del 98.5% (68 pacientes). En un paciente que presentaba la lesión en sien izquierda no se detectó migración linfática del radiotrazador en la linfogammagrafía previa a la cirugía y tampoco se detectó intraoperatoriamente el ganglio centinela. Se disecaron un total de 164 ganglios linfáticos, siendo el número medio de ganglios centinela extirpados de 2.37. En el 33% de los casos solo se extirpó un ganglio centinela, las cuencas linfáticas en las que se detectó el ganglio centinela incluyeron: axila unilateral (33 casos, 47.8%), ambas axilas (un caso, 1.4%), ingle unilateral (27 casos, 39.1%), ambas ingles (un caso, 1.4%), ambas ingles y ambas axilas (2 casos, 2.9%), región de cabeza y cuello unilateral (3 casos, 4.3%), cabeza y cuello bilateral (2 casos, 2.9%). El área de drenaje para los melanoma de los miembros fue siempre homolateral. Se observó drenaje a múltiples campos en 5 casos (7.1%), todos ellos originados de melanomas de localización dorsal.
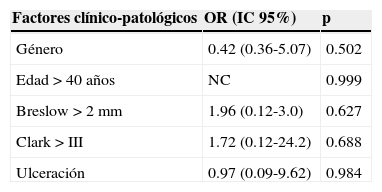
De los 68 pacientes en los que se detectó el ganglio centinela, 23 (33.8%) dieron un resultado positivo para afectación metastásica. Respecto a los factores predictores de afectación metastásica del ganglio centinela, a pesar de que sí se observa un aumento del riesgo relativo de la afectación proporcional al grosor de Breslow y al nivel de Clark, este hallazgo no ha alcanzado un valor estadístico significativo en el análisis univariante (tabla 1) ni en el multivariante (tabla 2).
Análisis multivariante de factores clínico-patológicos predictores de afectación del ganglio centinela
| Factores clínico-patológicos | OR (IC 95%) | p |
|---|---|---|
| Género | 0.42 (0.36-5.07) | 0.502 |
| Edad>40 años | NC | 0.999 |
| Breslow>2mm | 1.96 (0.12-3.0) | 0.627 |
| Clark>III | 1.72 (0.12-24.2) | 0.688 |
| Ulceración | 0.97 (0.09-9.62) | 0.984 |
GC: ganglio centinela; IC: intervalo de confianza; NC: no conocido; OR: odds ratio; p: valor estadístico.
De los pacientes con ganglio centinela positivo, el 78% (18 de 23 pacientes) fueron sometidos a linfadenectomía. Hubo 5 pacientes con ganglio centinela positivo en los que no se llevó a cabo la linfadenectomía por las condiciones basales del paciente y en ninguno de ellos se ha producido recidiva local o a distancia. Solo 2 pacientes de 18 sometidos a linfadenectomía (11%) presentaban otros ganglios linfáticos afectados por metástasis, con un grosor de Breslow de 15.2mm. y 2.77mm, respectivamente. De los pacientes con ganglio centinela positivo, el 47% fueron tratados con interferón alfa2b a dosis altas durante un año (pauta kirwood). Un paciente (4.6%) con ganglio centinela negativo pero con factores pronósticos negativos (estadio iib) fue tratado con interferón alfa2b.
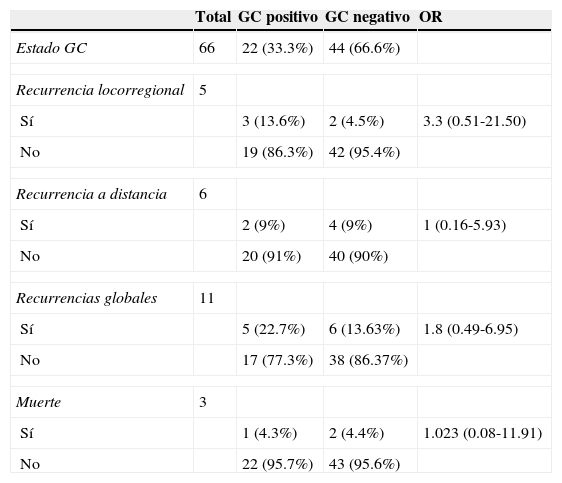
Los pacientes fueron seguidos durante un periodo medio de 95 meses (rango 7-100). Se produjo la pérdida del seguimiento en 2 casos, uno presentaba ganglio centinela positivo y otro ganglio centinela negativo. Se han producido 11 recurrencias (16.6%), 5 a nivel locorregional y 6 a distancia. En el grupo de pacientes con ganglio centinela positivo, 5 (22.7%) de 22 pacientes desarrollaron recurrencia, 3 a nivel local y 2 a distancia. En el grupo de pacientes con ganglio centinela negativo, 6 pacientes (13.63%) desarrollaron recurrencia, 2 a nivel local y 4 a distancia, lo que determina una tasa de falsos negativos del 9.5% (considerando la tasa de falsos negativos como la presencia de una recurrencia local en los pacientes con ganglio centinela negativo). No obstante, si incluyéramos también a aquellos pacientes que han sufrido una recidiva a distancia presentando el ganglio centinela negativo, la tasa de falsos negativos se incrementaría hasta el 13.6%. De los 18 pacientes con ganglio centinela positivo a los que se realizó linfadenectomía, 3 de ellos (16%) desarrollaron una recurrencia a nivel local. En nuestra muestra, aunque existe una diferencia porcentual en la recurrencia entre los pacientes con ganglio centinela positivo y ganglio centinela negativo (OR=1.8; tabla 3), tampoco hemos alcanzado en este tema un valor estadísticamente significativo.
Análisis de recurrencias y muertes en función del estado del ganglio centinela
| Total | GC positivo | GC negativo | OR | |
|---|---|---|---|---|
| Estado GC | 66 | 22 (33.3%) | 44 (66.6%) | |
| Recurrencia locorregional | 5 | |||
| Sí | 3 (13.6%) | 2 (4.5%) | 3.3 (0.51-21.50) | |
| No | 19 (86.3%) | 42 (95.4%) | ||
| Recurrencia a distancia | 6 | |||
| Sí | 2 (9%) | 4 (9%) | 1 (0.16-5.93) | |
| No | 20 (91%) | 40 (90%) | ||
| Recurrencias globales | 11 | |||
| Sí | 5 (22.7%) | 6 (13.63%) | 1.8 (0.49-6.95) | |
| No | 17 (77.3%) | 38 (86.37%) | ||
| Muerte | 3 | |||
| Sí | 1 (4.3%) | 2 (4.4%) | 1.023 (0.08-11.91) | |
| No | 22 (95.7%) | 43 (95.6%) | ||
GC: ganglio centinela; OR: odds ratio.
La mortalidad global de la muestra fue del 5.79%; se han producido 3 muertes (4.3%) causadas por melanoma, una de ellas en el grupo de ganglio centinela positivo (tasa de mortalidad del 4.3%) y las otras 2 muertes corresponden al grupo de ganglio centinela negativo (tasa de mortalidad del 4.4%).
Se observaron complicaciones postoperatorias de la biopsia selectiva del ganglio centinela (seroma, infección) en un 4.4% (3/68), en comparación con las complicaciones de los pacientes sometidos a linfadenectomía (linfedema, linfocele, seroma, infección) en caso de ganglio centinela positivo que se observaron en 38% de estos pacientes (7/18) (OR=0.07; p=0.0005), presentando estas diferencias un valor estadísticamente significativo.
DiscusiónEn nuestro estudio el porcentaje de positividad del ganglio centinela fue del 33.8%, que está por encima de otros estudios en los que este porcentaje varió entre el 15 y el 23%6,8,10–12. De los pacientes sometidos a linfadenectomía tras un resultado de ganglio centinela positivo, el 11% presentó otros ganglios no-centinela afectados, un resultado comparable a otras series que variaban desde el 7.8% hasta el 33%5,6,13. Es reseñable la baja incidencia de positividad en los ganglios no-centinela extirpados en la linfadenectomía observada en nuestro estudio (11%), así como en otros estudios que puede indicar que este procedimiento podría ser innecesario en pacientes con melanomas delgados4,14,15, mostrando que las metástasis en estos pacientes están exclusivamente confinadas en el ganglio centinela.
Respecto a los factores predictores de afectación del ganglio centinela, no hemos encontrado relación estadísticamente significativa en el análisis univariante para el grosor de Breslow ni para el nivel de Clark, al contrario que otros estudios16,17. No obstante, sí se observa una tendencia según la cual al aumentar el grosor de Breslow o el nivel de Clark se evidencia un aumento de la OR para la afectación metastásica del ganglio centinela. Es muy probable que el tamaño muestral sea insuficiente para alcanzar un valor estadísticamente significativo.
El valor pronóstico del nivel de Clark para la presencia de ganglio centinela positivo ha sido controvertido en otros estudios18,19. Al analizar los estudios publicados se observa que los niveles de corte del índice de Clark utilizados son muy variables, haciendo la comparación de los resultados difícil, por lo que no existe un nivel de Clark establecido como el óptimo para predecir la presencia de ganglio centinela positivo20.
En nuestro estudio no hemos encontrado relación significativa entre ulceración y afectación del ganglio centinela, a diferencia de otras series, en los que la ulceración está asociada negativamente con la supervivencia en todos los subgrupos de Breslow del melanoma21, lo que ha hecho que esté incluida en la clasificación TNM de la AJCC desde su sexta edición. No obstante, Sondak et al.22 no encuentran asociación entre la presencia de ulceración y el resultado positivo del ganglio centinela, lo que atribuyen a las distintas posibles causas de la ulceración y al error que puede inducir su presencia al medir el Breslow.
Las variables edad y sexo no fueron significativas en el análisis univariante; la edad ha sido un tema de debate en diversos estudios18,19,22 y algunos estudios han detectado una menor afectación ganglionar en los pacientes de mayor edad pese a tener menor tiempo libre de enfermedad y supervivencia18. De la misma forma, la relación entre sexo y el resultado de la biopsia selectiva del ganglios centinela no está establecida, habiendo estudios que muestran mayor número de ganglio centinela positivos en varones21,23 y otros que no la encuentran18,19,22. En nuestro estudio las mujeres presentaron un mayor porcentaje de afectación del ganglio centinela, pero este resultado no fue estadísticamente significativo.
En el análisis multivariante no hemos encontrado relación estadística significativa para ninguna de las variables analizadas. Este resultado podría explicarse por varios factores: el tamaño muestral, la escasez de eventos y finalmente porque muchas variables histológicas como el espesor de Breslow, los niveles de Clark y la ulceración están correlacionadas entre sí y actúan como factor de confusión20.
Hemos encontrado 2 casos en los que el ganglio centinela fue negativo y desarrollaron una recurrencia ganglionar local, dando lugar a una tasa de falsos negativos del 9.5%, cifra que está en el rango de lo observado en otros estudios que varían entre el 4 y el 32%5,12,24. Estos falsos negativos pueden estar asociados a diferentes factores: la curva de aprendizaje de la técnica25, la alteración de los trayectos linfáticos asociados a la escisión de la lesión primaria, obstrucción linfática por embolismo de células tumorales, presencia de un ganglio centinela en el cuello26, análisis histopatológico inadecuado y diseminación hematógena.
Las recurrencias fueron más frecuentes en el grupo de pacientes de ganglio centinela positivo (22.7%) que en el grupo de ganglio centinela negativo (13.63%), aunque las diferencias obtenidas no son estadísticamente significativas. En nuestro estudio la tasa de recidiva local después de linfadenectomía tras un ganglio centinela positivo fue del 13.6%, cifra en el rango de lo publicado en otros estudios que variaban entre el 0 y el 20%8,27. En cambio, la tasa de recidivas locales después de una linfadenectomía de ganglios clínicamente palpables varía entre el 20 y el 50%27–29. Es difícil diferenciar, no obstante, si el mejor control regional está relacionado con la linfadenectomía complementaria realizada tras un ganglio centinela positivo. Otro estudio27 comparó retrospectivamente 2 grupos de pacientes con ganglio centinela positivo de diferentes hospitales, algunos de los cuales fueron sometidos a linfadenectomía. Los autores no encontraron diferencias significativas en términos de supervivencia entre ambos grupos. En nuestro estudio es reseñable que solo 2 pacientes de los 22 con ganglio centinela positivo presentaron otros ganglios afectados (11%) en la linfadenectomía, y entre los que presentaron linfadenectomía negativa, otros 2 pacientes (13%) desarrollaron recurrencia local, resultados que ofrecen dudas acerca de la efectividad real de la linfadenectomía.
Con relación al estudio de la mortalidad de la muestra, se produjeron 3 muertes (4.3%) directamente relacionadas con el melanoma durante un periodo de seguimiento medio de 95 meses. Este porcentaje es levemente inferior al de otras series14,15 en las que se encuentra en torno al 8%. Esta diferencia podría explicarse por el elevado porcentaje (23.5%) de pacientes incluidos en nuestra muestra en estadios iniciales de la enfermedad, que está también por encima del de las series mencionadas, que se encuentra en alrededor del 4%. El resultado de la biopsia selectiva del ganglio centinela es considerado el factor pronóstico más específico y sensible para el tiempo libre de enfermedad y la mortalidad20. En nuestro estudio, no obstante, no hemos encontrado diferencias estadísticamente significativas en términos de mortalidad entre los paciente con ganglio centinela positivo y negativo, lo que puede explicarse por el escaso número de eventos registrados.
La frecuencia de complicaciones postoperatorias (seroma, infección) observadas en nuestro estudio fue similar a la de otros estudios, en términos de morbilidad en relación con el análisis del ganglio centinela30, observándose una clara diferencia entre los efectos secundarios asociados a la biopsia selectiva del ganglio centinela respecto a la linfadenectomía, resultados estos estadísticamente significativos.
Hemos compartido nuestra experiencia de 8 años en nuestro centro hospitalario respecto a la biopsia selectiva del ganglio centinela en el melanoma y observamos que este estudio presenta algunas limitaciones, como son: el tamaño muestral, la escasez de eventos registrados asociada a la alta tasa de supervivencia de la muestra y el hecho de que la recogida de datos fue retrospectiva.
ConclusiónLa biopsia selectiva del ganglio centinela en pacientes con melanoma proporciona valiosa información sobre las vías de diseminación linfática del tumor, y también permite una aproximación a la estadificación regional del mismo, evitando los efectos secundarios de la linfadenectomía. No obstante, serían necesarios estudios de mayor tamaño muestral y tiempo de seguimiento para confirmar la validez de la técnica de la biopsia selectiva del ganglio centinela en pacientes con melanoma, y especialmente de la linfadenectomía en casos de ganglio centinela positivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.