La oclusión intestinal secundaria a hernia interna es un reto diagnóstico. La ausencia de síntomas y signos específicos durante la exploración clínica a menudo conducen a una subestimación de la gravedad y a tratamiento quirúrgico temprano.
El propósito de este artículo es revisar la presentación clínica de 2 pacientes con oclusión intestinal secundaria a hernia interna, describir los hallazgos clínicos, bioquímicos y radiológicos, con énfasis en el L-lactato como marcador sérico de isquemia intestinal.
Casos clínicosCaso 1: mujer de 44 años, con historia de litiasis renal y 2 cesáreas. Caso 2: mujer de 86 años, con antecedente de colecistectomía abierta, plastia de pared e inguinal bilateral con colocación de malla. Ambas ingresaron por dolor abdominal y datos de oclusión intestinal. Los reportes de laboratorios demostraron: elevación de L-lactato. Por radiografía, se observaron niveles hidroaéreos, dilatación de asas de intestino delgado y colon. En ambas pacientes la tomografía abdominal con contraste evidenció líquido libre, hernia interna y torsión del mesenterio. En los 2 casos se realizó una laparotomía exploradora con resección intestinal de segmentos isquémicos, con buenos resultados.
ConclusionesLa isquemia intestinal secundaria a hernia interna es difícil de diagnosticar. En pacientes con alta sospecha, signos de obstrucción intestinal y la elevación de L-lactato podrían ser de utilidad para el diagnóstico temprano de isquemia intestinal y tratamiento quirúrgico inmediato.
The intestinal obstruction secondary to internal hernia is a diagnostic challenge. The absence of specific symptoms and signs during clinical examination often lead to underestimation of the severity and its early surgical treatment. The purpose of this article is to review the clinical presentation of two patients with internal hernia, was well as to describe the clinical, biochemical and radiological findings, with emphasis on L-lactate as an early serum marker of intestinal ischaemia.
Clinical casesCase 1: female, 44 years old, with a history of urolithiasis and 2 caesarean sections. Case 2: female, 86 years old, with a history of open cholecystectomy, incisional and bilateral inguinal hernia repair with mesh placement. Both admitted with abdominal pain and intestinal obstruction data. The only significant laboratory finding was elevation of L-lactate. The abdominal X-rays showed air-fluid levels, and dilated loops of small intestine and colon. Abdominal contrast tomography showed free abdominal fluid, internal hernia and mesenteric torsion. In both cases, exploratory laparotomy was performed with bowel resection of ischaemic segments, with uneventful recovery.
ConclusionsIntestinal ischaemia secondary to internal hernia is difficult to diagnose. In patients with a high suspicion, signs of intestinal obstruction by plain radiography, and the elevation of L-Lactate, could help in the early diagnosis of intestinal ischaemia and its immediate surgical treatment.
Una hernia interna está formada por la protrusión de una víscera a través de una abertura peritoneal o mesentérica, dentro de los confines de la cavidad peritoneal1. Tienen una incidencia global de menos del 1%, que constituye hasta un 5.8% de todas las obstrucciones del intestino delgado, las cuales, si no se tratan, alcanzan una mortalidad global superior al 50% en caso de isquemia intestinal y necrosis2–4.
La clasificación de Meyers describe las hernias internas según sus características clínicas y radiográficas, y el sitio anatómico, siendo las más frecuentes: paraduodenales (53%), pericecales (13%), transmesentéricas y del foramen de Winslow (8%)2–4.
Es difícil realizar el diagnóstico preoperatorio de una hernia interna y con frecuencia requiere la resección del intestino afectado durante la cirugía1,4. La discrepancia de los signos clínicos y los síntomas a menudo conduce a una subestimación de la gravedad. El diagnóstico definitivo de isquemia intestinal presenta un mayor reto; su desarrollo lleva consigo una mortalidad de entre el 67 y el 80% cuando no se realiza tratamiento quirúrgico temprano5.
Hoy en día, el L-lactato se mide de forma rutinaria como un marcador de isquemia de órganos o en cualquier situación de hipoxia. A pesar de que el lactato no ha sido reconocido como biomarcador específico de isquemia intestinal, el fallo en su corrección se ha asociado a una mortalidad del 100%6.
El propósito de este artículo es revisar la presentación clínica de 2 pacientes con oclusión intestinal secundaria a hernia interna; describir los hallazgos clínicos, bioquímicos y radiológicos, con énfasis en el L-lactato como biomarcador sérico de isquemia intestinal.
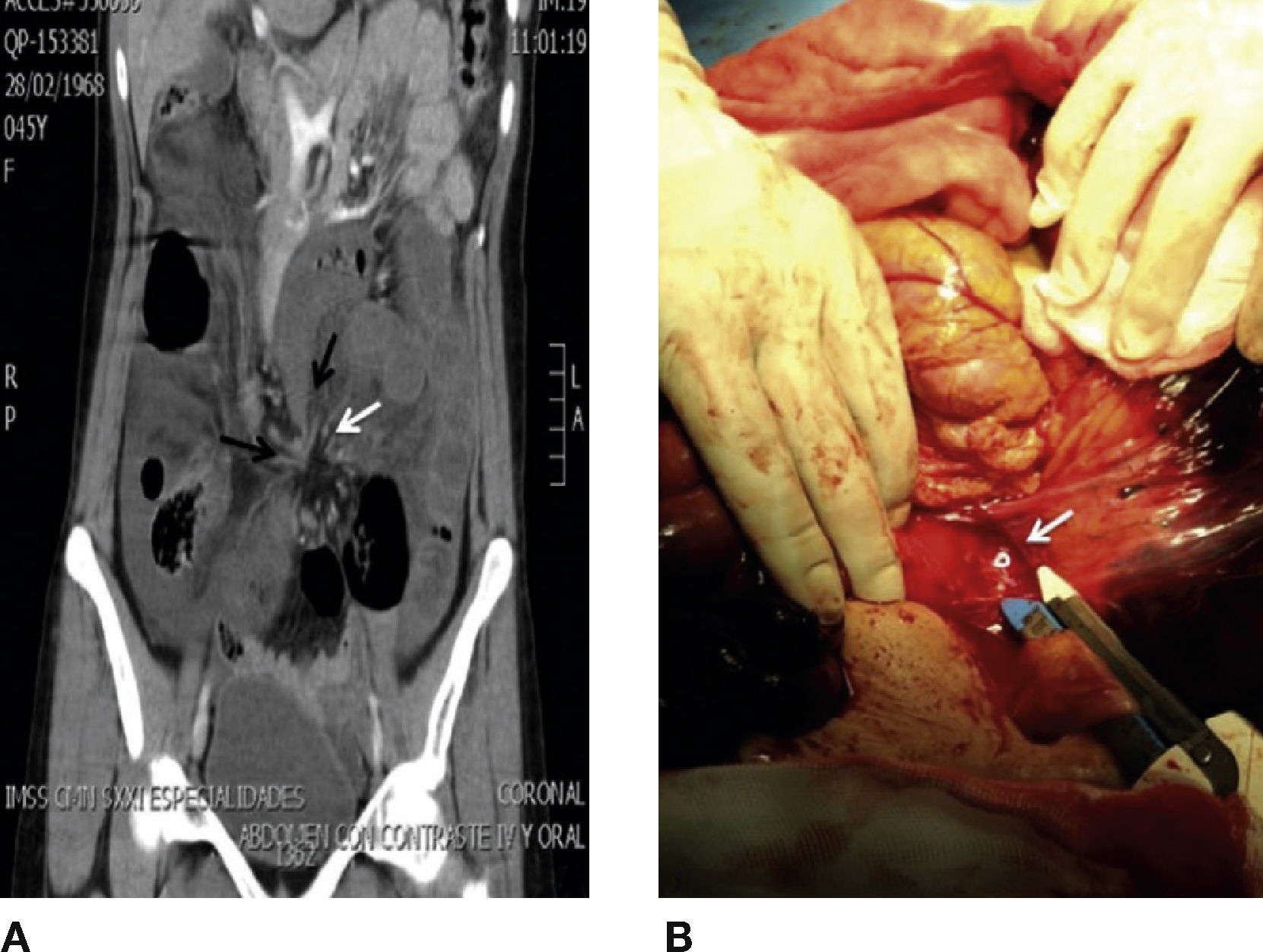
Casos clínicosCaso 1Mujer de 44 años, con antecedentes de litiasis renal y 2 cesáreas. Acudió al servicio de Urgencias por dolor abdominal tipo cólico de inicio súbito, de 1h de evolución, el cual se localizó en el flanco y la fosa iliaca izquierda. Se acompañó de constipación, obstipación y distensión abdominal. En la exploración abdominal, se encontró: abdomen globoso a expensas de panículo adiposo, peristalsis presente y dolor leve a la palpación profunda en el flanco izquierdo, sin datos de irritación abdominal. La biometría hemática, la química sanguínea y los electrolitos séricos no mostraron alteraciones; sin embargo, la medición sérica del lactato fue de 5.4 mmol/l. La radiografía de abdomen demostró dilatación de asas de intestino delgado y colon, fijas en el mesogastrio, con niveles hidroaéreos. La tomografía abdominal con contraste evidenció líquido libre en ambas correderas parietocólicas, dilatación de asas de intestino delgado, estenosis fusiforme en el íleon terminal y el colon distal (signo del pico), torsión del mesenterio adyacente al íleon terminal y al colon distal (signo del remolino) (fig. 1 A).
A) Reconstrucción coronal de tomografía de abdomen que evidencia estenosis fusiforme en el íleon terminal y colon distal (signo del pico, flecha negra), torsión del mesenterio adyacente al íleon terminal y colon distal (signo del remolino, flecha negra). B) Laparotomía exploradora que muestra el orificio transmesentérico que originó la hernia interna de intestino delgado y colon.
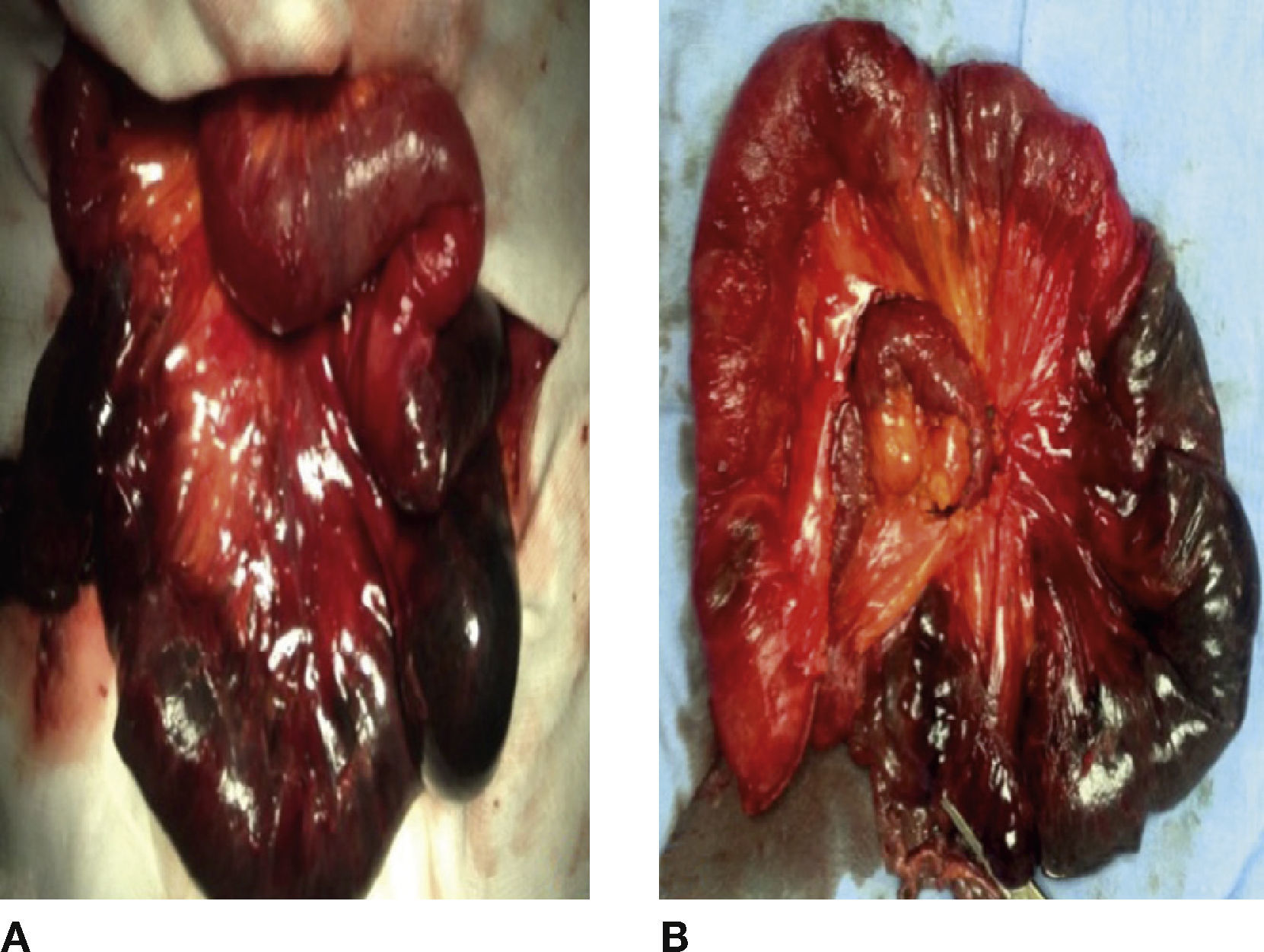
Se realizó una laparotomía exploradora, con hallazgo de hernia transmesentérica con involucro de 110cm de íleon terminal y 50cm de colon descendente (fig. 1 B). Se realizó la resección de los segmentos isquémicos, entero-entero anastomosis latero-lateral, y una colostomía terminal con procedimiento de Hartmann.
La paciente presentó una evolución adecuada, egresándose al quinto día postoperatorio.
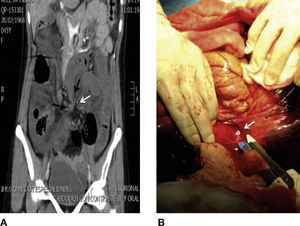
Caso 2Mujer de 86 años, con antecedentes de colecistectomía abierta, plastia de la pared e inguinal bilateral, con colocación de malla. Ingresó por dolor abdominal tipo cólico, progresivo, de 48h de evolución, mal localizado, que se acompañó de náuseas y vómito de contenido gastroalimentario, obstipación y distención abdominal. En la exploración se encontró: abdomen distendido, con defecto herniario sobre la línea media de 10cm y peristalsis presente. Durante la palpación abdominal, el contenido herniario fue reductible, dolor leve a la palpación profunda en el mesogastrio, sin datos de irritación abdominal. Los reportes de laboratorio demostraron: leucocitosis de 10.9ml/mm3 y lactato sérico de 2.2 mmol/l. Se realizaron radiografías de abdomen simple, las cuales mostraron dilatación de asas del intestino delgado, niveles hidroaéreos y presencia de gas en el colon descendente. Se inició tratamiento conservador con hidratación y descompresión abdominal con sonda nasogástrica. Doce horas después, presentó aumento del dolor y elevación del lactato sérico a 4 mmol/l. La tomografía abdominal contrastada demostró líquido libre perihepático en el fondo de saco, y ambas correderas parietocólicas, defecto herniario en la pared anterior abdominal, con presencia de asas de intestino delgado y mesenterio; el segmento de intestino delgado contenido se reportó dilatado con niveles hidroaéreos, neumatosis en su pared y torsión de su mesenterio.
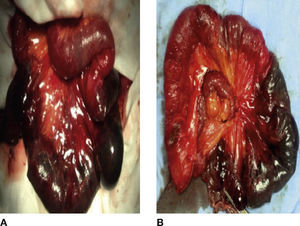
Se realizó una laparotomía exploradora encontrando: defecto de la pared abdominal en la línea media de 8cm aproximadamente, saco herniario con asas de intestino delgado reductible, una hernia interna que incluyó 60cm de yeyuno isquémico con adherencias y la raíz de su mesenterio volvulado (fig. 2 A). Se realizaron una adherenciólisis, una resección de los segmentos isquémicos y entero enteroanastomosis latero-lateral (fig. 2B).
La paciente evolucionó de forma satisfactoria, egresándose al décimo día del postoperatorio.
DiscusiónLa oclusión aguda del intestino y su compromiso vascular son una urgencia quirúrgica cuya gravedad es secundaria a varios factores: la constitución de un tercer espacio en la luz intestinal (fuente de trastornos hidroelectrolíticos que son agravados por el incremento de las secreciones), con disminución de la absorción en el interior del intestino ocluido, edema parietal, trasudación hacia la cavidad peritoneal y pérdidas secundarias a vómitos. Todo esto provoca deshidratación extracelular, con hipovolemia e insuficiencia renal, que puede conducir a un estado de choque rápidamente irreversible. La proliferación de bacterias en el líquido intestinal conduce a la liberación de estos y sus toxinas a la circulación venosa, llevando a un estado séptico5.
La isquemia intestinal tiene una mortalidad del 67 al 80% cuando no es tratada de forma temprana5. El tipo de lesión varía de acuerdo con numerosos factores, incluyendo: el tipo de vaso afectado, el grado de oclusión, el mecanismo de isquemia (oclusiva o no oclusiva), su duración y la presencia de circulación colateral. De todas las capas del intestino, la mucosa es la más vulnerable a los efectos de la hipoxia. De ahí que las lesiones iniciales se asienten en la mucosa, donde se aprecian áreas de edema y hemorragia submucosa, ulceración y, finalmente, necrosis. Solo si la isquemia persiste, la afectación llega a ser transmural, con posibilidad de perforación, sepsis y peritonitis7.
Una vez tratada la causa de la isquemia, se plantea el problema de conservación o resección del asa del intestino delgado inicialmente desvitalizada. Toda resección intestinal conlleva un riesgo de contaminación de la cavidad peritoneal y fístula anastomótica. Inversamente, la conservación de un asa intestinal desvitalizada expone al riesgo de peritonitis posquirúrgica por perforación y, más raramente, estenosis isquémica secundaria y oclusión posquirúrgica iterativa5.
En contraste con los marcadores serológicos de isquemia utilizados en el corazón, el hígado y otros órganos, que identifican la isquemia rápidamente y con precisión, los marcadores para isquemia intestinal son de baja precisión y utilidad; hay varias explicaciones posibles para esto. En primer lugar, el intestino tiene arquitectura compleja compuesto por mucosa, submucosa y una capa de músculo liso externa. Un marcador ideal de la viabilidad intestinal debe ser capaz de reflejar esta complejidad, lo que permite la distinción entre daños limitados a la mucosa o en el espesor total del intestino. El segundo obstáculo potencial es el metabolismo de primer paso hepático. Cualquier marcador de isquemia intestinal lanzado a través de la ruta venosa-portal en el sistema puede presentar aclaramiento hepático antes de alcanzar la circulación sistémica. Una tercera explicación es la sobreexpresión de proteínas entre el hígado y el intestino, lo que hace difícil distinguir el órgano específico de origen8.
Durante la isquemia de los tejidos, el metabolismo cambia de aeróbico a anaeróbico y las células dependen de la glucólisis anaeróbica, cuyo producto final al es el L-lactato. Esta ruta metabólica es común para todos los tejidos en el cuerpo, por lo tanto, los niveles elevados de L-lactato no son un marcador específico de isquemia intestinal; sin embargo, autores como Kurimoto et al.8 han encontrado elevaciones significativas en la vena mesentérica superior, posteriores al pinzamiento arterial, lo que indica que el Llactato es un marcador de isquemia en colon9.
En la isquemia intestinal, existe disminución del oxígeno luminal, bacterias que pertenecen a la flora gastrointestinal normal (Escherichia coli, especies de Lactobacillus y de Klebsiella) aumentan su metabolismo anaeróbico, teniendo como resultado la producción de 2 isómeros de lactato: Llactato y D-lactato10. En condiciones normales, la mucosa intestinal sana evita el paso del D-lactato a la circulación. Durante la isquemia mesentérica, la función de barrera de la mucosa está comprometida, lo cual facilita la translocación de bacterias en la pared intestinal, incrementando la capilaridad y la permeabilidad de la mucosa8, lo que permite el paso del D-lactato a la circulación portal. Se ha estudiado el D-lactato como marcador sérico de isquemia intestinal; sin embargo, los resultados no han sido favorables7,11,12.
El hecho de haber realizado L-lactato fue significativo, ya que en ambos casos se reportó una elevación importante, lo que indicó metabolismo anaeróbico, secundario a una mala perfusión del tejido intestinal. En el segundo caso, su elevación progresiva facilitó identificar la pobre respuesta al manejo conservador y la persistencia del estado de isquemia del segmento intestinal afectado.
A pesar de que el L-lactato no ha sido reconocido como marcador específico de isquemia intestinal, el fallo en su corrección se ha asociado a mortalidades del 100%. McNelis et al.6 demostraron que la compensación en menos de 24h tiene una mortalidad del 4%, entre 24 a 48h la mortalidad se eleva al 13%, llegando al 43% en aquellos que es posterior a esto en la Unidad de Cuidados Intensivos y Quirúrgicos. La respuesta a una elevación del lactato implica medidas orientadas a la maximización del flujo de oxígeno. La normalización de una concentración sérica de lactato arterial indicaría una adecuada perfusión tisular a nivel celular, corrección y extracción adecuada de oxígeno6. En ambos casos, la corrección del lactato arterial se produjo en menos de 24h posteriores al tratamiento quirúrgico y, a pesar de que fue necesaria la resección de los segmentos intestinales isquémicos, los pacientes evolucionaron de forma adecuada.
ConclusiónLa oclusión intestinal secundaria a hernia interna es difícil de diagnosticar antes de la operación, a pesar de la gran variedad de técnicas de diagnóstico actualmente disponibles. La ausencia de signos específicos durante la exploración clínica del paciente hace que la decisión temprana del abordaje quirúrgico continúe siendo un reto. El diagnóstico temprano es fundamental para la preservación del segmento intestinal comprometido. En ambos casos presentados, el único marcador bioquímico sérico alterado fue el L-lactato, que representó la presencia de un metabolismo anaeróbico. La elevación progresiva en el segundo caso nos indicó una persistencia de inadecuada perfusión tisular. El complemento de la tomografía abdominal con contraste nos permitió identificar los segmentos de intestino afectado y el compromiso de su perfusión, siendo determinante en ambos casos para la decisión de exploración quirúrgica. Las hernias internas progresan rápidamente a isquemia intestinal. En pacientes con alta sospecha, signos de obstrucción intestinal por radiografía simple, la elevación de lactato podría ser útil para el diagnóstico temprano de la isquemia intestinal y el tratamiento quirúrgico inmediato.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.