El manejo de las fracturas orbitarias es uno de los retos del trauma facial. La gama de materiales para su reconstrucción es amplia y se mantiene en crecimiento constante, no así el consenso para su uso ni la literatura que lo sustenta.
ObjetivoPresentar el uso y diseño del implante óseo preformado como alternativa para la reconstrucción de las fracturas de piso de órbita en edad pediátrica.
Caso clínicoVarón de 7 años, quien sufre trauma contuso en hemicara derecha. Se integra diagnóstico clínico y tomográfico de fractura de piso de órbita derecha, de tipo estallamiento, pura, con atrapamiento de músculo recto inferior y ptosis palpebral derecha postraumática. Como tratamiento se realiza con éxito reconstrucción quirúrgica a los 7 días, con colocación de implante de cemento óseo preconstruido. A las 8 semanas posquirúrgicas, el paciente presenta ptosis leve residual, sin limitación a los movimientos ni diplopía.
ConclusionesEl uso de cemento óseo se puede considerar adecuado para la reconstrucción de dichas fracturas, como una alternativa más dentro de los biomateriales que pueden ser utilizados por el oftalmólogo. Consideramos que nuestro optimismo por los resultados obtenidos en este reporte de caso nos obliga a aumentar el número de pacientes para recabar mayores evidencias y mayor seguimiento a largo plazo.
The management of orbitary fractures is one of the most challenging in facial trauma; the variety of reconstruction materials for its treatment is broad and is constantly improving, but despite this there is no consensus for its use or literature that sustains it.
ObjectiveTo present the use and design of a preformed bone implant as an alternative for the reconstruction of orbital floor fractures in the pediatric age group.
Clinical caseA 7-year old male who suffered a right hemifacial contusion trauma with clinical and tomographic diagnosis of right pure blowout type orbital floor fracture with inferior rectus muscle entrapment and right post-traumatic palpebral ptosis. Successful surgical reconstruction was performed 7 days later with a pre-constructed bone cement implant. Eight weeks after surgery the patient presented with mild residual palpebral ptosis, no ocular movement limitations and no diplopia.
ConclusionsThe use of a bone cement implant can be considered appropriate for the reconstruction of these fractures, as another alternative to be used by the ophthalmologist among the variety of all the other materials used for this purpose. We consider that our optimism based on the results obtained in this case obligates us to increase the number of patients treated in order to gather more evidence and do larger follow up.
El manejo de las fracturas orbitarias es uno de los retos del trauma facial: un manejo no adecuado conlleva dramáticas consecuencias, que van desde los defectos en la visión (diplopía) hasta alteraciones en la apariencia física, con impacto directo en todos los aspectos de la vida del paciente.
Se considera que las fracturas orbitarias son poco frecuentes en la población pediátrica, y varían desde un 5 hasta un 25% de todas las fracturas faciales. Su etiología principal son los accidentes de tráfico, en el grupo de los 0 a los 6 años, seguida por las actividades diarias en el grupo de edad de los 7 a los 12 años. La baja incidencia está relacionada con las características anatómicas del infante, como frente prominente, falta de neumatización de los senos, estructuras cartilaginosas que permiten la absorción del impacto y menor desplazamiento de los fragmentos1–3. La afección al piso de órbita tiene una frecuencia aproximada del 25-58%4. El mecanismo más común de fractura del piso de órbita es el conocido como «blow out» descrito por primera vez en 1943 por Pfeiffer. Ocurre cuando la fuerza de impacto sobre el globo ocular es absorbida por el reborde orbitario y transmitida hacia el piso, que se fractura más frecuentemente en el tercio medio, próximo al canal infraorbitario, provocando así herniación del contenido orbitario hacia el seno maxilar3,5. La rotura puede ser lineal, en bisagra, de tipo «trap door» y conminuta; y se divide en pura (sin involucro del reborde orbitario) e impura (con involucro del reborde orbitario)6.
El tratamiento continúa siendo un reto, ya que una adecuada elección del abordaje quirúrgico, del momento idóneo y del material para osteosíntesis impactan directamente en el resultado posoperatorio y en el pronóstico. La gama de materiales disponibles actualmente para la reconstrucción de estas fracturas es amplia y se mantiene en crecimiento constante, no así el consenso nio las indicaciones específicas para cada uno de ellos.
ObjetivoMostrar el uso y la construcción de un implante de cemento óseo preformado como una alternativa a las ya existentes para la reconstrucción de las fracturas del piso de órbita en edad pediátrica.
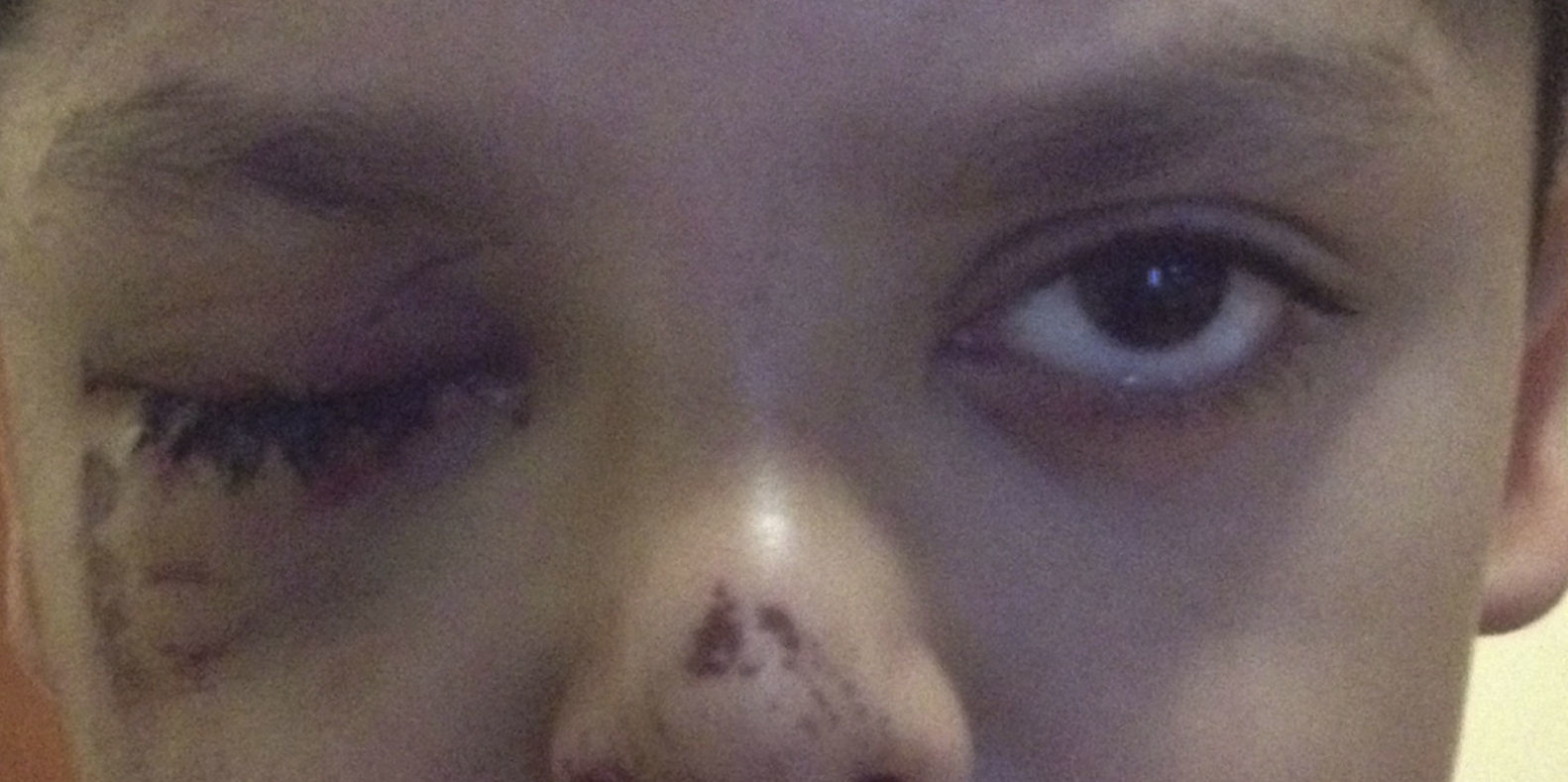
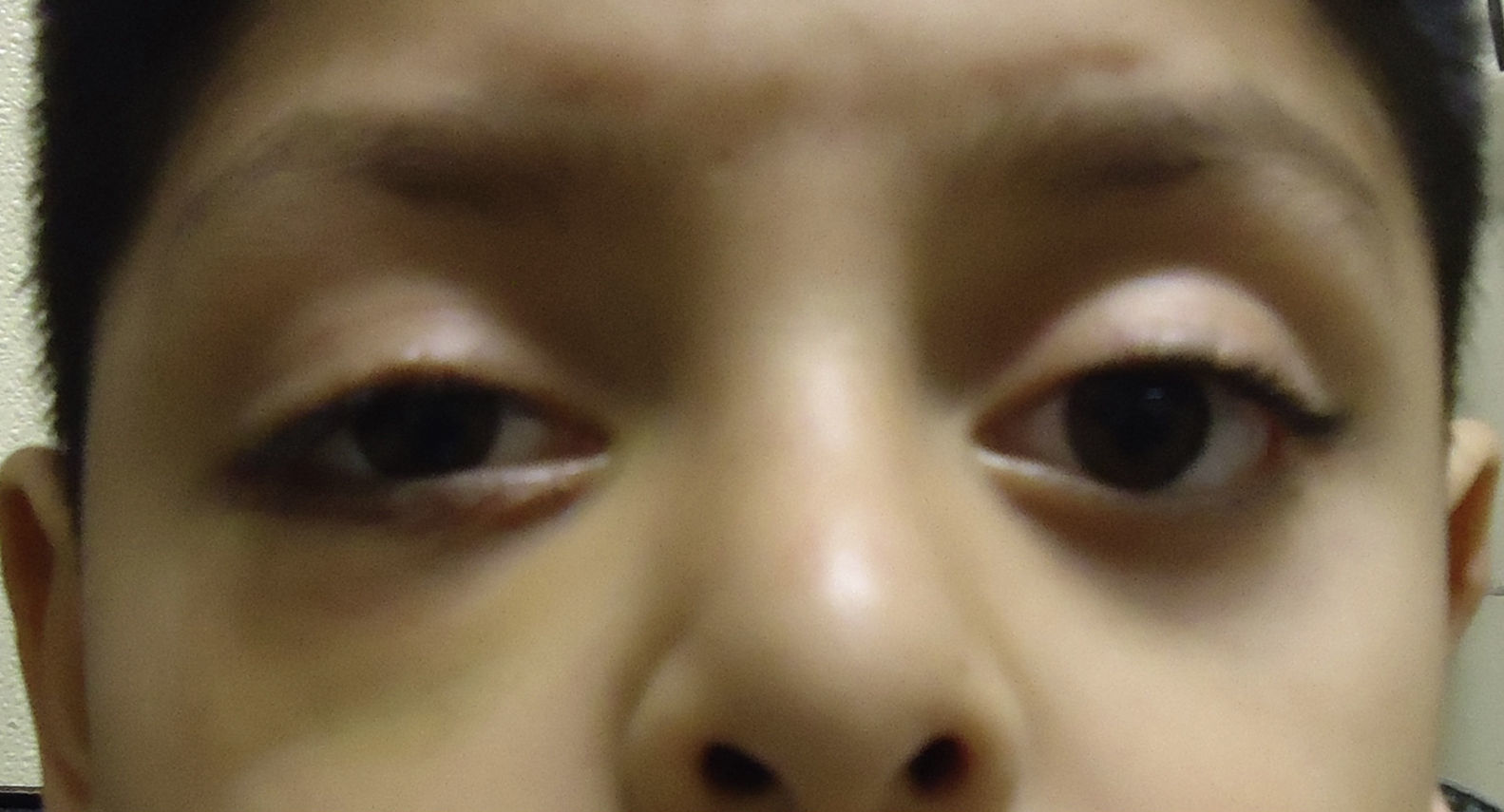
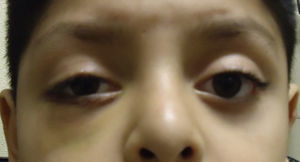
Caso clínicoPresentamos el caso de un varón escolar de 7 años de edad, quien sufre trauma contuso en hemicara derecha, presenta dolor en la región orbitaria derecha, imposibilidad para abrir el párpado derecho y visión doble; niega mareo, náuseas o vómito (fig. 1).
Exploración física oftalmológicaAgudeza visual: ojo derecho 20/30; ojo izquierdo 20/20.
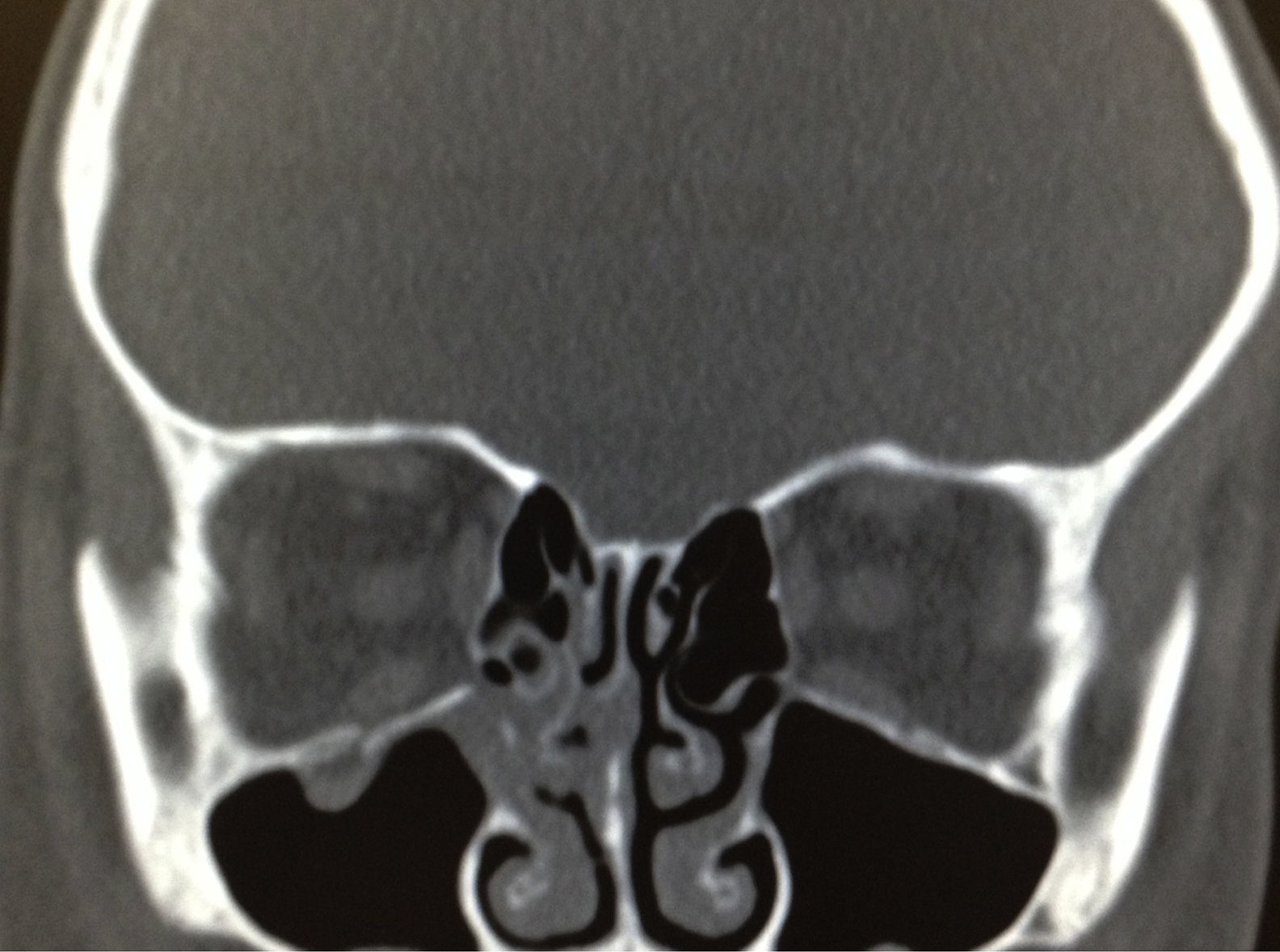
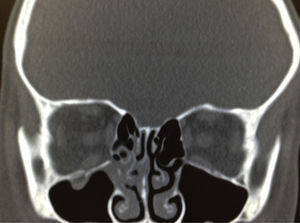
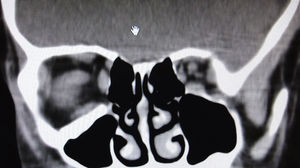
Blefaroedema derecho (+), ptosis palpebral severa, múltiples abrasiones dérmicas. Hipotropía de 30 dioptrías prismáticas en el ojo derecho con limitación (−2) a la supraducción. Los reflejos pupilares están presentes en ambos ojos, sin alteraciones; la presión intraocular es en ambos ojos de 16mmHg. Presenta diplopía vertical en supraversión y la prueba de ducción forzada del ojo derecho es positiva para la supraducción. Se realiza tomografía computada de cráneo y órbitas, con cortes axiales y coronales de 1mm, en la cual se aprecia solución de continuidad ósea en piso orbitario derecho, correspondiente a fractura por estallamiento. El reborde orbitario aparece sin afección. Se aprecia herniación de los tejidos intraorbitarios hacia el seno maxilar y atrapamiento del músculo recto inferior, con integridad de la estructura del globo ocular (fig. 2).
DiagnósticoFractura de piso de órbita derecha, de tipo estallamiento, pura.
Ptosis palpebral derecha postraumática.
TratamientoSe realiza reconstrucción quirúrgica con osteosíntesis utilizando implante preformado de cemento óseo, a los 7 días del diagnóstico.
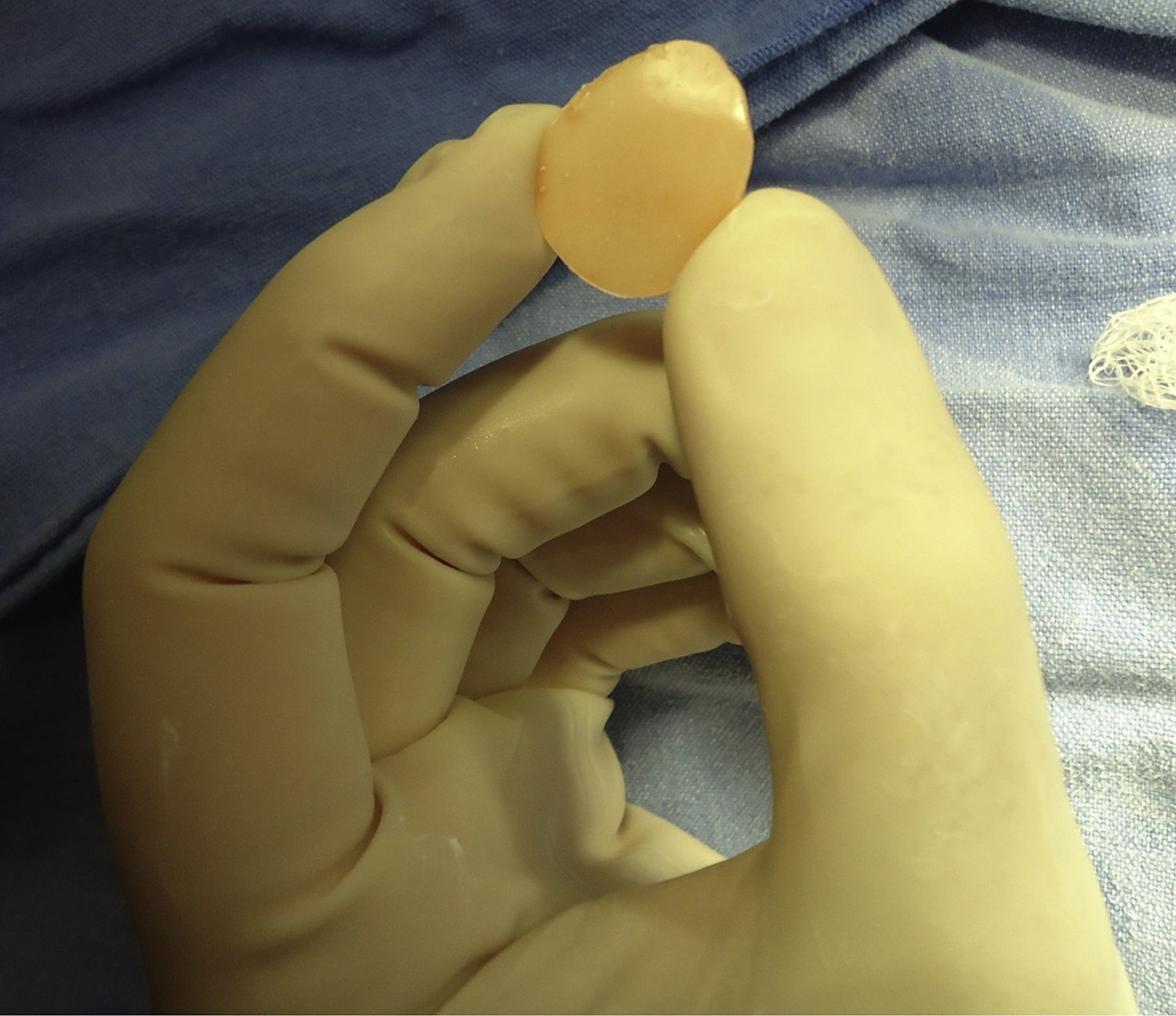
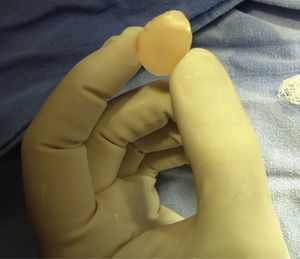
Para la construcción del implante preformado seguimos el siguiente proceso:
- 1.
Planeación de las dimensiones con base en el cráneo muestra.
- 2.
Se calcula el volumen formando un modelo con plastilina basado en las dimensiones previamente tomadas.
- 3.
Se moldea manualmente el cemento óseo respetando el volumen y los radios de curvatura ya establecidos en los moldes de plastilina.
- 4.
Matriz de cemento óseo, aún sin desbastar los excesos de las dimensiones.
- 5.
Producto terminado y esterilizado por plasma, se muestran para pared interna y piso (fig. 3).
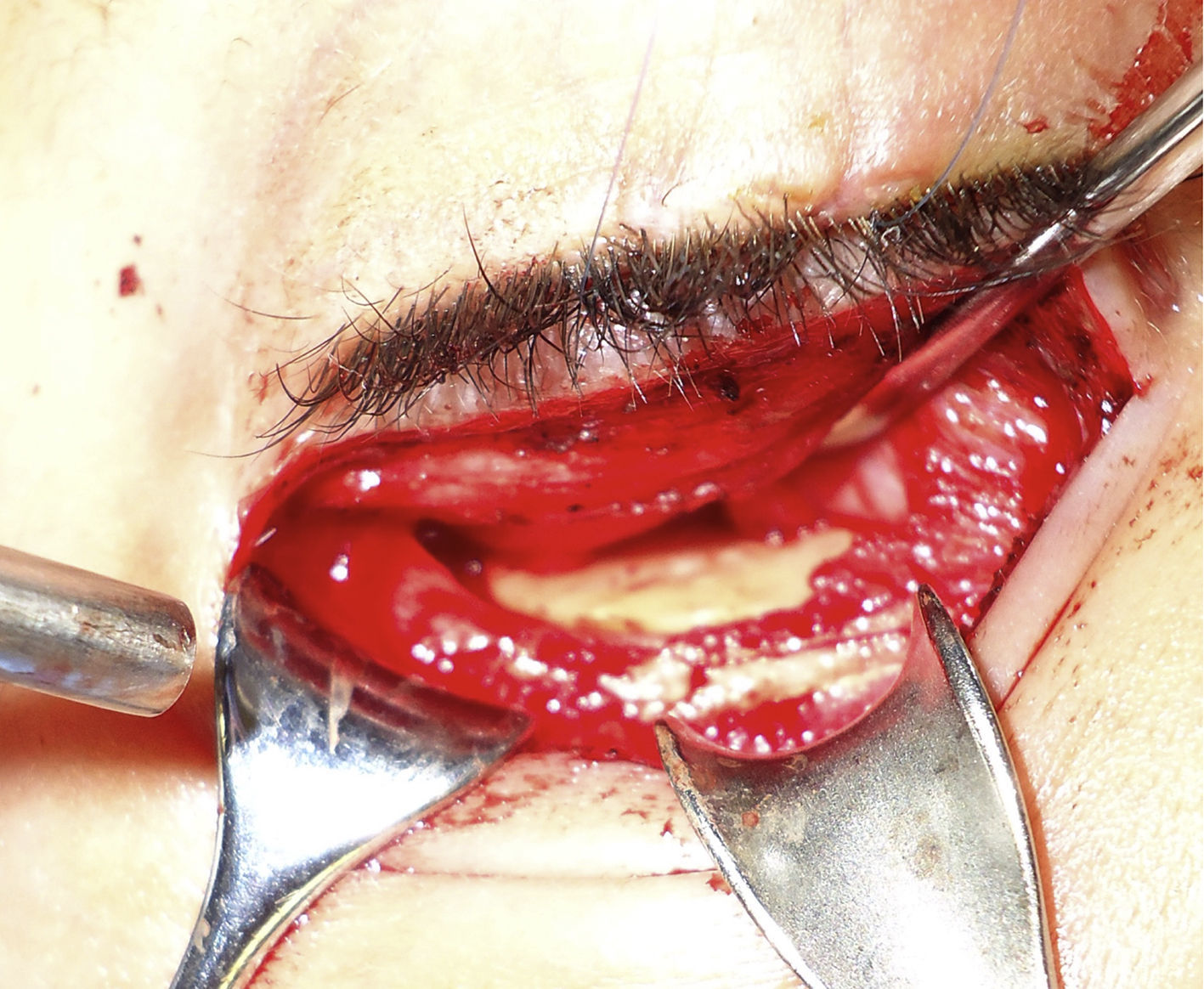
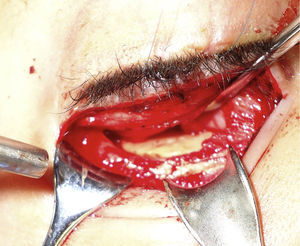
Bajo anestesia general, se realiza abordaje infraciliar, se expone zona de fractura, se retiran fragmentos óseos libres, se liberan y reponen los tejidos herniados, se coloca el modelo preformado de cemento óseo sobre el área del defecto, lo cual no requiere uso de tornillos para su fijación, se reparan y suturan tejidos por planos. Posquirúrgicamente se maneja con antibiótico y esteroides tópicos y sistémicos (fig. 4).
EvoluciónPrimer día posquirúrgico: diplopía leve a la supraversión, ptosis palpebral moderada.
Se realiza TC posquirúrgica en la cual se aprecian paredes orbitarias sin soluciones de continuidad, el implante se muestra en el sitio adecuado con densidad parecida a hueso, los tejidos intraorbitarios están adecuadamente contenidos en la cavidad (fig. 5).
A las 8 semanas, el paciente se encuentra sin diplopía, con ptosis leve residual (fig. 6).
DiscusiónEl objetivo del tratamiento es restablecer el volumen orbitario y la reposición de los tejidos herniados y la forma de la órbita. Referente al abordaje quirúrgico, los más comúnmente utilizados son: infraorbitario, subciliar, transconjuntival y, más recientemente, endoscópico transantral7,8. Todos proveen una buena exposición y permiten la reparación de la fractura. Sin embargo, permanece aún en discusión cuál es el más apropiado, ya que no se tiene registro de las complicaciones a largo plazo. Hasta ahora no existe un consenso que determine el momento idóneo para llevar a cabo la reparación quirúrgica de una fractura. Se considera importante esperar el suficiente tiempo para una planeación quirúrgica adecuada, con manejo de la respuesta inflamatoria asociada al trauma inicial, lo cual altera las estructuras y dificulta su manejo durante el transoperatorio, y repercute en el resultado final. Yun et al. recomiendan una intervención temprana, con entrenamiento muscular funcional posoperatorio para evitar complicaciones tardías, y demuestran que el parámetro asociado más importante a la diplopía residual fue el intervalo de tiempo entre la lesión y el manejo quirúrgico2. Putterman indicó que los pacientes con fracturas «blow out» puras deben ser valorados de 4 a 6 meses y, dependiendo del grado de mejoría, se llevará a cabo o no la cirugía9. Otros autores como Hawes asocian una reparación temprana (en los primeros 2 meses) con un mejor resultado10. Por su parte, Baek propone el manejo temprano de las fracturas orbitarias, con una disminución de las complicaciones tardías6.
Respecto a los materiales utilizados para la reconstrucción y osteosíntesis de las fracturas orbitarias, son múltiples las opciones, lo cual dificulta el consenso para su uso. Es aún más complicado en pacientes pediátricos, ya que por la relativa baja frecuencia de estas fracturas la literatura es escasa. Los grupos principales son:
Materiales autógenos: Los injertos de hueso o cartílago fueron considerados por mucho tiempo el estándar para la reparación de las fracturas con un bajo costo. Se obtienen de hueso del cráneo, costilla, pared maxilar, mandíbula, cresta ilíaca, etcétera11–13, que son fijados con placas y tornillos o usados en conjunto con materiales aloplásticos como mallas de titanio o polietileno poroso14. Ofrecen adecuada rigidez, fuerza, radioopacidad, fácil vascularización, lo que reduce la posibilidad de infección, reacciones de cuerpo extraño, extrusión. Dentro de las desventajas encontramos dificultad de moldeado, que no siempre es posible su uso en fracturas de múltiples paredes15 y que no es posible predecir el tiempo de resorción. Sin embargo, la más importante es que requiere la toma del injerto de un sitio lejano a la fractura, hecho que aumenta el tiempo total de cirugía, representa una herida quirúrgica extra y mayores cuidados posoperatorios. Con riesgos en la zona donadora, como infecciones, hematomas, seromas, la necesidad del uso de drenajes, lo que aumenta el tiempo de recuperación y el dolor posoperatorio11. Otros materiales autógenos son: injertos de fascia lata e injertos de periostio, con diferentes resultados a largo plazo16,17.
Materiales alogénicos: Se considera que son poco utilizados. Las principales ventajas de estos materiales son la reducción de la morbilidad en la zona donadora, lo cual a su vez disminuye el tiempo quirúrgico y de recuperación11. Los más utilizados son duramadre humana, cartílago liofilizado, banco de huesos e injerto de hueso bovino17,18. Como desventajas podemos mencionar que presentan una resorción mayor que los autógenos y la existente posibilidad de transmisión de enfermedades infectocontagiosas como el VIH o la hepatitis C19.
Materiales aloplásticos permanentes: Representa el grupo más grande y en crecimiento constante. Fueron creados pensando en disminuir el tiempo trans- y posoperatorio, los riesgos de infección en el sitio donador y la transmisión de enfermedades. Presentan como ventajas que son de disponibilidad inmediata, muchos son preformados, lo cual permite hacer un abordaje más directo y una mejor planeación preoperatoria. Como desventajas: la posibilidad de que los tornillos se aflojen o sufran corrosión o, en reacciones más pronunciadas, que puedan sufrir extrusión y producir artefactos durante las técnicas de imagen, o incluso que puedan resultar carcinogénicos4. El uso de estos materiales en edades pediátricas debe ser cuidadoso, ya que tienen riesgo de desplazamiento con el crecimiento o de generar cambios en los patrones de crecimiento facial. Dentro de los más utilizados se encuentran:
Los implantes de silastic y las placas de silicón, las cuales proveen flexibilidad, bajo costo y adecuado soporte a las estructuras20, sin embargo, presentan baja incorporación a nivel celular, y requieren su remoción hasta en un 13%, según Laxenaire et al.21.
- •
Polietileno poroso: La característica de ser poroso facilita el crecimiento vascular dentro del implante y disminuye las reacciones de tipo cuerpo extraño, las formaciones de cápsulas y sus complicaciones11. Ram et al., en un estudio de 20 pacientes, no encontraron diferencias significativas en resultados posoperatorios del uso de polietileno poroso vs. injerto de cresta ilíaca22.
- •
Titanio: Es un metal rígido pero moldeable, útil para la reconstrucción de grandes defectos, con posibilidad de osteointegración, radioopacidad, pero con un costo elevado y dificultad para su retiro en caso necesario12,23, Gear et al., en un estudio con 55 pacientes, demostraron que los implantes de titano mantenían una adecuada reducción de las fracturas orbitarias, y solo tuvieron un caso de absceso24.
- •
Cemento óseo (polimetilmetracrilato): No existen reportes de su uso en fracturas orbitarias, sin embargo, es un material de uso frecuente y con un rango de complicaciones bajo en cirugías de cráneo, y de uso generalizado en traumatología y ortopedia. Ofrece una adecuada resistencia, maleabilidad y fácil adaptación25,26.
Materiales reabsorbibles aloplásticos: Varios polímeros han sido desarrollado como alternativa para la reconstrucción orbitaria. Disminuyen los problemas asociados al uso de materiales metálicos, pero mantienen las cualidades necesarias para una adecuada fijación inicial para la cicatrización ósea. Sin embargo, existen reportes de casos de inflamación, cambios osteolíticos y activación linfocítica4. Por mencionar algunos:
- •
Lámina de gelatina: formado de colágeno desnaturalizado. Comparado con las hojas de silicón demostró menos migración y menor respuesta inflamatoria27.
- •
Acido poliglicólico: se calcula que pierde su estructura en aproximadamente 2 meses y se resorbe el 95% en 9 meses. Dentro de las complicaciones encontramos enoftalmos en defectos grandes28.
- •
Polidioxanona: polímero sintético biodegradable. Con su uso están reportados hematomas, diplopía residual, remoción parcial por extrusión y enoftalmos hasta en el 22.6% de los pacientes. Este material se ha asociado a una cicatriz insuficiente para soportar el contenido orbitario29.
La combinación de copolímeros de ácido poliláctico (82%) y poliglicólico (18%) mejora el comportamiento biomecánico y minimiza la degradación no uniforme y la consecuente reacción de cuerpo extraño, pero con dificultad para su adaptación y con fragilidad en las cabezas de los tornillos30. Liceaga et al. recomiendan el uso de materiales reabsorbibles en pacientes menores de 7 años, ya que eliminan la necesidad de su remoción posterior y, sobre todo, la restricción del crecimiento, el cual se completa a los 7 años. Para mayores de 7 años recomiendan el uso de placas de titanio o materiales permanentes4.
ConclusionesEl material ideal debe ser adaptado para cada caso en particular tomando en cuenta la accesibilidad y su costo y, primordialmente, que provea una adecuada rigidez, que sea biocompatible, que no altere el crecimiento facial y que se minimicen las complicaciones por uso.
El uso del cemento óseo se puede considerar adecuado para la reconstrucción de fracturas orbitarias en edad pediátrica, ya que ofrece adecuado soporte, rigidez suficiente y no altera el crecimiento facial. Por ello, debe ser tomado como una alternativa más dentro de los materiales biocompatibles que pueden ser utilizados por el oftalmólogo.
Consideramos que nuestro optimismo por los resultados obtenidos en este reporte de caso nos obliga a aumentar el número de pacientes para recabar mayores evidencias y mayor seguimiento a largo plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.