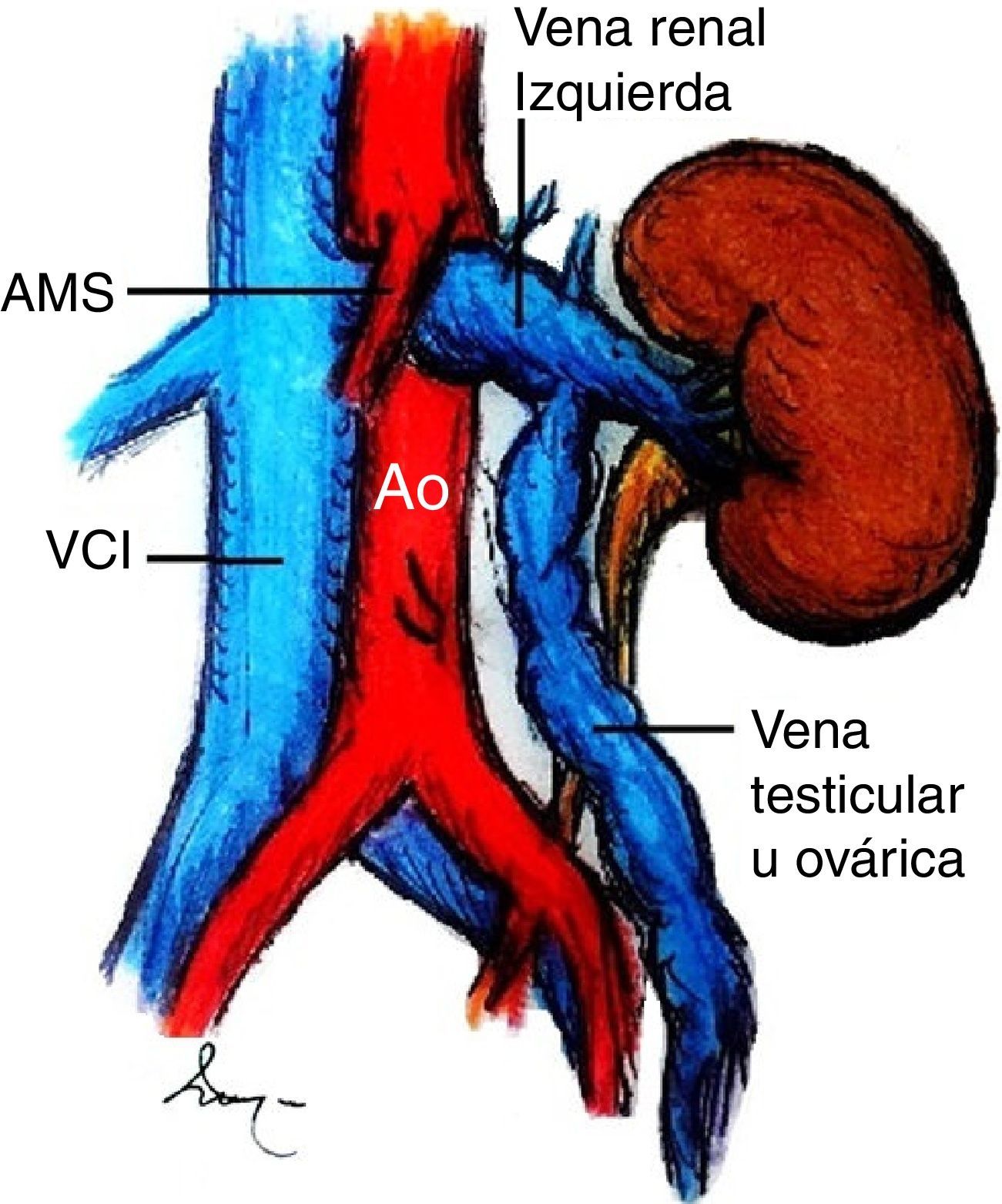
El síndrome de cascanueces es una entidad rara y en la mayoría de los casos es el resultado de la compresión extrínseca de la vena renal izquierda a su paso entre la arteria mesentérica superior y la aorta, asociada a estenosis funcional.
ObjetivoPresentamos el caso de una paciente de 19 años sin antecedentes patológicos importantes, a quien se le confirmó diagnóstico de síndrome de cascanueces que se resolvió con terapia endovascular.
Caso clínicoLa paciente presentó hematuria macroscópica de 6 meses de evolución y fue referida al Servicio de Cirugía Vascular después de descartar otras etiologías. Una angiotomografía reveló la compresión de la vena renal izquierda. A la paciente se le colocó un stent expandible por balón de 12×16mm de manera exitosa, con inmediata mejoría angiográfica, reducción de gradientes de presión y la progresiva resolución de la hematuria. A un año de la intervención, continúa libre de síntomas.
ConclusiónEl síndrome de cascanueces es una entidad poco frecuente que requiere un alto índice de sospecha. La hematuria macroscópica es una manifestación clínica no siempre presente. En nuestro caso, la colocación de un stent demostró ser efectiva en la resolución de síntomas a 12 meses de seguimiento. Además, en este artículo presentamos una breve revisión de la literatura.
Nutcracker syndrome is a rare entity, and in the majority of cases is the result of extrinsic compression of the left renal vein between the superior mesenteric artery and the aorta, associated with functional stenosis.
ObjectiveTo present the case of a 19-year-old female with no significant medical history with confirmed diagnosed of nutcracker syndrome treated successfully by endovascular means.
Clinical caseShe was referred to the Vascular Surgery Department with a 6-month history of macroscopic haematuria, after other aetiologies were ruled out. Abdominal computed tomography angiography revealed compression of the left renal vein; the patient underwent endovascular treatment, and a 12×16 mm balloon expandable stent was placed with immediate angiographic improvement, decreased pressure gradients and progressive resolution of haematuria. At one year, she remains symptom-free.
ConclusionNutcracker syndrome is uncommon, and a high index of suspicion is needed. Macroscopic haematuria is not always present, and in our case stent placement demonstrated effectiveness in the resolution of symptoms at 12 months’ follow--up. We also present a brief review of the literature.
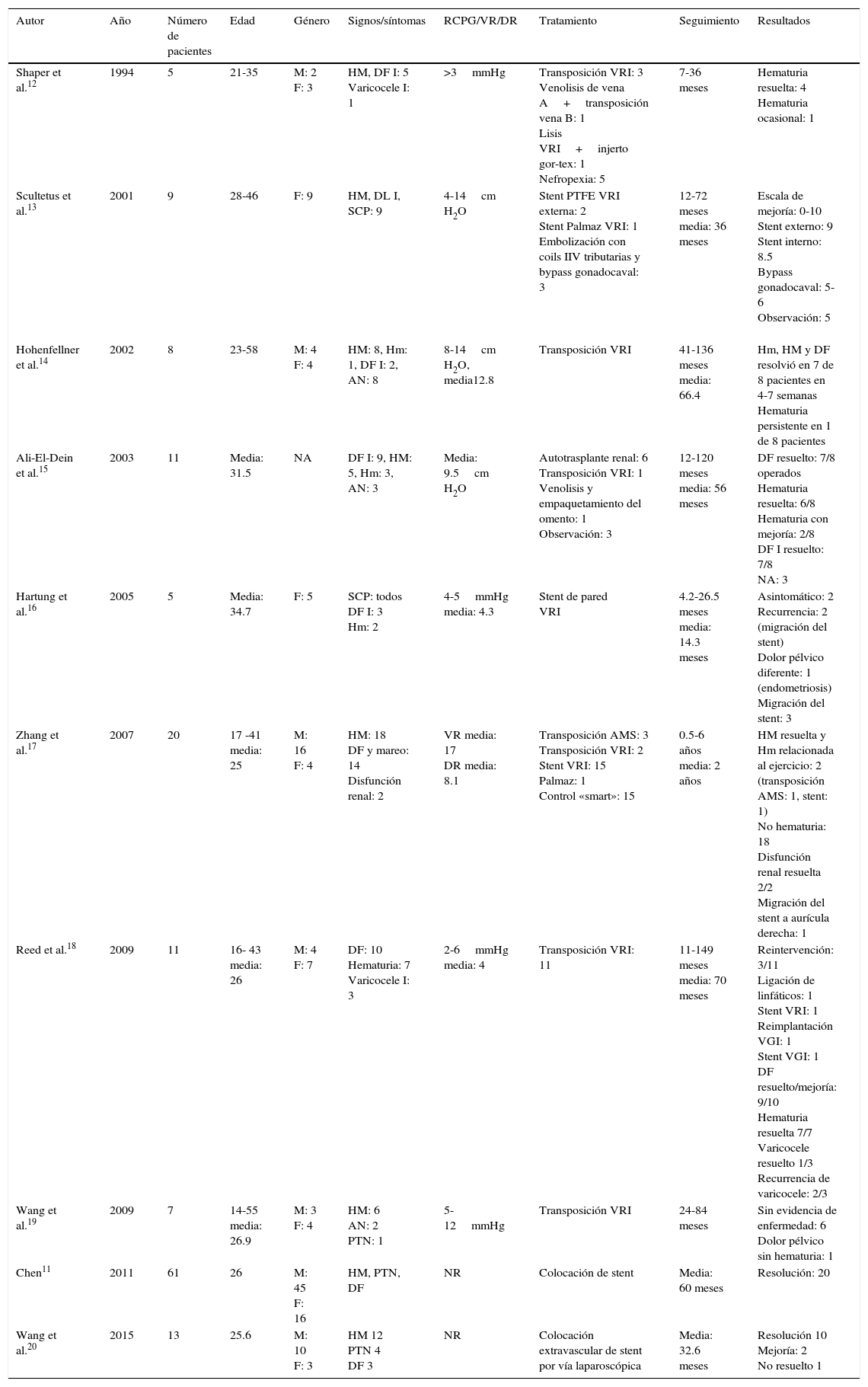
El síndrome de cascanueces es una entidad rara y en la mayoría de los casos es resultado de la compresión sintomática de la vena renal izquierda (VRI), comúnmente entre la arteria mesentérica superior (AMS) y la aorta abdominal (fig. 1)1. Fue descrito inicialmente en la década de los 30por Grant, quien describió la característica anomalía anatómica2. Sin embargo, no fue hasta 1950 cuando se reportó el primer paciente con manifestaciones clínicas asociadas3, aunque la compresión de la vena que pudo ser demostrada por flebografía no ocurrió hasta 2décadas más tarde4. El término de «cascanueces» fue introducido por Chait, si bien todavía es frecuente encontrar en la literatura que se le acredita a Schepper5. La compresión extrínseca de la VRI produce hipertensión venosa que se traduce en insuficiencia y varices de la vena gonadal izquierda, congestión pélvica, desarrollo de varicosidades alrededor de la pelvis renal y del uréter1. Clínicamente se caracteriza por dolor abdominal en flanco y fosa ilíaca izquierda; la hematuria es un signo poco frecuente. Generalmente es diagnosticada una vez que se han descartado otras causas de dolor pélvico o hematuria6.
Presentamos el caso de una paciente joven con 6 meses de hematuria macroscópica, la cual fue tratada con terapia endovascular exitosa. Adicionalmente, realizamos una breve revisión de la literatura.
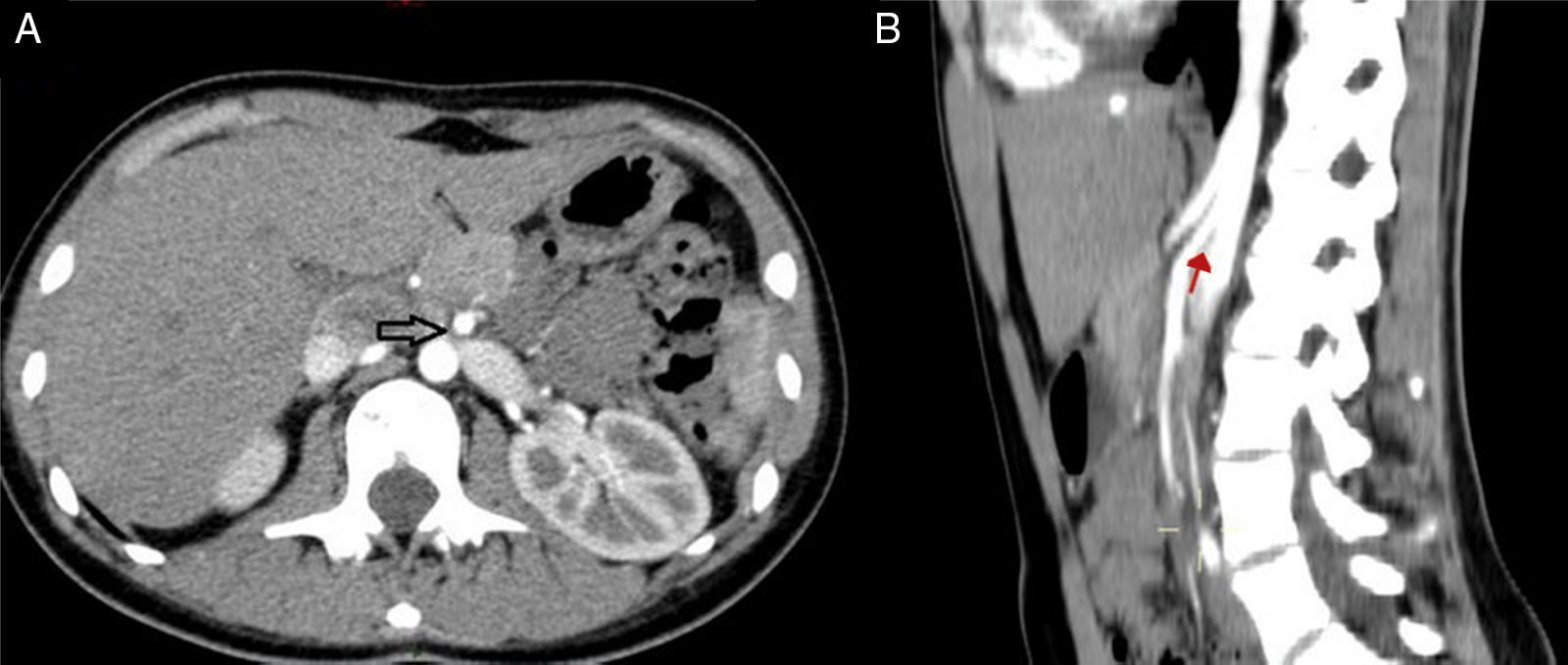
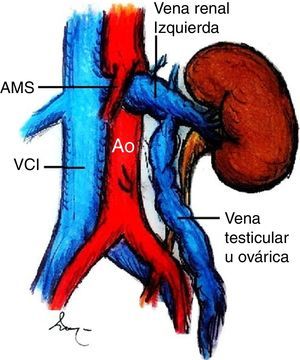
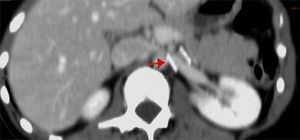
Caso clínicoLa paciente es una joven de 19 años de edad sin antecedentes personales patológicos, quirúrgicos ni heredofamiliares de importancia, quien en marzo de 2014 experimentó un episodio de hematuria macroscópica de inicio súbito. Ella negó antecedente traumático y la presencia de otra sintomatología como fiebre, pérdida de peso, dolor pélvico o abdominal. A la exploración física sus signos vitales eran normales, el abdomen, sin alteraciones. Inicialmente fue estudiada por el Servicio de Urología. En los análisis de laboratorio, como biometría hemática, química sanguínea incluyendo ácido úrico, urea y creatinina, los resultados se encontraron en rangos normales. El examen general de orina confirmó la presencia de proteinuria y hematuria. Posteriormente, se realizó un ultrasonido doppler renal bilateral. En este estudio no fueron identificadas anormalidades ni lesiones en los riñones ni en la vejiga, y se descartó la presencia de reflujo ureteral. Una angiotomografía computada demostró un riñón izquierdo con dimensiones de 12×5.1×4.9 cm, una arteria renal única con un diámetro de 5mm y una VRI única con ectasia en la porción intra- y extrarrenal, se observó además la vena ovárica ectásica y tortuosa y la formación de colaterales. En una vista axial y lateral se podía apreciar la obstrucción extrínseca ocasionada por la AMS y la aorta (fig. 2A, B). Se consideró como posible diagnóstico el síndrome de atrapamiento de la VRI o «cascanueces».
Angiotomografía abdominal. A) Vista axial en la cual la fecha negra señala la compresión extrínseca de la vena renal izquierda (VRI) entre la aorta abdominal y la arteria mesentérica superior (AMS) y la dilatación de la vena renal. B) En la vista lateral izquierda se observa, señalado por la flecha roja, el ángulo agudo de la AMS menor a 20° que produce compresión extrínseca de la VRI.
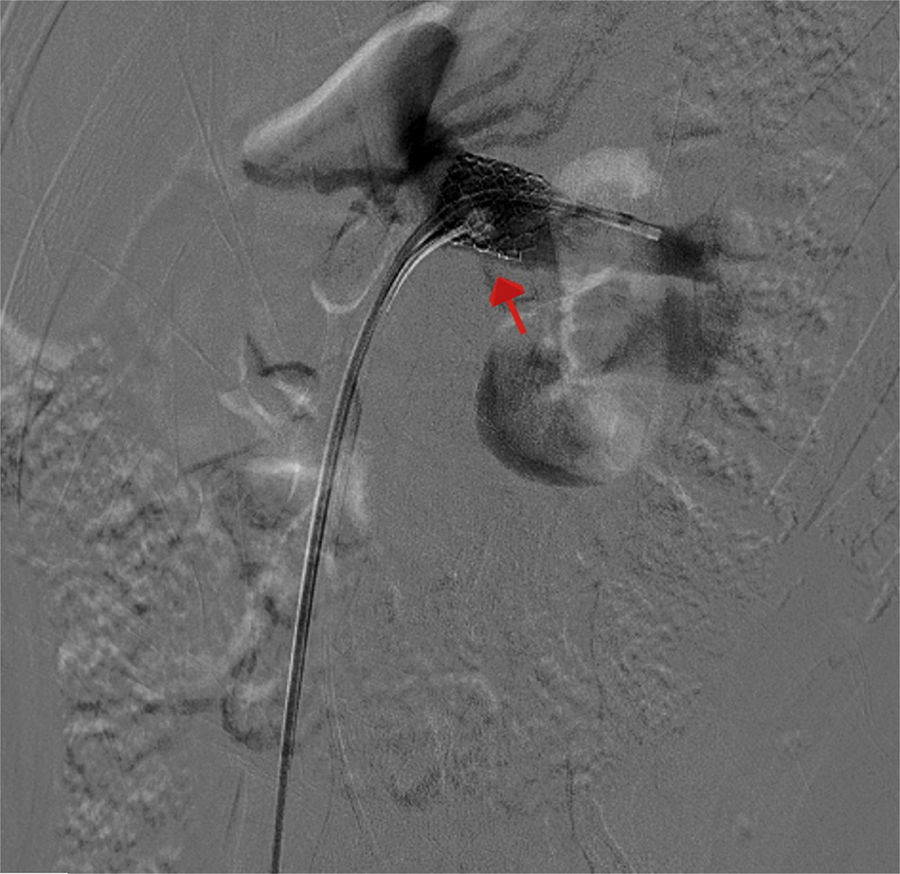
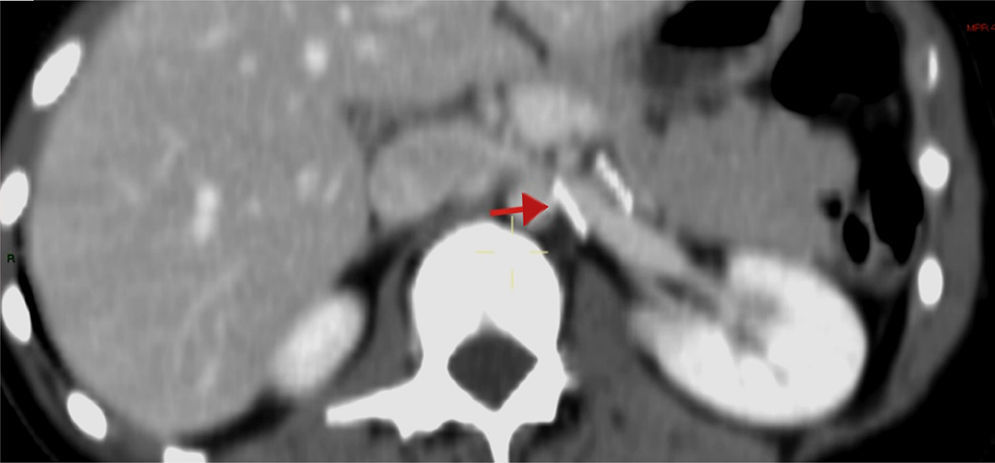
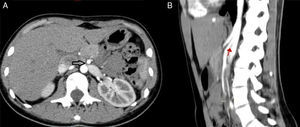
Los hallazgos fueron discutidos con la paciente y sus familiares, a quienes se les presentaron las opciones terapéuticas. Se les propuso inicialmente una flebografía con el objetivo de medir los gradientes de presión y, de ser posible, tratarla con la colocación de un stent. La paciente fue llevada a la sala de hemodinamia. Se obtuvo acceso a través de ambas venas femorales comunes; por el lado izquierdo se colocó un catéter en la vena cava inferior, mientras que el segundo catéter canalizó selectivamente la VRI a través de la vena femoral común derecha. La inyección de contraste confirmó la estenosis extrínseca y se documentó un gradiente cavo-renal de 10mmHg. Posteriormente se colocó un introductor largo de 9 F, en la ingle derecha y se decidió realizar angioplastia y colocación de stent expandible por balón (Palmaz, Cordis, Miami Lakes, Fla, EUA) de 12×16mm (fig. 3). Se observó inmediatamente la reducción significativa de la circulación colateral y finalmente se evaluó el gradiente medio cavo-renal que se redujo a 1mmHg. La paciente toleró el procedimiento sin complicaciones y se dio de alta al día siguiente. La hematuria se resolvió gradualmente y a un año de la intervención la paciente niega molestias, su función renal es normal y no existe evidencia de hematuria ni proteinuria en examen general de orina. En tomografía, el stent se identifica permeable y la descompresión de la VRI es evidente (fig. 4).
Los términos de síndrome y fenómeno de «cascanueces» son frecuentemente intercambiables en la literatura, sin embargo, la anatomía anómala característica del cascanueces no siempre es asociada a manifestaciones clínicas y puede representar una variante anatómica1. La etiología de esta entidad puede ser comprendida si se conoce la anatomía de la región. La VRI drena en la vena cava inferior. Típicamente, la porción distal de la vena renal cursa anterior a la aorta yuxtarrenal y posterior al segmento proximal de la AMS. La VRI cursa posterior a la aorta en aproximadamente el 3% de los casos e, inclusive, una doble vena renal puede ser encontrada hasta en el 0.5 a 0.7% de los individuos7,8. Por otra parte, la AMS corre ventralmente por unos 5mm en una configuración rectangular y luego caudalmente; su origen se encuentra a una distancia de 2 a 4mm de la VRI y la distancia entre la aorta y la AMS es de aproximadamente 0.6-2.6cm.
EtiopatogeniaCon relación a su etiopatogenia se han propuesto varias teorías para explicar este síndrome: todas implican anomalías en la VRI o la AMS, aunque raras veces el «cascanueces» puede ocurrir cuando la tercera porción del duodeno cursa frente a la VRI. El síndrome de cascanueces posterior se presenta cuando la vena corre retroaórtica y existe compresión. Factores que pueden contribuir a la expresión clínica incluyen la constitución física del individuo, la presencia de grasa retroperitoneal, la cual puede causar estrechamiento del ángulo aorto mesentérico o un estiramiento de la VRI. La compresión generalmente se agrava cuando el paciente se encuentra de pie: este fenómeno provoca un incremento de la presión venosa proximal al sitio de compresión extrínseca que induce la formación de varices y circulación venosa colateral. El gradiente de presión es de 1mmHg en condiciones normales, que puede elevarse hasta 14mmHg y conducir a la rotura de los septos delgados entre las venas pequeñas y el sistema colector, lo que resulta en hematuria1.
Manifestaciones clínicas y diagnósticoLa presentación clínica clásica es en paciente del sexo femenino en la segunda o tercera décadas de la vida con peso promedio y constitución delgada7. La severidad de los síntomas varía desde hematuria microscópica hasta síntomas de dolor abdominal en flanco izquierdo y pélvico asociado a congestión de los vasos. El dolor se acentúa al sentarse, al ponerse de pie o caminar. La hematuria macroscópica no está presente en todos los casos, pero en nuestra paciente fue la única manifestación clínica y el síndrome de cascanueces finalmente pudo demostrarse en estudios de imagen.
El diagnóstico suele ser difícil y, como se mencionó, es usualmente de exclusión: un alto índice de sospecha es necesario por parte del médico tratante. Entre las enfermedades que deben descartarse se incluyen la litiasis renal, infecciones, neoplasias y malformaciones arteriovenosas. Una vez que se sospecha el síndrome de cascanueces, el estudio inicial no invasivo es la utrasonografía con doppler, seguido por angiotomografía o resonancia magnética con contraste en fase venosa. Una vez que este síndrome se ha considerado como posibilidad diagnóstica, una flebografía retrógrada es el «estándar de oro» y cuando existe un gradiente de presión mayor a 3mmHg es confirmatorio. En nuestro caso, se pudo comprobar un gradiente muy elevado que se normalizó con la colocación del stent.
El tratamiento está indicado en pacientes sintomáticos y se individualiza de acuerdo con la severidad, el posible resultado anticipado y la edad del paciente. Se suele realizar vigilancia cercana en pacientes menores de 18 años debido a la posibilidad de remisión espontánea. Este manejo conservador se debe mantener por lo menos 6 meses antes de considerar un tratamiento invasivo.
Tratamiento endovascular y quirúrgicoEl tratamiento endovascular se ha utilizado desde 1996 cuando Neste9 publicó el primer caso; desde entonces múltiples autores han reportado series de casos. El tratamiento quirúrgico abierto incluye reconstrucciones tales como transposición de la VRI, derivación de la vena renal o gonado-caval. El autotrasplante renal es también una alternativa e, inclusive, abordajes arteriales como transposición de la AMS.
En la tabla 1, resumimos las series de casos más extensas disponibles en la literatura, intervenidos por cirugía abierta y terapia endovascular. El tratamiento quirúrgico, aunque no libre de morbilidad significativa y complicaciones, ha sido satisfactorio en pacientes con gradientes superiores a 3mmHg. Por otra parte, el uso de la terapia endovascular y la colocación de stents se ha expandido en los últimos años y actualmente centros con experiencia significativa lo recomiendan como la primera opción de tratamiento10,11. En el caso aquí descrito, la colocación de stent demostró ser efectiva para la resolución de la hematuria. Se recomiendan una estrecha vigilancia y el seguimiento a largo plazo.
Resumen de las características clínicas y resultados de las series de casos en la literatura
| Autor | Año | Número de pacientes | Edad | Género | Signos/síntomas | RCPG/VR/DR | Tratamiento | Seguimiento | Resultados |
|---|---|---|---|---|---|---|---|---|---|
| Shaper et al.12 | 1994 | 5 | 21-35 | M: 2 F: 3 | HM, DF I: 5 Varicocele I: 1 | >3mmHg | Transposición VRI: 3 Venolisis de vena A+transposición vena B: 1 Lisis VRI+injerto gor-tex: 1 Nefropexia: 5 | 7-36 meses | Hematuria resuelta: 4 Hematuria ocasional: 1 |
| Scultetus et al.13 | 2001 | 9 | 28-46 | F: 9 | HM, DL I, SCP: 9 | 4-14cm H2O | Stent PTFE VRI externa: 2 Stent Palmaz VRI: 1 Embolización con coils IIV tributarias y bypass gonadocaval: 3 | 12-72 meses media: 36 meses | Escala de mejoría: 0-10 Stent externo: 9 Stent interno: 8.5 Bypass gonadocaval: 5-6 Observación: 5 |
| Hohenfellner et al.14 | 2002 | 8 | 23-58 | M: 4 F: 4 | HM: 8, Hm: 1, DF I: 2, AN: 8 | 8-14cm H2O, media12.8 | Transposición VRI | 41-136 meses media: 66.4 | Hm, HM y DF resolvió en 7 de 8 pacientes en 4-7 semanas Hematuria persistente en 1 de 8 pacientes |
| Ali-El-Dein et al.15 | 2003 | 11 | Media: 31.5 | NA | DF I: 9, HM: 5, Hm: 3, AN: 3 | Media: 9.5cm H2O | Autotrasplante renal: 6 Transposición VRI: 1 Venolisis y empaquetamiento del omento: 1 Observación: 3 | 12-120 meses media: 56 meses | DF resuelto: 7/8 operados Hematuria resuelta: 6/8 Hematuria con mejoría: 2/8 DF I resuelto: 7/8 NA: 3 |
| Hartung et al.16 | 2005 | 5 | Media: 34.7 | F: 5 | SCP: todos DF I: 3 Hm: 2 | 4-5mmHg media: 4.3 | Stent de pared VRI | 4.2-26.5 meses media: 14.3 meses | Asintomático: 2 Recurrencia: 2 (migración del stent) Dolor pélvico diferente: 1 (endometriosis) Migración del stent: 3 |
| Zhang et al.17 | 2007 | 20 | 17 -41 media: 25 | M: 16 F: 4 | HM: 18 DF y mareo: 14 Disfunción renal: 2 | VR media: 17 DR media: 8.1 | Transposición AMS: 3 Transposición VRI: 2 Stent VRI: 15 Palmaz: 1 Control «smart»: 15 | 0.5-6 años media: 2 años | HM resuelta y Hm relacionada al ejercicio: 2 (transposición AMS: 1, stent: 1) No hematuria: 18 Disfunción renal resuelta 2/2 Migración del stent a aurícula derecha: 1 |
| Reed et al.18 | 2009 | 11 | 16- 43 media: 26 | M: 4 F: 7 | DF: 10 Hematuria: 7 Varicocele I: 3 | 2-6mmHg media: 4 | Transposición VRI: 11 | 11-149 meses media: 70 meses | Reintervención: 3/11 Ligación de linfáticos: 1 Stent VRI: 1 Reimplantación VGI: 1 Stent VGI: 1 DF resuelto/mejoría: 9/10 Hematuria resuelta 7/7 Varicocele resuelto 1/3 Recurrencia de varicocele: 2/3 |
| Wang et al.19 | 2009 | 7 | 14-55 media: 26.9 | M: 3 F: 4 | HM: 6 AN: 2 PTN: 1 | 5-12mmHg | Transposición VRI | 24-84 meses | Sin evidencia de enfermedad: 6 Dolor pélvico sin hematuria: 1 |
| Chen11 | 2011 | 61 | 26 | M: 45 F: 16 | HM, PTN, DF | NR | Colocación de stent | Media: 60 meses | Resolución: 20 |
| Wang et al.20 | 2015 | 13 | 25.6 | M: 10 F: 3 | HM 12 PTN 4 DF 3 | NR | Colocación extravascular de stent por vía laparoscópica | Media: 32.6 meses | Resolución 10 Mejoría: 2 No resuelto 1 |
a: anterior; AMP: acetato de medroxiprogesterona; AMS: arteria mesentérica superior; AN: anemia; ASA: ácido acetil salicílico; DA: dolor abdominal; DF: dolor en flanco; DR: diámetro anteroposterior de vena renal; Hm: hematuria microscópica; HM: mematuria macroscópica; I: izquierdo; NA: sin información; NR no reportado; P: posterior; PTN: proteinuria; SCP: síndrome de congestión pélvica; VGI: vena gonadal izquierda; VR: pico sistólico de velocidad en vena renal; VRI: vena renal izquierda.
El síndrome de cascanueces es una entidad poco frecuente que requiere un alto índice de sospecha y cuyo tratamiento se basa en la severidad de los síntomas. La cirugía abierta y, particularmente, la transposición de la VRI es el estándar de oro; sin embargo, la creciente experiencia en terapia endovascular presenta resultados similares en cuanto a la resolución de síntomas, aunque todavía no se tienen datos de la permeabilidad a largo plazo. La hematuria macroscópica es una manifestación clínica no siempre presente. En nuestro caso clínico, la colocación de un stent ha demostrado ser efectiva en la resolución de esta a 12 meses de seguimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.