La biopsia por punción y aspiración con aguja fina guiada por ultrasonido endoscópico ha sido utilizada como una técnica eficaz que se está convirtiendo rápidamente en el procedimiento de elección para el diagnóstico y la estadificación de los pacientes en los que se sospecha cáncer de páncreas. Este procedimiento ha desplazado a la colangiopancreatografía retrógrada y a la citología por cepillado debido a su mayor sensibilidad y menor riesgo.
ObjetivoDeterminar el nivel sérico de enzimas pancreáticas tales como amilasa y lipasa posterior a la realización de una biopsia por punción y aspiración con aguja fina guiada por ultrasonido endoscópico en lesiones de páncreas, además de la frecuencia de pancreatitis aguda pospunción.
Material y métodosSe realizó un estudio longitudinal y descriptivo de casos consecutivos en pacientes que fueron sometidos a una biopsia por punción y aspiración con aguja fina. Se realizó la medición de los niveles séricos de enzimas pancreáticas amilasa y lipasa antes y después de la punción, además de documentar los casos de pancreatitis.
ResultadosUn total de 100 pacientes con lesiones pancreáticas de tipo sólido y quístico fueron incluidos. Encontramos una elevación clínicamente significativa, el doble del valor de referencia de lipasa en 5 casos (5%) y de amilasa en 2 (2%); en ningún caso se presentó cuadro clínico de pancreatitis aguda. El 8% de los pacientes refirió dolor no compatible con un diagnóstico de pancreatitis.
ConclusiónLa biopsia por punción y aspiración con aguja fina guiada por ultrasonido endoscópico se asoció a una baja tasa de elevación de enzimas pancreáticas y en ningún caso se desarrolló pancreatitis pospunción.
Puncture biopsy and fine needle aspiration guided by endoscopic ultrasound has been used as an effective technique and is quickly becoming the procedure of choice for diagnosis and staging in patients suspected of having pancreatic cancer. This procedure has replaced retrograde cholangiopancreatography and brush cytology due to its higher sensitivity for diagnosis, and lower risk of complications.
ObjectiveTo assess the levels of pancreatic enzymes amylase and lipase, after the puncture biopsy and fine needle aspiration guided by endoscopic ultrasound in pancreatic lesions and the frequency of post-puncture acute pancreatitis.
Material and methodsA longitudinal and descriptive study of consecutive cases was performed on outpatients submitted to puncture biopsy and fine needle aspiration guided by endoscopic ultrasound in pancreatic lesions. Levels of pancreatic enzymes such as amylase and lipase were measured before and after the pancreatic puncture. Finally we documented post-puncture pancreatitis cases.
ResultsA total of 100 patients who had been diagnosed with solid and cystic lesions were included in the study. Significant elevation was found at twice the reference value for lipase in 5 cases (5%) and for amylase in 2 cases (2%), none had clinical symptoms of acute pancreatitis. Eight (8%) of patients presented with mild nonspecific pain with no enzyme elevation compatible with pancreatitis.
ConclusionPancreatic biopsy needle aspiration guided by endoscopic ultrasound was associated with a low rate of elevated pancreatic enzymes and there were no cases of post-puncture pancreatitis.
La biopsia por punción aspirativa con aguja fina (BAAF) guiada por ultrasonido endoscópico (USE) ha sido utilizada para el diagnóstico en pacientes con sospecha de tumor de páncreas1–6, ya que el ultrasonido ha demostrado la mayor sensibilidad para el diagnóstico, además de un bajo riesgo de complicaciones. Se tienen reportes que oscilan del 0 al 5% de complicaciones asociadas al procedimiento, tales como: pancreatitis aguda7, hemorragia, infección y perforación. Los factores de riesgo para la pancreatitis relacionados con la biopsia son desconocidos, pero el resultado de un estudio evidencia que los pacientes con historia de pancreatitis aguda reciente o punción de páncreas sano son más propensos a desarrollar un cuadro de pancreatitis aguda después de la punción aspirativa con aguja fina8, por lo que algunos investigadores consideran estos antecedentes como un factor de riesgo9.
La pancreatitis aguda o inflamación aguda del páncreas es secundaria a la activación intraglandular de las enzimas pancreáticas y es una enfermedad de variada presentación clínica que va desde los casos muy leves y autolimitados hasta otros con falla multiorgánica y muerte. Este es un proceso inflamatorio local que lleva a una respuesta inflamatoria sistémica en la mayoría de los casos10.
La fisiopatología de la enfermedad incluye la activación y la liberación de enzimas pancreáticas en el intersticio con autodigestión pancreática, y en los casos severos, la disfunción orgánica múltiple por extensión de los mediadores inflamatorios del páncreas11,12 y otras enzimas pancreáticas como amilasa, lipasa y nucleasas, que también son secretadas de forma activa.
La producción de citocinas y quimocinas por las células acinares del páncreas se ha reconocido recientemente como la primera señal requerida para el reclutamiento de células inflamatorias hacia el páncreas durante el inicio de la pancreatitis13. El daño de la célula acinar es seguido de una cascada proinflamatoria que lleva a la necrosis pancreática, al síndrome de respuesta inflamatoria sistémica y a la disfunción de órganos distantes14. Las quimocinas se relacionan con citocinas altamente conservadas con propiedad de quimiotaxis y orquestan la migración de los leucocitos a sitios de inflamación15. La amilasa, en casos de pancreatitis, tiende a elevarse en las primeras 24h y permanece elevada de uno a 3 días; las cifras tienden a retornar a la normalidad después del día 3-5. Esta prueba tiene una sensibilidad de un 82%, una especificidad de un 91% y un valor predictivo positivo de un 65%. Siempre se deberán excluir otros procesos que elevan la amilasa; sin embargo, en la práctica y en condiciones normales, solo el páncreas y las glándulas salivales contribuyen de forma significativa al mantenimiento de los niveles séricos de esta enzima; los valores de amilasa en suero solo son de utilidad en el diagnóstico y no guardan correlación con la severidad del cuadro, por lo tanto, no tienen valor pronóstico.
La lipasa es la segunda determinación más frecuentemente utilizada en el diagnóstico de la pancreatitis aguda. La lipasemia tiene la ventaja de que no se eleva en algunas situaciones que son causa de falsos positivos de la amilasa; sin embargo, acompaña a la amilasa en los falsos positivos secundarios a enfermedad biliar, úlcera perforada, obstrucción intestinal, trombosis mesentérica y apendicitis aguda. La actividad de la lipasa sérica aumenta de forma paralela a la de la amilasa y la determinación de ambas enzimas aumenta el rendimiento diagnóstico.
Los niveles de lipasa pueden permanecer elevados de 7 a 14 días. La lipasa puede ser ahora la enzima más indicada para establecer el diagnóstico. Su sensibilidad es del 94%, su especificidad del 96% y su valor predictivo positivo es del 86%. Los valores elevados de lipasa y de tripsina sérica suelen ser diagnósticos de pancreatitis aguda, por lo que estas pruebas son especialmente útiles en los pacientes con hiperamilasemia de origen no pancreático.
Se ha publicado en la literatura internacional que para considerar el diagnóstico de pancreatitis deben documentarse la presencia de dolor abdominal y la elevación enzimática de al menos 3 veces las cifras del valor de referencia.
Dado que en nuestro país aún no hay publicaciones al respecto, es imperativo contar con información generada en nuestro medio y contrastarla con los resultados publicados en la literatura internacional, ya que cada vez hay más centros donde se realizan estos procedimientos. Por ello, los autores nos propusimos como objetivo principal evaluar los niveles de enzimas pancreáticas, particularmente de amilasa y lipasa, antes y después de realizar una BAAF guiada por USE en lesiones pancreáticas y hacer las comparaciones de sus valores en estos 2 momentos. Además, como objetivo secundario planteamos reportar la frecuencia de pancreatitis aguda en nuestros pacientes después de realizada la punción.
Material y métodoSe realizó un estudio longitudinal, prospectivo y descriptivo de los niveles de amilasa y lipasa en suero de pacientes sometidos a BAAF de páncreas guiada por USE referidos a nuestro servicio en el periodo comprendido del 1 de marzo del 2012 al 1 de marzo del 2013. Las mediciones se realizaron antes y después de realizada la biopsia. El estudio fue llevado a cabo en el Servicio de Endoscopia del Hospital de Especialidades del Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social.
PacientesEl diagnóstico de los pacientes fue de lesiones pancreáticas, incluyendo sólidas y quísticas. Se incluyeron todos los pacientes que requirieran la biopsia por punción aspirativa con ultrasonido para determinar la etiología de las lesiones y que aceptaron participar en el estudio previa firma del consentimiento informado.
Se excluyeron del estudio aquellos pacientes con diagnóstico de abscesos pancreáticos ya documentados y los que tenían elevación de enzimas pancreáticas antes de realizar el procedimiento de punción. Los pacientes que otorgaron la firma para el consentimiento informado y que posteriormente declinaron su participación fueron eliminados del estudio sin hacer uso alguno de sus datos.
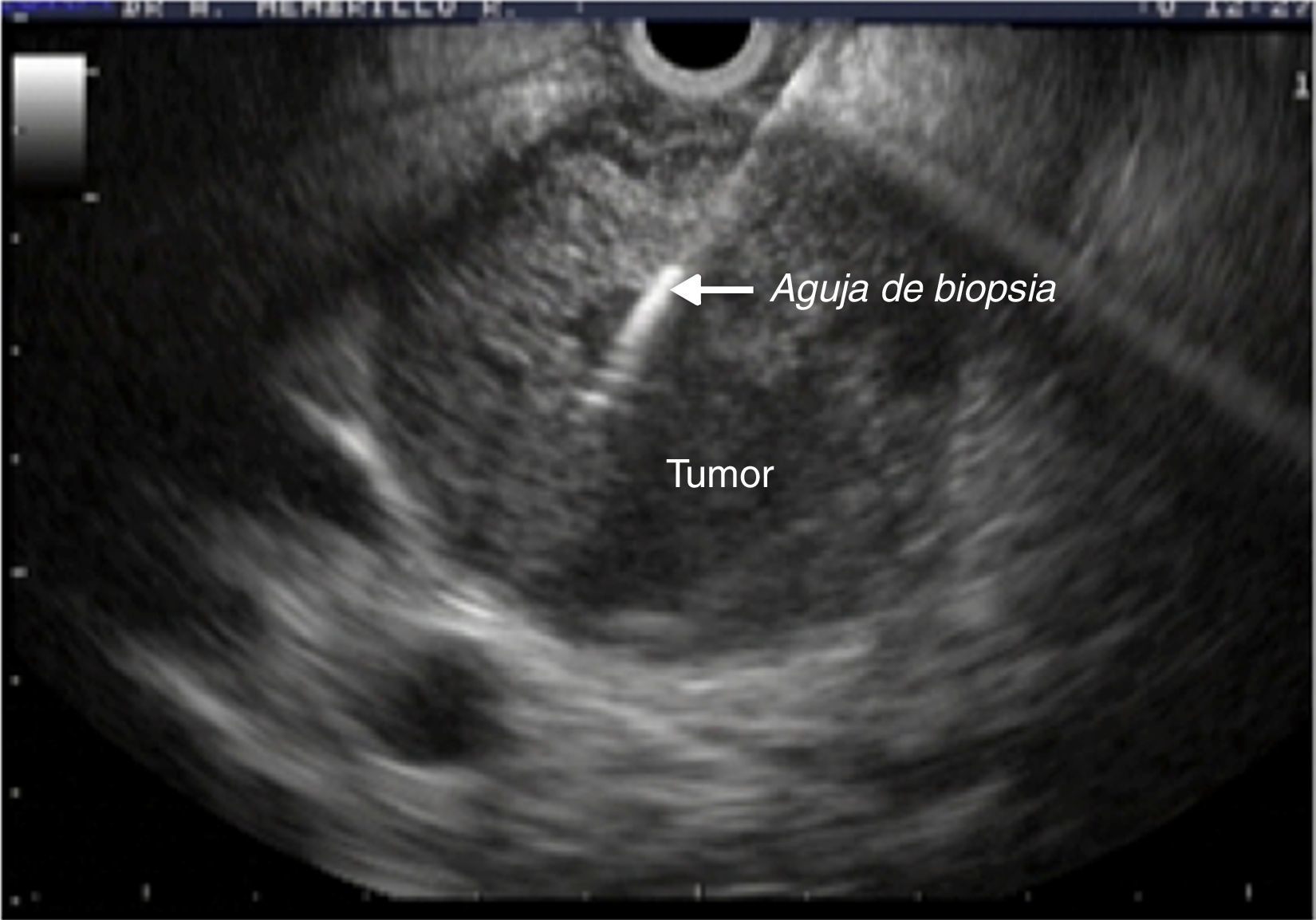
Equipo y procedimientosLa punción aspirativa guiada por ultrasonido se realizó con aguja de 22G marca Wilson Cook® (Cook Medical Incorporated) y un equipo de ultrasonido lineal GF-UCT140 marca Olympus® (Olympus Corporation) (fig. 1). Todo el equipo forma parte de los servicios integrales de biomédica que proporciona el Instituto Mexicano del Seguro Social. Los procedimientos se llevaron a cabo con apoyo anestésico y previa valoración preoperatoria. Para las lesiones de cuello, cuerpo y cola de páncreas se realizó un abordaje transgástrico; en los casos de lesiones en la cabeza y proceso uncinado del páncreas se requirió el abordaje transduodenal.
En todos los casos se tomó una muestra de sangre antes del procedimiento para la determinación de los valores séricos de amilasa y lipasa; la segunda toma se requirió 2h después de realizada la punción. Una vez terminado el procedimiento, los pacientes fueron vigilados en la sala de recuperación, en donde permanecieron un promedio de 6-8h, hasta su egreso. Dado que la mayoría se trataba de pacientes ambulatorios, el seguimiento se realizó mediante vía telefónica a las 24, 48 y 72h. En el caso de los pacientes hospitalizados, el seguimiento se llevó a cabo mediante visitas hasta su egreso. También se hospitalizaron los pacientes en quienes se sospechaba o presentaban datos clínicos de pancreatitis aguda tales como dolor abdominal, náuseas y vómitos.
La determinación de las enzimas pancreáticas fue realizada en el mismo laboratorio del hospital. Para la amilasa, se usó la técnica fotométrica con reactivo 4,6-etilideno-(G7)-p-nitrofenil-(G1)-alfa-D-maltoheptaósido, el cual es un oligosacárido que se desdobla bajo la acción catalítica de las alfa-amilasas; los fragmentos resultantes se hidrolizan completamente a p-nitrofenol y glucosa bajo la acción alfa-glucosidasa. La intensidad del p-nitrofenol formado es directamente proporcional a la actividad de la alfa-amilasa. La lipasa es una glucoproteína con un peso molecular de 47,000Da y se denomina hidrolasa de triglicéridos, catalizando su transformación a diglicéridos, monoglicéridos y ácidos libres. Al agregar la lipasa se forma ácido glutárico, que es una solución alcalina que se transforma en metilresorufina. Esta reacción es proporcional a la cantidad de lipasa, dando una coloración rojiza que también es medida por fotometría. Todas las determinaciones se realizaron de forma automatizada con un autoanalizador Hitachi.
Análisis estadísticoDebido a que no existen datos muy claros en la literatura sobre cuánto es el incremento de las enzimas pancreáticas posterior a la realización de una punción aspirativa guiada por ultrasonido, los autores nos propusimos hacer una descripción de las modificaciones en estas cifras, particularmente de amilasa y lipasa, como variable de interés, y de forma secundaria reportar la frecuencia de pancreatitis aguda pospunción. La muestra fue obtenida mediante un muestreo no probabilístico de casos consecutivos por conveniencia, en donde usamos la estadística descriptiva para variables demográficas y clínicas de la muestra, representada por frecuencias y porcentajes para variables nominales y medias con desviación estándar para variables continuas. Los datos finales fueron analizados usando el programa SPSS versión 20 para MAC.
ResultadosPara el estudio, se incluyeron un total de 100 pacientes durante el periodo de un año.
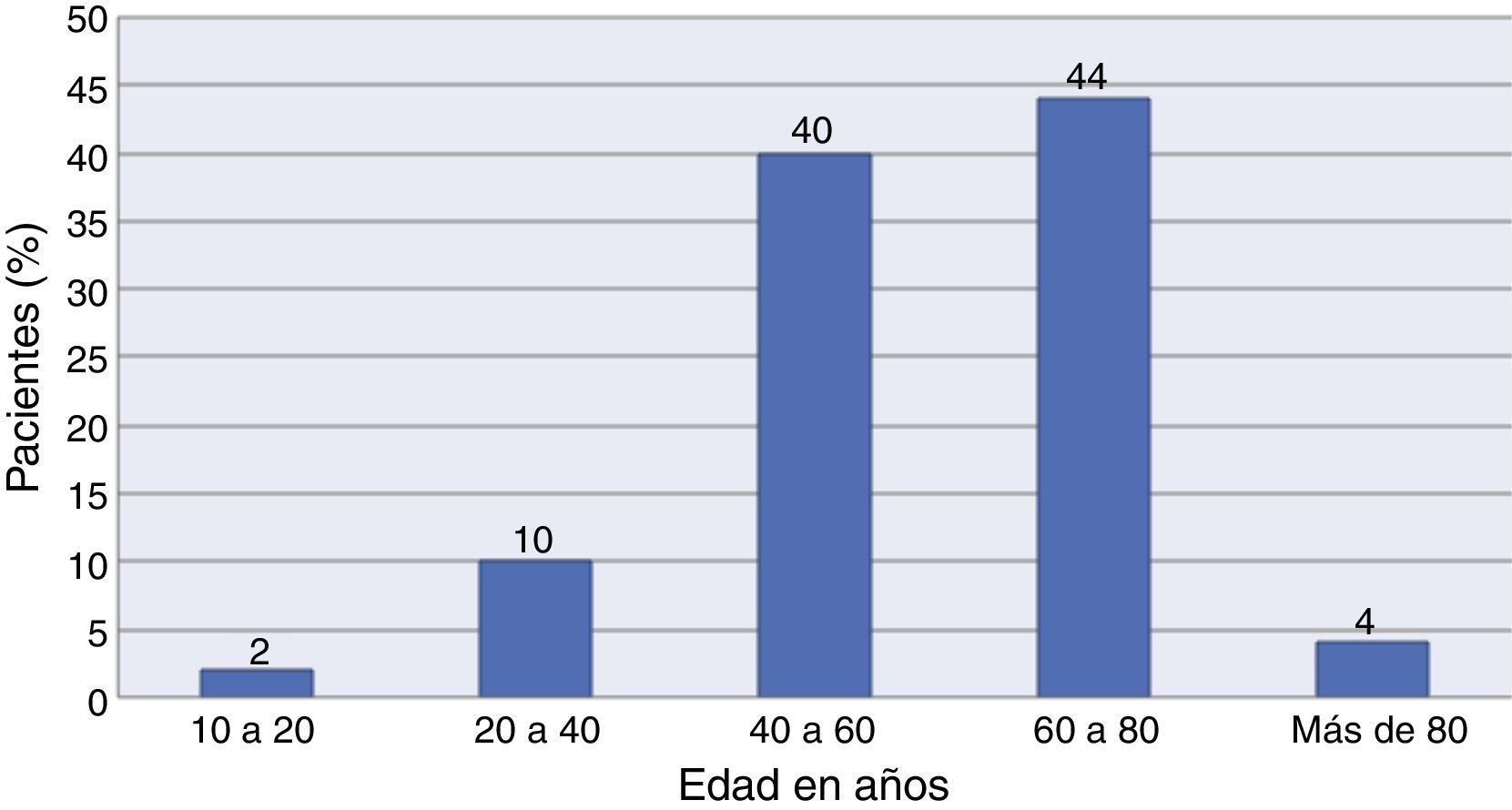
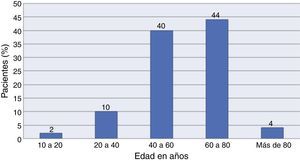
Del total de la muestra, un 40% (n=40) correspondieron al género masculino y un 60% (n=60) al género femenino. El rango de edad osciló entre los 17 y los 86 años, con un promedio de edad de 56.4±13.3. La distribución por edades se muestra con detalle en la figura 2.
Las lesiones pancreáticas más frecuentes fueron localizadas en la cabeza del páncreas (73%, n=73), seguidas del cuerpo (24%, n=24) y, por último, en la cola y proceso uncinado del páncreas (3%, n=3). Los diagnósticos citológicos fueron clasificados en: maligno 67% (n=67), sospechoso 7% (n=7), benigno 15% (n=15) y muestra inadecuada en el 11% (n=11). El adenocarcinoma fue el diagnóstico histopatológico más frecuente y un promedio de 3 pases de aguja en todos los casos.
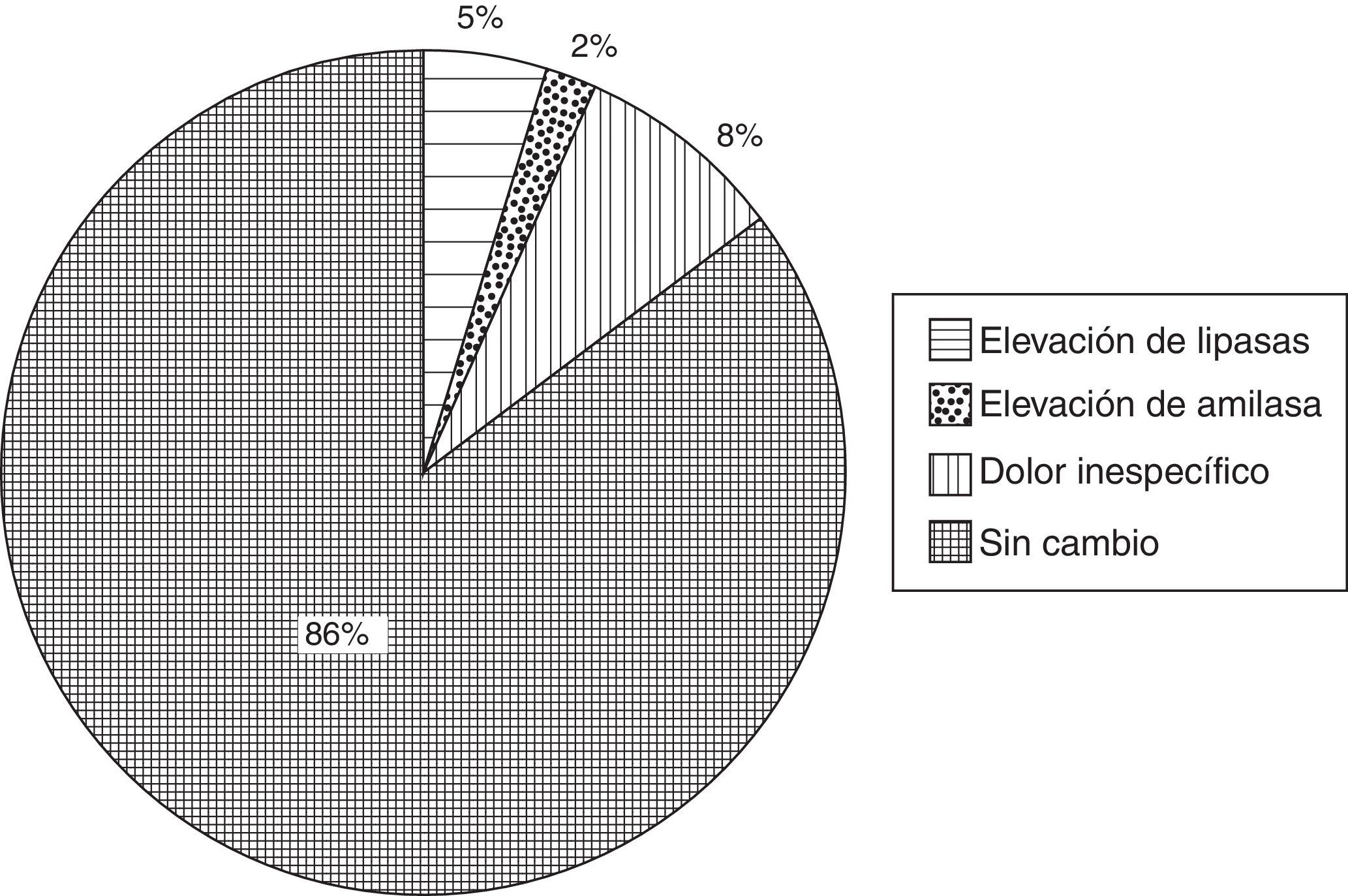
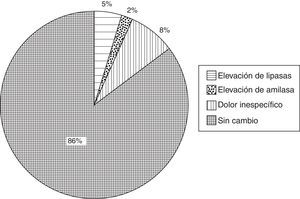
Con respecto a las enzimas pancreáticas, se documentó una elevación de lipasa en un 5% (n=5) de los casos y de amilasa en un 2% (n=2) de los casos. Ningún paciente cursó con elevación significativa de amilasa ni lipasa mayor de 3 veces del valor de referencia (13-60U/L para lipasa y 28-100U/L para amilasa). En un 8% (n=8) de los pacientes se presentó dolor abdominal referido como leve e inespecífico (fig. 3). El dolor desapareció antes de su egreso y sus niveles de enzimas pancreáticas no mostraron alteraciones con respecto al valor basal. Por lo anterior, ninguno de los casos fue compatible con el diagnóstico de pancreatitis aguda pospunción. Tampoco se refirió dolor abdominal durante la vigilancia clínica posterior a su egreso de recuperación y en su domicilio.
DiscusiónAunque no existen criterios estandarizados para el diagnóstico de pancreatitis pospunción, nos basamos en los criterios universales aplicados para la pancreatitis aguda, que son: cuadro de dolor abdominal y elevación de enzimas pancreáticas al menos 3 veces su valor. Este centro hospitalario es considerado como un hospital de concentración y se realizan un promedio de 800 a 1,000 procedimientos al año. Dada la cantidad, en general podemos decir que los riesgos asociados al procedimiento de biopsia por punción aspirativa con ultrasonido son reducidos, así como en otros centros en donde es realizado el procedimiento16. Algunos estudios evidencian que la pancreatitis después de la punción ocurre con mayor frecuencia en pacientes con antecedentes de pancreatitis17 o cuando se punciona un páncreas sano; también se han mencionado otros factores de riesgo, como son lesiones menores de 3cm y un número de pases mayor a 4. El mecanismo por el cual se produce pancreatitis después de una punción con aguja sigue siendo especulativa y se piensa que la punción del parénquima pancreático causa un traumatismo directo sobre la glándula, sobre el conducto principal o bien sobre una de sus ramas. Esto genera edema y una respuesta inflamatoria aguda que bien podría asociarse con el diámetro de las lesiones, el diámetro de la aguja, el número de punciones realizadas, la técnica utilizada y la susceptibilidad del paciente. Sabemos que el páncreas reacciona ante factores que lo traumatizan con una elevación de las enzimas pancreáticas, básicamente la amilasa y la lipasa, por lo que ante un paciente con cuadro clínico de dolor abdominal, náuseas y vómitos posterior a una biopsia por punción aspirativa guiada por ultrasonido es conveniente realizar una determinación de los niveles de la amilasa y la lipasa en sangre. Si estos valores están incrementados más de 3 veces con respecto a las cifras basales, el paciente debe iniciar un protocolo de manejo similar al de la pancreatitis aguda, puesto que hoy en día no se ha planteado un protocolo de manejo para la pancreatitis pospunción. Si bien en nuestro estudio hubo una elevación de las cifras de amilasa y lipasa, estas no fueron significativas para evidenciar datos indicativos de pancreatitis pospunción, además de que esta elevación no coincidió con los pacientes que cursaron con dolor abdominal. Es esos casos el dolor no requirió manejo analgésico, dado que fue transitorio y estuvo asociado más bien a la distensión abdominal generada por el ingreso de aire necesario para realizar el procedimiento, así como a la punción de la pared abdominal18. En suma, el riesgo de pancreatitis pospunción aspirativa de páncreas guiada por USE es baja de acuerdo con la literatura mundial (<4%)19, y en el presente trabajo no se documentó ningún cuadro compatible con pancreatitis pospunción. De forma similar, no observamos casos de perforación digestiva, hemorragias secundarias al procedimiento ni ningún proceso infeccioso, que sí se han descrito como complicaciones en otras publicaciones20.
El beneficio de este reporte radica en que la biopsia de páncreas guiada por USE es un método que está en crecimiento, y en México aún no contamos con reportes oficiales de sus riesgos y sus complicaciones, por lo que la información obtenida en este grupo de pacientes es de mucha utilidad para el mejor desarrollo del procedimiento. Las complicaciones reportadas mundialmente indican que es un procedimiento diagnóstico seguro, lo que reflejamos también con nuestros resultados, y que, finalmente, se traduce en una técnica eficiente, sensible y con un amplio margen de seguridad cuando es realizada por endoecosonografistas experimentados.
ConclusiónLa BAAF guiada por USE se asoció a una baja tasa de elevación de enzimas pancreáticas y en ningún caso se desarrolló pancreatitis pospunción. La frecuencia de pancreatitis aguda después de la punción varía en cada centro que realiza USE y podría estar relacionada con la experiencia del médico que lleva a cabo el procedimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.