Presentamos el caso de una mujer de 26 años con síndrome antifosfolípido primario y trombosis valvular obstructiva de prótesis mecánica en posición mitral que requirió una reintervención quirúrgica urgente.
We report a case of a 26 years old female with primary antiphospholipid syndrome and obstructive valvular thrombosis of mechanical prothesis in mitral position that required urgent surgical reintervention.
El síndrome antifosfolípido (SAF), también conocido como síndrome de Hughes en honor a Graham R.V. Hughes, quien lo describió por primera vez en 1983, es una enfermedad sistémica y de características autoinmunes. Se trata del estado de hipercoagulabilidad adquirido más común, ocurriendo en el 2% de la población general. En el Consenso Internacional celebrado en Sapporo en 1999 se establecieron los criterios para el diagnóstico del SAF, que posteriormente se modificaron en Sídney en 20061. Según estos, el SAF se define por la presencia de trombosis vascular (arterial, venosa o de pequeños vasos) o complicaciones obstétricas (3 o más abortos espontáneos consecutivos antes de la 10.ª semana de gestación, una o más muertes inexplicadas de un feto morfológicamente normal después de la 10.ª semana de gestación o uno o más nacimientos prematuros de neonatos morfológicamente anormales antes de la 34.ª semana de gestación por eclampsia, preeclampsia severa o insuficiencia placentaria) asociados a marcadores serológicos positivos que se incluyen bajo la denominación de anticuerpos antifosfolípidos (AAF): anticuerpos anticoagulante lúpico, anticuerpos anticardiolipina y anticuerpos anti-b2 glicoproteína. Afecta predominantemente a mujeres (80%), entre los 20 y 40 años.
Puede presentarse de forma aislada (SAF primario) o asociado a otras enfermedades, comúnmente al lupus eritematoso sistémico (SAF secundario). Se pueden detectar AAF en otras situaciones, como infecciones, neoplasias o en relación con la toma de fármacos. Más recientemente, se ha descrito un subgrupo de SAF en el que los pacientes desarrollan múltiples trombosis, sobre todo en los vasos de pequeño calibre de diversos órganos, durante un corto espacio de tiempo, que se ha denominado SAF catastrófico y es responsable de una mortalidad del 30%.
El espectro clínico de esta entidad es amplio y diverso, abarcando alteraciones hematológicas (trombocitopenia, anemia hemolítica), neurológicas (accidente cerebrovascular, isquemia transitoria, migraña, demencia, epilepsia, corea, hipertensión intracraneal idiopática o pseudotumor cerebri, neuritis óptica, sordera neurosensorial, síndrome de Guillain-Barré), digestivas (isquemia intestinal, trombosis vena porta o venas suprahepáticas, lesiones hepáticas, esplénicas o pancreáticas), renales (afectación vascular renal, proteinuria, hematuria, síndrome nefrótico e insuficiencia renal), reumatológicas (artralgias, artritis, osteonecrosis) y dermatológicas (livedo reticularis, úlceras).
Las manifestaciones cardíacas incluyen: valvulopatía, enfermedad arterial coronaria, miocardiopatía dilatada, trombo intracardiaco e hipertensión pulmonar. El compromiso valvular es la más frecuente de todas ellas2. Las lesiones valvulares se han descrito en el 50% de los casos —pudiendo llegar a alcanzar cifras superiores al 80%, si se utilizan técnicas altamente sensibles como el ecocardiograma transesofágico (ETE)— y suelen consistir en masas o vegetaciones (endocarditis de Libman-Sacks) y engrosamiento valvular. Las válvulas comúnmente afectadas son la mitral y la aórtica, con mayor proporción la primera. Aunque estas lesiones tienen, habitualmente, escasa repercusión hemodinámica, a veces originan disfunción valvular, predominantemente regurgitación, siendo la estenosis muy rara. En la actualidad, se acepta que la existencia de afectación valvular concomitante predispone a fenómenos tromboembólicos. Aunque los mecanismos patogénicos involucrados en la producción de alteraciones valvulares aún no han sido claramente identificados, varios estudios han demostrado una relación directamente proporcional entre los títulos de AAF y el grado de disfunción valvular. Pese a su elevada prevalencia, tan solo el 4-6% de los pacientes progresan a formas severas que requieren intervención quirúrgica. En este contexto, los datos publicados sobre el resultado del recambio valvular en pacientes con SAF son escasos y generalmente se limitan a informes de casos o series pequeñas3. La cirugía de reemplazo valvular en estos pacientes conlleva una morbimortalidad temprana y tardía considerable, existiendo un alto riesgo de complicaciones hemorrágicas y tromboembólicas. La trombosis valvular protésica es una complicación temida por cardiólogos y cirujanos cardíacos. Sus diversas formas de presentación hacen necesario un alto nivel de sospecha clínica y la rápida utilización de métodos diagnósticos con vistas a un tratamiento precoz que evite un desenlace fatal.
Caso clínicoMujer de 26 años con SAF primario previamente diagnosticado e historia cardiológica de insuficiencia mitral severa por engrosamiento nodular del borde libre de los velos con movimiento restrictivo del velo anterior compatible con endocarditis de Libman-Sacks, que requirió reparación valvular mitral con colocación de anillo flexible Physio (Carpentier-Edwards, Irvine, California, EE. UU.) n.° 26 hace 6años y estenosis mitral severa sometida a recambio valvular por prótesis mecánica Masters (St. Jude Medical, St. Paul, Minnesota, EE. UU.) n.° 25 hace 8meses. También antecedentes personales de vasculitis cerebral con microinfartos en sustancia blanca, hipertensión intracraneal idiopática con neuritis óptica y papiledema bilateral, corea de origen vascular, insuficiencia renal crónica por microangiopatía, hipotiroidismo autoinmune y síndrome anémico multifactorial.
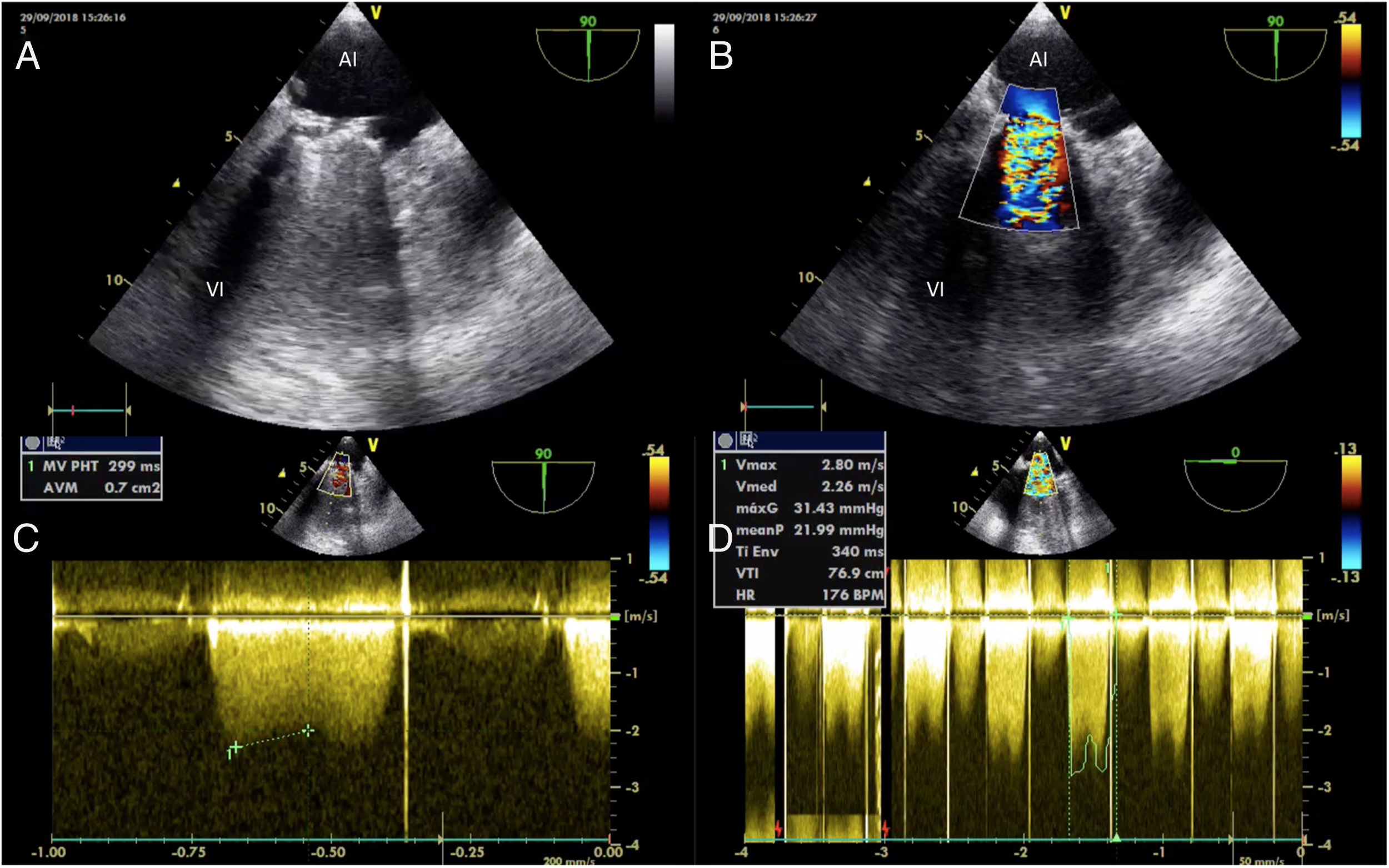
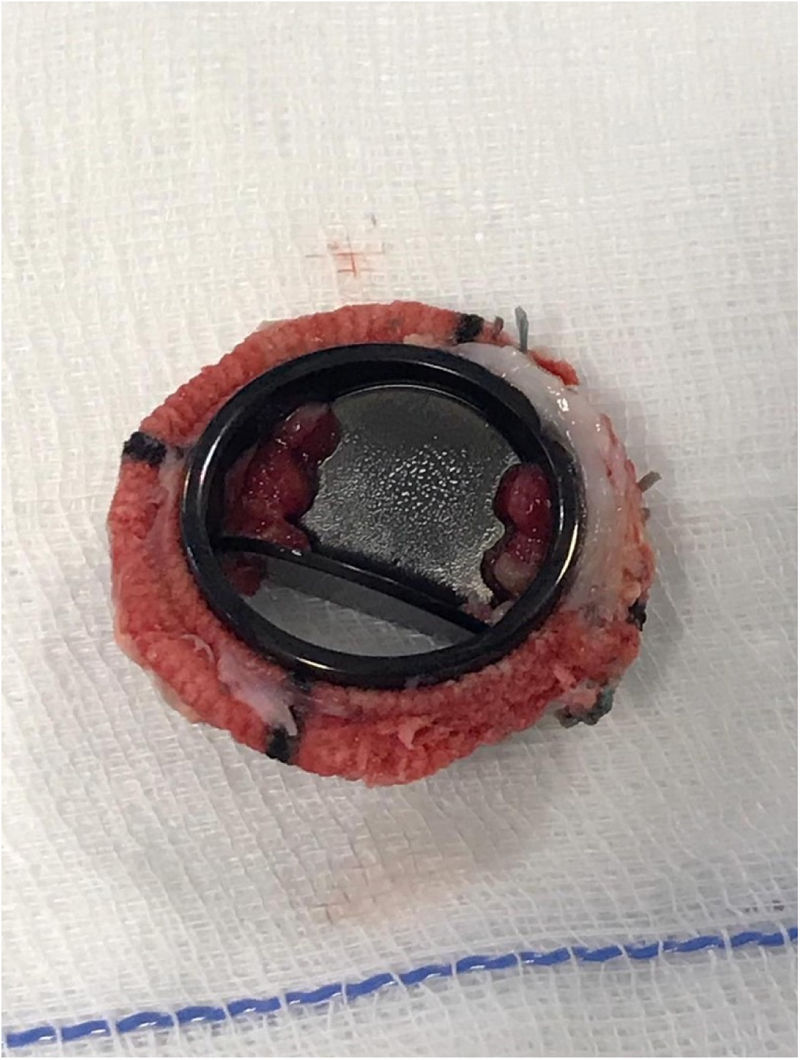
Acude a urgencias por disnea a mínimos esfuerzos, prácticamente de reposo, de 2-3 días de evolución, junto con episodios de hemoptisis y fiebre. La radiografía de tórax mostraba un infiltrado algodonoso bilateral difuso. Analíticamente, elevación de reactantes de fase aguda e International Normalized Ratio (INR) en 2,74. Ingresa en la Unidad de Cuidados Intensivos por insuficiencia respiratoria aguda hipoxémica en probable relación con proceso respiratorio infeccioso o cuadro de hemorragia alveolar difusa en paciente anticoagulada con warfarina. Se iniciaron antibioterapia y corticoterapia, y se suspendió la anticoagulación oral (ACO). A las 48 h, dada la evolución indicativa de edema agudo de pulmón cardiogénico y ante la sospecha de disfunción valvular protésica, se realizó un ecocardiograma transtorácico (ETT), detectándose estenosis mitral severa por inmovilidad de hemidisco de la prótesis mecánica mitral, con imagen compatible con trombosis protésica. En ese momento, puesto que la terapia con ACO había sido inadecuada, se inició perfusión con heparina no fraccionada por vía intravenosa, con respuesta fallida a la misma a las 24 h, tal y como se constató en el ETE de control (fig. 1). Se decidió entonces, de forma consensuada por equipo multidisciplinar, reintervención quirúrgica urgente. Bajo anestesia general, se procedió a la canulación de la arteria y la vena femoral común derechas. Tras esternotomía media, se canuló la vena cava superior. Una vez instaurada la circulación extracorpórea, se pinzó la aorta ascendente y se administró cardioplejía anterógrada. Seguidamente, a través de auriculotomía izquierda, se llevó a cabo la exéresis de la prótesis mecánica mitral (fig. 2) y se sustituyó por una prótesis biológica Epic (St. Jude Medical) del n.° 25. El postoperatorio inmediato se caracterizó por la estabilidad hemodinámica sin necesidad de soporte vasoactivo y extubación a las pocas horas de la cirugía. Sangrado escaso a través de drenajes que se pudieron retirar al tercer día de postoperatorio. Trombocitopenia que se corrigió, pudiendo iniciarse ACO sin incidencias al quinto día. Trasladada a planta de Cardiología a los 10días de la cirugía, donde su evolución fue lenta pero favorable, presentando como incidencias reseñables anemia en rango transfusional y bacteriemia por Staphilococcus epidermidis asociada a infección de catéter venoso periférico. Fue dada de alta domiciliaria a los 30 días de la intervención. En las revisiones en Consultas Externas de Cardiología no se han apreciado anomalías ecocardiográficas y sigue un control estricto por parte de Hematología y Reumatología.
Ecocardiograma transesofágico: plano longitudinal de 2cámaras. A) Apertura incompleta de ambos discos de la prótesis mecánica mitral. B) Flujo turbulento a través de la prótesis. C) Área calculada por tiempo de hemipresión de 0,7cm2. D) Gradientes transvalvulares elevados (gradiente máximo de 31,43mmHg y gradiente medio de 21,99mmHg).
El manejo terapéutico óptimo de los pacientes con SAF es controvertido y está en continua revisión. Con el propósito de dar respuesta a esta cuestión, en el 13th International Congress of Antiphospholipid Antibodies que tuvo lugar en Galveston en 2010 se elaboró un documento de consenso sobre la profilaxis primaria y secundaria en portadores de AAF4. Se recomienda la tromboprofilaxis primaria con ácido acetilsalicílico (AAS) a dosis bajas (75-100mg/día) en individuos asintomáticos con perfil de AAF de alto riesgo, particularmente en presencia de factores de riesgo cardiovascular. Los pacientes que han sufrido un evento tromboembólico venoso deben recibir ACO de intensidad media (INR 2,0-3,0). Sin embargo, aquellos que han presentado un evento tromboembólico arterial deben tratarse con ACO de intensidad alta (INR> 3) o con terapia combinada con dosis bajas de AAS más ACO con INR 2,0-3,0. La duración de la ACO también ha sido objeto de debate. Datos recientes sugieren un incremento del riesgo de recurrencia de trombosis tras la interrupción de la terapia anticoagulante, por lo que se debe mantener la profilaxis de forma indefinida. Tan solo en casos de un primer evento venoso, AAF de perfil de bajo riesgo y un factor precipitante conocido transitorio/reversible, podría limitarse la anticoagulación a 3-6 meses.
La elección entre válvulas biológicas y mecánicas en pacientes con SAF aún no está clara. Berkun et al.5 recomiendan el uso de prótesis mecánicas dado que los pacientes suelen ser jóvenes y la necesidad de terapia de ACO a largo plazo en el SAF. Por el contrario, Colli et al.6 sugieren el empleo de prótesis biológicas ya que el riesgo de hemorragias y complicaciones tromboembólicas es menor. No obstante, el rápido deterioro estructural en estos pacientes es inevitable. Más recientemente, Erdozain et al.7 publicaban una serie de 32 pacientes en la que no demostraron diferencias en los resultados entre pacientes con prótesis mecánicas y biológicas. Puesto que la evidencia presente hasta el momento se limita a casos y series de casos de pequeño tamaño, hacen falta más estudios para llegar a conclusiones firmes.
La tasa de trombosis valvular protésica es muy variable y lo más probable es que se subestime su incidencia real8, puesto que no se realizan ecocardiogramas de control de forma rutinaria o, si se hacen, a veces la ventana acústica es subóptima. Este acontecimiento puede ocurrir tanto en prótesis mecánicas como en bioprótesis implantadas de forma convencional o transcatéter. El riesgo de trombosis es mayor en aquellos pacientes con prótesis valvulares implantadas en posición mitral, frente a la aórtica, y aún mayor en las prótesis del lado derecho. La trombosis valvular protésica es un fenómeno multifactorial complejo en el que participan, de acuerdo con la tríada de Virchow, 3mecanismos básicos: factores relacionados con la superficie protésica, factores hemodinámicos y factores hemostáticos.
La presentación clínica, atendiendo a la clasificación de Lengyel, es muy variable, pudiendo ir desde un hallazgo incidental en un paciente asintomático, hasta un cuadro grave por obstrucción protésica —tal y como sucedió en nuestra paciente— y embolia. Se debe sospechar en todo paciente portador de cualquier tipo de prótesis que presente síntomas recientes de disnea o un evento embolico. El diagnóstico debe confirmarse mediante ETT, ETE, fluoroscopia o tomografía axial computarizada si está fácilmente disponible.
El tratamiento de la trombosis valvular obstructiva de prótesis mecánicas de lado izquierdo, como el caso que presentamos, constituye un desafío clínico, ya que, independientemente de la estrategia que se siga, el pronóstico es adverso9. La tasa de mortalidad a los 30 días tras cirugía es del 10-15%, con una tasa inferior al 5% en pacientes con clase funcional i-ii según la New York Heart Association (NYHA). Los resultados de la fibrinólisis antes del 2013 mostraban una tasa de mortalidad a los 30 días del 7% y una tasa éxito del 75%, pero con una tasa de tromboembolia y hemorragia del 13 y el 6%, respectivamente. Sin embargo, estudios recientes que emplean un protocolo fibrinolítico de infusión lenta y dosis bajas guiado por ecocardiograma han mostrado tasas de éxito superiores al 90%, con tasas de tromboembolismo y hemorragia inferiores al 2% en ambos casos. Adicionalmente, se ha observado que este nuevo régimen de terapia fibrinolítica puede ser efectivo en pacientes con clase funcional avanzada y trombos de mayor tamaño. Con base en estos hallazgos, en el documento de actualización de la AHA/ACC, realizado en 2017 con respecto a las enfermedades valvulares10, se recomienda un tratamiento urgente con fibrinólisis o intervención quirúrgica, pero la elección de un tratamiento u otro dependerá de las características individuales y preferencias del paciente, así como de la experiencia y la disponibilidad de quirófano de cada institución. Los parámetros descritos a favor de la cirugía son: bajo riesgo quirúrgico, experiencia del cirujano, contraindicación para la fibrinólisis, trombosis recurrente, clase iv NYHA, trombo grande (> 10mm), trombo en la aurícula izquierda y enfermedad coronaria concomitante que amerita revascularización.
ConclusiónAunque se han descrito varias anormalidades valvulares asociadas al SAF, afortunadamente, la cirugía de reemplazo valvular es infrecuente, ya que se ha observado una morbimortalidad mayor que en la población general, dada la alta tasa de complicaciones tromboembólicas y hemorrágicas que obligan a un control estricto de la ACO para mejorar el pronóstico en estos pacientes.
La trombosis valvular protésica es una entidad muy grave y de difícil diagnóstico, cuyo tratamiento constituye un reto médico-quirúrgico. Pese a las indicaciones de fibrinólisis (clase de recomendación iia, nivel de evidencia C) recogidas en algunas guías de práctica clínica, el reemplazo valvular urgente para la trombosis obstructiva de prótesis mecánica en posición izquierda sigue siendo el tratamiento de elección en pacientes críticos sin contraindicaciones para la cirugía (clase de recomendación i, nivel de evidencia C).
Conflicto de interesesNinguno.