La endocarditis de Libman-Sacks es una forma de endocarditis no bacteriana asociada a los pacientes con lupus eritematoso sistémico (LES). Aunque con frecuencia cursa de forma asintomática, en ocasiones es causa de insuficiencia cardíaca grave. Presentamos un caso de reparación valvular mitral en una paciente aquejada de esta infrecuente entidad, que debutó clínicamente con un edema agudo de pulmón secundario a insuficiencia mitral masiva. La reparación valvular mitral puede ser un procedimiento eficaz y seguro, que permite evitar el riesgo adicional asociado al uso de prótesis valvulares en estos pacientes con riesgo trombótico elevado.
Libman-sacks endocarditis is a form of non-bacterial endocarditis described in systemic lupus erythematosus patients. Although usually asymptomatic, it is an infrequent cause of congestive heart failure. We report the case of a nonbacterial endocarditis in a young girl who suffered from acute pulmonary edema due to massive mitral regurgitation refractory to medical treatment. Mitral valve repair might be an effective and safe procedure, which avoids the additional risk of valve prostheses in these high thrombotic-risk patients.
La endocarditis de Libman-Sacks es la manifestación cardíaca más característica del LES1, siendo la pericarditis la manifestación cardíaca más frecuente2,3. Fue descrita por primera vez en el año 1924 por Libman y Sacks en el Hospital Mount Sinai de Nueva York4. La lesión histopatológica clásica consiste en unos acúmulos verrugosos localizados habitualmente en la superficie ventricular del velo posterior de la válvula mitral, debido al depósito de fibrina y células mononucleares5. La inmunofluorescencia revela depósito de inmunoglobulinas y complemento5. Desde el punto de vista macroscópico, estos depósitos se traducen en un crecimiento de vegetaciones o engrosamiento de los velos5,6. La afectación valvular habitualmente es silente, y ocurre en aproximadamente la mitad de los pacientes con LES, aunque en algunos casos la disfunción valvular puede ser el origen de insuficiencia cardíaca5. Las válvulas mitral y aórtica se afectan con más frecuencia que las del lado derecho, predominando la insuficiencia valvular sobre la estenosis5. La necesidad de tratamiento quirúrgico valvular varía según las series, siendo en general poco frecuente (entre 1 y 8%)1,7. La presencia de anticoagulante lúpico supone un riesgo de padecer fenómenos trombóticos y embólicos aumentado en estos pacientes8.
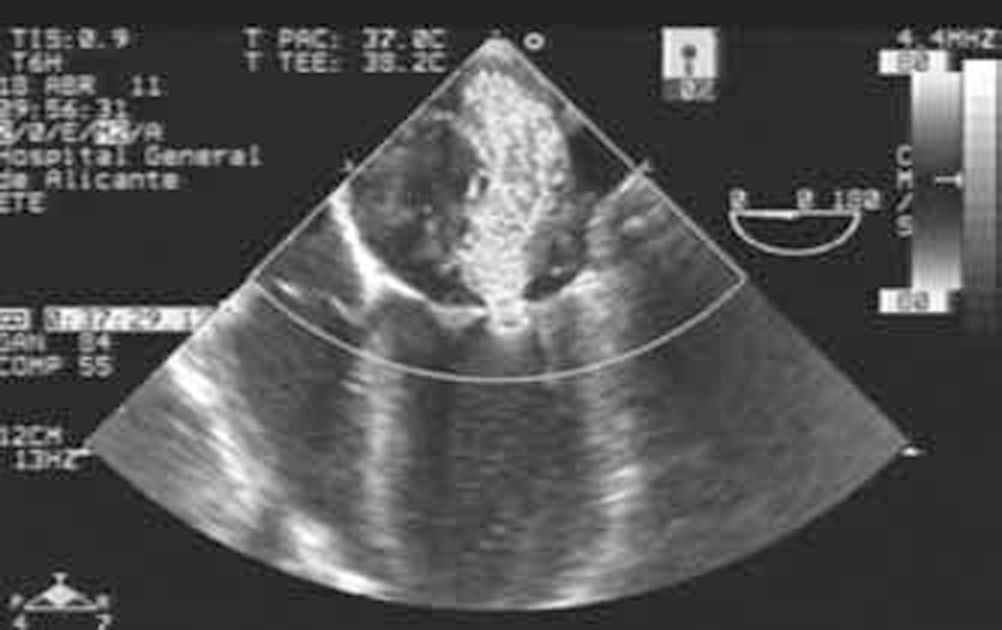
Caso ClínicoMujer de 17 años sin antecedentes de interés, que ingresa en nuestro hospital para estudio de síndrome febril, acompañado de poliartralgias y exantema facial. En este contexto, y tras la realización de exploraciones complementarias es diagnosticada de LES. En la analítica sanguínea se demostró, además, la presencia de anticoagulante lúpico, lo cual suponía un riesgo trombótico aumentado. De manera súbita, la paciente presentó deterioro de su situación clínica con aparición de disnea de reposo y ortopnea. Ante la presencia de insuficiencia respiratoria grave, la paciente fue ingresada en la Unidad de Cuidados Intensivos. Ante la sospecha inicial de embolia pulmonar aguda, se realizó una angiotomografía computarizada torácica que describía una ocupación alveolar en relación con edema agudo de pulmón, sin evidencia de trombos en las cavidades cardíacas o en el árbol vascular pulmonar. En el ecocardiograma (Fig. 1) se objetivó una insuficiencia mitral grave con aurícula izquierda ligeramente dilatada y un velo posterior mitral restrictivo que generaba un déficit de coaptación. Se instauró tratamiento endovenoso con vasodilatadores y diuréticos, y soporte ventilatorio mecánico no invasivo. Ante la mala evolución clínica pese al tratamiento médico se realizó intervención con carácter de urgencia.
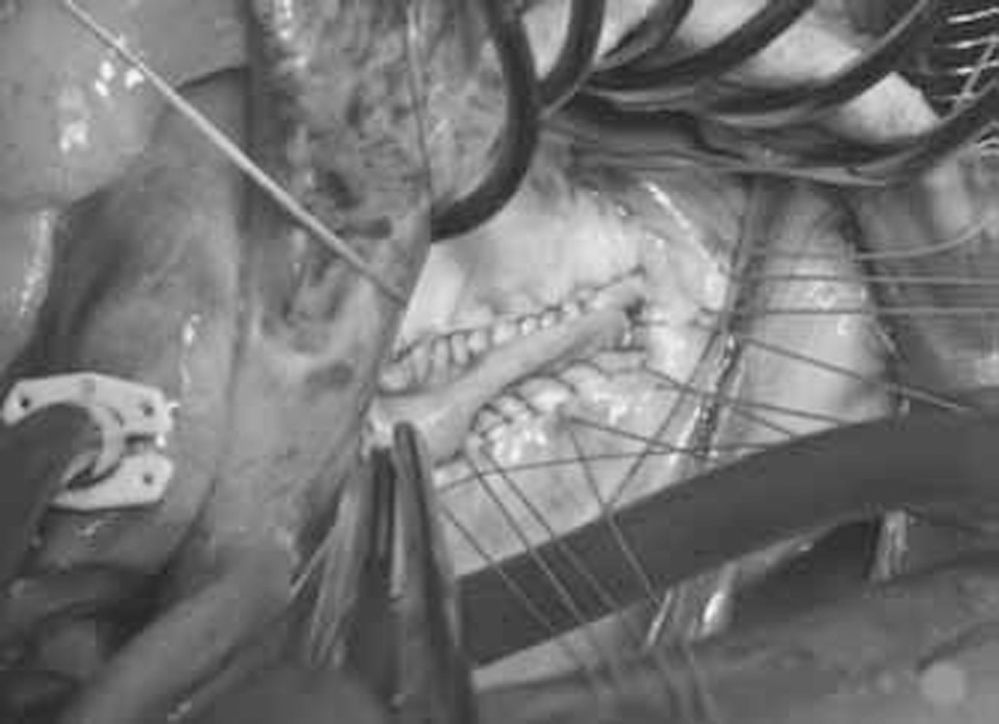
Bajo circulación extracorpórea, se abordó la válvula mitral a través de atriotomía izquierda. El análisis intraoperatorio de la válvula mostró engrosamiento y restricción en los movimientos del velo mitral posterior, con aspecto inflamatorio, sin apreciarse prolapso en ningún segmento de los velos anterior o posterior (Fig. 2). El aparato subvalvular se encontraba conservado. Ante dicha disfunción, se amplió el velo posterior de la mitral con parche de pericardio heterólogo Synovis Surgical Supple Peri-Guard Repair Patch (St. Paul, Minnesota, EE.UU.) (Fig. 3) y se implantó un anillo protésico mitral Edwards Lifesciences Physio II® de 30mm (Irvine, California, EE.UU.). La reconstrucción del velo posterior consistió en desinsertar el mismo a unos 5mm del anillo valvular de forma transversal, preservando las cuerdas primarias y secundarias, hasta alcanzar prácticamente las comisuras. Se confeccionó un parche de forma semilunar, que en su largo medía la longitud de la zona desinsertada del velo posterior más 5mm que se perderían con la sutura de mismo, y cuya anchura en su porción central era de unos 15 mm. El parche se suturó al velo y al anillo nativo con sutura monofilamento de 5/0, de forma continua, y cruzando la sutura en cada punto, para evitar un efecto de bolsa de tabaco de la misma. La altura del velo posterior tras la ampliación del mismo no superaba los 2cm. La ecocardiografía transesofágica intraoperatoria mostró una insuficiencia mitral ligera residual, sin gradiente transanular ni movimiento sistólico anterior.
El postoperatorio inmediato cursó sin incidencias, extubándose la paciente en las primeras horas. El ecocardiograma de control postoperatorio inmediato objetivó una mínima insuficiencia mitral residual con una fracción de eyección del ventrículo izquierdo moderadamente deprimida, que se normalizó al alta.
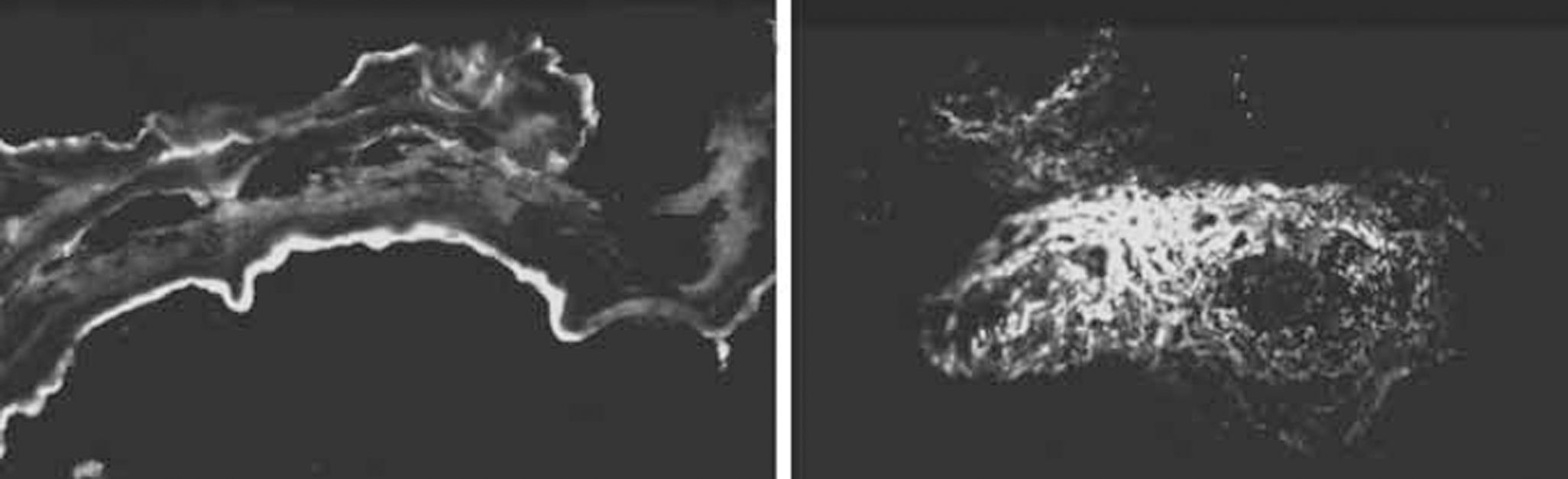
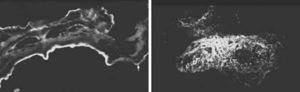
La histopatología de los fragmentos de velo posterior demostró un incremento de la vascularización, así como infiltración por neutrófilos. La inmunofluorescencia directa confirmó la presencia de depósitos de fibrina (Fig. 4 A) y de la fracción C1q del complemento (Fig. 4 B). Tras un año de seguimiento, la paciente permanece asintomática, con una insuficiencia mitral ligera y función sistólica conservada.
DiscusiónExisten pocas series publicadas sobre tratamiento quirúrgico de endocarditis de Libman-Sacks. El uso de prótesis valvulares biológicas se ha desestimado por la tendencia de estas a desarrollar valvulitis9,10. Además, algunos de los pacientes con LES presentan insuficiencia renal crónica con necesidad de diálisis, con lo que se acelera más la degeneración de las prótesis biológicas. Por otra parte, las prótesis mecánicas tienen un riesgo trombótico superior a las biológicas. Considerando la tendencia de los pacientes con LES a desarrollar fenómenos trombóticos y embólicos, y la presencia de anticoagulante lúpico en algunos casos, creemos que la reparación valvular mitral debe ser considerada cuando exista una anatomía favorable. Las series publicadas muestran buenos resultados a medio y largo plazo con las técnicas de reparación mitral9,11.
La técnica de reparación valvular mitral a emplear en cada caso particular (resección cuadrangular, uso de anillo protésico, uso de material heterólogo…) queda supeditada al tipo de disfunción valvular encontrada en cada paciente12. En nuestra paciente no existía prolapso de ninguno de los velos –disfunción tipo II de la Clasificación Funcional de Carpentier–, por lo que no estaba indicado ninguna resección segmentaria del mismo con posterior reconstrucción, ni dilatación anular del anillo nativo –disfunción tipo I–, por lo que un anillo exclusivamente no hubiera corregido la insuficiencia mitral. La restricción del velo posterior fue diagnosticada preoperatoriamente por la ecocardiografía y refrendada en el posterior análisis intraoperatorio de la válvula. Ante la disfunción tipo IIIa de Carpentier (restricción diastólica del movimiento del velo), se optó por emplear una técnica apropiada para corregir dicha disfunción.
ConclusiónLa reparación valvular mitral debe ser considerada en el tratamiento de la endocarditis de Libman-Sacks cuando sea técnicamente factible. En casos con riesgo trombótico aumentado, especialmente con la presencia de anticoagulante lúpico, permite disminuir el riesgo adicional que supone el implante de una prótesis valvular.