La perfusión en la enfermedad patología sigue siendo un gran reto. Los constantes cambios que se han producido en la canulación, han producido como consecuencia la modificación del sentido de los flujos, vena cava superior (retrógrada) o a través de las arterias subclavia, carótida izquierda y carótida derecha, que permiten mejorar la protección cerebral y reducir los problemas neurológicos. Siempre acompañado de un mejor control de los procesos metabólicos y de la incorporación de sistemas fiables que nos indican en qué estado está la oxigenación y la actividad eléctrica cerebral.
Perfusion in pathology disease remains a major challenge. The constant changes that have occurred in cannulation have produced the effect of altering the direction of flows, the superior vena cava (retrograde) or through the subclavian artery, left carotid, right carotid, which improve brain protection and reduce neurological problems. Always accompanied by better control of metabolic processes and the incorporation of reliable systems that indicate the state of this oxygenation and cerebral electrical activity.
La patología de aorta continúa siendo unos de los retos más importantes para la cirugía cardiaca y la perfusión, los problemas incontrolados de sangrado perioperatorio y el daño a nivel del sistema nervioso central, han hecho que este tratamiento quirúrgico se encuentre asociado con una gran morbimortalidad1,2. La hipotermia profunda3, la perfusión retrograda4, la anterógrada cerebral con un mejor manejo de la monitorización han permitido la disminución de las secuelas neurológicas. El objetivo de este trabajo es exponer las fases de monitorización, canulación, bypass cardiopulmonar, y sus fases, control metabólico y monitorización cerebral.
Monitorización en la patología aórticaLa monitorización en estos casos se debe completar con sistemas que nos van a informar de una forma más exacta de las condiciones concretas del cerebro:
- -
Electrocardiograma
- -
Presión arterial:
- •
Radial izquierda- derecha
- •
Presión arteria femoral Presión venosa central
- •
Presión arteria pulmonar
- •
- -
Temperaturas:
- •
Nasofaríngea
- •
Timpánica
- •
Cutánea
- •
Vesical
- •
- -
Índice biespectral (BIS®)
- -
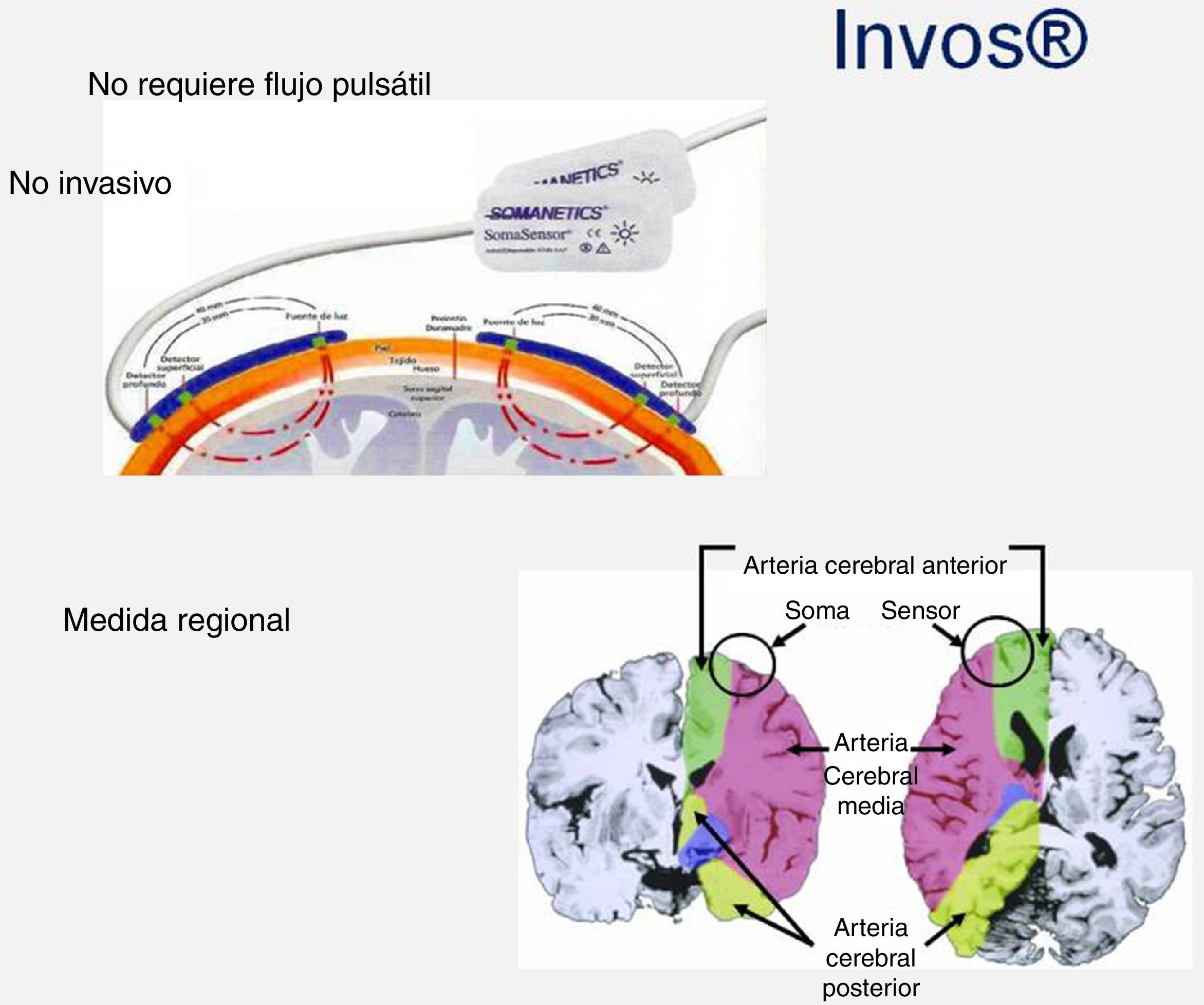
Saturación regional cerebral (INVOS®)
La canulación es un punto de controversia en los diferentes equipos quirúrgicos. Lo que va a definir una vía u otra será en muchos casos la patología del paciente. Variantes (fig. 1):
- -
Prótesis vascular 8–10mm en subclavia derecha
- -
Cánula en arteria subclavia derecha
- -
Cánula en aorta ascendente
- -
Cánula en cayado aórtico
- -
Cánula en arteria femoral
- -
Canulación a través de prótesis bifurcada
- -
Canulación mixta:
- •
Femoral y subclavia
- •
La canulación venosa, siendo lo más estandarizado, ha sufrido cambios en los últimos años con el desarrollo de nuevas cánulas para las técnicas mínimamente invasivas y de Heart Port, que son de gran utilidad en cualquier tipo de patología de alto riesgo:
- -
Cánula cavo-atrial Canulación doble:
- •
Cava superior
- •
Cava inferior
- •
- -
Cánula vena femoral
- -
Cánula yugular externa
- -
Canulación mixta:
- •
Femoral-yugular externa
- •
La instauración de la circulación extra corpórea tiene como objetivo primordial la sustitución de la función cardiaca y respiratoria, de una forma lo más fisiológica posible, mantenimiento íntegro de la función fisiológica de todos los órganos (corazón, cerebro, riñón, hígado, medula espinal, etc. Con el desarrollo de la perfusión son los perfusionistas los que tienen que dar las alternativas al cirujano en el bypass cardiopulmonar:
- -
Inicio bypass cardiopulmonar: Se realizará de forma progresiva, controlando en todo momento la presión en la línea arterial, dado los problemas que podemos encontrar por las alteraciones anatómicas producidas por el aneurisma o disecciones de la aorta
- -
Por subclavia derecha índice cardiaco 2-2.65
- -
Comienzo enfriamiento para conseguir la hipotermia profunda5,10
- -
Control de gases alfa-stat y pH-stat.
- -
Administración de medicación según protocolo del servicio
- -
Antes de parada circulatoria dosis de cardioplejía de alta dosis de potasio
- -
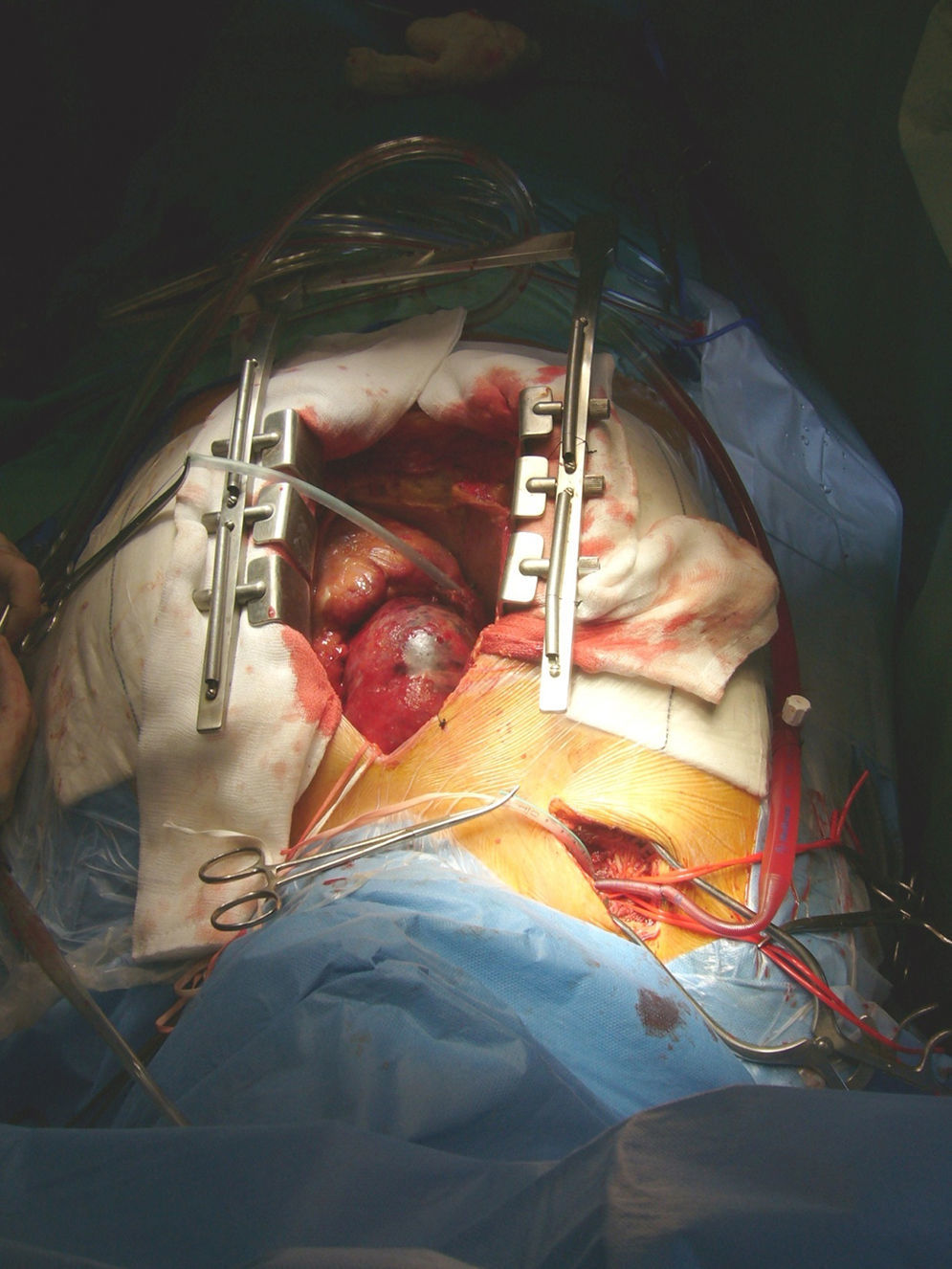
Parada circulatoria e inicio de la perfusión cerebral anterógrada: Se realiza visionando en todo momento las presiones y saturaciones cerebrales (fig. 2)
- -
Se realiza control de temperaturas que se empleen (timpánica, nasofaríngea, vesical y cutánea)11
- -
Que exista tasa de supresión cerebral 100% (índice biespectral)
- -
Control de saturación cerebral en ambos hemisferios (saturación regional cerebral)
- -
Comienzo de la perfusión (8-10ml/min) por la subclavia derecha, temperatura: 16–18°C
- -
Presión en línea arterial de 75-100mmHg
- -
Perfusión por la carótida izquierda si procede
- -
Reinicio del bypass cardiopulmonar y calentamiento: Esta fase es considerada la más critica, por eso está descrita como la que se debe cumplir todos los protocolos largamente descritos como:
- -
Reinicio del bypass cardiopulmonar con índices cardiacos (1.5–2.6)
- -
Calentamiento del enfermo con un tiempo mínimo de 60min
- -
Máxima diferencia de temperatura entre arterial y venosa (8–10°C)
- -
Corrección de la acidosis metabólica
- -
Corrección del hematocrito (24–28)
Cuando realizamos un bypass cardiopulmonar ponemos en contacto sangre con elementos artificiales, que producen una alteración inflamatoria muy importante, si añadimos el efecto isquémico no controlado en el organismo, las alteraciones metabólicas son importantes. Tendremos que actuar a 3 niveles: hemodilución, pH-CO2 y glucemia.
- -
Hemodilución: Según se ha demostrado es importante para limitar las lesiones cerebrales, dado que mejorar el flujo cerebral a bajas temperaturas, debido a la gran afinidad de la hemoglobina por el oxígeno a bajas temperaturas, la mayoría del oxígeno que toma los tejidos procede del disuelto en la sangre y no le afecta prácticamente la reducción de la células sanguíneas con la hemodilución. La hemodilución produce una disminución de la viscosidad de la sangre, evitando también las agregación de los hematíes9,13.
- -
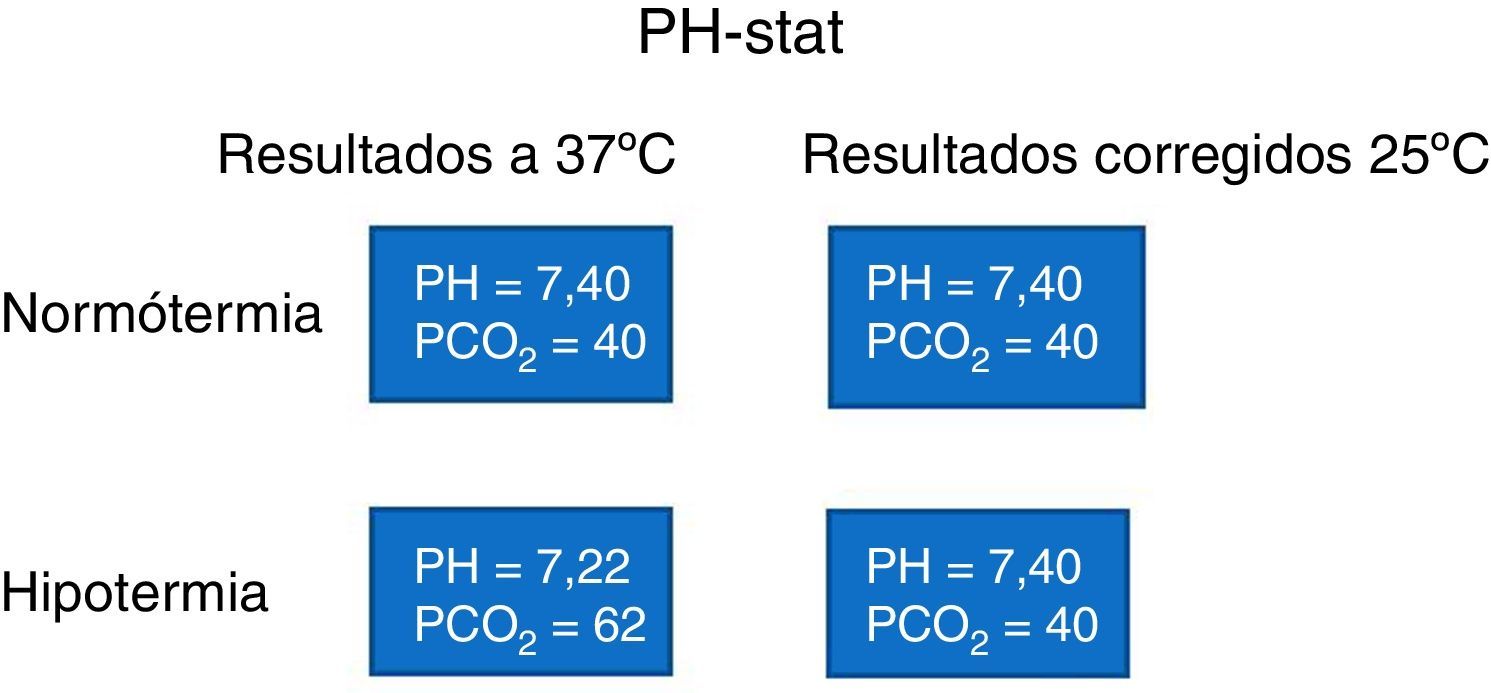
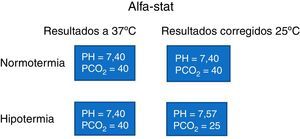
Control de PH-CO2: Lo realizamos con el método alfa-stat, el cual se caracteriza por niveles de CO2 más bajos y gasometrías leídas a 37°C, el cual mantiene un adecuado flujo cerebral en relación con el metabolismo de este, generando en las fases de enfriamiento y calentamiento una gran seguridad con reducción del riesgo de híper o hipoperfusión cerebral14, puesto que conserva el sistema de autorregulación. El alfa-stat presupone un beneficio de mayor utilidad del oxígeno, perfusión periférica, mejor perfusión de los órganos, mejor autorregulación cerebral, técnica más sencilla de la ventilación y no producción de acidosis intracelular6-8 (fig. 3).
No obstante,, existen discrepancias en la fase de hipotermia profunda en la cual algunos autores pregonan los beneficios del Ph-stat que se caracterizan por niveles más altos de CO2 y gasometrías leídas temperatura del paciente, presupone unos mejores beneficios en la disponibilidad de oxígeno y mayor perfusión cerebral por la pérdida de la autorregulación debido a la edad12 (fig. 4).
- -
La glucemia: La hiperglucemia conduce a una glucólisis anaerobia generando una acumulación rápida de lactato y acidosis intracelular durante el periodo de parada9. La hipotermia produce una liberación de catecolaminas15 y la administración de esteroides15, potencia la hiperglucemia, por lo que debe ser tratada de forma agresiva en este periodo.
Actualmente en todas las intervenciones de cirugía cardiaca y en particular en las enfermedades de la aorta es prácticamente de uso obligado la utilización de 2 sistemas de monitorización cerebral:
- -
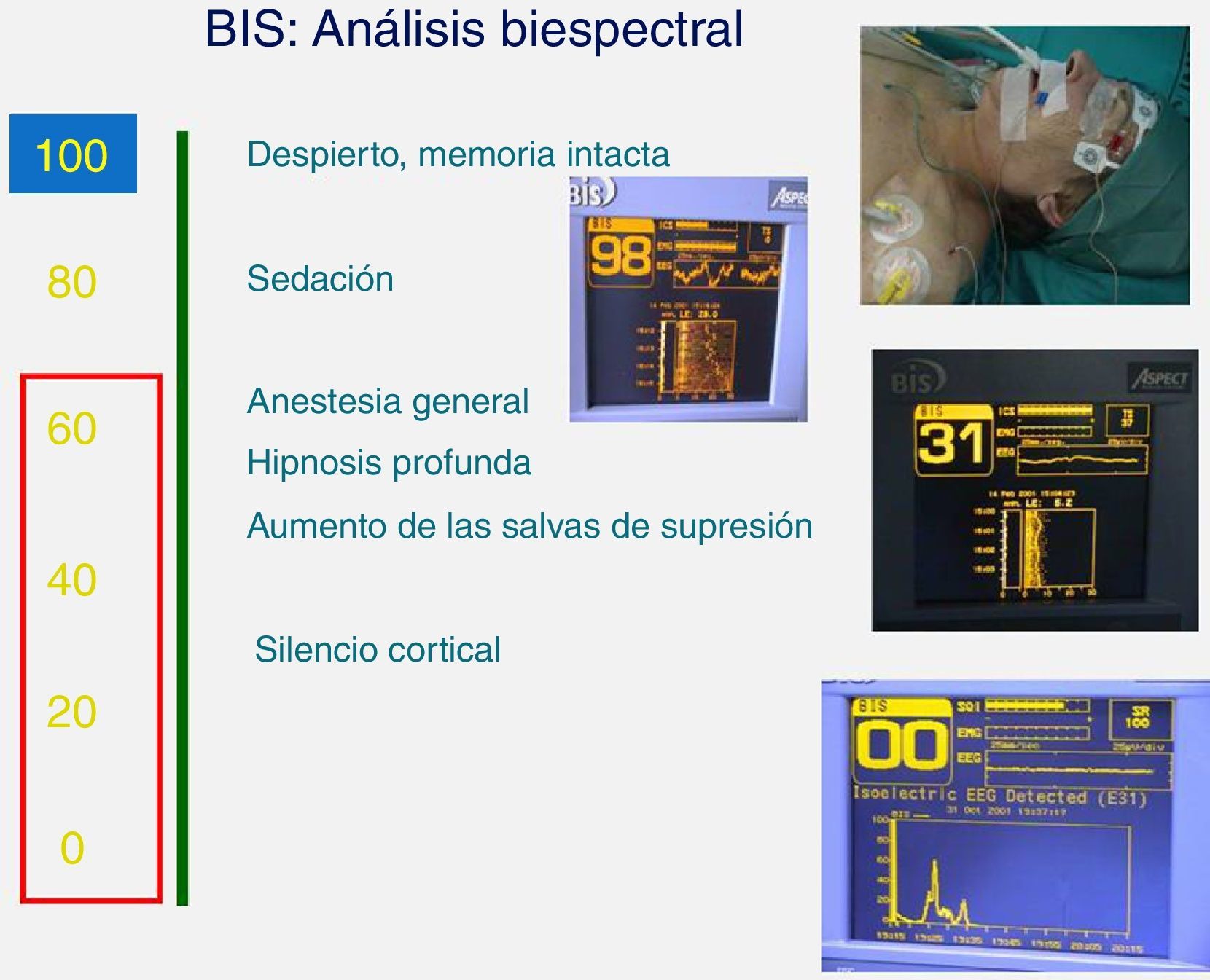
BIS®«índice biespectral»: Es un índice que se basa en variables del EEG procesado y que mide la profundidad anestésica. Permite una evaluación continua y puede ser la primera señal de un deterioro neurológico. Sus valores están entre 0 y 100 (100: paciente despierto; 0: paciente sin actividad eléctrica cerebral). Cuando la tasa de supresión es >80 (o BIS®<20) nos indica que el EEG está suprimido. En el coma barbitúrico la tasa de supresión debe ser superior al 60% (fig. 5).
- -
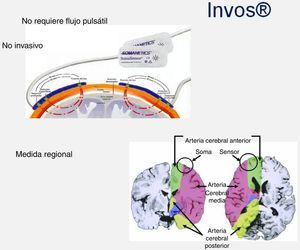
Saturación regional de oxígeno cerebral «INVOS®»: El sensor emite una longitud de onda 700-1.000nm que atraviesa los tejidos hasta una profundidad de 3-4cm. El valor que recoge es la saturación regional de oxígeno cerebral (es una mezcla de sangre venosa (75%), sangre arterial (20%), sangre capilar (5%). Funciona con independencia del tipo de flujo establecido en la circulación extracorpórea, es decir, en pulsátil y continuo (fig. 6).
La perfusión en la patología aórtica nunca debe ser dogmatica, la adopción de una técnica u otra debe ser una decisión consensuada y multidisciplinar. La perfusión anterógrada cerebral nos permite controlar y minimizar la hipoperfusión-hiperperfusión como consecuencia de disminuir los posibles daños cerebrales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.