Escherichia coli (E. coli) es el responsable de la mayoría de las infecciones del tracto urinario comunitarias. El objetivo del estudio es conocer el espectro de sensibilidad de E. coli en infecciones del tracto urinario para recomendar el tratamiento antibiótico empírico adecuado.
DiseñoEstudio transversal, multicéntrico, retrospectivo.
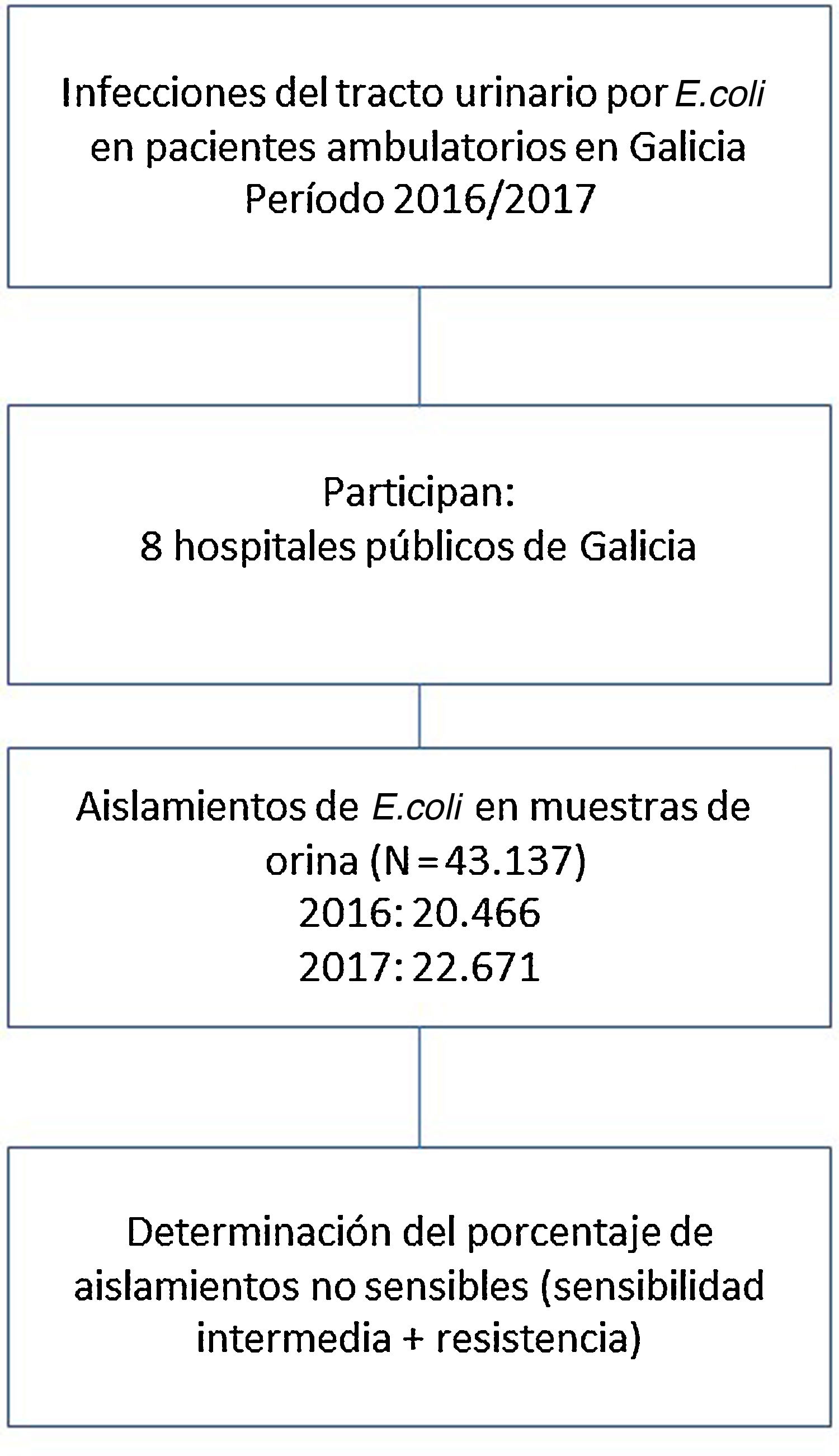
EmplazamientoOcho hospitales públicos gallegos, prácticamente toda la población de Galicia (España).
ParticipantesCuarenta y tres mil ciento treinta y siete pacientes ambulatorios con infección del tracto urinario por E. coli aislados en orina en 2016/2017.
Mediciones principalesVariables analizadas: demográficas, concentración mínima inhibitoria e interpretación de la sensibilidad según criterios de CLSI y mecanismos de resistencia. Los antibióticos estudiados fueron: ampicilina, amoxicilina-ácido clavulánico, ciprofloxacino, cefotaxima, cefepime, gentamicina, nitrofurantoína, fosfomicina, cotrimoxazol, imipenem y ertapenem. La identificación y sensibilidad se hicieron principalmente por sistemas automatizados.
ResultadosLos porcentajes de no sensibilidad de los aislamientos de E. coli fueron: ampicilina 49,2%, amoxicilina-ácido clavulánico 17,8%, cefotaxima 6,7%, cefepime 5,7%, ertapenem 0,04%, imipenem 0,05%, gentamicina 9,1%, ciprofloxacino 26,2%, fosfomicina 3,3%, nitrofurantoína 2,4% y cotrimoxazol 23,9%. Las no sensibilidades fueron superiores en hombres y a medida que aumenta la edad. El 6% fueron productores de betalactamasas de espectro extendido.
ConclusionesEl tratamiento empírico en Galicia para cistitis no complicadas producidas por E. coli en mujeres continúa siendo nitrofurantoína y fosfomicina. En hombres menores de 15 años se indica fosfomicina y en hombres mayores de 15 años el tratamiento en nuestro medio debe incluir la realización de cultivo y administrar una cefalosporina de 3.a generación oral empíricamente. No se recomienda cotrimoxazol ni ciprofloxacino como tratamiento empírico por sus altos porcentajes de resistencia.
Escherichia coli (E. coli) is responsible for the majority of community urinary tract infections. The objective of the study is to know the sensitivity spectrum of E. coli in urinary tract infections to be able to recommend the appropriate empirical antibiotic treatment.
DesignCross-sectional, multicentric, retrospective study.
LocationGalician 8 public hospitals, practically the entire population of Galicia (Spain).
Participants43,137 outpatients with urinary tract infection due to E. coli isolated in urine in 2016/2017.
Main measurementsAnalyzed variables: demographic, minimum inhibitory concentration and interpretation of sensitivity according to CLSI criteria and resistance mechanisms. The antibiotics studied were: ampicillin, amoxicillin-clavulanic acid, ciprofloxacin, cefotaxime, cefepime, gentamicin, nitrofurantoin, fosfomycin, cotrimoxazole, imipenem and ertapenem. The identification and sensitivity were made mainly by automated methods.
ResultsThe percentages of non-sensitivity of E. coli isolates were: ampicillin 49.2%, amoxicillin-clavulanic acid 17.8%, cefotaxime 6.7%, cefepime 5.7%, ertapenem 0.04%, imipenem 0.05%, gentamicin 9,1%, ciprofloxacin 26.2%, fosfomycin 3.3%, nitrofurantoin 2.4% and cotrimoxazole 23.9%. The non-sensitivities were higher in men and as age increases. Six percent of E. coli were producers of extended-spectrum beta-lactamases.
ConclusionsThe empirical treatment in Galicia for uncomplicated cystitis produced by E. coli in women continues to be nitrofurantoin and fosfomycin. In men under 15 years of age, fosfomycin is indicated and in men older than 15 years, treatment in our environment should include culture and administer a 3rd generation oral cephalosporin empirically. Cotrimoxazole and ciprofloxacin are not recommended as empirical treatment because of their high resistance rates.
Las infecciones del tracto urinario (ITU) comunitarias no complicadas son una de las infecciones bacterianas más frecuentes. Escherichia coli (E. coli) es el microorganismo más prevalente1–3, causando el 75-95% de episodios de cistitis aguda no complicada4.
Las ITU causan una elevada morbilidad en mujeres (37-40% de las mujeres desarrollan una ITU a lo largo de su vida)4,5, niños y hombres mayores. Aunque el tratamiento antibiótico tiene buenos resultados en las ITU, tanto complicadas como no complicadas, algunos individuos desarrollan cistitis recurrente, requiriendo profilaxis a largo plazo1,6. Pero con el uso de los antimicrobianos fueron surgiendo cepas resistentes a los antibióticos con el consiguiente descenso de la efectividad de los tratamientos5. El espectro de sensibilidad a los antimicrobianos más utilizados para el tratamiento de las ITU debe estudiarse en cada zona, con la finalidad de poder establecer un tratamiento empírico adecuado, como ocurre normalmente en atención primaria. Solorzano et al.7 recomiendan realizar estudios de vigilancia de resistencias para adecuar el tratamiento empírico.
En 2011/2012 el Grupo de trabajo para el estudio de resistencias de la Sociedad Gallega de Microbiología (SOGAMIC) llevó a cabo un estudio retrospectivo que analizaba las resistencias a determinados antibióticos de E. coli causantes de ITU comunitarias8. Con el objetivo de conocer si ha variado la sensibilidad antibiótica desde 2011/2012, se repitió el estudio en los años 2016/2017, con el fin de que, en caso de que sea necesario, modificar las recomendaciones de tratamiento empírico de las ITU comunitarias.
Material y métodosSe analizó retrospectivamente el patrón de sensibilidad de los aislamientos de E. coli de muestras de orina recogidas durante los años 2016 y 2017 procedentes de pacientes ambulatorios de 8 hospitales públicos gallegos. Los centros participantes eran todos los hospitales del Sergas, excepto 2 hospitales comarcales, ambos de la Estrutura Organizativa de Xestión Integrada (EOXI) de Lugo. Tampoco participó el hospital privado concertado POVISA.
Se escogió para el análisis solo la primera muestra registrada para cada paciente y año. Las muestras procedieron de los servicios de urgencias hospitalarias, atención primaria y consultas externas.
Las variables analizadas fueron: hospital de procedencia, año de aislamiento, datos de filiación, sexo, edad, grupo de edad (0 a 4 años, 5 a 14, 15 a 44, 45 a 50, 51 a 55, de 56 a 60, de 61 a 65 y 66 años y más), fecha de recogida de la muestra, concentración mínima inhibitoria, mecanismo de resistencia, para cada antibiótico analizado e interpretación de la sensibilidad antibiótica. Para la interpretación de la concentración mínima inhibitoria en términos de sensibilidad se emplearon los criterios de referencia del CLSI (Clinical&Laboratory Standards Institute).
Los antibióticos elegidos para el estudio fueron los más relevantes en las ITU: ampicilina, amoxicilina/ácido clavulánico, cefotaxima, cefepime, imipenem, ertapenem, gentamicina, ciprofloxacino, fosfomicina, nitrofurantoína y cotrimoxazol.
La identificación y el antibiograma del microorganismo se realizó preferentemente mediante sistemas comerciales normalmente empleados en los laboratorios: Vitek® (Biomérieux, Francia) y MicroScan® (Beckman, EE. UU.).
El mecanismo de resistencia para detección de betalactamasas de espectro extendido (BLEE) se realizó mediante disco-difusión según protocolos del CLSI. Para la detección de carbapenemasas se realizaron pruebas fenotípicas9 y moleculares10.
Se consideraron aislamientos no sensibles cuando la sensibilidad fue intermedia y/o resistente según los criterios de CLSI. Se consideró multirresistencia (MDR) la no sensibilidad simultánea a amoxicilina, gentamicina, ciprofloxacino y cotrimoxazol11. En nuestro estudio se analiza la MDR de 2 formas: como describen Arana et al.11, cambiando amoxicilina por ampicilina, y cambiando ampicilina por amoxicilina/ácido clavulánico, que es el antibiótico más prescrito en Galicia12.
Los datos fueron procesados mediante el programa Excel 2016® y el análisis estadístico mediante EPIDAT 3.1. y 4.1. Se calcularon los porcentajes de aislamientos de E. coli no sensibles en orinas por sexo, grupo de edad y hospital. Se empleó el test estadístico chi-cuadrado de Pearson para la comparación de grupos, considerando los resultados estadísticamente significativos cuando p<0,05.
Para el estudio de la incidencia se empleó la población del padrón de habitantes correspondiente a las áreas de influencia de los hospitales que notificaron aislamientos durante los años 2016/2017. Se ajustaron las tasas de incidencia por sexo, edad y población de referencia de cada hospital a partir de la población global de Galicia.
ResultadosDurante el período 2016/2017 se analizó el patrón de sensibilidad de 43.137 E. coli procedentes de muestras de orinas remitidas a los servicios de microbiología a partir de pacientes ambulatorios. El número de aislamientos fue 20.466 en el año 2016 y 22.671 en el año 2017. Destaca el Complejo Hospitalario Universitario de Vigo, con la mayoría de aislamientos.
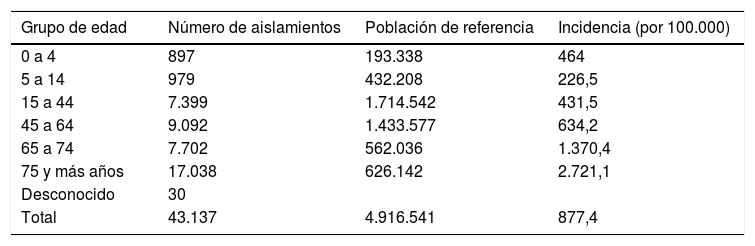
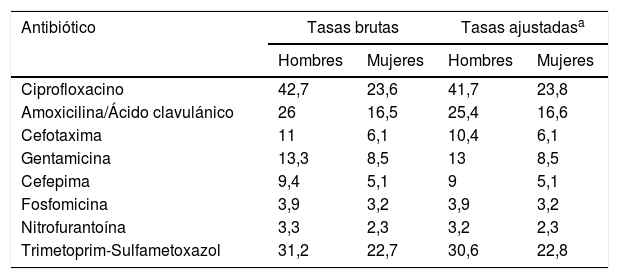
Las tasas de aislamiento por 100.000 habitantes específicas por grupo de edad se muestran en la tabla 1. Las tasas de no sensibilidad por 100 de E. coli por antibiótico, brutas y ajustadas por el método directo, tomando como población estándar la muestra total, se muestran en la tabla 2, donde destaca que las no sensibilidades son mayores en hombres. Los aislamientos de E. coli en orina fueron más frecuentes en mujeres (índice de masculinidad 0,2).
Número de aislamientos y tasas de incidencia de ITU comunitarias por E. coli por grupo de edad. Galicia 2016-2017
| Grupo de edad | Número de aislamientos | Población de referencia | Incidencia (por 100.000) |
|---|---|---|---|
| 0 a 4 | 897 | 193.338 | 464 |
| 5 a 14 | 979 | 432.208 | 226,5 |
| 15 a 44 | 7.399 | 1.714.542 | 431,5 |
| 45 a 64 | 9.092 | 1.433.577 | 634,2 |
| 65 a 74 | 7.702 | 562.036 | 1.370,4 |
| 75 y más años | 17.038 | 626.142 | 2.721,1 |
| Desconocido | 30 | ||
| Total | 43.137 | 4.916.541 | 877,4 |
Tasas de no sensibilidad (intermedia+resistencia) de E. coli por 100
| Antibiótico | Tasas brutas | Tasas ajustadasa | ||
|---|---|---|---|---|
| Hombres | Mujeres | Hombres | Mujeres | |
| Ciprofloxacino | 42,7 | 23,6 | 41,7 | 23,8 |
| Amoxicilina/Ácido clavulánico | 26 | 16,5 | 25,4 | 16,6 |
| Cefotaxima | 11 | 6,1 | 10,4 | 6,1 |
| Gentamicina | 13,3 | 8,5 | 13 | 8,5 |
| Cefepima | 9,4 | 5,1 | 9 | 5,1 |
| Fosfomicina | 3,9 | 3,2 | 3,9 | 3,2 |
| Nitrofurantoína | 3,3 | 2,3 | 3,2 | 2,3 |
| Trimetoprim-Sulfametoxazol | 31,2 | 22,7 | 30,6 | 22,8 |
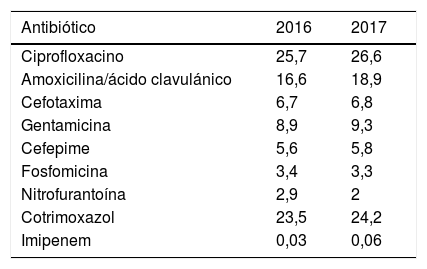
No se observaron diferencias estadísticamente significativas en el porcentaje de aislamientos no sensibles entre 2016 y 2017, pero cabe destacar el elevado porcentaje de aislamientos no sensibles a ciprofloxacino y cotrimoxazol, superior al 20%, y a amoxicilina/ácido clavulánico, en el último año cerca del 19% (tabla 3).
Porcentaje de aislamientos no sensibles (sensibilidad intermedia+resistencia) según año del estudio
| Antibiótico | 2016 | 2017 |
|---|---|---|
| Ciprofloxacino | 25,7 | 26,6 |
| Amoxicilina/ácido clavulánico | 16,6 | 18,9 |
| Cefotaxima | 6,7 | 6,8 |
| Gentamicina | 8,9 | 9,3 |
| Cefepime | 5,6 | 5,8 |
| Fosfomicina | 3,4 | 3,3 |
| Nitrofurantoína | 2,9 | 2 |
| Cotrimoxazol | 23,5 | 24,2 |
| Imipenem | 0,03 | 0,06 |
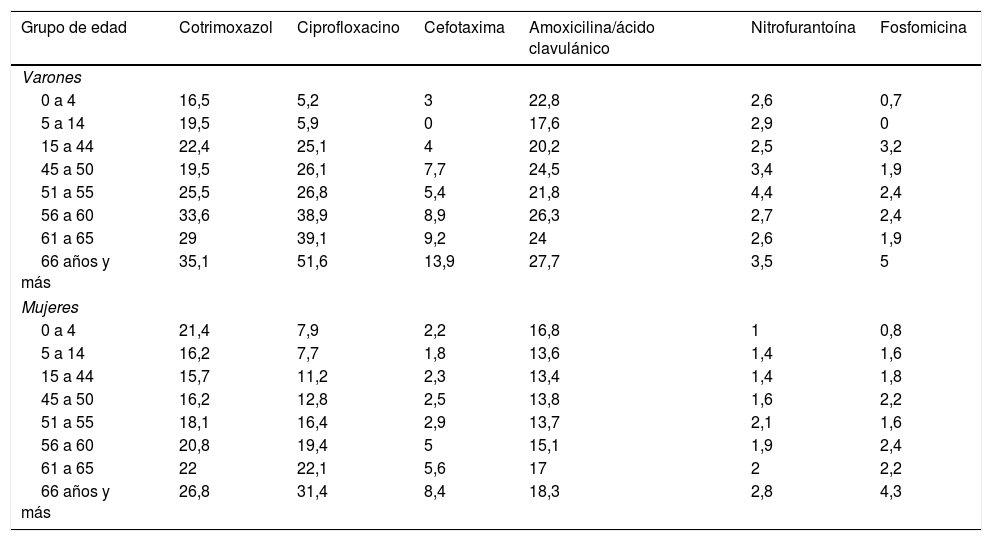
Los porcentajes de resistencia de E. coli en las ITU comunitarias en varones y mujeres por grupo de edad en Galicia durante el período 2016/2017 se muestran en la tabla 4.
Porcentajes de no sensibilidad (intermedia+resistencia) de E. coli en ITU comunitarias por grupo de edad y sexo
| Grupo de edad | Cotrimoxazol | Ciprofloxacino | Cefotaxima | Amoxicilina/ácido clavulánico | Nitrofurantoína | Fosfomicina |
|---|---|---|---|---|---|---|
| Varones | ||||||
| 0 a 4 | 16,5 | 5,2 | 3 | 22,8 | 2,6 | 0,7 |
| 5 a 14 | 19,5 | 5,9 | 0 | 17,6 | 2,9 | 0 |
| 15 a 44 | 22,4 | 25,1 | 4 | 20,2 | 2,5 | 3,2 |
| 45 a 50 | 19,5 | 26,1 | 7,7 | 24,5 | 3,4 | 1,9 |
| 51 a 55 | 25,5 | 26,8 | 5,4 | 21,8 | 4,4 | 2,4 |
| 56 a 60 | 33,6 | 38,9 | 8,9 | 26,3 | 2,7 | 2,4 |
| 61 a 65 | 29 | 39,1 | 9,2 | 24 | 2,6 | 1,9 |
| 66 años y más | 35,1 | 51,6 | 13,9 | 27,7 | 3,5 | 5 |
| Mujeres | ||||||
| 0 a 4 | 21,4 | 7,9 | 2,2 | 16,8 | 1 | 0,8 |
| 5 a 14 | 16,2 | 7,7 | 1,8 | 13,6 | 1,4 | 1,6 |
| 15 a 44 | 15,7 | 11,2 | 2,3 | 13,4 | 1,4 | 1,8 |
| 45 a 50 | 16,2 | 12,8 | 2,5 | 13,8 | 1,6 | 2,2 |
| 51 a 55 | 18,1 | 16,4 | 2,9 | 13,7 | 2,1 | 1,6 |
| 56 a 60 | 20,8 | 19,4 | 5 | 15,1 | 1,9 | 2,4 |
| 61 a 65 | 22 | 22,1 | 5,6 | 17 | 2 | 2,2 |
| 66 años y más | 26,8 | 31,4 | 8,4 | 18,3 | 2,8 | 4,3 |
Según el método de Arana11 modificado, el porcentaje de aislamientos sensibles a todos los antibióticos fue del 44,1%, con un 4,3% de resistencias a todos ellos; y según el método descrito en el Boletín Epidemiológico de Galicia12, el porcentaje de aislamientos sensibles a todos los antibióticos fue del 57% y el de resistencia a todos ellos del 2,5% para todos los antibióticos estudiados excepto para los carbapenemes.
El Complejo Hospitalario Universitario de Ourense fue el que, en general, tuvo un porcentaje mayor de no sensibilidad, aunque podría estar influido por la edad (datos no mostrados).
En el 6% de los aislamientos se detectó presencia de BLEE como mecanismo de resistencia. El 12,9% de los productores de BLEE fueron resistentes a fosfomicina (p<0,0001). En 6 aislamientos se identificó producción de carbapenemasas, de modo que fueron: 2 aislamientos con carbapenemasas sin especificar aislados en el Complejo Hospitalario Universitario de Vigo; 3 casos de OXA-48, 2 en el Hospital Universitario Lucus Augusti y uno en el Complejo Hospitalario Universitario de A Coruña; un KPC en el hospital comarcal de O Barco, que a su vez asoció BLEE.
DiscusiónEn este trabajo se analizan las no sensibilidades de E. coli en muestras de orina de pacientes ambulatorios remitidas a 8 hospitales públicos gallegos, que cubren la mayoría de los habitantes de Galicia y además, por el elevado número de aislamientos, hace que sus resultados sean relevantes.
En el presente estudio se muestran cifras de no sensibilidad a cotrimoxazol superiores al 20%, cifra por encima de la cual no se recomienda su uso como tratamiento empírico11. Tampoco se puede considerar al ciprofloxacino ni a la amoxicilina/ácido clavulánico como elección, dado su alto porcentaje de no sensibilidad3. Estos datos coinciden con lo publicado por Solorzano et al.7, en donde las resistencias de E. coli a imipenem, fosfomicina y nitrofurantoína fueron inferiores al 5% y las resistencias a ciprofloxacino y cotrimoxazol superiores al 20-30%. Sin embargo, en su estudio7, la prevalencia de E. coli productores de BLEE aislados de pacientes comunitarios fue superior a la de nuestro estudio (7,5 vs. 6%). Según Grabe et al.13, la mayoría de E. coli en ITU comunitarias productores de BLEE son sensibles a fosfomicina. En nuestro trabajo encontramos un 5,4% de aislamientos productores de BLEE y sensibles a fosfomicina, y un 12,9% de los productores de BLEE que son no sensibles a fosfomicina. Oteo et al.14 describieron que entre 2005 y 2009 hubo un aumento de aislamientos de E. coli productores de BLEE resistentes a fosfomicina en relación con el extendido uso de esta en la comunidad, con un incremento del 340% de dosis diarias definidas por 1.000 habitantes de fosfomicina en 2008 respecto a 1997 y lo relacionaron también con la amplia distribución de un clon de E. coli 025b/B2 y la existencia de población susceptible de mujeres residentes en centros sociosanitarios. Comparando los datos de 2011/20128 con los de 2016/2017, las cifras de E. coli no sensibles a fosfomicina se mantuvieron a pesar de su uso.
Se planteó la variable MDR según se incluyó en el análisis: ampicilina (MDR del 4,3%) o amoxicilina/ácido clavulánico (MDR del 2,5%). En otro estudio español9 donde analizaron la evolución de E. coli MDR en infecciones urinarias, concluyeron que está en aumento, y las cifras de E. coli MDR en pacientes ambulatorios son similares a estas, un 4,58% para el período 2011-2014. Destacaron el papel de la fosfomicina como una alternativa terapéutica en casos de MDR, aunque encontraron a lo largo de los 12 años de análisis que durante los primeros 8 años todas las cepas fueron sensibles, y durante los últimos años emergieron aislamientos resistentes.
En Europa, la resistencia de E. coli a cefalosporinas de tercera generación fue del 11,8% y a fluoroquinolonas del 22,3%. En EE. UU., los E. coli resistentes a quinolonas representan el 31,3% entre 2007 y 201015.
Aunque las ITU son más frecuentes en mujeres, las no sensibilidades lo son en el sexo masculino, tanto en el estudio previo de este grupo de trabajo8 como en el publicado por Aguinaga et al.16. Las no sensibilidades también se incrementan con la edad, tal como también observaron Guneysel O et al.17, que encontraron mayores resistencias a cefpodoxima, amoxicilina/ácido clavulánico y ciprofloxacino en mayores de 50 años de edad; y Chervet et al.18, que comunicaron mayores tasas de enterobacterias productoras de BLEE en ITU comunitarias asociadas con la edad avanzada como factor de riesgo.
Por otra parte, la no sensibilidad a carbapenemes es poco frecuente (<1%), aunque se duplicó en 2017 con relación a 2016, pero esas diferencias no son estadísticamente significativas. Al comparar estos datos con los obtenidos en el informe SOGAMIC para muestras invasoras (2015/2016)19, se observó que las no sensibilidades a carbapenemes en orinas son mayores en el año 2017. En el análisis de las muestras invasoras en el año 2017, se evidencia un 0,1% de aislamientos no sensibles a carbapenemasas, manteniéndose las cifras del informe previo20.
En los años 2011/2012 se había realizado un estudio previo que evaluó las ITU comunitarias por E. coli, aunque se analizaron menos antibióticos8, y se pudo observar que los E. coli no sensibles eran más frecuentes que en 2016/2017. Eso es debido fundamentalmente a que en este segundo estudio se analizó solo el primer aislamiento por paciente y año, tal y como recomienda la «Guía para preparación de informes acumulados de sensibilidades» que elaboró la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)21, lo cual pudo determinar ese descenso en la no sensibilidad. De todos modos, una limitación del estudio es que estos aislamientos podrían incluir casos con fallos en el tratamiento inicial, o más complejos o más graves o recidivas, ya que en la mayoría de las ITU comunitarias primarias no se realiza cultivo y antibiograma inicialmente. Esto hace que este segundo estudio quizás se acerque más a la realidad. Además, el origen de los pacientes, aunque de procedencia comunitaria, es variado, dado que algunos pueden estar institucionalizados, sondados, etc. Otra limitación de este estudio es la heterogeneidad de procedimientos para procesar las orinas entre los diferentes laboratorios, aunque esto se solventa dado que se emplearon métodos comerciales estandarizados y puntos de corte CLSI.
De nuestro estudio se deduce que la fosfomicina (preferentemente) y la nitrofurantoína, por su bajo porcentaje de no sensibilidad, tal y como sucedió en 2011/2012, continúan siendo el tratamiento empírico de elección en Galicia en las ITU comunitarias no complicadas en mujeres. Esto coincide con los patrones de susceptibilidad en Europa y EE. UU., donde son consideradas como fármacos de primera elección, en la mayoría de los países13,22. Aguinaga et al.16 también recomiendan la fosfomicina de forma empírica en varones menores de 15 años. En varones mayores de 15 años en nuestra zona, donde las resistencias a ciprofloxacino, amoxicilina/ácido clavulánico y cotrimoxazol son muy elevadas en varones (superiores al 20%), el tratamiento empírico podría hacerse con una cefalosporina de tercera generación oral23 tras la recogida de muestra de orina para cultivo y antibiograma. El tratamiento se ajustará después en función del antibiograma clásicamente dando prioridad a cotrimoxazol y a ciprofloxacino. Aunque esto puede cambiar, debido a que recientemente la European Medicines Agency (EMA) celebró una audiencia pública sobre los efectos secundarios potencialmente permanentes de las quinolonas, en la que recomendaba la restricción de su uso, lo cual será ratificado próximamente por la Comisión Europea24.
Debe tenerse en cuenta, además, que según la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), se han notificado reacciones adversas graves, especialmente pulmonares o hepáticas, en tratamientos profilácticos prolongados o intermitentes de meses de duración con nitrofurantoína, por lo cual la AEMPS25 recomienda utilizarla exclusivamente en el tratamiento de la cistitis aguda (durante un máximo de 7 días) en mujeres a partir de los 3 meses de edad. No está recomendado su uso profiláctico (más de 7 días) o en pautas intermitentes, y no está indicada en el tratamiento de ITU en varones, ni en infecciones de vías urinarias altas, bacteriemia o sepsis secundaria a la misma. Su uso está contraindicado en caso de insuficiencia renal con aclaramiento de creatinina inferior a 45ml/min. No obstante, se podría utilizar en pacientes con cifras de aclaramiento entre 30 y 44ml/min en casos de antecedentes o sospecha de infección por microorganismos multirresistentes con la vigilancia adecuada. Esta misma precaución debe tenerse en pacientes de edad avanzada por la posible alteración de la función renal. Debe informarse a los pacientes acerca de los riesgos pulmonares, hepáticos, alérgicos y neurológicos (parestesias y neuropatías periféricas) para que, en caso de aparición de los mismos, consulten al médico e interrumpan el tratamiento, que nunca será superior a 7 días.
- •
E. coli es el microorganismo más frecuente en infecciones urinarias comunitarias no complicadas.
- •
El tratamiento empírico en Galicia en mujeres indicaba en 2011/2012 fosfomicina o nitrofurantoína.
- •
Se recomienda conocer periódicamente cuál es el espectro de sensibilidad a los antimicrobianos de E. coli en áreas determinadas, con el fin de establecer el tratamiento empírico adecuado.
- •
En el período 2016/2017 el tratamiento empírico de las ITU comunitarias en mujeres continúa siendo fosfomicina (preferentemente) y nitrofurantoína. En varones menores de 15 años también se recomienda fosfomicina.
- •
Las resistencias de E. coli en ITU comunitarias son superiores al 20% para ciprofloxacino y cotrimoxazol, por lo cual en Galicia no pueden emplearse como tratamiento empírico.
- •
Aunque las ITU comunitarias son más frecuentes en mujeres, las resistencias a los antibióticos lo son en varones, por lo cual, para hombres mayores de 15 años, se recomienda el tratamiento empírico con cefalosporinas de 3.a generación orales, además de la realización de cultivo y antibiograma.
María González-Domínguez (Hospital Comarcal de Valdeorras).
Francisco José Vasallo Vidal (Complexo Hospitalario Universitario de Vigo).
Patricia Álvarez García (Complexo Hospitalario Universitario de Pontevedra).
Isabel Paz Vidal (Complexo Hospitalario Universitario de Ourense).
Fernanda Peña Rodríguez (Hospital Arquitecto Marcide de Ferrol).
Gael Naveira Barbeito (Dirección Xeral de Saúde Pública, Consellería de Sanidade, Xunta de Galicia).
Los autores declaran no tener conflicto de intereses.