Analizar si la nota informativa de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), de 30 de octubre del 2018, sobre agranulocitosis y metamizol contiene la información precisa y necesaria para proteger a los pacientes de la aparición de esta reacción adversa (RA) y si la documentación oficial de los medicamentos con metamizol para médicos, farmacéuticos y población general está adaptada a las directrices de la AEMPS para disminuir el riesgo.
Emplazamiento y participantesNota informativa, búsqueda bibliográfica, información sobre los medicamentos con metamizol comercializados en España en la Agencia Europea del Medicamento, fichas técnicas, prospectos, base de datos de información sanitaria Bot PLUS y Catálogo de Especialidades Farmacéuticas. Notificación de 4casos de agranulocitosis por metamizol posteriores a la fecha de la nota informativa.
Intervenciones y mediciones principalesComparación de los puntos clave de la nota informativa y de los documentos oficiales sobre metamizol con la bibliografía. Descripción de 4casos de agranulocitosis por metamizol y aplicación del algoritmo de causalidad y gravedad.
ResultadosLa nota informativa presenta ausencias y dudas respecto a la bibliografía y al uso de metamizol en la práctica asistencial. Los documentos oficiales presentan faltas de actualización, indicaciones no aprobadas y dosis superiores a las recomendadas. La nota informativa no ha frenado la presentación de casos de agranulocitosis por metamizol.
ConclusionesLa nota informativa de la AEMPS es mejorable y es necesario actualizar los documentos oficiales de información sobre el metamizol para profesionales sanitarios y pacientes para disminuir el riesgo de agranulocitosis.
To analyze whether the drug safety update issued by the Spanish Agency of Medicines and Healthcare Products (AEMPS), dated October 30, 2018, on agranulocytosis and metamizole contains accurate and necessary information to protect patients from the presentation of this adverse reaction (AR) and if the official documentation of medicines containing metamizole for doctors, pharmacists and the general population conforms to the guidelines of the AEMPS to reduce this risk.
Setting and participantsDrug safety update, bibliographic search, information at the European Medicines Agency on metamizole drugs marketed in Spain, technical datasheets, leaflets, Bot PLUS Health Information Database and Catalog of Pharmaceutical Specialties. Notification of 4cases of agranulocytosis due to metamizole after the drug safety update was issued.
Main interventions and measurementsComparison of the key points of the drug safety update and official documents on metamizole with the bibliography. Description of the 4cases of agranulocytosis due to metamizole and application of the causality and severity algorithm.
ResultsThe drug safety update contains omissions and contradiction in respect to the bibliography and the actual use of metamizole in healthcare practice. The official documents show a lack of updating, unapproved indications and doses higher than those recommended. The drug safety update has not stopped the presentation of cases of agranulocytosis due to metamizole.
ConclusionsThe AEMPS drug safety update can be improved and it is necessary to update the official information documents on metamizole for health professionals and patients in order to decrease the risk of agranulocytosis.
El metamizol (dipirona) es un derivado pirazolónico con efecto analgésico, antipirético y espasmolítico, comercializado en Alemania en el año 19221,2. Este fármaco, por su asociación con la agranulocitosis, fue retirado del mercado farmacéutico en 1965 en Australia, seguido de Dinamarca, Singapur, Jordania y Arabia Saudí. En Estados Unidos se retiró en 1977 y en Suecia en 19991. Sin embargo, sigue comercializado en países de América Central y del Sur, Europa, Asia y África3,4. En la Unión Europea está comercializado en 20países. En España se comercializó en los años 50 del siglo xx para el tratamiento del dolor agudo postoperatorio o postraumático, de tipo cólico o de origen tumoral, y para la fiebre alta que no responda a otras medidas terapéuticas; actualmente, está comercializado solo o en combinación y es el analgésico no opioide más utilizado tras el paracetamol5-7.
Desde julio del 2013, los ciudadanos pueden comunicar sospechas de reacciones adversas a medicamentos (RAM) directamente al Sistema Español de Farmacovigilancia (SEFV)8. En agosto del 2018, The Sunday Times9 se hacía eco de la agranulocitosis inducida por metamizol y de las consecuencias graves, incluso muertes, que afectaron a más de 100 turistas en España. Los británicos e irlandeses fueron señalados por su susceptibilidad aparentemente mayor que los españoles. Los casos fueron recopilados y notificados al SEFV por una traductora médica y jurídica (TMJ), después de una llamada en las redes sociales. De las 115 notificaciones de sospechas de RAM relacionadas con metamizol ocurridas entre 2001 y 2018, 79 correspondían a agranulocitosis (46 mujeres) con una media de edad de 64,9 años y 10 tenían desenlace fatal; 72 casos eran británicos. Estas RAM motivaron la nota informativa (NI) de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en octubre del 20186, que recuerda que los medicamentos con metamizol están sujetos a prescripción médica y hace recomendaciones para disminuir el riesgo de agranulocitosis. Sin embargo, los casos de agranulocitosis por metamizol siguen ocurriendo en España. Lo que hace pensar que la información de esta NI, como otras, es insuficiente y no incluye referencias a muchos de los estudios publicados10,11.
El objetivo de este trabajo es analizar si la NI de la AEMPS6 sobre agranulocitosis y metamizol contiene la información precisa y necesaria para proteger a los pacientes de la aparición de esta RAM y si la documentación de los medicamentos con metamizol disponibles para médicos, farmacéuticos y población general está adaptada a las directrices de la AEMPS que permita disminuir el riesgo de agranulocitosis o si, por lo contrario, quedan aspectos para optimizar su uso. En este sentido, presentamos 4casos de agranulocitosis relacionados con metamizol tras publicarse esta NI.
Material y métodosDiseñoSe trata de un estudio descriptivo comparativo. Analiza si la información de la NI de la AEMPS6 y los documentos oficiales para profesionales sanitarios y población general es concordante con la bibliografía. Se describen 4casos de sospecha de agranulocitosis por metamizol tras la publicación de la NI. La Comisión de Investigación del Departamento Salud Dénia autorizó el estudio el 8 de junio del 2020.
MedicionesLa búsqueda bibliográfica y la revisión de los documentos de los medicamentos que contienen metamizol se han actualizado el 18 de junio del 2020. Se han utilizado las fuentes de información siguientes:
- a.
Para la evaluación de la NI:
- –
MEDLINE. Se ha realizado una búsqueda bibliográfica mediante PubMed empleando una combinación de términos MESH y en texto libre: «metamizole or dipyrona and agranulocytosis» con la restricción de humanos.
- –
European Medicines Agency (EMA)5. Se han analizado las recomendaciones sobre metamizol.
- b.
Para evaluar la documentación disponible para profesionales sanitarios y población general:
- –
Ficha técnica. Información científica esencial del medicamento dirigida a los profesionales sanitarios12. Disponible en: https://cima.aemps.es/cima/publico/lista.html?multiple=metamizol
- –
Base de datos de información sanitaria Bot PLUS (disponible en: https://www.portalfarma.com/inicio/botplus20/Paginas/Bot-PLUS-2-0.aspx) y Catálogo de Especialidades Farmacéuticas del año 2019 (CEF)13. Información sobre los medicamentos de uso humano autorizados en España dirigida a profesionales farmacéuticos.
- –
Prospecto. Información similar a la ficha técnica, resumida y redactada de forma legible, dirigida al paciente12. Disponible en: https://cima.aemps.es/cima/publico/lista.html?multiple=metamizol
Los casos de sospechas de agranulocitosis por metamizol han sido notificados por la TMJ al SEFV a través de https://www.notificaram.es. Todos los pacientes dieron su consentimiento informado. El grupo investigador evaluó los casos a partir de las historias clínicas de alta hospitalaria. Las variables estudiadas fueron: datos del paciente (edad, sexo, antecedentes patológicos, medicación concomitante); datos del medicamento implicado (nombre del principio activo, grupo terapéutico, indicación, dosis, vía y periodo de administración) y datos de la RAM (aparatos y sistemas afectados, inicio y final de la reacción, periodo de latencia, reexposición, retirada del fármaco sospechoso, respuesta a la retirada, exploraciones complementaria, conocimiento de la RAM y causas alternativas). La plausibilidad clínica entre el metamizol y la RAM se estableció mediante el algoritmo de causalidad del SEFV que distingue 5categorías: improbable, condicional, posible, probable y definida14,15. La gravedad se determinó según la escala del SEFV en leve, moderada, grave, mortal o no codificable16.
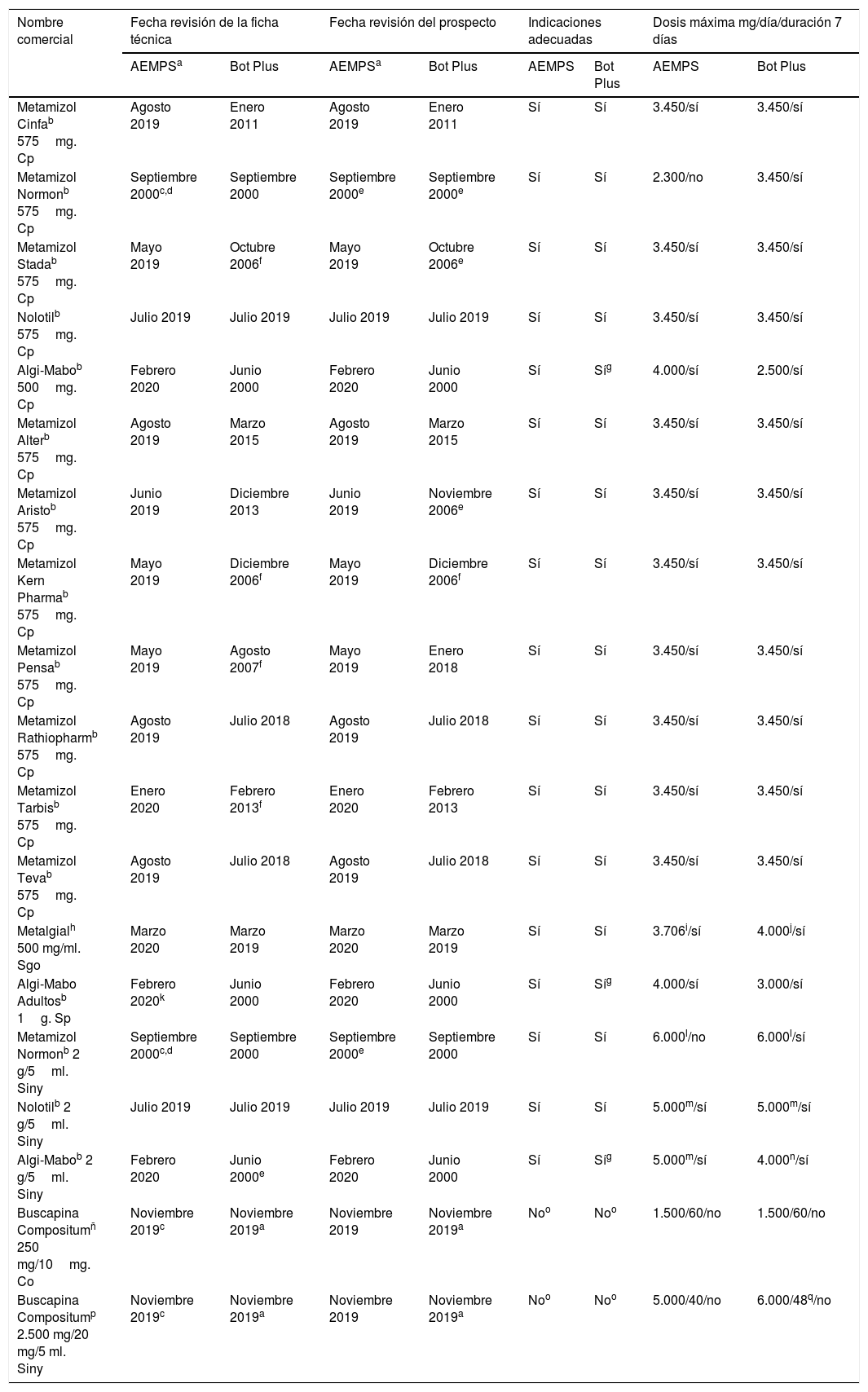
ResultadosLa búsqueda bibliográfica aportó 1.486 artículos; revisados título y resumen, se analizaron a texto completo 60 y se han seleccionado los más relevantes. En España, el metamizol está comercializado en 17 medicamentos como único principio activo y 2en asociación13 (tabla 1).
Revisión de la información en la ficha técnica y el prospecto de los medicamentos con metamizol comercializados en España, disponibles en la página web de la AEMPS y en el Bot Plus, en marzo del 2020, respecto a la nota informativa de la AEMPS de 30 de octubre del 2018 (Ref.: MUH [FV], 15/2018)
| Nombre comercial | Fecha revisión de la ficha técnica | Fecha revisión del prospecto | Indicaciones adecuadas | Dosis máxima mg/día/duración 7 días | ||||
|---|---|---|---|---|---|---|---|---|
| AEMPSa | Bot Plus | AEMPSa | Bot Plus | AEMPS | Bot Plus | AEMPS | Bot Plus | |
| Metamizol Cinfab 575mg. Cp | Agosto 2019 | Enero 2011 | Agosto 2019 | Enero 2011 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Normonb 575mg. Cp | Septiembre 2000c,d | Septiembre 2000 | Septiembre 2000e | Septiembre 2000e | Sí | Sí | 2.300/no | 3.450/sí |
| Metamizol Stadab 575mg. Cp | Mayo 2019 | Octubre 2006f | Mayo 2019 | Octubre 2006e | Sí | Sí | 3.450/sí | 3.450/sí |
| Nolotilb 575mg. Cp | Julio 2019 | Julio 2019 | Julio 2019 | Julio 2019 | Sí | Sí | 3.450/sí | 3.450/sí |
| Algi-Mabob 500mg. Cp | Febrero 2020 | Junio 2000 | Febrero 2020 | Junio 2000 | Sí | Síg | 4.000/sí | 2.500/sí |
| Metamizol Alterb 575mg. Cp | Agosto 2019 | Marzo 2015 | Agosto 2019 | Marzo 2015 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Aristob 575mg. Cp | Junio 2019 | Diciembre 2013 | Junio 2019 | Noviembre 2006e | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Kern Pharmab 575mg. Cp | Mayo 2019 | Diciembre 2006f | Mayo 2019 | Diciembre 2006f | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Pensab 575mg. Cp | Mayo 2019 | Agosto 2007f | Mayo 2019 | Enero 2018 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Rathiopharmb 575mg. Cp | Agosto 2019 | Julio 2018 | Agosto 2019 | Julio 2018 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Tarbisb 575mg. Cp | Enero 2020 | Febrero 2013f | Enero 2020 | Febrero 2013 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metamizol Tevab 575mg. Cp | Agosto 2019 | Julio 2018 | Agosto 2019 | Julio 2018 | Sí | Sí | 3.450/sí | 3.450/sí |
| Metalgialh 500 mg/ml. Sgo | Marzo 2020 | Marzo 2019 | Marzo 2020 | Marzo 2019 | Sí | Sí | 3.706i/sí | 4.000j/sí |
| Algi-Mabo Adultosb 1g. Sp | Febrero 2020k | Junio 2000 | Febrero 2020 | Junio 2000 | Sí | Síg | 4.000/sí | 3.000/sí |
| Metamizol Normonb 2 g/5ml. Siny | Septiembre 2000c,d | Septiembre 2000 | Septiembre 2000e | Septiembre 2000 | Sí | Sí | 6.000l/no | 6.000l/sí |
| Nolotilb 2 g/5ml. Siny | Julio 2019 | Julio 2019 | Julio 2019 | Julio 2019 | Sí | Sí | 5.000m/sí | 5.000m/sí |
| Algi-Mabob 2 g/5ml. Siny | Febrero 2020 | Junio 2000e | Febrero 2020 | Junio 2000 | Sí | Síg | 5.000m/sí | 4.000n/sí |
| Buscapina Compositumñ 250 mg/10mg. Co | Noviembre 2019c | Noviembre 2019a | Noviembre 2019 | Noviembre 2019a | Noo | Noo | 1.500/60/no | 1.500/60/no |
| Buscapina Compositump 2.500 mg/20 mg/5 ml. Siny | Noviembre 2019c | Noviembre 2019a | Noviembre 2019 | Noviembre 2019a | Noo | Noo | 5.000/40/no | 6.000/48q/no |
Co: comprimidos; Cp: cápsulas; Sgo: solución gotas orales; Siny: solución inyectable; Sp: supositorios.
No incluye la frase «No usar en pacientes si no es posible realizar controles (p. ej., población flotante).
El apartado de información sobre farmacocinética corresponde a la administración oral o intravenosa y no hay ninguna información sobre la administración rectal.
Dolor crónico oncológico 6.000 mg/24 h, puede administrarse vía oral.
ñ 250mg de metamizol sódico + 10mg de butilbromuro de escopolamina.
La NI de la AEMPS6 presenta ausencias y dudas respecto a la bibliografía3,4,7,9,17-21 y al uso de metamizol en la práctica asistencial (tabla 2), entre otros: se prescribe para dolor crónico (pautas de larga duración), los controles hematológicos supondrían un elevado consumo de recursos, no incluye como factor de riesgo de agranulocitosis las alergias, la edad como factor de riesgo de agranulocitosis es confusa y la referencia a población flotante es ambigua (no incluye a población británica empadronada).
Revisión de la información de la nota informativa de la AEMPS de 30 de octubre del 2018. Metamizol y riesgo de agranulocitosis (Ref.: MUH [FV], 15/2018) con respecto a la bibliografía y a la práctica clínica
| Información o recomendación de la nota | Comentarios |
|---|---|
| Medicamentos sujetos a prescripción | – En las oficinas de farmacia habitualmente se dispensa sin receta (contrastado por el grupo investigador)a |
| Utilizar metamizol solo para tratamientos de corta duración (7 días como máximo) dentro de las indicaciones autorizadasb y a las dosis mínimas eficaces | – La alerta no incluye las indicaciones autorizadas lo que puede favorecer la prescripción de metamizol para cualquier tipo de dolora– Es habitual la prescripción a pacientes con dolor crónico osteomuscular y cefalea con pautas de larga duracióna– Hay series de casos de agranulocitosis relacionadas con metamizol que se presentan en la primera semana de tratamientoc,d |
| Si es necesario un tratamiento más prolongado, realizar controles hematológicos periódicos, incluyendo fórmula leucocitaria | – A partir del día 7de tratamiento hay que hacer analítica; no se hace habitualmente y supondría una elevada carga asistencial en atención primaria y un considerable impacto económico dado su elevado consumoe– No se especifica la frecuencia de realización de los controles hematológicos |
| Durante el tratamiento, vigilar la aparición de sintomatología indicativa de agranulocitosis, informando a los pacientes que, en tal caso, suspendan el tratamiento | – Es frecuente el uso de metamizol a nivel de urgencias hospitalarias y de hospitalizaciones cortas o intervenciones ortopédicas sin ingreso en las que, tras el alta, no se suele hace ningún seguimiento– En el alta hospitalaria no suelen constar los fármacos prescritos durante el ingreso hospitalario |
| Antes de prescribir metamizol, realizar una anamnesis detallada para evitar su uso en pacientes con antecedentes de reacciones de hipersensibilidad o hematológicas a metamizol, pacientes con tratamiento inmunosupresor o con medicamentos que pueden producir agranulocitosis | – Alergias generales o a cualquier fármaco son factores de riesgo de agranulocitosis por metamizolf– El metamizol como analgésico se prescribe habitualmente para pacientes con enfermedades reumatológicas con dolor crónicoa y pacientes con dolor oncológico (indicación aprobada) que habitualmente están con tratamientos inmunosupresores o citostáticos que incrementan el riesgo de agranulocitosis |
| Adoptar especial precaución en casos de pacientes de edad avanzada | – No especifica qué se entiende por edad avanzada– Hay series publicadas de agranulocitosis por metamizol en las que la media de edad es inferior a 60 añosf,g,h– También puede producirse la agranulocitosis por metamizol en niñosh |
| No utilizar metamizol en pacientes en los que no sea posible realizar controles (p. ej., población flotante) | – Afirmación difícil de concretar y menos el ejemplo de población flotante– Es más apropiado referirse a población no empadronada y sin médico asignado en Atención Primaria |
| Con la información disponible no se puede ni descartar ni confirmar un mayor riesgo en poblaciones con características étnicas específicas | – Hay características genéticas que predisponen a un mayor riego a padecer agranulocitos por metamizoli– Los casos notificados por la TMJ al SEFV son muy significativos de una mayor sensibilidad de agranulocitosis por metamizol en británicos, hecho avalado por la bibliografiaj,k– Se desconocen los datos de la base FEDRA dado que las «tarjetas amarillas» no recogen esta información |
FEDRA: Farmacovigilancia Española Datos de Reacciones Adversas; TMJ: traductora médica jurídica; SEFV: Sistema Español de Farmacovigilancia.
La información de la ficha técnica y el prospecto de estos medicamentos respecto a la NI y a la bibliografía (tabla 1) presenta particularidades a reseñar6,12: no mencionan «no usar en pacientes si no es posible realizar controles», ningún prospecto deja claro que es medicamento sujeto a prescripción, las fichas técnicas y los prospectos de Metamizol Normon® y Buscapina Compositum® (Laboratorio Reig Jofré, S.A., St. Joan Despí, Barcelona, España) no incluyen la necesidad de receta médica y que es para uso a corto plazo, y ambos documentos de Metamizol Normon® no están actualizados.
La información del Bot PLUS (tabla 1) muestra, entre otros, que solo 5fichas técnicas y prospectos están actualizados, las presentaciones de Algi-Mabo® (Mabo-Farma, S.A., Madrid, España) incluyen indicaciones no aprobadas y las de Buscapina Compositum® no mencionan «no usar en pacientes si no es posible realizar controles».
El CEF para metamizol recoge la información textual de la NI6,13. Pero incluye indicaciones no aprobadas para todos los medicamentos, las presentaciones parenterales para Nolotil® (Boehringer Ingelheim España, S.A.) y Metamizol Normon® superan la dosis diaria máxima recomendada, para el metamizol en asociación la información no se adecua a la NI y la presentación parenteral supera la dosis diaria máxima recomendada5.
Estas 4fuentes de información recomiendan la administración por «vía oral» para el tratamiento del dolor oncológico de todas las presentaciones parenterales y la dosis diaria máxima recomendada supera los 6.000mg. Las presentaciones de Buscapina Compositum® indicadas para el dolor cólico biliar o renal mantienen las indicaciones de «tratamiento del dolor postoperatorio o postraumático moderado o intenso» y la dosis diaria máxima recomendada supera los 5.000mg5.
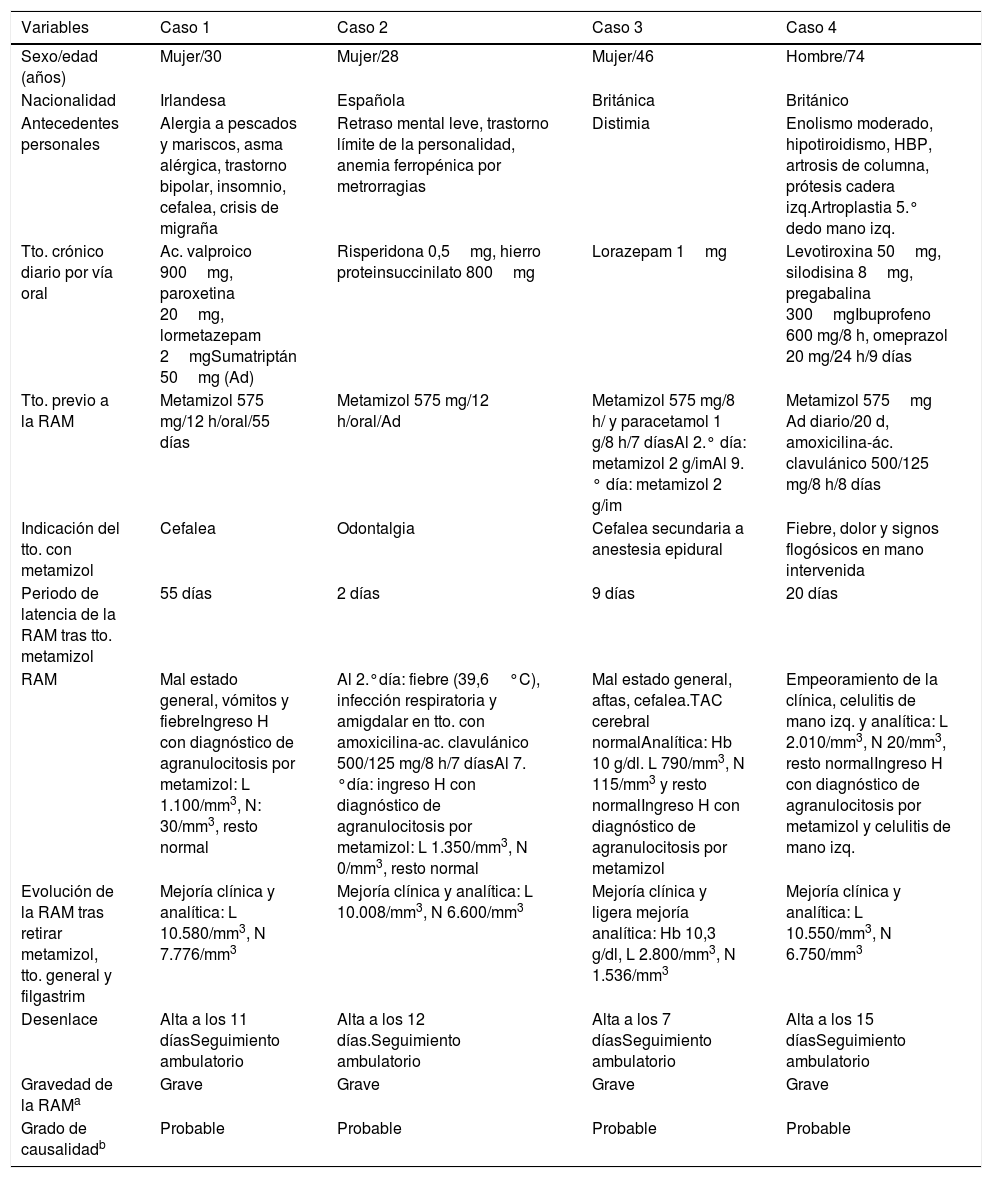
Las características clínicas de los 4pacientes con sospecha de agranulocitosis por metamizol comunicados se recogen en la tabla 3. Tres pacientes son mujeres. Dos son de nacionalidad británica, una irlandesa y una española. La media de edad ± desviación estándar es de 44,5 ± 21,3 años. La indicación del metamizol en 3pacientes fue fuera de indicación autorizada (off-label) y la duración del tratamiento superior a la recomendada en 3. Los 4casos son graves y el grado de imputabilidad del metamizol como responsable de la RAM es probable.
Características clínicas de los pacientes con sospecha de agranulocitosis relacionados con metamizol
| Variables | Caso 1 | Caso 2 | Caso 3 | Caso 4 |
|---|---|---|---|---|
| Sexo/edad (años) | Mujer/30 | Mujer/28 | Mujer/46 | Hombre/74 |
| Nacionalidad | Irlandesa | Española | Británica | Británico |
| Antecedentes personales | Alergia a pescados y mariscos, asma alérgica, trastorno bipolar, insomnio, cefalea, crisis de migraña | Retraso mental leve, trastorno límite de la personalidad, anemia ferropénica por metrorragias | Distimia | Enolismo moderado, hipotiroidismo, HBP, artrosis de columna, prótesis cadera izq.Artroplastia 5.° dedo mano izq. |
| Tto. crónico diario por vía oral | Ac. valproico 900mg, paroxetina 20mg, lormetazepam 2mgSumatriptán 50mg (Ad) | Risperidona 0,5mg, hierro proteinsuccinilato 800mg | Lorazepam 1mg | Levotiroxina 50mg, silodisina 8mg, pregabalina 300mgIbuprofeno 600 mg/8 h, omeprazol 20 mg/24 h/9 días |
| Tto. previo a la RAM | Metamizol 575 mg/12 h/oral/55 días | Metamizol 575 mg/12 h/oral/Ad | Metamizol 575 mg/8 h/ y paracetamol 1 g/8 h/7 díasAl 2.° día: metamizol 2 g/imAl 9.° día: metamizol 2 g/im | Metamizol 575mg Ad diario/20 d, amoxicilina-ác. clavulánico 500/125 mg/8 h/8 días |
| Indicación del tto. con metamizol | Cefalea | Odontalgia | Cefalea secundaria a anestesia epidural | Fiebre, dolor y signos flogósicos en mano intervenida |
| Periodo de latencia de la RAM tras tto. metamizol | 55 días | 2 días | 9 días | 20 días |
| RAM | Mal estado general, vómitos y fiebreIngreso H con diagnóstico de agranulocitosis por metamizol: L 1.100/mm3, N: 30/mm3, resto normal | Al 2.°día: fiebre (39,6°C), infección respiratoria y amigdalar en tto. con amoxicilina-ac. clavulánico 500/125 mg/8 h/7 díasAl 7. °día: ingreso H con diagnóstico de agranulocitosis por metamizol: L 1.350/mm3, N 0/mm3, resto normal | Mal estado general, aftas, cefalea.TAC cerebral normalAnalítica: Hb 10 g/dl. L 790/mm3, N 115/mm3 y resto normalIngreso H con diagnóstico de agranulocitosis por metamizol | Empeoramiento de la clínica, celulitis de mano izq. y analítica: L 2.010/mm3, N 20/mm3, resto normalIngreso H con diagnóstico de agranulocitosis por metamizol y celulitis de mano izq. |
| Evolución de la RAM tras retirar metamizol, tto. general y filgastrim | Mejoría clínica y analítica: L 10.580/mm3, N 7.776/mm3 | Mejoría clínica y analítica: L 10.008/mm3, N 6.600/mm3 | Mejoría clínica y ligera mejoría analítica: Hb 10,3 g/dl, L 2.800/mm3, N 1.536/mm3 | Mejoría clínica y analítica: L 10.550/mm3, N 6.750/mm3 |
| Desenlace | Alta a los 11 díasSeguimiento ambulatorio | Alta a los 12 días.Seguimiento ambulatorio | Alta a los 7 díasSeguimiento ambulatorio | Alta a los 15 díasSeguimiento ambulatorio |
| Gravedad de la RAMa | Grave | Grave | Grave | Grave |
| Grado de causalidadb | Probable | Probable | Probable | Probable |
Ac: ácido; Ad: a demanda; AP: Atención Primaria; h: hora; H: hospital; Hb: hemoglobina; HBP: hipertrofia benigna de próstata; im: intramuscular; izq.: izquierda; L: leucocitos; N: neutrófilos; RAM: reacción adversa a medicamento; TAC: tomografía axial computarizada; tto.: tratamiento.
La NI sobre metamizol y riesgo de agranulocitosis de la AEMPS6, que pretendía mejorar la seguridad en el uso de este fármaco, tras el análisis de la documentación disponible y de la bibliografía, no contiene la información precisa y necesaria para proteger a los pacientes de la aparición de esta RAM (tabla 2). Además, las fuentes oficiales de información sobre metamizol para profesionales sanitarios y pacientes presentan deficiencias que facilitan la utilización inadecuada de este fármaco (tabla 1). La utilización de metamizol sigue incrementándose en España, lo que es bien conocido que se acompaña de un aumento de los casos de agranulocitosis4,7,19,22.
Las inexactitudes del contenido de la NI (tabla 1) suscitan la continuidad de una práctica clínica que perpetúa la inseguridad de este fármaco, por:
- a.
Falta de especificación de algunas recomendaciones. No incluye las indicaciones aprobadas, lo que facilita que se utilice para cualquier tipo de dolor, como sucede en otros países y en 3de los casos de agranulocitosis descritos4; no incluye como factores que incrementan el riesgo de agranulocitosis antecedentes de alergias generales o a cualquier fármaco19; los controles analíticos periódicos recomendados en tratamientos de más de 7 días no son realistas con relación al gran consumo de este fármaco7,19,22; además, la agranulocitosis aparece en el 40% de casos en la primera semana de tratamiento4; la «edad avanzada» es un término desacertado ya que se puede entender como 65 o más años y la edad media referida en la bibliografía para padecer esta RAM es inferior a 60 años por lo que, para intentar reducir el riesgo, no debería excluirse a ningún grupo de edad3,4,18,19, y la recomendación de «no utilizar metamizol en pacientes en los que no sea posible realizar controles (p. ej., población flotante)» es ambigua y no restringe su uso en ningún paciente en la práctica clínica.
- b.
Falta de control de las recomendaciones. Aunque son medicamentos sujetos a prescripción médica, en la práctica se dispensan en las oficinas de farmacia sin solicitud de receta, lo que aumenta su utilización off-label (tabla 2) y hay una falta de control de documentos oficiales que incluyen indicaciones no aprobadas y dosis máximas superiores a las recomendadas, aspectos que incrementan la toxicidad5,23.
- c.
Esta NI6 surge de un incremento de notificaciones de agranulocitosis por metamizol, la mayor parte en población británica (país donde no está comercializado por esta RAM)9. Está descrita una mayor susceptibilidad en poblaciones del norte de Europa17,21; sin embargo, la NI no restringe el uso de metamizol en ninguna población, lo que expone a un riesgo innecesario a los británicos que nos visitan cada año (https://es.statista.com/estadisticas/475100/numero-de-turistas-britanicos-en-espana/#statisticContainer) o a los empadronados en España (https://www.ine.es/jaxi/Tabla.htm?path=/t20/e245/p08/l0/&file=02005.px&L=0).
La NI de la AEMPS6 para considerar la frecuencia de agranulocitosis por metamizol evita citar artículos que describen frecuencias más altas17 y cita una de las más bajas24. La incidencia de esta RAM varía ampliamente según los estudios analizados, con cifras que van desde 1/1.439 pacientes ambulatorios tratados en Suecia17 hasta 1/1.000.000 de usuarios y semana de tratamiento25, que se podrían explicar por la metodología utilizada, por diferencias clínicas en el uso de metamizol o genéticas o étnicas3,17,25-27. La incidencia de agranulocitosis por metamizol sigue siendo motivo de preocupación y, actualmente, se ha puesto el foco de atención en si las características genéticas de británicos, suecos o escandinavos pudieran ser una de las causas de incremento del riesgo3,17,20,21,24,26,28,29. Sin embargo, la NI soslaya el estudio de Mérida Rodrigo et al.21, que describen un incremento del riesgo de padecer esta RAM en población británica 2,5 veces superior a la población general censada en Marbella, y alega que no hay datos que confirmen este hecho.
La ficha técnica es el documento oficial y legal que incluye todas las condiciones de uso autorizadas por la AEMPS para un medicamento12. Es de especial relevancia para los profesionales médicos y farmacéuticos conocer este hecho ya que establece las circunstancias en las que se puede prescribir o dispensar un medicamento. La información dirigida a los profesionales sanitarios por la ficha técnica y a los pacientes por el prospecto debe contener y garantizar la información de un medicamento autorizado12,30, por tanto, han de reflejar el contenido de la NI. El hecho de que existan documentos de medicamentos con metamizol que no estén actualizados respecto a que son de prescripción médica y de uso para tratamientos de corta duración (7 días como máximo)5,6 favorece su utilización off-label, tratamientos prolongados y riesgo de RAM23. Todas las presentaciones inyectables exceden las dosis máximas diarias recomendadas, lo que incumple las recomendaciones europeas y puede condicionar mayor toxicidad5. Ninguno de estos documentos oficiales incluye la frase de «no usar en pacientes si no es posible realizar controles (p. ej., población flotante)», lo que resta importancia a este punto de la NI que tiene una trascendencia clave para la seguridad del metamizol6,30.
Respecto a la información dirigida a profesionales farmacéuticos, el Bot PLUS y el CEF incluyen la necesidad de receta médica para su dispensación y la recomendación de «No usar en pacientes si no es posible realizar controles», lo que discrepa con la práctica habitual de dispensar estos medicamentos sin receta (tabla 2). En el Bot PLUS la información obtenida de las fichas técnicas y prospectos de los medicamentos a través del acceso directo on-line no está actualizada en 14medicamentos con metamizol y en algunos medicamentos difieren de la información de estos documentos accesibles a través del portal web de la AEMPS, lo que crea confusión entre profesionales y usuarios favoreciendo un uso irracional del metamizol. El CEF incluye indicaciones no autorizadas (dismenorrea y odontalgia) para todos los medicamentos con metamizol, al igual que el Bot PLUS en todas las presentaciones de Algi-Mabo®, que facilitan la utilización off-label del metamizol, con incremento del riesgo de RAM e interacciones farmacológicas4,23.
Buscapina Compositum® (metamizol sódico en asociación con butilbromuro de escopolamina) pertenece a un grupo terapéutico distinto (A03DB) del grupo del metamizol solo (N02BB) y probablemente esta sea la causa de que no esté actualizada la información y merme la seguridad del paciente.
La notificación espontánea de RAM es el pilar de la farmacovigilancia que ha mejorado de forma importante la seguridad de los medicamentos; la participación de los ciudadanos en la notificación de sospechas de RAM facilita la transparencia y la comunicación sobre la seguridad de los mismos8,31. La comunicación de casos de RAM relacionadas con metamizol por la TMJ ha supuesto una aportación importante al SEFV que ha motivado la NI sobre agranulocitosis y metamizol6,9,29. Sin embargo, esta NI no parece haber sido lo suficientemente eficaz para conseguir su objetivo y evitar nuevos casos de agranulocitosis por este fármaco, como ilustra el presente trabajo. La notificación de estos casos presenta relevancia clínica alta31 por la gravedad de la RAM, porque puede ayudar a modificar la práctica clínica y contribuir a que se tomen medidas administrativas sobre la utilización del metamizol para mejorar la seguridad de los pacientes.
Las principales limitaciones del estudio son la falta de referencias bibliográficas en la NI que genera dudas sobre las recomendaciones tomadas y dificulta su evaluación10,11, la infranotificación de casos de agranulocitosis por metamizol que impide el conocimiento real del problema32, el desconocimiento de los pacientes a riesgo de consumirlo y los posibles cambios en los hábitos de prescripción consecuencia de la NI.
La ausencia de conocimiento no indica que no exista un incremento del riesgo en una población determinada18,33 y, por tanto, hasta tener esa información, estaría justificado no prescribir el metamizol a pacientes de países en los que no está autorizado el metamizol por el riesgo de agranulocitosis. En conclusión, la NI es mejorable en los aspectos comentados y sería necesario actualizar los documentos oficiales de información sobre el metamizol para profesionales sanitarios y pacientes.
- –
La notificación de sospechas de casos de agranulocitosis relacionados con metamizol al Sistema Español de Farmacovigilancia motivó la nota informativa de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en octubre del 2018.
- –
La Nota Informativa de la AEMPS recuerda que el metamizol es de prescripción médica y hace recomendaciones para disminuir el riesgo de agranulocitosis.
- –
The Sunday Times se hizo eco de los casos de agranulocitosis inducida por metamizol, y de la aparente mayor susceptibilidad de los británicos respecto a los españoles.
- –
La nota informativa deja importantes lagunas y es mejorable para disminuir el riesgo de agranulocitosis por metamizol.
- –
Es necesario actualizar los documentos oficiales de información sobre el metamizol para profesionales sanitarios y pacientes para disminuir el riesgo de agranulocitosis.
- –
La nota informativa no clarifica el incremento de riesgo de agranulocitosis por metamizol para población británica y se siguen produciendo casos nuevos en España.
Todos los autores declaramos que hemos leído y aprobado el manuscrito y que los requisitos para la autoría se han cumplido. Además, nos responsabilizamos de su contenido, que ha sido revisado y aprobado por todos los autores.
Así mismo, declaramos no tener ninguna fuente de financiación ni conflicto de interés con su contenido.
Los autores agradecen la ayuda técnica prestada, en la búsqueda y la localización de la bibliografía, a Juan M. de la Cámara, bibliotecario del Hospital Universitario La Ribera.