Brolucizumab, un anti-VEGF de nueva generación, ha demostrado su eficacia y seguridad en la degeneración macular asociada a la edad neovascular exudativa (DMAEn) en los ensayos pivotales HAWK y HARRIER. Tras su comercialización, se han reportado eventos adversos relacionados con la inflamación intraocular no detectados previamente. Una revisión post hoc independiente de los ensayos pivotales cifra la tasa de inflamación intraocular (IIO) en el 4,6%. El objetivo de este trabajo es proponer una serie de recomendaciones para implementar el manejo de brolucizumab en la práctica clínica.
MétodoLas recomendaciones realizadas por los autores se han basado en su experiencia clínica y en la revisión crítica de: 1)los ensayos pivotales; 2)el análisis post hoc del Comité de Revisión de Seguridad, y 3)la literatura publicada.
ResultadosEn los ensayos pivotales, brolucizumab mostró ganancias funcionales sostenidas, resultados anatómicos superiores con intervalos entre inyecciones potencialmente más prolongados y un perfil de seguridad global bien tolerado. Los eventos adversos reportados tras la comercialización incluyen vasculitis retiniana y la oclusión vascular retiniana. De acuerdo con la información disponible, los expertos recomiendan: 1)descartar los perfiles de pacientes no recomendados (historial previo de IIO); 2)explorar al paciente antes de cada inyección para descartar la presencia de IIO activa; 3)monitorizar al paciente para detectar precozmente los signos de alerta, y 4)tratar de inmediato en el caso de que se desarrolle algún evento adverso.
ConclusionesLos eventos adversos reportados son poco frecuentes, pero pueden estar asociados con una pérdida severa e irreversible de agudeza visual. Las recomendaciones realizadas pretenden facilitar el manejo de brolucizumab en la práctica habitual de los retinólogos, garantizar la seguridad del paciente y, en caso de que se produzca alguno de los eventos adversos, minimizar su impacto sobre la visión.
Brolucizumab, a new generation anti-VEGF, has demonstrated efficacy and safety in AMD in the pivotal HAWK and HARRIER trials. Post-marketing, previously undetected adverse events related to intraocular inflammation have been reported. An independent post hoc review of the pivotal trials puts the rate of intraocular inflammation (IOI) at 4.6%. The aim of this paper is to propose a set of recommendations for implementing the management of brolucizumab in clinical practice.
MethodThe recommendations made by the authors are based on their clinical experience and critical review of (i)the pivotal trials; (ii)the post-hoc analysis of the Safety Review Committee, and (iii)the published literature.
ResultsIn the pivotal trials, brolucizumab showed sustained functional gains, superior anatomical outcomes with potentially longer intervals between injections and a well-tolerated overall safety profile. Adverse events reported post-marketing include retinal vasculitis and retinal vascular occlusion. Based on the available information, experts recommend (i)ruling out non-recommended patient profiles (prior history of ORI); (ii)screening the patient prior to each injection to rule out active IOI; (iii)monitoring the patient for early warning signs, and (iv)treating immediately should any adverse events develop.
ConclusionsThe adverse events reported are rare, but may be associated with severe and irreversible loss of visual acuity. The recommendations made are intended to facilitate the management of brolucizumab in the routine practice of retinologists, to ensure patient safety and, should any adverse events occur, to minimise their impact on vision.
El desarrollo de la terapia anti-VEGF (por sus siglas en inglés, vascular endothelial growth factor) supuso un cambio en el paradigma del tratamiento de la degeneración macular asociada a la edad neovascular exudativa (DMAEn)1,2. Desde su aparición en 2006, la incidencia de la ceguera entre los pacientes con DMAEn se ha reducido en más de un 50%3-6. Sin embargo, todavía existen importantes necesidades no cubiertas en el manejo de la DMAEn. Actualmente, la evidencia en práctica clínica real en España con pacientes con DMAEn demuestra que casi el 70% de los intervalos entre visitas al especialista y casi el 50% de los intervalos entre inyecciones no son superiores a 8semanas tras 2años de seguimiento7. Esto supone una elevada carga de la enfermedad para clínicos, pacientes y cuidadores8, pudiendo repercutir en el apropiado seguimiento y tratamiento de los pacientes, y abocando a muchos a una situación de infratratamiento con ganancias subóptimas de agudeza visual9. Además, a pesar de que la presencia de fluido en la retina se considera como criterio de retratamiento por las principales sociedades científicas10-13, la evidencia en práctica clínica real demuestra que más del 50% de los ojos de pacientes con DMAEn presentan fluido persistente después de 2años de seguimiento14, manteniéndose todavía en el 35% tras una década de tratamiento15.
Brolucizumab es un anticuerpo de cadena sencilla que se desarrolló con el propósito de ejercer un efecto más potente y duradero sobre la neovascularización macular para reducir la periodicidad de las inyecciones y, por tanto, disminuir la carga de la enfermedad16. La eficacia de brolucizumab quedó demostrada en sus ensayos pivotales HAWK y HARRIER, la evidencia clínica más reciente y robusta sobre el fármaco en DMAEn. Brolucizumab 6mg mostró no inferioridad en la ganancia de agudeza visual con respecto a aflibercept en la semana48 (objetivo primario), ganancia que fue mantenida en el tiempo hasta la semana96. En la semana16, tras la fase de carga (mismo número de inyecciones para ambos fármacos), el brazo de brolucizumab mostró un menor porcentaje de pacientes con presencia de actividad de la enfermedad. Brolucizumab 6mg fue superior a aflibercept en cuanto a la mejora anatómica de la retina a las semanas16 y48, manteniéndose los resultados hasta la semana96: reducción del grosor central de la retina (GCR) y resolución del fluido intrarretiniano (FIR)/subretininano (FSR) y por debajo del epitelio pigmentario de la retina (sub-EPR). Estos resultados se obtuvieron con más del 50% de los pacientes tratados con brolucizumab en un intervalo cada 12semanas inmediatamente después de la fase de carga hasta el primer año. Más del 75% de estos pacientes se mantuvo en un intervalo cada 12semanas hasta el final del estudio17,18.
Brolucizumab 6mg mostró una tasa de inflamación intraocular (IIO) más elevada que aflibercept 2mg (4,5% frente al 0,9%). Más del 90% de los casos de IIO fueron leves o moderados y el 85,3% se resolvieron sin secuelas. Los eventos de oclusión arterial retiniana (OAR) presentaron una tasa del 0,9%. Sin embargo, la proporción de pacientes que perdieron ≥15letras fue similar con ambos fármacos a la semana96. Al cierre de ambos estudios, brolucizumab mostró un perfil de seguridad global bien tolerado17,18. Desde entonces, brolucizumab ha sido aprobado en más de 70 países en todo el mundo.
En febrero de 2020, la Sociedad Americana de Especialistas en Retina (American Society of Retinal Specialists [ASRS]) presentó una actualización de seguridad que detallaba 14 casos de vasculitis retiniana (VR) en pacientes tratados con brolucizumab (tras la comercialización aproximada de 46.000 inyecciones del fármaco), de los cuales, 11 se reportaron con presencia de oclusión vascular retiniana (OVR)19. Desde entonces, Novartis ha recibido informes posteriores a la comercialización de eventos adversos asociados con IIO (EAAI) poco comunes de VR y OVR tras la administración de brolucizumab20-24. En marzo de 2021, la tasa de incidencia post-comercialización de VR y/o OVR era de 15,6 por cada 10.000 inyecciones25, equivalente al 0,16% de los tratamientos vendidos. En respuesta a estos informes, Novartis conformó un Comité de Revisión de Seguridad (Safety Review Committee [SRC]) formado por 9 miembros, que comprenden especialistas mundiales en retina y uveítis, expertos en oftalmología e imagen de dos comités de monitorización de datos externos, y un observador independiente de la ASRS. El propósito del SRC fue proporcionar una revisión post hoc independiente y desenmascarada de los eventos de IIO, endoftalmitis y OVR detectados en los estudios HAWK y HARRIER. El SRC revisó todas las imágenes de los pacientes (60ojos), determinó si los eventos adversos estaban relacionados con el fármaco o no y los clasificó como IIO, VR y/o OVR, independientemente de la terminología de la versión del Medical Dictionary for Regulatory Activities [MedDRA]) utilizada en los ensayos. El SRC concluyó que cualquier forma de IIO fue identificada en 50 de los 1.088 ojos tratados con brolucizumab (4,6%, similar a la encontrada en los estudios HAWK y HARRIER). De estos 50 ojos con IIO, 36 ojos tenían VR concomitante (3,3%), de las cuales 23 tenían OVR concomitante (2,1%). A pesar del riesgo de pérdida de la visión asociada a estos eventos después de la inyección de brolucizumab, la incidencia global de pérdida de visión moderada debido a IIO siguió siendo baja (0,7%) y la proporción de pacientes que perdieron ≥15letras fue similar entre ambos brazos de tratamiento (brolucizumab, 7,4%; aflibercept, 7,7%)26. Debido a estos hallazgos, se actualizó la ficha técnica de brolucizumab27. En la Unión Europea, esta actualización incluye los términos «vasculitis retiniana» y/u «oclusión vascular retiniana», normalmente en presencia de inflamación intraocular, en las secciones 4.4 (advertencias y precauciones especiales de uso) y 4.8 (efectos indeseados)28. La ficha técnica advierte que los pacientes que desarrollen estos eventos deberían interrumpir el tratamiento y los EAAI deberían ser tratados de inmediato28.
Hasta la fecha se han dado a conocer los primeros estudios de evidencia en práctica clínica real sobre la eficacia y la seguridad de brolucizumab. Gracias a las bases de datos estadounidenses IRIS y Komodo se han podido realizar dos estudios observacionales retrospectivos sobre la seguridad de brolucizumab durante 6meses en pacientes mayoritariamente pre-tratados. Las tasas detectadas de los EAAI en ambos estudios fueron del 2,4% para la IIO (incluyendo VR) y/o OVR y del 0,6% para VR y/o OVR. Ambos registros contaron con tamaños poblacionales similares (IRIS, 10.654; Komodo, 11.161) y resultados consistentes entre ellos e inferiores a los de los estudios pivotales29. Sin embargo, ambos estudios presentan ciertas limitaciones: 1)puede haber pacientes duplicados entre estudios; 2)no existe acceso a las historias clínicas de los pacientes; 3)algún EAAI pudo no haber sido reportado; 4)el seguimiento fue únicamente de 6meses, y 5)la relación causal entre la administración de brolucizumab y el EAAI no se pudo determinar.
Otros estudios observacionales más recientes, aunque con tamaños poblacionales menores, han concluido resultados más dispares: desde no reportar EAAI30-32 a reportar eventos inflamatorios leves con resolución espontánea33,34 o eventos inflamatorios de mayor severidad, pero con tasas variadas35-42. Toda esta evidencia en práctica clínica reportada hasta el momento también refleja que el tratamiento con brolucizumab resulta en una mejora anatómica en todos los tipos de pacientes (naïve y pre-tratados), favoreciendo la mejora de la agudeza visual en pacientes naïve y su estabilización, o incluso su aumento34,41,42, en pacientes pre-tratados con intervalos más largos33,39-42.
Aunque los eventos de inflamación ocular han sido ampliamente reportados en el tratamiento anti-VEGF para la DMAEn43-55, la evidencia de casos no infecciosos de VR u OVR es limitada56-59. Por ello, Novartis creó un grupo de trabajo internacional (think tank) para conocer las causas subyacentes del EAAI, las características de los pacientes con un riesgo elevado a sufrir EAAI y cómo prevenir, mitigar y tratar los EAAI. Aunque son poco frecuentes, estos eventos pueden estar asociados con una pérdida de visión de moderada a grave26. En este trabajo se proponen una serie de recomendaciones basadas en la evidencia publicada y la experiencia de los autores para implementar el manejo de brolucizumab en la práctica clínica habitual de los retinólogos, garantizar la seguridad del paciente y, en el caso de que se produzcan los EAAI, minimizar su impacto sobre la visión.
Perfil de paciente y estratificación del beneficio-riesgo de brolucizumabLa información sobre el perfil de paciente de riesgo todavía es limitada; sin embargo, se han dado a conocer ya las primeras evidencias sobre la etiología del EAAI vinculado al uso de brolucizumab. Su inicio tardío (de media, 166días desde el inicio del tratamiento o 20días desde la última inyección de brolucizumab) sugería una causa de naturaleza inmunitaria25. Algunos de los casos publicados independientemente han sugerido que la inflamación tras la inyección de brolucizumab podría estar causada por anticuerpos locales que pueden conducir a la formación de complejos inmunes que, a través de un mecanismo de hipersensibilidad retardada, podrían provocar la vasculitis. En este sentido, un reciente estudio (BASICHR0049) ha mostrado que las muestras de sangre de algunos pacientes con VR y/u OVR presentan: 1)mayores niveles de anticuerpos anti-fármaco neutralizantes; 2)linfocitosT que se activan tras ser expuestos a brolucizumab, y 3)mayor agregación plaquetaria en presencia de brolucizumab y concentraciones de VEGF-A por encima de las fisiológicas28. Los autores del trabajo sugieren que estos complejos inmunes podrían estar formados por anticuerpos anti-fármaco, VEGF-A y brolucizumab60. Otras causas propuestas por otros autores antes de la publicación de los resultados del estudio BASIC son el tratamiento anterior con anti-VEGF, eventos de IIO anteriores, presencia de determinados antígenos leucocitarios humanos y comorbilidades20-23,29.
Hasta el momento, los estudios HAWK y HARRIER son la evidencia clínica más amplia y sólida de la eficacia y la seguridad de brolucizumab. De 1.088 pacientes naïve tratados con brolucizumab, 50 pacientes presentaron eventos adversos inflamatorios vinculados al tratamiento26. Más del 90% de los EAAI fueron reportados como leves o moderados por los investigadores y el 85,3% se resolvieron sin secuelas25. La edad media de los pacientes que presentaron este tipo de EAAI fue de 74años y la mayoría de los pacientes fueron mujeres (74%)25,28. Un estudio reciente de práctica clínica real basado en los pacientes con IIO reportados a la ASRS reveló que en la mayoría de los casos los síntomas se resolvieron y se acabó recuperando la leve pérdida de agudeza visual61. En base a estos datos y de acuerdo con las autoridades sanitarias, brolucizumab tiene un perfil beneficio-riesgo favorable. No obstante, se recomienda prestar especial atención a los siguientes perfiles de pacientes (fig. 1):
- a)
Perfiles de pacientes por factor de riesgo: inflamación intraocular. 1)Pacientes con IIO activa previa a la inyección de brolucizumab28. Es preceptiva una exploración completa del paciente antes de cada inyección para detectar posibles signos de inflamación. Si existe IIO activa, el uso de brolucizumab está contraindicado28,43,44. Se debe tratar la inflamación de acuerdo con la práctica médica estándar62,63. 2)Pacientes con un historial de eventos previos de IIO y/o OVR a causa de tratamientos anti-VEGF anteriores u otras causas28. Estudios recientes de evidencia en práctica clínica real revelaron que los pacientes con eventos de IIO y/o OVR durante los 12meses anteriores a la primera inyección de brolucizumab tenían más probabilidades de presentar eventos similares en los 6meses posteriores a la inyección que los pacientes sin antecedentes de este tipo de eventos29. 3)Aunque la evidencia es limitada, pacientes con un historial de enfermedades autoinmunes64 o con alteraciones sistémicas de carácter inflamatorio podrían ser potencialmente excluibles debido a que podrían tener una mayor tendencia a la inflamación vascular. En una serie de casos publicados se mostró que el 20% de los pacientes que tenían antecedentes de inflamación presentaban enfermedades autoinmunes subyacentes, como esclerosis múltiple, fenómeno de Raynaud, hipotiroidismo, enfermedad de Graves y psoriasis22. En otra serie, el 58% de los casos presentaban artritis, esclerosis múltiple e hipotiroidismo, todos ellos de naturaleza autoinmune23. Además, dos reportes de casos de vasculitis relacionada con brolucizumab mostraron antecedentes de artritis e hipotiroidismo20,21.
- b)
Perfiles de pacientes por criterios de beneficio-riesgo. Los beneficios y riesgos clínicos de brolucizumab se aplican a cada ojo tratado y a cada inyección. 1)Pacientes con buena preservación de la agudeza visual, ausencia de fluido y presencia de atrofia macular. 2)Pacientes monoculares. En los estudios HAWK y HARRIER, la tasa global de cualquier forma de IIO asociada con la pérdida de ≥15letras en la última visita fue del 0,7%26. Aunque son poco frecuentes, estos eventos pueden estar asociados con una pérdida de visión de moderada a grave20-24. 3)Pacientes con afectación bilateral. Cuando se trate al paciente de forma bilateral, es recomendable no inyectar brolucizumab en ambos ojos al mismo tiempo hasta conocer mejor las causas subyacentes del EAAI22,64.
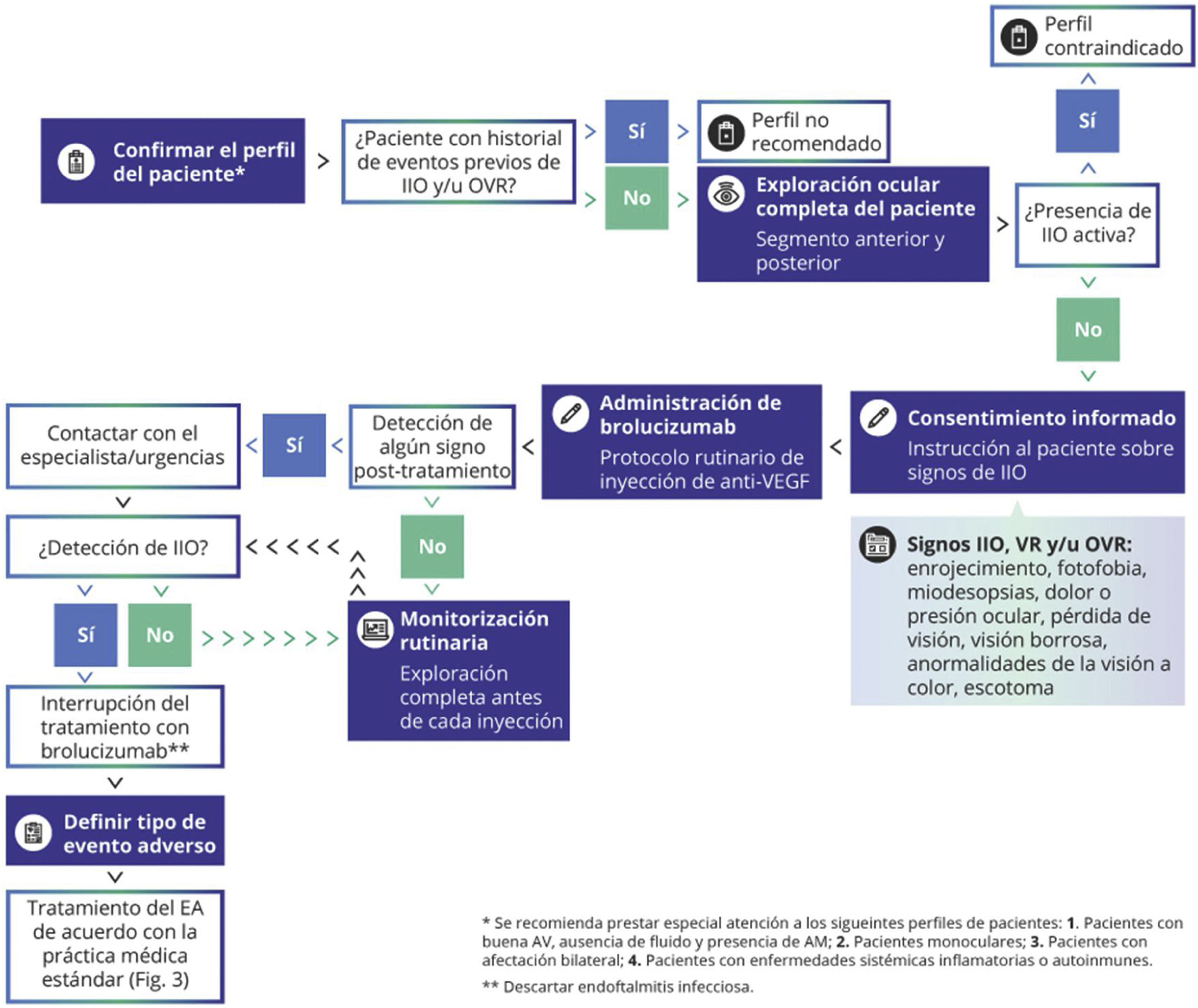
Algoritmo médico de decisión para el tratamiento con brolucizumab. Se recomienda confirmar el adecuado perfil del paciente para el tratamiento con brolucizumab, realizar una exploración completa del paciente antes de cada inyección y monitorizar de manera rutinaria al paciente para descartar eventos de IIO. En presencia de inflamación intraocular activa, el tratamiento con brolucizumab está contraindicado y se debe interrumpir.
AM: atrofia macular; AV: agudeza visual; IIO: inflamación intraocular; OVR: oclusión vascular retiniana; VEGF: factor del crecimiento endotelial vascular; VR: vasculitis retiniana.
Se están realizando grandes esfuerzos para investigar la causa raíz de estos eventos. Aunque existen varias hipótesis sobre las que se sigue trabajando, hoy en día se desconoce la causa subyacente del desarrollo de este tipo de eventos inflamatorios. Disponer de más información sobre la patogenia de la IIO ayudará a respaldar mejor las recomendaciones sobre el perfil del paciente y la estratificación del perfil beneficio-riesgo de brolucizumab60.
Pauta de tratamiento con brolucizumabLa posología aprobada para brolucizumab en pacientes con DMAEn basada en los ensayos clínicos de faseIII HAWK y HARRIER17,18 es la de un intervalo cada 8-12semanas tras la fase de carga (3inyecciones mensuales iniciales)28. Otras pautas de tratamiento con brolucizumab están siendo aún estudiadas. Dados los resultados preliminares del estudio de faseIIIa MERLIN65, se recomienda no pautar brolucizumab en intervalos inferiores a 8semanas tras la fase de carga inicial28,66. Por su parte, los ensayos clínicos de faseIIIb TALON67 y TALON-EXT68, todavía en curso, evalúan la eficacia y la seguridad de brolucizumab 6mg en comparación con aflibercept 2mg utilizando un régimen flexible de treat-to-control(treat-and-extend) en pacientes con DMAEn. Estos estudios proporcionarán nuevos datos sobre el uso de brolucizumab en intervalos de tratamiento más prolongados, de hasta 16 y 20semanas, respectivamente. La evidencia en práctica clínica real a largo plazo en otros países proporcionará información adicional sobre el manejo y la pauta de brolucizumab en la práctica clínica. La pauta de inyección cada 8-12 semanas tras la fase de carga sigue siendo una opción de tratamiento importante y eficaz para los pacientes con DMAEn28.
Mitigación de los EAAI y monitorización del tratamiento con brolucizumabEn HAWK y HARRIER, aproximadamente el 50% de los EAAI ocurrieron durante los 3primeros meses del tratamiento de brolucizumab, el 75% durante los 6primeros y cerca del 70% de los casos ocurrieron durante las 4primeras inyecciones del fármaco. Sin embargo, algunos EAAI fueron reportados tras 18meses del inicio del tratamiento, después de 8-10inyecciones de brolucizumab, y, en algún caso, hasta 72días después de la última inyección26. Más del 50% de los EAAI fueron clasificados como leves, y la gran mayoría se resolvieron sin complicaciones25. Se ha demostrado que la detección rápida y el tratamiento precoz son clave para minimizar el daño. Los datos de HAWK y HARRIER mostraron que los signos de IIO precedieron a los eventos de VR o OVR en algunos pacientes25,26, lo que sugiere que estos EAAI pueden mitigarse mediante la realización de procedimientos clínicos básicos. Si no se detecta un evento adverso leve de IIO a tiempo y se sigue tratando al paciente con brolucizumab, el evento adverso puede empeorar y el paciente puede acabar desarrollando VR y/o OVR (fig. 2). Por todo ello, la comunidad médica y las sociedades científicas recomiendan realizar un seguimiento de los posibles síntomas asociados a la IIO en cada visita programada de los pacientes que reciben brolucizumab durante los primeros meses de tratamiento (fig. 1).
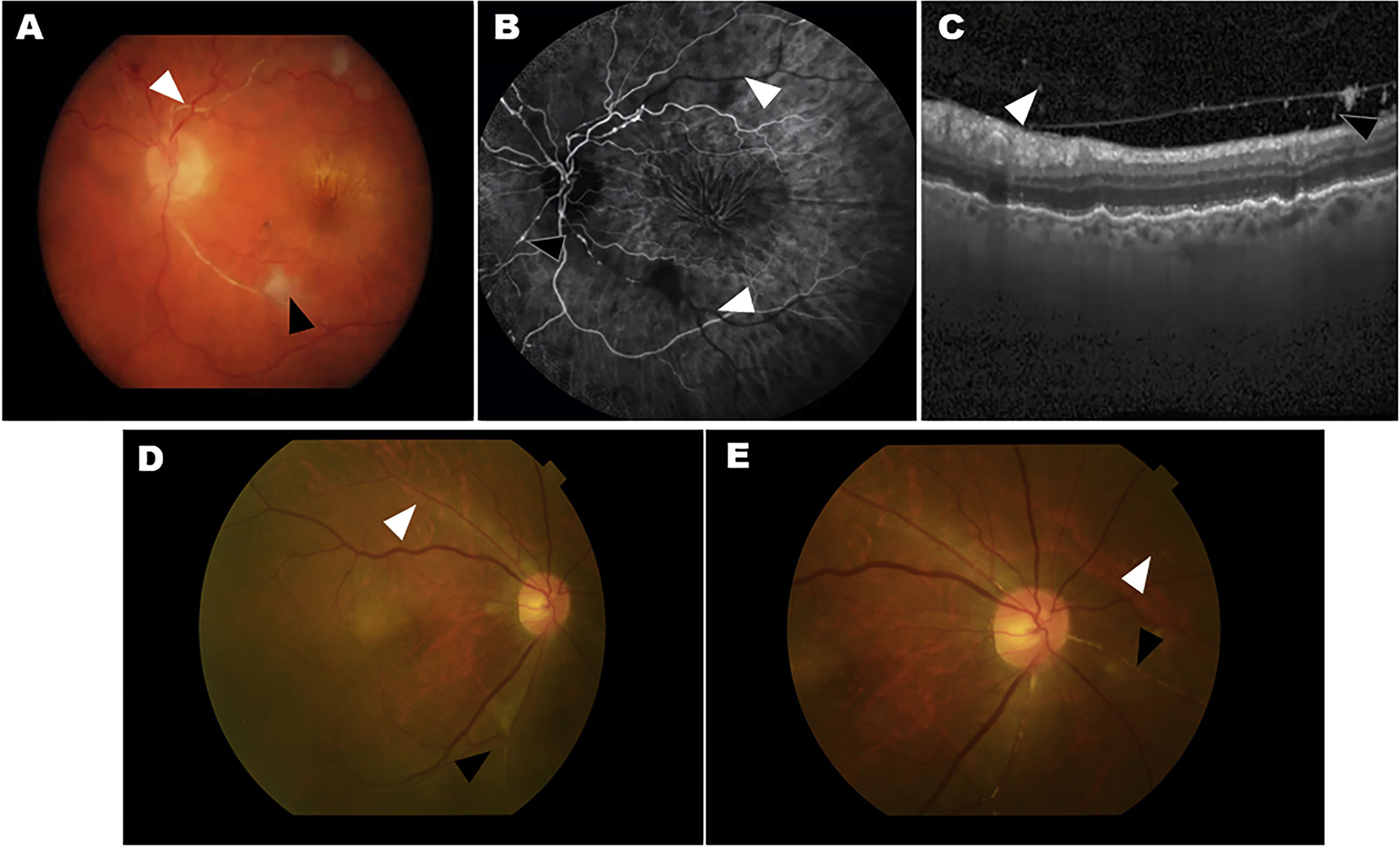
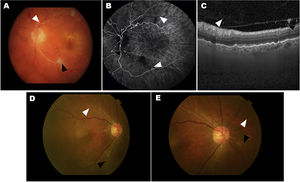
Dos casos de ojos con eventos adversos relacionados con inflamación intraocular (IIO) de los estudios HAWK y HARRIER. A-C, caso 1: iridociclitis y OVR. A)La fotografía en color del fondo de ojo muestra un blanqueamiento de la arteria retiniana compatible con oclusión vascular retiniana (OVR, punta de flecha blanca) y una mancha algodonosa (punta de flecha negra). B)La angiografía fluoresceínica en la fase venosa demuestra la falta de perfusión de las arterias de la retina (puntas de flecha blanca) y el box-carring arterial (punta de flecha negra). C)La imagen de tomografía de coherencia óptica (OCT) muestra la presencia de células en el vítreo en la hialoides posterior. D-E, caso 2: uveítis y OVR. La fotografía en color del fondo de ojo muestra un estrechamiento pequeño y focal de las arteriolas retinianas (punta de flecha blanca) y la oclusión (punta de flecha negra).
Figura cortesía de Michael Singer et al.25, de acuerdo con la licencia internacional 4.0 de Creative Commons.
En HAWK y HARRIER, casi el 25% de los EAAI fueron reportados en visitas no programadas25. Por lo tanto, es importante que los médicos también instruyan a los pacientes para detectar precozmente los síntomas y signos característicos de la IIO. Los pacientes deben estar atentos a signos como enrojecimiento, fotofobia, dolor o presión ocular, miodesopsias, defectos en el campo visual, visión borrosa, anormalidades de la visión a color; metamorfopsia, escotoma o pérdida de visión61,69,70 (fig. 1). El tiempo de reacción es clave para evitar cuadros de VR u OVR graves que acaben afectando a la visión. El paciente debe informar de inmediato al especialista o al centro sanitario para poder tomar las medidas de mitigación adecuadas. En presencia de IIO activa, el tratamiento con brolucizumab está contraindicado y se debe interrumpir (fig. 1).
Inflamación intraocularAntes del inicio del tratamiento con brolucizumab se debe descartar la presencia de inflamación activa en el paciente28. Para ello, será necesario hacer una exploración completa del segmento anterior y posterior del ojo del paciente con detalle71 (fig. 1) para detectar: 1)células en el humor acuoso mediante exploración del segmento anterior con lámpara de hendidura; 2)turbidez vítrea mediante fundoscopia en midriasis con lámpara de hendidura (la fotografía a color del fondo de ojo debe ser considerada también), y 3)la presencia de células en la hialoides posterior en la imagen de OCT (por sus siglas en inglés, optical coherence tomography) (fig. 3). Es importante no confundir la presencia de células en la hialoides con un desprendimiento del vítreo posterior. Es posible no detectar la presencia de células en la hialoides posterior, pero sí cierta turbidez que impide la correcta toma de las imágenes72,73. En estos casos, el oftalmólogo juega un papel importante en la detección precoz de la IIO. En este sentido, un reciente análisis post hoc de las imágenes de OCT de pacientes en HAWK ha hallado la presencia de depósitos pre-retinianos hiperreflectivos con anterioridad al EAAI74. A nivel de imagen, estos signos son similares a depósitos pre-retinianos hallados en otras patologías retinianas de carácter inflamatorio, aunque de diferente etiología75-78.
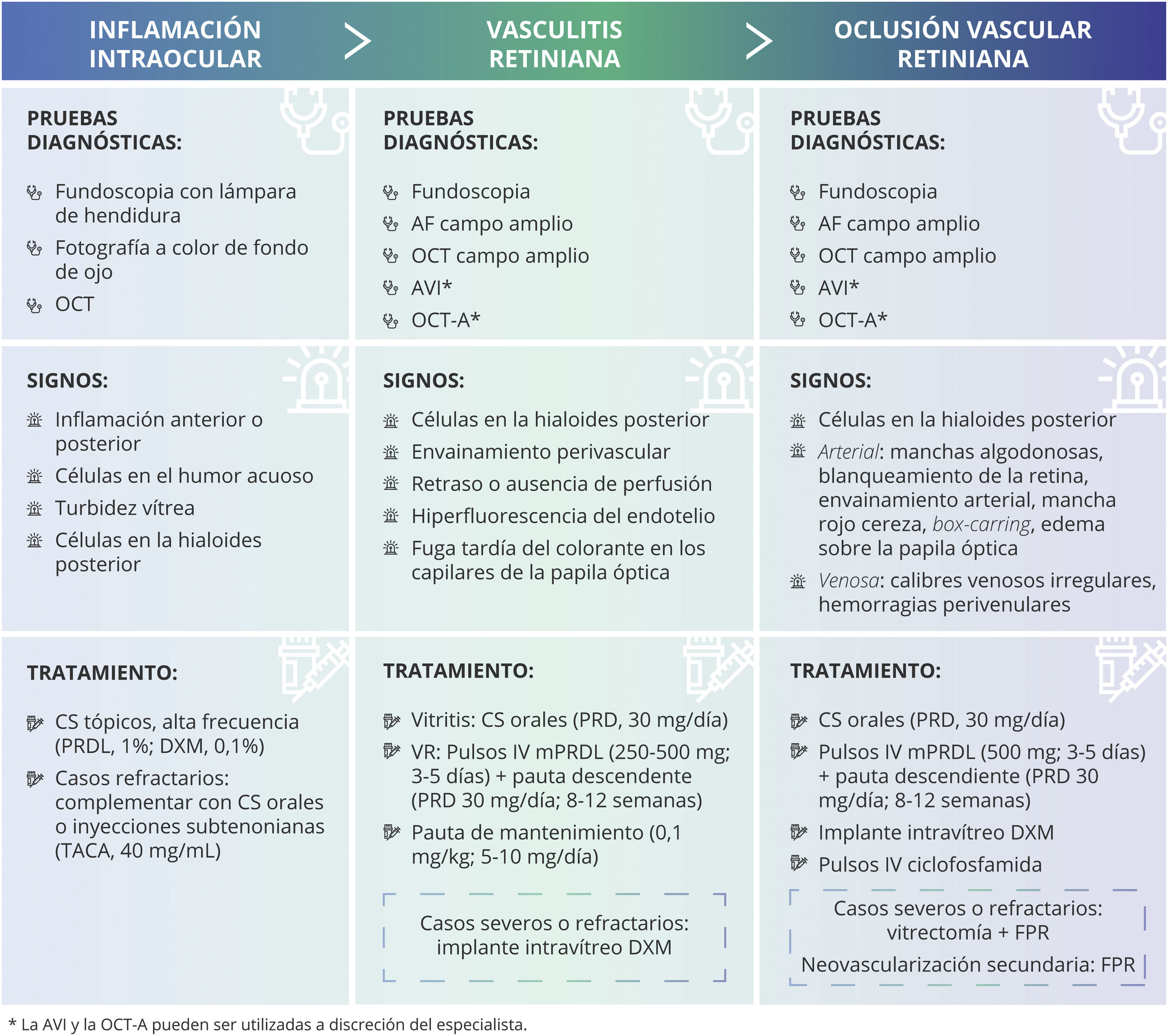
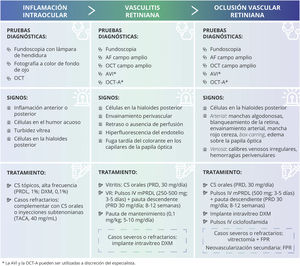
Cuadro resumen de signos y tratamientos de los eventos adversos asociados con IIO (EAAI). Los corticosteroides son la opción terapéutica de primera línea para el tratamiento de la IIO. Según la gravedad de la inflamación, su evolución y la localización, los médicos deben establecer la vía de administración, la dosis y la posología del tratamiento.
AF: angiografía fluoresceínica; AVI: angiografía con verde de indocianina; CS: corticosteroides; DXM: dexametasona; FPR: fotocoagulación panretiniana; IIO: inflamación intraocular; IV: intravenoso; mPRDL: metilprednisolona; OCT: tomografía de coherencia óptica; OCT-A: angio-OCT; OVR: oclusión vascular retiniana; PRD: prednisona; PRDL: prednisolona; TACA: acetónido de triamcinolona; VR: vasculitis retiniana.
Es fundamental distinguir la IIO no infecciosa de la endoftalmitis infecciosa, ya que estas dos afecciones pueden tener presentaciones clínicas comunes, pero tienen diferentes cursos de manejo71,79 (fig. 1). A diferencia de la IIO no infecciosa, la endoftalmitis infecciosa se desarrolla precozmente, típicamente durante la primera semana después de la inyección intravítrea del agente anti-VEGF, y se caracteriza por un inicio agudo o subagudo de dolor, malestar, agudeza visual reducida, epífora, hiperemia conjuntival, quemosis, edema palpebral, hipopión y reacción celular del segmento anterior y vítreo o fibrina71,80. Se pueden tomar muestras del humor acuoso y vítreo para conocer la naturaleza de la infección, y esta deberá ser tratada de acuerdo con la práctica médica estándar71,81. Por el contrario, la IIO se presenta más tardíamente tras la inyección del anti-VEGF (en el caso de brolucizumab, de media, 20días desde la última inyección)82,83 y no suele presentar hipopión ni el resto de los signos agudos. Es importante descartar cualquier enfermedad infecciosa o sistémica subyacente que pueda contribuir o agravar estos EAAI.
Vasculitis retiniana y oclusión vascular retinianaDurante el primer año de tratamiento se recomienda hacer una exploración ocular completa antes de repetir el tratamiento con brolucizumab para descartar cualquier signo de IIO (fig. 1). Si existen algunos de estos signos (salvo casos de uveítis anterior, exclusivamente), es recomendable realizar una angiografía fluoresceínica (AF) para confirmar el diagnóstico, describir mejor la naturaleza del evento adverso y descartar la presencia de VR83,84 u OVR22,26 (fig. 2). La VR y la OVR tienen presentaciones clínicas variadas, pudiendo ser central, afectando el nervio óptico y la mácula, periférica o multifocal, afectando a vasos de gran y pequeño calibre. Por lo general, la VR afecta primero a las arterias retinianas y, más tarde, a las venas retinianas con hemorragias perivenulares, con presencia o ausencia de eventos oclusivos82. Se recomienda utilizar técnicas de imagen de campo amplio para revisar la retina central y periférica, documentar la extensión completa de las áreas afectadas y detectar cualquier actividad o progresión de la enfermedad que podría pasarse por alto utilizando imágenes convencionales26,62,64. En el caso de no contar con técnicas de imagen de campo amplio, se deben utilizar los procedimientos estándar, tomando imágenes de los sectores periféricos. La angiografía con verde de indocianina (AVI) o la angio-OCT (OCT-A) pueden ser utilizadas a discreción del especialista para evaluar cambios en el flujo vascular de los plexos vasculares retinianos y en la vasculatura coriocapilar22,82-85 (fig. 3).
En casos de vasculitis retiniana, la fundoscopia puede ser útil para revelar signos típicos, como el envainamiento perivascular (focal o multifocal)69,86, pero debe ser confirmada mediante AF. El retraso o la ausencia de la perfusión en las arterias retinianas, la hiperfluorescencia del endotelio vascular retiniano o la fuga tardía del colorante en los capilares dilatados de la papila óptica en la AF son signos de VR69,87 (fig. 3).
En casos de oclusión vascular retiniana, el examen del fondo del ojo puede ser útil para revelar signos de isquemia, como la presencia de manchas algodonosas (típico en oclusiones arteriolares retinianas precapilares), blanqueamiento de la retina, envainamiento arterial y la mancha rojo cereza en la mácula, observada en casos de oclusión aguda de la arteria central de la retina. Otros signos pueden ser atenuación de las arterias retinianas, segmentación del flujo de sangre de los vasos retinianos (box-carring), edema sobre la papila óptica, calibres venosos irregulares y hemorragias perivenulares intrarretinianas70,87. El examen de imagen por OCT es recomendable para detectar la presencia de células en el vítreo posterior y explorar el grosor de la mácula (presencia de edema)69. La AF es recomendable para confirmar la oclusión vascular, evaluar el grado de isquemia y delimitar el área afectada69,70,88 (fig. 3).
Tratamiento de los eventos adversos asociados a inflamaciónLas recomendaciones para el tratamiento de los EAAI vendrán guiadas por la práctica médica habitual y por la severidad del evento adverso. La duración y la intensidad del tratamiento administrado dependerán de la respuesta de cada paciente. Idealmente, este tipo de eventos deben ser tratados por un especialista en retina o uveítis.
En HAWK y HARRIER, los investigadores reportaron más del 50% de los eventos adversos relacionados con IIO como leves, con una duración media de 54días, el 40% como moderados, con una duración media de 88días, y menos del 6% como graves, con una duración media de 237días. Más del 80% de los EAAI se resolvieron sin secuelas25; algunos sin necesidad de tratamiento22,25. No hubo correlación entre el número de inyecciones de brolucizumab recibidas y la severidad del EAAI25. En algunos pacientes, los signos de IIO precedieron a los eventos de VR u OVR25,26, por lo que la detección rápida y el tratamiento precoz son clave para evitar el empeoramiento del EAAI y minimizar el daño sobre la visión del paciente.
Los corticosteroides son la opción terapéutica de primera línea para el tratamiento de la IIO89,90. Por lo tanto, una vez que se confirma el diagnóstico de IIO, se recomienda el inicio de la terapia con corticosteroides. Según la gravedad de la inflamación, su evolución y la localización, los médicos deben establecer la vía de administración, la dosis y la posología del tratamiento (fig. 3). Si los síntomas empeoran con el uso de corticosteroides, se debe reconsiderar la etiología infecciosa62,63 (fig. 1).
Los tratamientos con corticosteroides pueden incrementar la presión intraocular (PIO)91 e inducir la formación de cataratas92. Se recomienda comprobar la PIO para descartar hipertensión ocular inducida por corticosteroides o inflamación. Si es necesario, se puede pautar medicación para reducir la PIO (betabloqueantes o inhibidores de la anhidrasa carbónica). Por este motivo, se debe prestar especial atención al historial médico del paciente para asegurarse de que no tenga un riesgo mayor de sufrir un efecto secundario inducido por corticosteroides. En casos de intolerancia, efectos secundarios importantes o contraindicaciones a los corticosteroides, se pueden considerar otras opciones de tratamiento, como agentes inmunomoduladores o agentes no esteroides93. Sin embargo, por el momento, no existe evidencia de la efectividad de estas terapias en estas condiciones62,63; será necesaria más información sobre la etiología de los EAAI inducidos por brolucizumab para determinar su potencial terapéutico.
Uveítis anteriorLa inflamación en cámara anterior sin presencia de inflamación vascular es un evento adverso leve, pero puede ser el signo inicial de cuadros más graves. Antes de pautar el tratamiento del evento adverso se recomienda realizar una AF para tener un diagnóstico certero y descartar la presencia de uveítis posterior o VR22,26. Por regla general, la uveítis anterior puede manejarse bien con terapia corticosteroidea tópica, preferiblemente sustancias activas de alta potencia (acetato de prednisolona, 1%; dexametasona, 0,1%) y con una frecuencia elevada (hasta cada hora en casos de inflamación severa de puntuación igual o superior a +3 en la escala SUN)90,94,95. Si hay falta de respuesta, la terapia tópica se puede complementar con corticosteroides orales o mediante inyecciones subtenonianas (acetónido de triamcinolona, 40mg/ml)96. Se debe reducir la frecuencia y ajustar la dosis (o usar principios activos menos potentes) conforme la inflamación vaya remitiendo. La uveítis anterior puede requerir tratamiento durante varias semanas (fig. 3).
Uveítis posterior, vasculitis retiniana y oclusión vascular retinianaSi la inflamación afecta al humor vítreo y/o al segmento posterior del ojo, se recomienda confirmar la presencia de vasculitis retiniana mediante AF22,26 y reforzar el tratamiento con una pauta intensiva de corticosteroides intravítreos y/o sistémicos. Es importante monitorizar cuidadosamente a los pacientes con VR desde el principio para evaluar el alcance y la gravedad de la filtración vascular e identificar cualquier complicación isquemizante para permitir una intervención oportuna70. La aparición de VR es un momento clave, puesto que todavía no se ha producido la isquemia y, por tanto, el daño estructural irreversible y la afectación visual.
En el caso de que la IIO consista solo en vitritis, se recomiendan corticosteroides orales (30mg/día). Si, además, se objetiva VR, se recomiendan pulsos de metilprednisolona por vía intravenosa (250-500mg durante 3-5días) y, después, continuar con prednisona 30mg/día en pauta descendente durante un período de 8-12semanas en función de la evolución clínica del evento97. Los efectos secundarios del uso de corticosteroides sistémicos a largo plazo son bien conocidos98. Por eso, idealmente, el tratamiento esteroideo debe ser retirado de manera paulatina. Si es necesario, se debe reducir gradualmente hasta alcanzar una dosis de mantenimiento (0,1mg/kg; 5-10mg/día)99 (fig. 3). Una alternativa a los pulsos de metilprednisolona, o como tratamiento adyuvante en casos severos o refractarios, es el implante intravítreo de dexametasona100 (fig. 3). Sin embargo, es preferible evitar el tratamiento intraocular en este tipo de casos. Por su parte, el implante intravítreo de fluocinolona no es recomendable debido a que el inicio de su efecto es tardío (hasta un mes en algunos casos) y su duración demasiado prolongada para estos casos (hasta 3años)101. En el caso de producirse una vasculitis oclusiva, se pueden plantear dosis más elevadas de metilprednisolona (pulsos de 500mg durante 3-5días), asociar de inicio el implante de dexametasona o, incluso, pulsos intravenosos de ciclofosfamida, en cuyo caso se recomienda la colaboración con el servicio de medicina interna, con el de reumatología o con el de inmunología. En estos casos, la vitrectomía asociada a la fotocoagulación panretiniana puede ser una alternativa con un beneficio potencial22,23; sin embargo, la evidencia clínica sobre esta opción es limitada (fig. 3).
Es muy importante monitorizar exhaustivamente a los pacientes con eventos oclusivos vasculares retinianos. Los cuadros isquemizantes graves pueden desarrollar neovascularización secundaria. La fotocoagulación panretiniana puede usarse en caso de neovascularización secundaria y considerarse en pacientes con isquemia periférica extensa antes de la aparición de nuevos vasos62 (fig. 3).
ConclusionesHasta el momento, los estudios HAWK y HARRIER son la evidencia clínica más reciente y robusta sobre la eficacia y la seguridad de brolucizumab17,18. Los primeros datos en práctica clínica real ofrecen evidencia preliminar sobre la incidencia y el manejo de los EAAI; sin embargo, estos están limitados por tamaños de muestra pequeños y cortos períodos de seguimiento de los estudios de los que se han obtenido29-42. Además de los reportes estándar de seguridad, actualmente se está llevando a cabo un análisis sistemático enfocado en múltiples frentes en un esfuerzo por comprender mejor la naturaleza de los EAAI tras el tratamiento con brolucizumab y de cómo abordarlos25,26,62,64.
Los actuales tratamientos anti-VEGF han demostrado ser eficaces y seguros en el manejo de la DMAEn; sin embargo, todavía existen importantes necesidades no cubiertas por este tipo de terapias7,9,14,15. Brolucizumab es un anti-VEGF de nueva generación capaz de proporcionar un control de la enfermedad efectivo acompañado de una mayor durabilidad17,18. Aunque los EAAI (VR y OVR) detectados durante la comercialización de brolucizumab suelen ser poco frecuentes28 y asequibles de manejar si se detectan precozmente, pueden estar asociados con una pérdida de agudeza visual26,62. El tratamiento con brolucizumab requiere, por tanto: 1)una detallada evaluación inicial para descartar a aquellos pacientes con perfiles no recomendados para brolucizumab; 2)la exploración del paciente antes de cada inyección para descartar la presencia de inflamación activa; 3)un seguimiento de los signos de alarma para la detección precoz de posibles EAAI, especialmente durante los primeros 6meses del tratamiento, y 4)un tratamiento inmediato en el caso de que se desarrollen EAAI (fig. 1).
Los pacientes tratados con brolucizumab deben estar concienciados y adoptar un papel activo en el proceso de monitorización. Se les debe instruir para saber identificar los síntomas precoces de la inflamación ocular y concienciar sobre la importancia del tratamiento precoz. Estos síntomas son signos de alerta que el paciente no debe entrar a valorar, sino comunicarlos inmediatamente al centro sanitario correspondiente (fig. 1). Es recomendable que el especialista comparta con ellos información educacional al respecto, ya sea la vinculada al Risk Management Plan de Novartis o la asociada a los protocolos propios de los centros hospitalarios. Además, es deseable informar y formar a los servicios de urgencias de los centros hospitalarios para que sepan atender y explorar a estos pacientes, e identificar y manejar este tipo de eventos adversos.
La DMAEn es una dolencia que requiere un tratamiento y un seguimiento estrictos7, lo que supone un consumo elevado de recursos sanitarios102. En este sentido, brolucizumab es una alternativa terapéutica diferente y necesaria que viene a cubrir importantes necesidades actualmente desatendidas. Las recomendaciones propuestas en este trabajo están basadas en la evidencia publicada hasta el momento y en la experiencia de los autores para implementar un manejo correcto de brolucizumab por parte de la comunidad oftalmológica, garantizar la seguridad del paciente y, en el caso de que se produzca algún EAAI, minimizar su impacto sobre la visión. La evidencia en práctica clínica real a largo plazo en otros países y los resultados de la investigación realizada hasta este momento proporcionarán información adicional sobre cómo manejar brolucizumab en la práctica clínica.
AvalesEste trabajo cuenta con el aval científico de la Sociedad Española de Retina y Vítreo (SERV) y la Sociedad Española de Inflamación Ocular (SEIOC).
FinanciaciónPara la contratación de los servicios de BCNscience para la redacción y traducción de este manuscrito se ha contado con la colaboración de Novartis Farmacéutica S.A.
Contribución de los autoresTodos los autores han contribuido de manera equitativa en la preparación, redacción y revisión del manuscrito. El presente trabajo se ha desarrollado a partir de la evidencia científica publicada y de la experiencia de los autores. El contenido del manuscrito ha sido escogido y elaborado por los autores de manera independiente. Novartis Farmacéutica S.A. ha contribuido en la financiación de los servicios de redacción y traducción del texto, pero no ha participado en la elaboración, revisión y/o aprobación del manuscrito.
Conflicto de interesesAlejandro Fonollosa ha sido consultor de Novartis, Bayer y Brill, y ha realizado conferencias remuneradas para Abbvie, Allergan y Brill.
Roberto Gallego-Pinazo ha sido consultor de Carl Zeiss Meditec, Novartis, ORA Clinical y Roche, ha realizado conferencias remuneradas para Alimera, Allergan, Heidelberg Engineering, Horus Pharma, Novartis, NTC Pharma y Roche, y ha ejercido como investigador para Celltrion, Ionis, Iveric BioPharma, Novartis y Roche.
Laura Sararols ha sido consultora de Novartis, Bayer, Allergan y Roche, y ha ejercido como investigadora para Celltrion, Chengdu Khanghon, Ionis, Iveric BioPharma, Novartis, Bayer y Roche.
Alfredo Adán ha sido consultor, ha realizado conferencias remuneradas y ha ejercido como investigador para Novartis, Bayer, Abbvie y Alimera.
Maribel López Gálvez ha sido consultora de Novartis, Bayer, Allergan, Roche, Alimera y Ferrer.
Marta S. Figueroa ha sido consultora de Novartis, Bayer, Allergan, Roche, Alcon y Zeiss, y ha ejercido como investigadora para Novartis, Roche, Allergan, Chengdu Kanghong Biothechnology, Gyroscope, Celltrion y Opthea Limited.
Aparte de las mencionados, los autores no tienen otras filiaciones relevantes o participaciones financieras con ninguna organización o entidad con un interés o conflicto financiero con el tema o los materiales discutidos en el manuscrito.