Se entiende por síndrome posneumonectomía la obstrucción bronquial postoperatoria, causada por un desplazamiento exagerado del mediastino. Este síndrome está bien documentado en la literatura médica como complicación tardía de una neumonectomía derecha, pero su producción tras una resección del pulmón izquierdo es excepcional, pues apenas se ha publicado una decena de casos. La fisiopatología, las manifestaciones clínicas, el pronóstico y el tratamiento son similares para ambos lados.
Presentamos el caso de un paciente adulto a quien se practicó una neumonectomía izquierda y que desarrolló un síndrome posneumonectomía a los 15 meses del postoperatorio. La estenosis del bronquio intermediario se produjo entre el cuerpo vertebral y la arteria pulmonar derecha. Se efectuó eficazmente tratamiento endoscópico con una prótesis metálica autoexpandible, con lo cual se observó la remisión completa de los síntomas durante los 6 meses de seguimiento.
Postpneumonectomy syndrome is characterized by postoperative bronchial obstruction caused by mediastinal shift. The syndrome is well documented in the medical literature as a late complication of right pneumonectomy; however, it rarely occurs following resection of the left lung, and only 10 cases have been published. The pathophysiology, clinical manifestations, prognosis, and treatment are similar for both sides of the lung.
We present the case of an adult patient who underwent left pneumonectomy and developed postpneumonectomy syndrome 15 months later. Stenosis of the intermediate bronchus occurred between the vertebral body and the right pulmonary artery. Endoscopic treatment with a self-expanding metal stent was successful, and complete remission was observed over the 6 months of follow-up.
En el postoperatorio de una neumonectomía se desencadena un asombroso proceso de adaptación, compuesto por un importante número de cambios anatómicos y fisiológicos. La hiperplasia e hiperinsuflación pulmonares, los cambios cardiovasculares, el desplazamiento del mediastino, la elevación diafragmática y el acortamiento de los espacios intercostales son ejemplos de estos fenómenos adaptativos. Durante este proceso, que puede durar meses e incluso años, pueden aparecer diversas complicaciones o efectos indeseables.
El síndrome posneumonectomía se genera por un desplazamiento exagerado del mediastino hacia el lado operado, que ocasiona la compresión de la vía aérea entre las estructuras adyacentes. Si bien se trata de una complicación tardía infrecuente cuando la neumonectomía es derecha, hay varias publicaciones que lo describen. Por el contrario, sólo se ha descrito de forma anecdótica cuando la neumonectomía es izquierda (SPNI).
En la literatura médica se han propuesto diversos tratamientos para este síndrome, tanto del lado derecho como del lado izquierdo.
Observación clínicaSe presenta el caso de un varón de 44 años de edad, exfumador de 30 paquetes/año y afectado de enfermedad pulmonar obstructiva crónica, con antecedentes de antrectomía por úlcera gástrica y linfoma de Hodgkin tratado hacía 25 años con quimioterapia, radioterapia y esplenectomía. Cabe destacar su complexión física, de aspecto marfanoide, con una marcada delgadez; su índice de masa corporal era de 17,37kg/m2.
Se efectuó una neumonectomía izquierda por un carcinoma pulmonar del lóbulo inferior izquierdo, estadificado como T2N0M0 (estadio Ib), tras quimioterapia neoadyuvante. A los 12 días del postoperatorio reingresó con diagnóstico de empiema de la cavidad tras neumonectomía no asociado con fístula bronquial, que se trató eficazmente con drenaje pleural y antibioterapia.
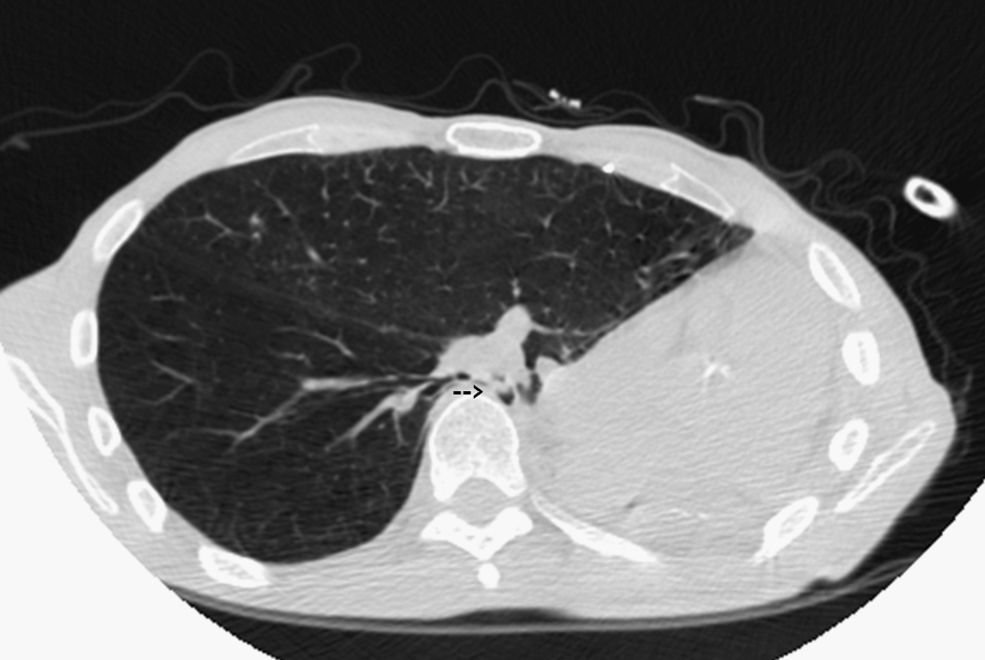
Tras 15 meses de evolución favorable, el paciente comenzó a presentar disnea progresiva y a mínimos esfuerzos, asociada a estridor inspiratorio y ocasionales dolores pleuríticos izquierdos. La tomografía computarizada de tórax (fig. 1) mostró los cambios posquirúrgicos de la neumonectomía izquierda: desplazamiento mediastínico, ausencia de líquido en la cavidad posneumonectomía, hiperinsuflación del pulmón derecho y compresión extrínseca del bronquio intermediario entre la cara anterolateral del cuerpo vertebral y la arteria pulmonar derecha. La luz bronquial era de aproximadamente 3mm en una extensión de 2cm al nivel del bronquio intermediario. Estos hallazgos quedaron confirmados en la fibrobroncoscopia, que descartó signos de broncomalacia o lesiones endoluminares.
Síndrome posneumonectomía izquierda: tomografía computarizada de tórax efectuada a los 15 meses de una neumonectomía izquierda, en la que se observan la ausencia de la cavidad pleural posneumonectomía, con marcado desplazamiento mediastínico; aumento del volumen pulmonar derecho, que traspasa la línea media, y estenosis por compresión del bronquio intermediario entre el cuerpo vertebral y la arteria pulmonar derecha (flecha).
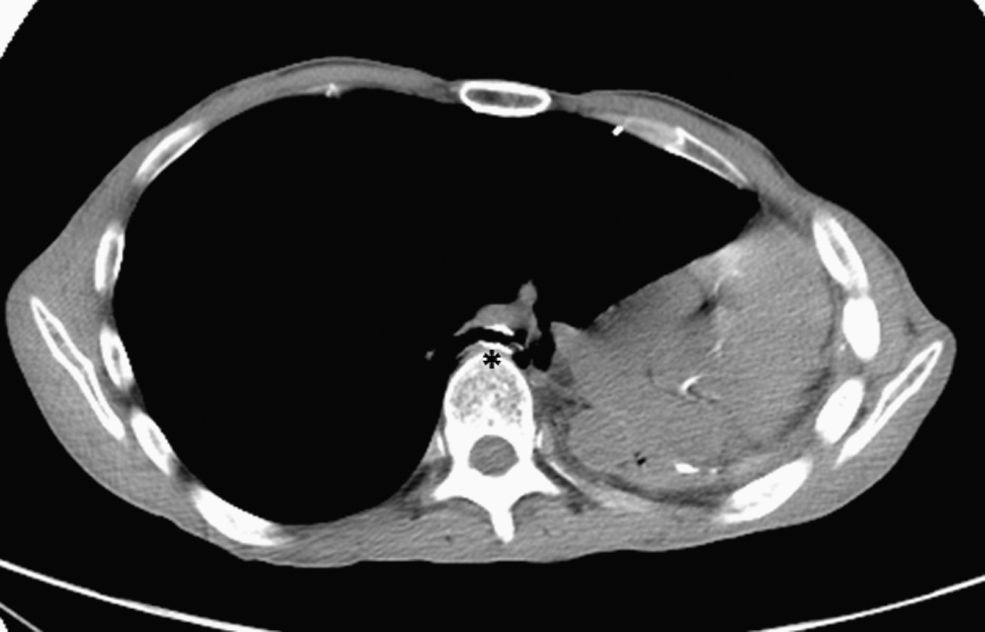
A los 2 meses de la aparición de los síntomas se procedió a la colocación por broncoscopia rígida de una prótesis metálica autoexpandible no recubierta (de 10mm de diámetro por 20mm de longitud) en el bronquio intermediario. A las 24h del procedimiento el paciente presentó remisión completa de los síntomas, incluso del dolor pleurítico. Durante los 6 meses siguientes la evolución ha sido favorable, sin que se hayan apreciado signos clínicos ni tomográficos de complicaciones (fig. 2). En la fibrobroncoscopia se observa la luz permeable del bronquio intermediario, con leve compresión extrínseca de la prótesis y la formación de pequeños granulomas que no han progresado en los últimos 3 meses.
Tratamiento endoscópico del síndrome posneumonectomía izquierda. En la tomografía computarizada de tórax efectuada a los 6 meses de la colocación endoscópica de una prótesis metálica autoexpandible en el bronquio intermediario (asterisco), tras neumonectomía izquierda y síndrome posneumonectomía, se observa el bronquio intermediario permeable, con un incremento de calibre de la luz bronquial si se compara con la figura 1.
Los primeros en utilizar el término de síndrome posneumonectomía fueron Wasserman et al1, en 1979, para referirse a una infrecuente complicación de la neumonectomía derecha, en la cual se producía una obstrucción del bronquio principal izquierdo entre el cayado aórtico y la arteria pulmonar izquierda2. No fue hasta 1991 cuando Quillin y Shackelford3 describieron el primer caso de SPNI, ocurrido en un neonato al que se realizó una neumonectomía izquierda por enfisema intersticial asociado a un cayado aórtico derecho. Esto condujo a los autores a suponer que esta malformación vascular era una condición imprescindible para producir este síndrome tras una neumonectomía izquierda3. Sin embargo, en años posteriores varios autores demostraron la posibilidad de que el SPNI se dé sin asociarse a malformaciones vasculares2–9, como sucede también en el caso aquí presentado. En una revisión efectuada en 1998 se encontraron sólo 8 casos publicados de SPNI5. Con posterioridad se han descrito unos pocos casos más, lo que da una idea aproximada de su excepcionalidad.
Esta complicación se presenta preferentemente en pacientes pediátricos y mujeres jóvenes a quienes se ha realizado una neumonectomía, por lo que presentan una mayor elasticidad de los tejidos que contribuye a desarrollar un desplazamiento exagerado del mediastino hacia el lado de la neumonectomía2–7. En el caso presentado, por tratarse de un varón de 44 años, es posible que la baja masa corporal, el hábito de aspecto marfanoide y el drenaje del empiema pleural a los 12 días de la neumonectomía favorecieran el desarrollo del síndrome. Las manifestaciones clínicas y los datos de la tomografía coinciden con los de la mayoría de las publicaciones: disnea progresiva y estridor, así como un exagerado desplazamiento del mediastino hacia el lado operado, sin líquido en la cavidad pleural posneumonectomía; estrechez del bronquio intermediario entre el cuerpo de la vértebra dorsal por detrás y la arteria pulmonar derecha por delante, e hiperinsuflación pulmonar1,2,4–8. Sin embargo, el dolor pleurítico relacionado con los esfuerzos, que desapareció con la colocación de la prótesis, es de difícil interpretación fisiopatológica.
Otros síntomas, como la hipotensión arterial por bajo gasto cardíaco y la disfagia, se han asociado a este síndrome en la literatura médica, relacionados con la compresión vascular y esofágica, respectivamente9. La asociación de broncomalacia se ha observado principalmente en los casos con larga evolución de los síntomas postoperatorios2,3,5–7.
Se han propuesto varias opciones terapéuticas para tratar este síndrome. Algunas de ellas son actualmente anecdóticas, como la división del arco aórtico e interposición de una prótesis vascular entre la aorta ascendente y la aorta descendente, o la frenectomía para disminuir la compresión pulmonar derecha2,3,6,8. Muchos autores proponen la liberación quirúrgica del mediastino y relleno de la cavidad con una prótesis expandible de Silastic como el tratamiento de elección1,2,4,8,9. Sin embargo, algunos han comunicado el fracaso de esta técnica por la hipercorrección o por la asociación de broncomalacia2,4,6–8.
Gracias al desarrollo de endoprótesis metálicas autoexpandibles, el tratamiento endoscópico se utiliza cada vez más6. Constituye una técnica menos agresiva, de menor riesgo operatorio y con resultados satisfactorios demostrados, aun en pacientes con broncomalacia2,5–7. Sin embargo, algunos autores consideran que hacen falta estudios que demuestren la seguridad y eficacia a largo plazo de este método, principalmente por tratarse de pacientes jóvenes que llevarán la prótesis durante muchos años. Remarcan la posibilidad de obstrucción por granulomas, migración o erosión de la arteria pulmonar como complicaciones tardías8. En caso de que sea necesaria la colocación de una endoprótesis debido a malacia, estos mismos autores aconsejan las prótesis metálicas autoexpandibles8.
Considerando la posibilidad de adherencias ocasionadas por el empiema pleural postoperatorio, en nuestro caso se decidió el tratamiento endoscópico de forma precoz para evitar el desarrollo de broncomalacia. Los síntomas remitieron por completo en el postoperatorio inmediato, desapareciendo la disnea, los dolores pleuríticos asociados y el estridor, lo que permitió al paciente retornar a sus actividades habituales. Un seguimiento exhaustivo con fibrobroncoscopia o broncoscopia virtuales es esencial para verificar la correcta posición de la endoprótesis y la ausencia de granulomas que puedan obstruir la prótesis en un paciente neumonectomizado.
Finalmente, queremos destacar que el SPNI es una complicación excepcional, aunque posible, sin malformaciones vasculares mediastínicas. Su detección para aplicar un tratamiento precoz requiere un alto grado de sospecha clínica y es esencial para evitar complicaciones aún mayores como la broncomalacia. Consideramos que la endoprótesis metálica autoexpandible es un tratamiento seguro y eficaz. Es preciso realizar estudios estadísticos para determinar los resultados a largo plazo de esta técnica.