Resumen. Introducción. La trombosis venosa profunda (TVP) postoperatoria es una entidad frecuente y potencialmente grave, cuya actuación diagnóstica, profiláctica y terapéutica posee excelentes niveles de evidencia. No obstante, existen circunstancias patogénicas especiales, como el síndrome antifosfolípido (SAF), que pueden complicar la evolución de la trombosis con una hemorragia suprarrenal bilateral motivando incertidumbre en la toma de decisiones. Caso clínico. Varón de 75 años, con antecedentes de TVP de repetición en el contexto de un SAF primario (tratado indefinidamente con acenocumarol), que se somete a cirugía por cáncer de colon. En el postoperatorio presenta una TVP en la extremidad inferior izquierda, a pesar de una correcta profilaxis antitrombótica. Durante el tratamiento de la TVP presenta un cuadro abdominal compatible con una hemorragia suprarrenal bilateral. Se suspende el tratamiento, se inserta un filtro en vena cava inferior (TrapEase) y, días más tarde, confirmada la estabilización de la hemorragia, se reinicia la anticoagulación al observarse progresión de la trombosis. Evolución satisfactoria del paciente. Conclusión. El SAF es una conocida causa de TVP de repetición, que también origina hemorragia suprarrenal bilateral, máxime si se asocia a postoperatorio y fármacos anticoagulantes/antitrombóticos. El complejo equilibrio de tratar una TVP y evitar la progresión de una hemorragia suprarrenal bilateral forma parte del arte médico. [ANGIOLOGÍA 2008; 60: 279–84]
La trombosis venosa profunda (TVP) es un problema de permanente actualidad. El interés por su estudio radica en su frecuencia, potencial gravedad (embolia pulmonar), secuelas (síndrome postrombótico), e implicaciones socioeconómicas. En la trombogénesis venosa continúan vigentes los factores parietal, hemodinámico y sanguíneo descritos por Virchow (1856), si bien los actuales conocimientos los enfocan de forma muy distinta. Desde un punto de vista práctico las estrategias diagnósticas, profilácticas (en situación de riesgo) y terapéuticas de la mayoría de TVP están bien estandarizadas [1]. Sin embargo, persisten situaciones complejas. En el caso que presentamos la etiología de la TVP es multifactorial -edad elevada, síndrome antifosfolípido (SAF), TVP de repetición, cáncer de colon y postoperatorio- y presentó una excepcional complicación durante el tratamiento antitrombótico (hemorragia suprarrenal bilateral), que obligó a suspender temporalmente la anticoagulación e indicar una técnica de interrupción de la vena cava inferior.
Caso clínicoVarón de 75 años con antecedentes personales de enfermedad de Paget (fémur derecho), hipertrofia benigna de próstata y hernia de hiato. Intervenido quirúrgicamente por prolapso rectal hace 20 años. Antecedentes trombóticos: al menos cuatro TVP bien documentadas, en las extremidades inferiores; no episodios venosos en otras localizaciones, ni eventos arteriales. Síndrome postrombótico grado 3–4 en la clasificación CEAP en las extremidades inferiores. Diagnosticado en 1995 de SAF primario (anticuerpos anticardiolipina positivos y anticoagulante lúpico negativo); sin otros datos de trombofilia (factor V de Leiden y G20210A negativos, no déficit de proteína C, proteína S y antitrombina III). En tratamiento con alfuzosina (10mg/día), omeprazol (20mg/día), cloracepato dipotásico (5mg/día), hierro (1 comprimido/día) y acenocumarol en dosis ajustada para mantener un INR entre 2 y 3.
El paciente consulta de forma ambulatoria por anemia ferropénica y un estudio positivo de sangre oculta en heces. En la colonoscopia se descubre una tumoración ulcerada en ciego. El diagnóstico anatomopatológico y de extensión fue adenocarcinoma de colon grado C de Dukes. Se realizó hemicolectomía derecha. Previamente (48h) se suspendió el tratamiento con acenocumerol y se administró heparina de bajo peso molecular (HBPM) (enoxaparina, 60mg/24h), iniciada 12h antes de la cirugía y que mantuvo durante el postoperatorio.
Diez días después de la intervención el paciente refiere dolor e hinchazón en la extremidad inferior izquierda. No disnea, hemoptisis o dolor torácico. En la exploración destacaba tumefacción y dolor a la palpación, con aumento de temperatura e impotencia funcional, signo de Hommans positivo. Los pulsos periféricos estaban conservados. El resto de la exploración fue normal. El eco-Doppler informó de TVP en la vena femoral superficial y poplítea. Se descartó la existencia de embolismo pulmonar mediante angiotomografía computarizada. Se inició tratamiento con HBPM en dosis terapéuticas (enoxaparina, 1mg/kg/12h).
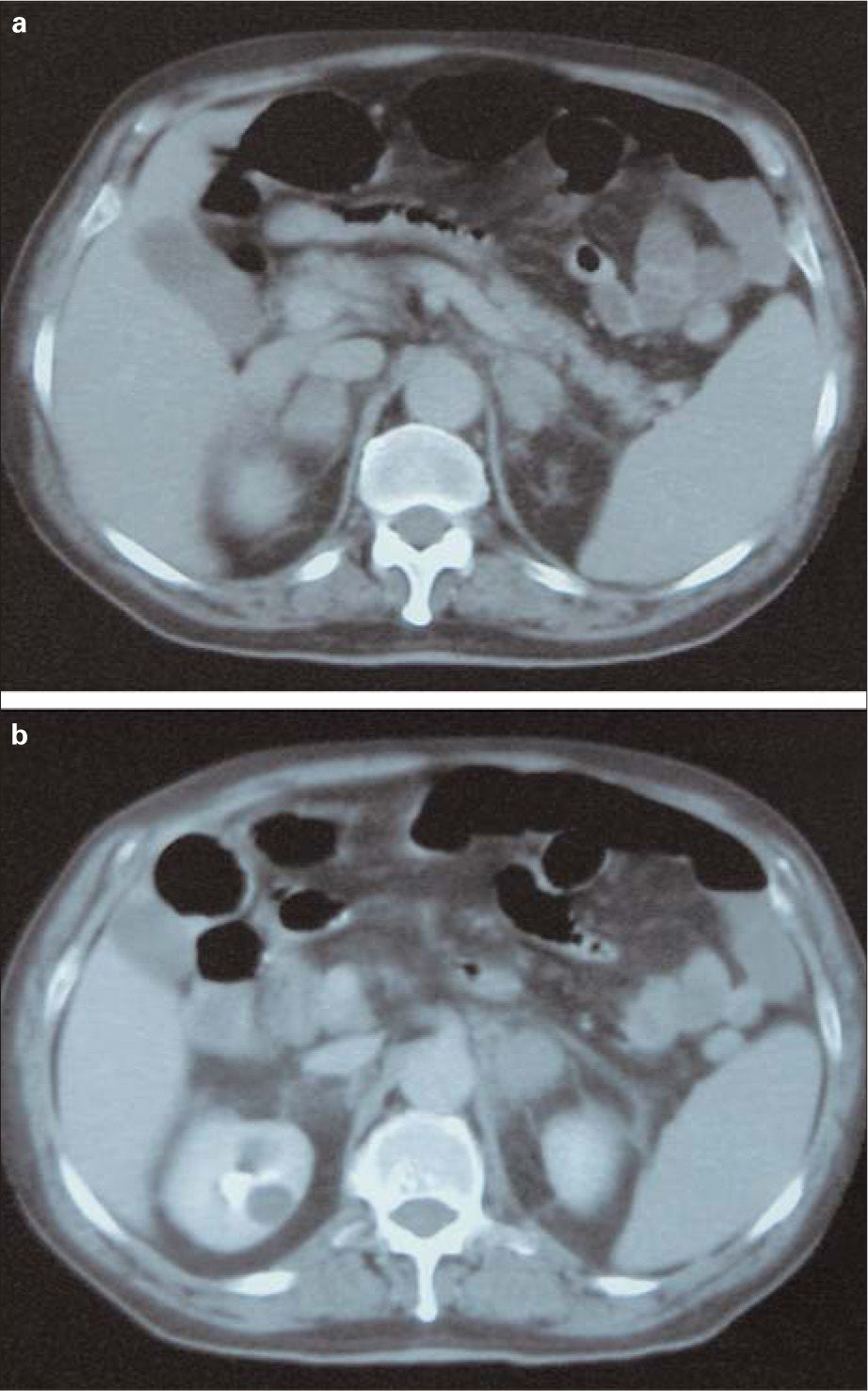
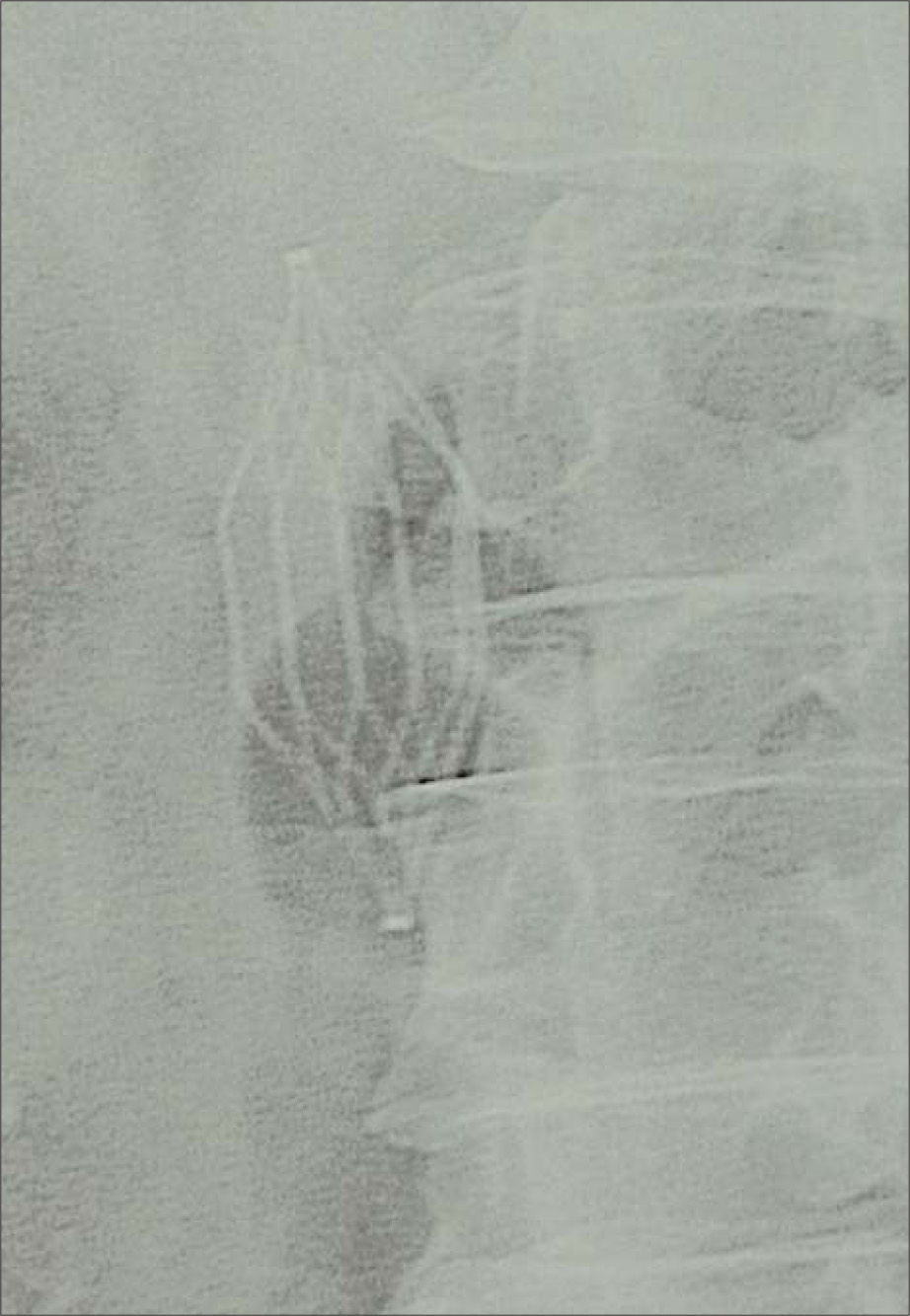
A partir del 16.° día del postoperatorio (seis días después de la TVP), el paciente comienza con dolor abdominal, náuseas/vómitos y fiebre de 38,4°C, sin foco clínico evidente, y tensión arterial de 145/90mmHg. Con el fin de descartar una posible infección posquirúrgica, se realiza una tomografía axial computarizada (TAC) abdominal, que muestra aumento de densidad y de tamaño (4 × 4cm) de ambas glándulas suprarrenales, con borramiento y aumento de la grasa adyacente compatible con hemorragia suprarrenal bilateral (Fig. 1). El paciente no presentaba datos clinicobiológicos de insuficiencia suprarrenal -sodio, 134mM/L (intervalo: 135–145); potasio, 2,9mM/L (3,5-5); urea, 31mg/dL (10–45), y creatinina, 1,1mg/dL (0,6-1,2)- y las repetidas determinaciones de cortisol fueron normales (11,9μg/dL). No obstante, las cifras de hemoglobina (Hb) y hematocrito (Hto) descendieron (Hb: 12,9 a 10,8g/dL; Hto: 37,9 a 31,7%), existiendo al cuarto día del diagnóstico de hemorragia una leve trombopenia (90 × 103/μL) y un alargamiento del tiempo de tromboplastina parcial activada (APTT) de 1,5-2,5 sobre el basal. Debido a la hemorragia activa secundaria al tratamiento con HBPM en dosis terapéuticas, se suspende este tratamiento y se inserta un filtro en vena cava inferior tipo TrapEase ® (Cordis, Miami, EE. UU.) (Fig. 2). Se añade piperacilina-tazobactam.
Siete días después de la colocación del filtro se objetiva progresión de la enfermedad tromboembólica, con trombosis de vena cava inferior y del filtro; al no evidenciarse por TAC incremento de la hemorragia suprarrenal, se inicia tratamiento con heparina no fraccionada intravenosa en dosis terapéuticas durante 10 días, seguido de acenocumarol para mantener un INR entre 2,5 y 3,5. En ningún momento el paciente recibió terapéutica hormonal. El paciente evolucionó favorablemente tras el tratamiento anticoagulante, con resolución de la trombosis femoral superficial y poplítea en el control por eco-Doppler realizado a los dos meses. En revisiones posteriores ha permanecido asintomático. Está pendiente de un nuevo TAC (seis meses) para valorar la posible atrofia de las glándulas suprarrenales.
DiscusiónSi la etiopatogenia de la TVP es de origen multifactorial, nuestro caso constituye un paradigma.
El SAF primario o secundario se caracteriza por inducir trombosis arteriales y/o venosas, trombopenia, etc., junto con la presencia de anticuerpos antifosfolípidos. Estos anticuerpos son inmunoglobulinas que se dirigen frente a los fosfolípidos de carga negativa (cardiolipina, etc.). Su presencia incrementa el riesgo de trombosis, y predice un elevado riesgo de recurrencia y muerte. La anticoagulación indefinida está indicada en estos pacientes [2].
De otro lado, la asociación de TVP a pacientes oncológicos es conocida desde hace muchos años. En el curso de ciertas neoplasias (digestivas, pulmón, genitourinarias, y mama) es frecuente asistir al desarrollo de una TVP, incrementándose el riesgo dos o tres veces. Intervienen como factores la desnutrición, la deshidratación con hemoconcentración y las alteraciones proteicas con aumento relativo del fibrinógeno. En su génesis, también intervienen reacciones inmunes a antígenos tumorales [2].
Finalmente, la TVP postoperatoria es con diferencia la forma más frecuente de trombosis. Su incidencia real es difícil de establecer; en pacientes operados del colon, sin profilaxis, la frecuencia puede superar el 25%. Valorar el papel de la cirugía en la TVP es muy difícil, ya que otros factores de riesgo (edad, neoplasia, etc.) entran en consideración. La profilaxis antitrombótica está indicada en este tipo de cirugía [2].
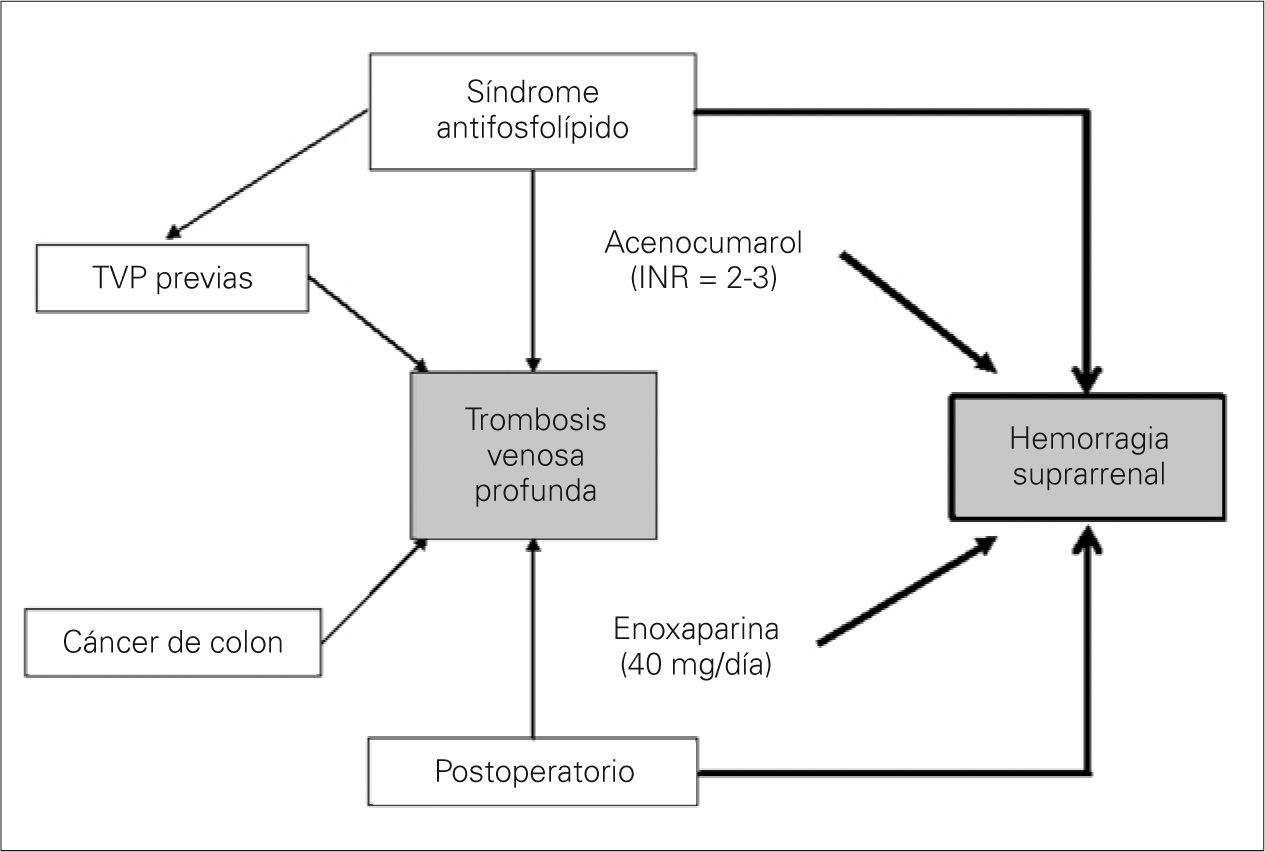
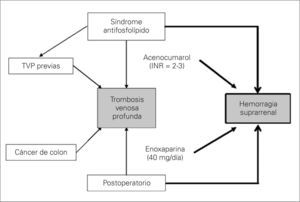
En nuestro paciente, a pesar de recibir una profilaxis antitrombótica de alto riesgo, la asociación de hasta cinco factores trombogénicos (predisponentes y desencadenantes) originó un nuevo episodio de TVP (Fig. 3). Hemos de tener en cuenta que la dosis profiláctica recibida en el perioperatorio (enoxaparina, 60mg/24h) fue insuficiente en nuestro paciente. Se acepta en pacientes quirúrgicos de alto riesgo trombótico una dosis de enoxaparina de 60mg/24h. Nuestro paciente recibía un tratamiento crónico con acenocumarol y, al no encontrarse en la fase aguda del tratamiento de la TVP, se decidió administrar dicha dosis. Es posible que una anticoagulación en dosis terapéutica hubiese disminuido el riesgo de recurrencia del episodio trombótico venoso y eliminado uno de los factores desencadenantes de la hemorragia suprarrenal bilateral (HSB), pero con un incremento notable del riesgo hemorrágico. No obstante, hubiera sido de interés una monitorización del tratamiento con la determinación de niveles de anti-Xa. Es posible que la monitorización con anti-Xa hubiera disminuido el riesgo hemorrágico al ajustar mejor los niveles de enoxaparina.
Patogenia de la trombosis venosa profunda (TVP) y de la hemorragia suprarrenal. El antecedente de síndrome antifosfolípido y trombosis venosa de repetición asociado a un postoperatorio de un paciente afecto de cáncer de colon son claros factores predisponentes y desencadenantes de una nueva TVP postoperatoria (flechas finas). En la aparición de la hemorragia suprarrenal de nuestro caso están presentes todos los mecanismos patogénicos invocados: diátesis hemorrágica (anticoagulación) y aumento en la liberación de hormona adrenocorticotropa y catecolaminas (estrés anestésico-quirúrgico) (fechas gruesas).
Las HBPM son actualmente el tratamiento de elección durante la fase aguda de una TVP. También conocemos que su empleo comporta riesgos y complicaciones [1,2]. Nuestro paciente, al sexto día del tratamiento con HBPM, presentó un cuadro abdominal que permitió mediante un TAC el diagnóstico de una HSB.
La HSB es un evento excepcional. Hasta la aparición del TAC su descripción era casi de autopsia. En la bibliografía anglosajona, hasta 1995, sólo se habían registrado 431 casos [3]. Aunque clásicamente la HSB se asocia a la sepsis meningocócica, se trata de una entidad heterogénea que responde a numerosas etiologías: sepsis/fallo multiorgánico, SAF, postoperatorio inmediato, empleo de anticoagulantes, etc. [4].
Espinosa et al [5], entre 1983 y 2002, han recogido de la bibliografía inglesa, francesa y española 86 pacientes con HSB y SAF; 13 habían sido operados y 5 recibieron anticoagulantes, pero ninguno de ellos presentó la asociación SAF + cirugía + anticoagulación. Ello hace único el caso que nosotros presentamos, que por otro lado es el cuarto caso publicado en la bibliografía española sobre HSB de cualquier etiología [6–8].
Las glándulas suprarrenales se hacen vulnerables a la hemorragia por diversos mecanismos [3]:
- –
Hormona adrenocorticotropa (ACTH), que aumenta el flujo arterial de la glándula suprarrenal.
- –
Catecolaminas, que contraen la musculatura de la vena central de drenaje, aumentando la resistencia al flujo y la presión sanguínea local.
- –
Diátesis hemorrágicas; así, estudios experimentales demuestran que la heparina o los dicumarínicos aumentan el riesgo de HSB en 5–10 veces.
- –
Diátesis trombóticas, donde la trombosis de la vena central de la glándula suprarrenal puede generar HSB; este último es el mecanismo implicado en el SAF.
Como se aprecia, en nuestro caso fueron varios los mecanismos patogénicos implicados (Fig. 3).
Una HSB puede manifestarse [5,6,8] clínicamente por dolor abdominal (55-66% de los pacientes) -que se supone que aparece en el momento de la hemorragia-, fiebre (40-50%), hipotensión (19-54%) y diversas manifestaciones neuropsiquiátricas, atribuibles a insuficiencia suprarrenal (12-19%). La aparición de una insuficiencia suprarrenal (Addison) es inconstante (10-36%). Analíticamente, en el 50% de casos podemos encontrar hiponatremia, hiperkalemia y azotemia, atribuible a insuficiencia suprarrenal, o bien signos de hemorragia oculta, con caída del Hto > 10% o disminución de la Hb > 2g/dL.
Nuestro paciente no presentó clínica de insuficiencia suprarrenal, si bien fue apreciable la caída en las cifras de Hb.
En la mayoría de casos el diagnóstico de HSB se realiza mediante TAC, al demostrar un reemplazamiento de ambas suprarrenales por masas generalmente hiperdensas [9]. El hematoma suele desaparecer en 1–6 meses, dejando una imagen de atrofia suprarrenal, lo que puede suponer una evolución hacia la insuficiencia suprarrenal crónica. Aunque la hemorragia suprarrenal puede ser unilateral, en los casos inducidos por SAF o anticoagulantes lo habitual es la afectación bilateral [4].
La confirmación de fracaso adrenal viene dada por determinaciones hormonales. El pronóstico de la HSB, sobre todo si asocia insuficiencia adrenal, ha mejorado notablemente con terapia hormonal [5–8].
Sabemos que el riesgo de trombosis recurrente en los pacientes con SAF es alto; por ello, es deseable en estos casos mantener una anticoagulación indefinida. Por otro lado y como se ha comentado, la anticoagulación también forma parte de la patogenia de la HSB. Por ello, se debe valorar el riesgo de nuevos episodios de HSB en el paciente anticoagulado, frente al riesgo de eventos trombóticos en el paciente no tratado. Dicho de otra manera, la anticoagulación puede actuar de forma favorable (evita la trombosis de las venas suprarrenales) o negativamente (incrementa la HSB). Al no existir precedentes en la bibliografía de nuestro caso, optamos por una actuación intermedia:
- –
Suspendimos la anticoagulación de forma temporal para evitar el incremento de la hemorragia, evitando con ello la aparición de una insuficiencia suprarrenal.
- –
Indicamos una técnica de interrupción de la vena cava inferior con el objetivo de evitar una embolia pulmonar mortal.
- –
Pasados unos días, reiniciamos nuevamente la anticoagulación, al observar mediante TAC la estabilización de la hemorragia, así como una progresión de la trombosis.
Al alta hospitalaria y dado el antecedente de recurrencia de trombosis venosa, la anticoagulación se mantuvo en intervalo superior al normal (INR 2,5-3,5). La utilización de anticoagulación de alta intensidad es un tema controvertido y no apoyado por estudios a gran escala; algunos autores sólo recomiendan esta pauta en pacientes de alto riesgo de recidiva, como parece ser nuestro caso, pero en última instancia depende de cada paciente en particular. Con esta estrategia nuestro paciente evolucionó satisfactoriamente.
Este trabajo ha recibido el segundo premio del Aula de Trombosis, Capitulo Español de Flebología, Sociedad Española de Angiología y Cirugía Vascular 2007.