La infección del pie diabético, sobre todo si se asocia a isquemia, es la causa más frecuente de amputación de la extremidad inferior en la población general, de ingreso hospitalario y de disminución de la calidad de vida en los diabéticos. El 15% de los diabéticos van a sufrir a lo largo de su vida una infección del pie, con una incidencia anual del 1-4%, precedida en más del 80% de los casos de una úlcera en el pie. Son infecciones complejas en cuyo pronóstico influyen muchos factores, dependientes de la úlcera (localización, extensión, cronicidad, amputación previa, grado de isquemia) y del paciente (edad, insuficiencia renal, tiempo de evolución de la diabetes, comorbilidad asociada), lo que hay que tener en cuenta a la hora de plantear su tratamiento. Las infecciones deben clasificarse en función de su gravedad (leves, moderadas-leves, moderadas-graves y graves). Su tratamiento es complejo y debe ser multidisciplinar; debe incluir desbridamiento, descarga, antibioticoterapia adecuada, revascularización y cura de la úlcera.
En este documento de consenso, fruto de la colaboración de la Sociedad Española de Angiología y Cirugía Vascular (SEACV), Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Quimioterapia (SEQ), Asociación Española de Cirujanos (AEC), Sociedad Española de Medicina de Urgencias y Emergencias (INFURG-SEMES) y Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), se desarrollan las pautas, basadas en la mejor evidencia disponible, de las infecciones de pie diabético, encaminadas a obtener la mayor eficacia clínica.
Diabetic foot infection, particularly if it is associated to ischaemia, is the most common cause of lower limb amputation, in the general population, of hospital admissions, and a decrease in the quality of life in diabetics. Of all diabetics, 15% of them are going to suffer from a foot infection during their life, with an annual incidence of 1-4%, preceded by a foot ulcer in more than 80% of cases. They are complex infections and the prognosis is influenced by many factors, depending on the ulcer (location, extension, whether chronic or not, previous amputation, ischaemia grade), and the patient (age, renal impairment, time of onset of diabetes, associated comorbidity). All these must be taken into account when establishing its treatment. The infections must be classified according to their severity (mild, moderate-mild, moderate-severe, and severe). Their treatment is complex and must be multidisciplinary and must include debridement, discharge, adequate antibiotic therapy, revascularisation, and treatment of the ulcer.
In this consensus document, produced in collaboration with the Spanish Angiology and Vascular Surgery Society (SEACV), the Spanish Society of Internal Medicine (SEMI), the Spanish Chemotherapy Society (SEQ), the Spanish Surgeons Association (AEC), the Spanish Society of Urgent Medicine and Emergencies (INFURG-SEMES) and the Spanish Society of Intensive and Critical Medicine and Coronary Care (SEMICYUC), the guidelines are developed based on the best available evidence on diabetic foot infections, aimed at achieving greater clinical efficacy.
La diabetes mellitus es un problema sanitario de primer orden, como lo demuestra su alta prevalencia y sus numerosas consecuencias. Una de las complicaciones más frecuentes durante la vida del diabético es la aparición de una úlcera en el pie. Un importante estudio europeo1 enfatiza en que la mitad de estas úlceras se acompañan de isquemia (49%) o de infección (58%), o de la conjunción de ambas en un tercio de los casos (31%). Ello agrava el proceso, incrementando la tasa de amputaciones y de mortalidad en estos pacientes.
Consciente de la problemática del pie diabético (PD), la Sociedad Española de Angiología y Cirugía Vascular (SEACV), en 1996 encarga a un comité ad hoc realizar un consenso sobre el PD2. Años más tarde (2005) la SEACV, atendiendo a la importancia que para la especialidad tenía todo lo referente al PD crea el grupo, hoy Sección, denominada PD-SEACV3. Solo un año después miembros de la SEACV y de la referida Sección son invitados a formar parte de un grupo de expertos, en representación de varias sociedades médicas, para realizar un documento de consenso sobre el tratamiento antimicrobiano de las infecciones en el PD, donde se recogen las pautas basadas en la mejor evidencia disponible, encaminadas a obtener la mayor eficacia clínica4. El tratamiento de las infecciones del PD, de gran complejidad, requiere una atención multidisciplinar por los múltiples factores que intervienen en su desarrollo5.
El presente documento nace fundamentalmente para dar continuidad y actualización de los consensos anteriormente citados. El grado y la calidad de evidencia clínica no es la más deseable debido a la falta de homogeneidad de la información disponible (ensayos clínicos), por lo que muchas de las decisiones presentadas se basan en la opinión de los expertos.
EpidemiologíaLa diabetes mellitus es una enfermedad de elevada prevalencia (6% de la población), existiendo un porcentaje similar de pacientes que presentándola no están diagnosticados, lo que ha multiplicado por 6 el número de diabéticos en los últimos 40 años6. Además, existe un incremento con la edad, alcanzando el 11% en mayores de 65 años7. En los países desarrollados es la séptima causa de muerte por causa directa, sin tener en cuenta su papel en la mortalidad cardiovascular, la principal causa de muerte precoz en diabéticos7–9.
Los pacientes diabéticos, al ver ampliada su expectativa de vida, presentan numerosos problemas, entre ellos el PD. Las principales complicaciones tardías de la diabetes (arteriosclerosis, neuropatía, retinopatía, etc.) son de etiopatogenia vascular (macro y microangiopatía) y metabólica. La úlcera en el pie es una de las complicaciones más frecuentes en las extremidades inferiores de los diabéticos. Aparece durante el curso de la enfermedad en aproximadamente el 15% de los casos10–12. Su incidencia anual es del 2-3% y del 7% en aquellos pacientes con neuropatía, y su prevalencia del 2-10%13,14.
Las infecciones del pie que afectan a la piel y tejidos blandos, y al hueso, con o sin repercusión sistémica, son la causa más frecuente de hospitalización de los diabéticos (25%), con estancias prolongadas11.
La diabetes es la causa más frecuente de amputación de la extremidad inferior en Europa y EE.UU.15. La tasa anual de amputaciones ajustada por edad es del 82 por 10.000 diabéticos. Estos enfermos tienen entre 15 y 40 veces más posibilidades de requerir una amputación que los no diabéticos, y los hombres al menos un 50% más que las mujeres8,16. Los diabéticos con una úlcera en el pie requerirán una amputación en el 14-20% de las ocasiones y a su vez la úlcera del pie es la precursora de más del 85% de las amputaciones de las extremidades inferiores en estos pacientes17,18. Después de la amputación de una extremidad inferior, la incidencia de una nueva úlcera y/o la amputación contralateral a los 2-5 años es del 50%11,19. La supervivencia de los pacientes diabéticos amputados es significativamente peor que la del resto de la población, y aún menor si han sufrido otra amputación previa11. Solo el 50 y 40% de los pacientes sobreviven a los 3 y 5 años de una amputación, respectivamente, y el pronóstico empeora conforme se eleva el nivel donde se realiza la misma19,20.
Aunque no se conocen con precisión los costes derivados de las úlceras e infecciones del PD, en EE.UU. se calcula que un episodio ulceroso cuesta entre 4.500 y 28.000 dólares a los dos años del diagnóstico, con una media de 5.500 dólares por paciente y año21,22. A pesar de que el tiempo de hospitalización de una amputación ha disminuido, sigue siendo un procedimiento oneroso, oscilando entre 20.000 y 40.000 dólares, en función del nivel de la amputación, la estancia o las comorbilidades del paciente11,23. Cifras más actualizadas e igualmente elevadas se tienen para Europa24.
Finalmente cabe referir que hay disponibles recientes estudios epidemiológicos españoles25,26 que informan en igual dirección (prevalencia, frecuencia de amputación, mortalidad, etc.).
FisiopatologíaEl conocimiento de la fisiopatología del PD es esencial para su cuidado óptimo, pues modificando los factores que influyen en su desarrollo se puede restaurar o mantener el pie intacto, conservando la extremidad y manteniendo un pie sano para que el paciente pueda hacer una vida completamente normal.
Aunque las lesiones del PD pueden parecer diferentes, la vía a la ulceración del pie y sus complicaciones son muy similares, siendo diversos los factores que la determinan. La neuropatía, presente en más del 90% de las úlceras, tiene un papel prínceps el desarrollo y progresión del PD. Provoca un pie insensible y deformado, alterando la biomecánica de la marcha, desarrollando hiperqueratosis (callos), donde se concentra la presión plantar, y donde, por un pequeño traumatismo, se produce una úlcera. Si el paciente no es consciente de la misma por la pérdida de sensibilidad, continúa andando, alterándose la cicatrización. La isquemia por obstrucción arterial, que existe en el 50% de las úlceras, y la infección, son las que determinarán el pronóstico de la úlcera y de la extremidad.
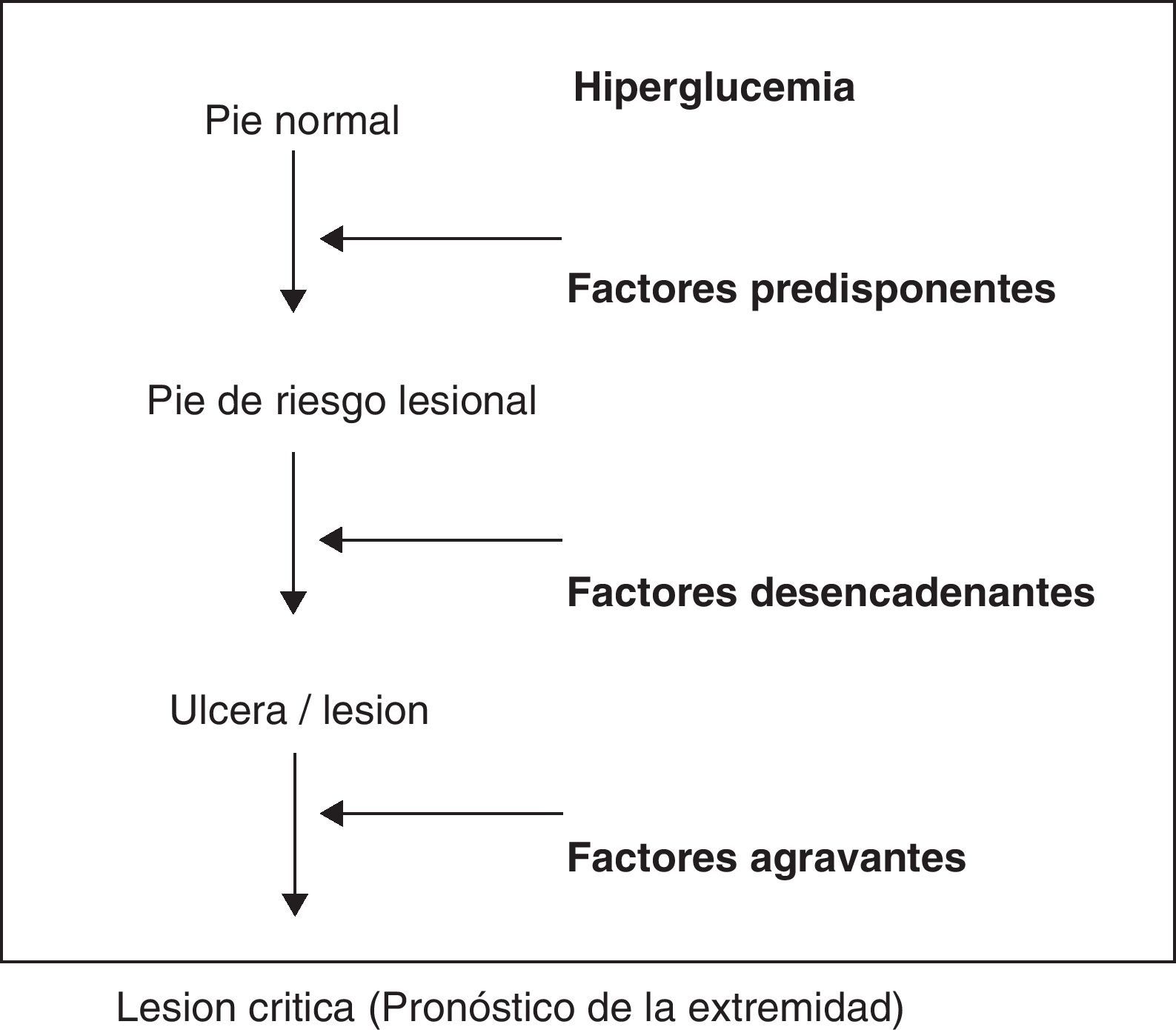
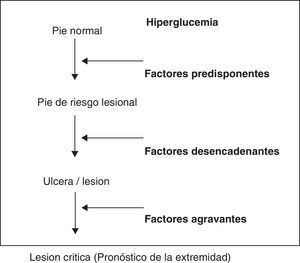
Esquematizando, existen unos factores predisponentes, neuropatía asociada en mayor o menor grado a macro y microangiopatía, que provocan un pie vulnerable, de alto riesgo; unos factores precipitantes o desencadenantes, generalmente un traumatismo mecánico, que producen una úlcera o necrosis y unos factores agravantes que determinan el pronóstico de la extremidad, que son la infección, que provocará daño tisular extenso, la isquemia que retrasará la cicatrización y la neuropatía que evitará el reconocimiento tanto de la lesión como del factor precipitante27(fig. 1).
La forma más frecuente de neuropatía es la polineuropatía metabólica, simétrica, distal, crónica, de aparición insidiosa, somática (sensitivo-motora) y autonómica. Afecta predominantemente a miembros inferiores28. Se encuentra aproximadamente en un 30% de los diabéticos29, aumentando su prevalencia conforme aumenta el tiempo de evolución de la enfermedad30.
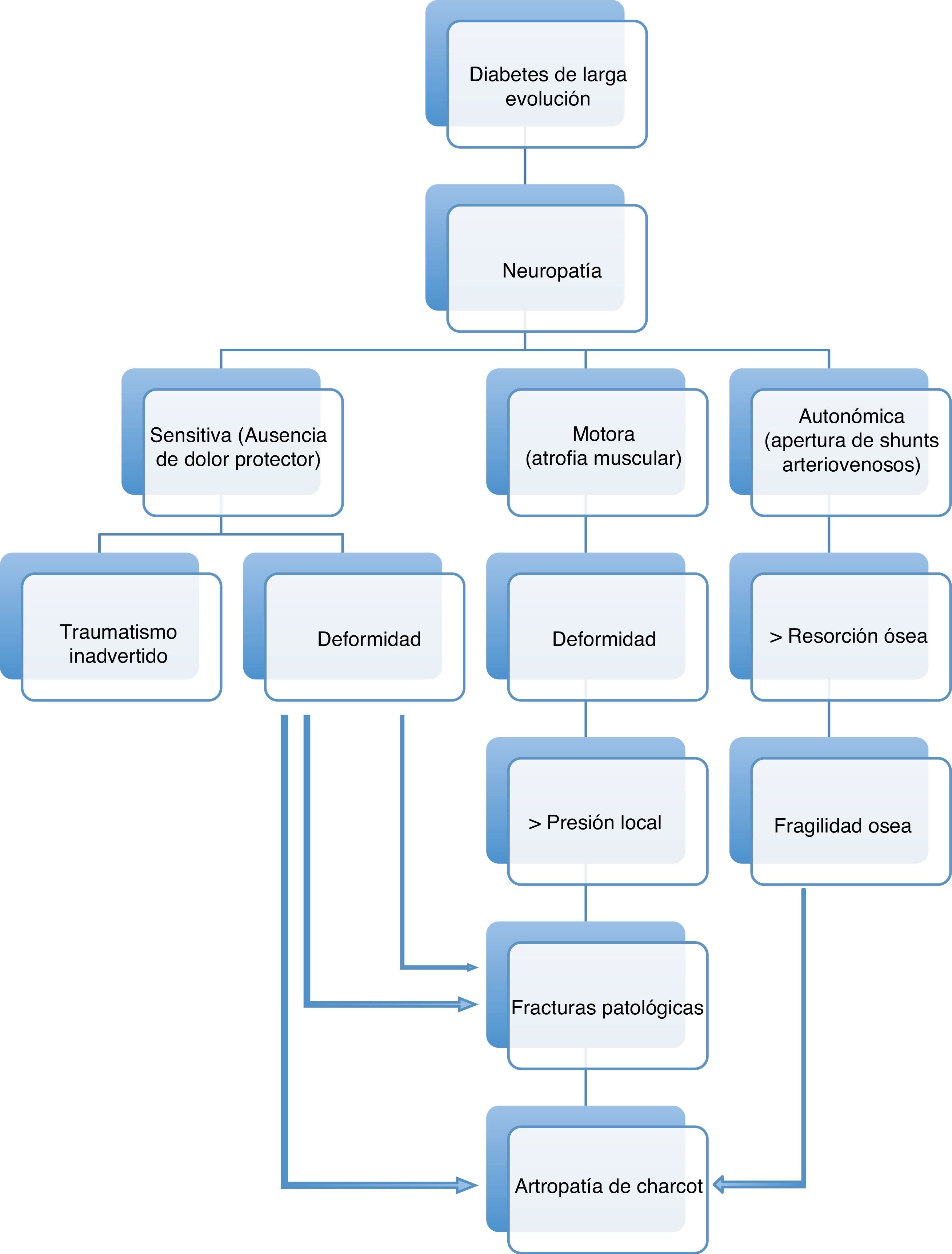
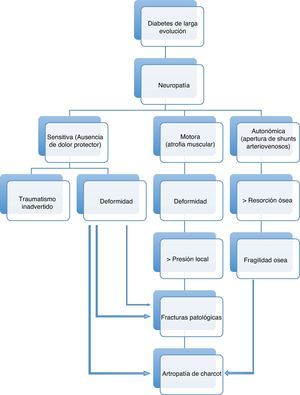
La afectación sensitiva suele ser asintomática. Produce inicialmente pérdida de la sensación de dolor y temperatura, y posteriormente de la percepción de vibración y la sensibilidad superficial. Debido a ella los diabéticos no son capaces de detectar los cambios de temperatura, el exceso de presión producido por zapatos ajustados o cualquier otro traumatismo mantenido. La afectación motora provoca atrofia y debilidad de los músculos intrínsecos del pie, perdiéndose la función de estabilización de las articulaciones metatarsofalángicas e interfalángicas, produciendo una contractura dinámica de los flexores y extensores largos, provocando dedos en martillo y dedos en garra, que conducen a la protrusión de las cabezas de los metatarsianos y a una distribución anormal de las cargas en el pie28. La neuropatía autonómica31 da lugar a anhidrosis, ocasionando piel seca o fisuras formando tejido calloso en áreas de carga, a apertura de shunts arteriovenosos cutáneos que, en ausencia de patología arterial obstructiva, disminuye la perfusión de la red capilar y aumenta la temperatura de la piel, provocando un trastorno postural en la regulación del flujo y una respuesta inflamatoria anormal a la agresión tisular32 y a edema neuropático33. Todo ello, a través del aumento de la actividad osteoclástica y mediante una reacción inflamatoria mediada por interleuquinas, puede dar lugar a una neuroartropatía de Charcot, una de las peores consecuencias de la diabetes en el pie34(fig. 2).
La neuropatía, con o sin isquemia asociada, está implicada en la fisiopatología de la úlcera del PD entre el 85 y 90% de los casos35–37, y la isquemia por macroangiopatía diabética entre el 40 y 50%, generalmente asociada a neuropatía35,36. La macroangiopatía diabética no es más que una arteriosclerosis en pacientes diabéticos, sin diferencias en el tipo de lesión anatomopatológica. Sin embargo, aparece a una edad más temprana, con similar incidencia en ambos sexos38 y con diferente localización de las lesiones, pues suele ser multisegmentaria, bilateral y distal39.
Existe una amplia controversia sobre la importancia real de la microangiopatía diabética en la fisiopatología del PD40. No hay disminución de la luz, pero sí un engrosamiento de la membrana basal capilar secundario a hiperglucemia, glucosilación no enzimática de colágeno y proteinglicanos y susceptibilidad genética41. Existen anomalías funcionales a nivel capilar, puesto que la última responsable de la necrosis tisular es el fracaso de la función de la microcirculación, que en diabéticos es debido a una interacción de los efectos que sobre ella tienen la neuropatía, la macroangiopatía y la propia microangiopatía.
La neuropatía sobre todo, asociada en ocasiones a la isquemia, junto con el resto de los factores descritos, son los que sitúan al PD en riesgo de ulceración. Pero es su combinación con los factores precipitantes o desencadenantes lo que provoca la úlcera. El factor principal son los traumatismos42 mecánicos, térmicos o químicos27, siendo los más frecuentes los mecánicos, generalmente por zapatos mal ajustados en las úlceras neuroisquémicas o por sobrecarga de presión en los callos formados en las neuropáticas35,43.
La infección no suele ser la causa de la úlcera, excepto en casos concretos de infecciones fúngicas (Tinea pedis, candidiasis) en los espacios interdigitales. Sin embargo, va a determinar en gran manera tanto el pronóstico como el tratamiento de cualquier lesión del pie, sobre todo si se asocia a isquemia. La solución de continuidad de la piel que supone una úlcera en el pie es una puerta de entrada para microorganismos. Existe una alteración del sistema inmune, tanto celular como humoral, concretamente de los granulocitos, afectando la diapedesis, adherencia leucocitaria, quimiotaxis, fagocitosis y lisis intracelular. Estos aspectos están agravados por un mal control de la glucemia44, que por otro lado produce glucosilación proteica no enzimática, alterando su función y estructura. Esto, con la pérdida de la sensibilidad provocada por la neuropatía, permite que el paciente camine sobre tejidos infectados sin ser consciente de ello, facilitando la difusión de la infección a planos más profundos, incrementando su gravedad45.
Los signos tradicionales de inflamación pueden ser debidos a otra causa, como la osteoartropatía aguda de Charcot, o estar ausentes en caso de isquemia u osteomielitis subyacente46.
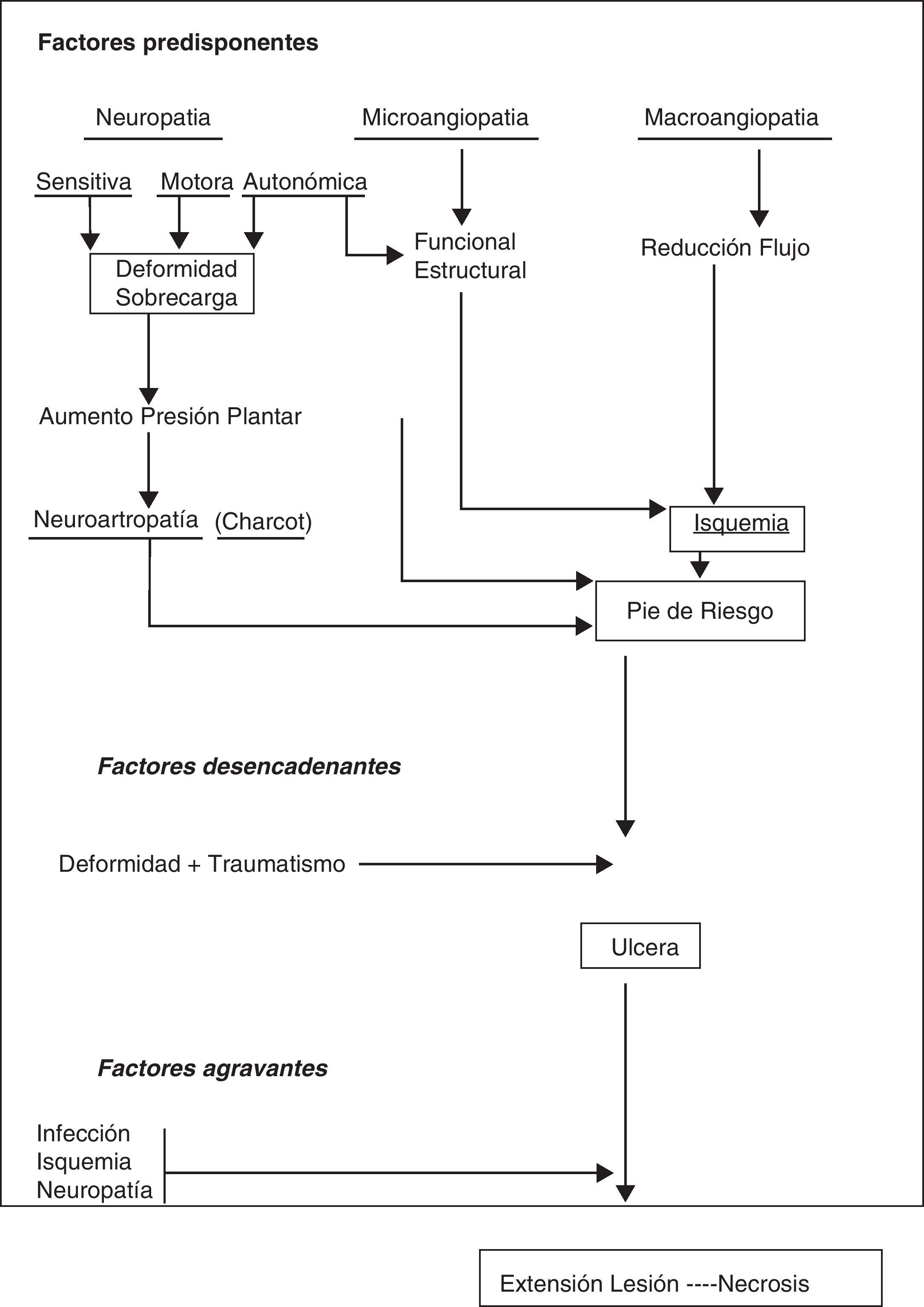
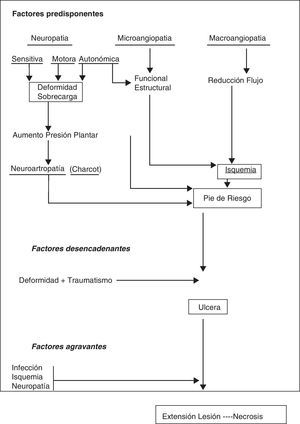
Podría resumirse la compleja fisiopatología del PD en que la hiperglucemia crónica provoca alteraciones biofísicas y bioquímicas en diferentes órganos y sistemas. En el caso del pie sobre todo neuropatía y macroangiopatía, y menos microangiopatía, convierten al PD en un pie de alto riesgo, sobre el que generalmente un traumatismo crónico y mantenido provoca una úlcera. El pronóstico de la úlcera y por tanto de la extremidad va a estar en función de las propia neuropatía, de la isquemia y de la infección que acompaña a la úlcera en mayor o menor grado4(fig. 3).
EtiologíaLos microorganismos implicados en la etiología de la infección del PD varían según el tipo de infección y determinadas situaciones del paciente (tratamiento antibiótico, manipulación u hospitalización previas) (tabla 1)4,47.
Etiología de las infecciones del pie diabético
| Infección | Microorganismos |
| CelulitisErisipela | Staphylococcus aureusEstreptococos beta hemolíticos (A, B, C y G) |
| Úlcera no tratada con antibióticos | Staphylococcus aureusEstreptococos beta hemolíticos (A, B, C y G) |
| Úlcera tratada con antibióticos o de larga evolución (generalmente polimicrobianas) | Staphylococcus aureusStaphylococcus aureus resistente a la meticilinaStreptococcus spp.Enterococcus spp.EnterobacteriasPseudomonas aeruginosaOtros bacilos gramnegativos no fermentadoresCorynebacterium spp.Candida spp. |
| Fascitis necrosante o mionecrosis (generalmente polimicrobianas) | Cocos grampositivos aerobiosEnterobacteriasBacilos gramnegativos no fermentadoresAnaerobios |
Las infecciones superficiales, como la erisipela y la celulitis, suelen estar producidas por grampositivos, especialmente estreptococos betahemolíticos de los grupos A, B, C y G y Staphylococcus aureus, respectivamente4,47. Las infecciones de las úlceras son generalmente polimicrobianas y mixtas, aislándose bacterias grampositivas y gramnegativas, facultativas y anaerobias, y Candida spp.48,49. La complejidad de la flora encontrada aumenta con los ingresos en el hospital, la duración clínica de la úlcera48,49, la profundidad/gravedad de la lesión y los antecedentes de tratamientos antimicrobianos48. En ocasiones los cultivos son negativos (6-12%)48,50. Este hecho puede deberse, entre otras circunstancias, a que los estudios microbiológicos son realizados a partir de muestras recogidas mientras el paciente está recibiendo antibióticos, las muestras no son representativas de la infección, la metodología microbiológica empleada no es adecuada o no se dispone de técnicas con la sensibilidad suficiente.
En las infecciones recientes los cultivos son con más frecuencia monomicrobianos y las bacterias más encontradas son S. aureus seguida de diversas especies de Streptococcus49.
En las infecciones de larga duración el papel de S. aureus y de los estreptococos sigue siendo importante, aunque baja el porcentaje de su recuperación. Se incrementa el de estafilococos coagulasa negativo (ECN), Enterococcus spp., bacilos gramnegativos —particularmente de Pseudomonas aeruginosa— y anaerobios49. En la India, en estudios recientes, el porcentaje de aislamientos de alguna especie de enterobacterias y P. aeruginosa iguala o incluso supera al de S. aureus51,52.
En infecciones moderadas o graves de úlceras, empleando tecnología microbiológica muy exigente y en pacientes que no recibían antibióticos, se ha comunicado el aislamiento de anaerobios en casi la mitad de las muestras positivas, en la mayoría de los casos en asociación. Se aislaron de una a 8 especies bacterianas por muestra, con una media de 2,7 microorganismos por cultivo. Por orden de frecuencia entre los aerobios y facultativos se recuperaron S. aureus, sensibles y resistente a la meticilina (18,7%), ECN (15,3%), Streptococcus spp. (15,5%), Enterococcus spp. (13,5%), enterobacterias (12,8%), Corynebacterium spp. (10,1%) y P. aeruginosa (13,5%). La distribución de los anaerobios fue la siguiente: cocos grampositivos (45,2%), Prevotella spp. (13,6%), Porphyromonas spp. (11,3%) y diversas especies del grupo de Bacteroides fragilis (10,2%)48.
En un estudio que empleó técnicas moleculares para investigar la etiología de úlceras crónicas infectadas, S. aureus fue la bacteria más detectada53. Otros aerobios y facultativos detectados fueron Morganella morganii, Enterococcus faecalis, Citrobacter spp. y Haemophilus spp. Entre los anaerobios los más frecuentes fueron: Anaerococcus spp., Bacteroides fragilis, Finegoldia magna, Peptoniphilus spp., Clostridium spp. y Veillonella spp.53.
En infecciones complicadas un estudio reciente realizado en España ha mostrado unos resultados similares, salvo en el hecho de que hubo superioridad de la etiología monomicrobiana (59%). La mayoría de los pacientes habían recibido antibióticos el mes anterior. Los grampositivos fueron los más recuperados tanto en cultivos monomicrobianos como polimicrobianos. Entre los gramnegativos predominaron las enterobacterias sobre los bacilos gramnegativos no fermentadores. Las bacterias anaerobias se aislaron fundamentalmente en cultivos polimicrobianos. Por orden de frecuencia las especies más recuperadas fueron: S. aureus (33%), P. aeruginosa (12%), Escherichia coli (8%) y E. faecalis (8%). El 38% de las cepas de S. aureus fueron resistentes a la meticilina (SARM), lo que significa que esta bacteria estaba presente en el 12% de las muestras clínicas analizadas50.
Las diferencias observadas en la bacteriología de las úlceras del PD se han relacionado con el tipo de muestra utilizada, la calidad del procesamiento microbiológico, la presencia o no de infección, la gravedad, el tratamiento antimicrobiano previo y las variaciones geográficas y temporales48.
En las fascitis necrosantes y gangrenas se aíslan fundamentalmente cocos grampositivos facultativos, enterobacterias, bacilos gramnegativos no fermentadores y anaerobios4,47.
En las osteomielitis un importante número de muestras tomadas por biopsia o aspiración son estériles. En las que se obtiene crecimiento bacteriano se suelen encontrar pocas especies bacterianas, con frecuencia solamente una. Los microorganismos aislados son similares a los encontrados en las úlceras crónicas. En un estudio reciente en alrededor del 50% de los casos se aislaron bacterias grampositivas, especialmente S. aureus sensible y resistente a la meticilina, a distancia de estafilococos coagulasa negativa, estreptococos del grupo B, enterococos y corinebacterias. Los bacilos gramnegativos se recuperaron en cerca un 40% de los casos, superando las enterobacterias a los no fermentadores. En aproximadamente un 10% de las ocasiones se encontraron bacterias anaerobias54–56.
Las bacterias aisladas en las infecciones del PD pueden ser multirresistentes. Como factores de riesgo significativos se han descrito la antibioterapia previa, la duración del tratamiento antimicrobiano, la frecuencia de ingresos hospitalarios por la misma herida, la duración de la/s estancia/s hospitalaria/s, la presencia de osteomielitis57 y neuropatía y el tamaño de la úlcera58.
Atendiendo a especies bacterianas concretas, S. aureus es la más recuperada, tanto en infecciones leves como en la graves, en las recientes y en las de larga evolución. En un 20% de las ocasiones se aísla en cultivo puro48. Esta bacteria dificulta la curación y coloniza persistentemente las úlceras59, especialmente la parte profunda y tejidos circundantes60. Se estima que en la mayoría de las infecciones el S. aureus sensible a meticilina (SASM), SARM y los estreptococos son los patógenos primarios y que el tratamiento dirigido hacia ellos las curaría independientemente de las bacterias acompañantes. Así, se ha formulado el concepto de la «cabeza de la serpiente» (cocos grampositivos), según el cual destruyéndola se mataría el cuerpo (bacilos gramnegativos y anaerobios)61. Se ha descrito la existencia de diferencias genómicas entre las cepas colonizantes y las que producen infección. En estas últimas son más frecuentes los genes de resistencia a los aminoglucoósidos59 y los que codifican algunos determinantes de virulencia59,62. Un número importante de cepas producen capa mucosa y adhesina intercelular polisacárida63, y un porcentaje variable son resistentes a la meticilina. En la revisión de Eleftheriadou64 los SARM representan del 15 al 30%, detectándose tanto en el hospital como en la comunidad. En España y en PD con infecciones complicadas se ha comunicado en un 38%50. Así mismo hay que señalar que su presencia se ha incrementado con el paso del tiempo65. El riesgo de resistencia a la meticilina se incrementa por el ingreso previo en el hospital, la duración de la úlcera, la insuficiencia renal crónica49, la presencia de osteomielitis, la colonización nasal, el uso previo de antimicrobianos y el tamaño de la úlcera64. La infección por SASM y SARM es un factor predictivo significativo de la amputación de una extremidad66. El conocimiento de la prevalencia local de la resistencia a meticilina es importante para el establecimiento de la terapia antimicrobiana empírica. La sensibilidad de los SARM a vancomicina es un motivo de controversia. Las concentraciones mínimas inhibitorias (CMI) han aumentando (cepas con resistencia moderada y elevada), existen aislados tolerantes67 e incluso hay muchos fallos terapéuticos en cepas con CMI dentro de la sensibilidad68.
Entre los ECN se ha comunicado el aislamiento de S. epidermidis, S. lugdunensis, S. haemolyticus y con menor frecuencia de S. auricularis, S. capitis, S. caprae, S. cohnii, S. hominis, S. schleiferi, S. sciuri, S. simulans, S. warneri y S. xylosus. El S. epidermidis suele ser el más frecuente y su aislamiento no suele asociarse al de S. aureus48. La mayoría de las cepas de S. epidermidis recuperadas del PD producen capa mucosa y adhesina intercelular polisacárida63. S. epidermidis suele aislarse más en úlceras neuroisquémicas que en neuropáticas69.
Streptococcus agalactiae se aísla en las infecciones del PD, incluso en formas graves, sobre todo si existe insuficiencia renal crónica, enfermedad arterial grave, alcoholismo, sobrepeso y/o inmunodepresión70.
El papel de los enterococos es controvertido, como evidencia la buena respuesta clínica de las úlceras con este microorganismo cuando se tratan con ertapenem, un antibiótico al que presentan resistencia natural71.
En un porcentaje importante de pacientes se aíslan diversas especies de Corynebacterium48. Consideradas habitualmente poco patógenas, estudios genómicos recientes han demostrado que son una parte importante de la biopelícula característica de las infecciones crónicas del PD72.
P. aeruginosa, una bacteria productora de capa mucosa, se aísla con más frecuencia y de forma significativa en las úlceras de evolución crónica49. Tradicionalmente se consideran factores de riesgo las circunstancias que favorecen la maceración de las úlceras4. En muchos casos está documentado el antecedente de tratamiento antimicrobiano en el mes anterior50. Su papel patogénico, como en el caso del enterococo, no está claro, pues en infecciones mixtas en las que se aisló se ha comunicado una respuesta clínica similar con ertapenem y con piperacilina- tazobactam71. Como en otras infecciones se aíslan cepas resistentes a imipenen y/o meropenen, productoras de carbapenemasas73. Con menor frecuencia se recuperan otros no fermentadores como Stenotrophomonas maltophilia, Alcaligenes faecalis48 o Acinetobacter spp.51.
Entre las enterobacterias aisladas predominan E. coli y Klebsiella spp., que pueden ser productoras de betalactamasas de espectro extendido (BLEE), un hecho que en determinados países como la India es creciente52,58,74,75, donde alcanza hasta el 44,758. En España un 29% de las cepas de E.coli fueron resistentes amoxicilina-ácido clavulánico y ciprofloxacino50. También se recuperan Enterobacter cloacae, Serratia marcescens y Citrobacter freundii48,50, especies que producen AmpC inducible codificada cromosómicamente y Proteus spp., Providencia spp. y Morganella morganii48,50 que presentan resistencia natural a tigeciclina.
Los anerobios, como se ha comentado anteriormente, se aíslan en úlceras de larga evolución y en el marco de infecciones polimicrobianas48.
Los datos sobre la implicación de los hongos en la infección del PD son escasos y discordantes. Yates et al. tan solo aislaron hongos en el 0,4% de sus aislamientos49. En estudios prospectivos dirigidos a la búsqueda de hongos en infecciones de úlceras del PD las diferencias geográficas —asociadas a otros factores— son marcadas. Un estudio realizado en Croacia cifró el aislamiento de Candida spp. en un 4,3%, siendo la especie más recuperada C. parapsilosis, asociada generalmente a diferentes bacterias en el marco de una infección mixta grave76. En contraposición, otro estudio realizado en la India encontró hongos en el 65% de los pacientes. En el 77% se aislaron levaduras, en su mayoría pertenecientes al género Candida (93%), especialmente C. albicans (49%), C. tropicalis (23%), C. parapsilosis (18%), C. guillermondi (5%) y C. krusei (5%). Las otras especies de levaduras aisladas fueron Trichosporon cutaneum y T. capitatum. Trichophyton spp. fue el único dermatofito recuperado. Los mohos se aislaron en el 38% de los pacientes, especialmente Aspergillus spp. (72%). También se cultivaron Fusarium solani, Penicillium marneffei y Basidiobolus ranarum77.
Las biopelículas son frecuentes en las infecciones crónicas de las úlceras, en las que están incluidas numerosas bacterias como se ha demostrado genómicamente72. La biopelícula explica alguna de las características de estas infecciones como cronicidad, etiología polimicrobiana, importancia y dificultad de la toma de la muestra para el diagnóstico, limitación de las técnicas microbiológicas tradicionales que solo recuperan algunas bacterias, utilidad de las técnicas genómicas y problemas en el tratamiento, ya que es imprescindible retirarla (desbridamiento).
ClasificaciónSería ideal disponer de un sistema de clasificación de las lesiones del PD que normalizara las definiciones de las distintas situaciones clínicas. Esta clasificación es necesaria para conocer la evolución de las distintas lesiones, para comparar los resultados de distintos tratamientos y para mejorar la comunicación interdisciplinaria. Se ha desarrollado una gran variedad de sistemas de clasificación, aunque ninguno ha sido aceptado universalmente.
Se propuso clasificar las heridas por presión en grados, según la profundidad de la herida y las estructuras que progresivamente se iban exponiendo en su fondo78. Meggitt estableció una clasificación de las úlceras del PD aplicando este concepto79, clasificación popularizada por Wagner, que se ha convertido en clásica y es probablemente la más utilizada en el mundo80.
Da gran importancia a la profundidad de la lesión. Se inicia en el grado 0 (situación de «pie de riesgo» con piel no penetrada), progresa al grado 1 (destrucción de la barrera dérmica alcanzando el tejido celular subcutáneo) y posteriormente al grado 2, donde se expone el tendón, la cápsula articular o el hueso. Si a esta úlcera profunda se asocia una artritis séptica, osteomielitis o absceso, se trata del grado 3. Los grados 0 y 1 se suelen tratar ambulatoriamente, y los 2 y 3 precisan ingreso hospitalario. Los grados 4 y 5 implican gangrena isquémica, el primero limitado al antepié y el segundo a todo el pie. En úlceras neuropáticas la tasa de cicatrización es menor y la de amputación mayor conforme aumenta la profundidad de la úlcera y alcanza tendón, hueso o articulación81,82. De hecho, todas las clasificaciones posteriores incorporan el grado de profundidad de la herida como un parámetro básico.
La limitación de esta clasificación estriba en que los grados 4 y 5 no son una fase más avanzada de los 1, 2 y 3, no diferencia si hay o no isquemia en los grados 1, 2 y 3, fundamental para conocer el pronóstico, y no especifica si hay infección asociada y en qué grado.
Se han analizado por separado isquemia y profundidad83, siendo la clasificación más completa probablemente la de la Universidad de Texas84. Valora profundidad, isquemia e infección. Relaciona los grados 0, I, II y III de profundidad de la lesión, similares a los previamente descritos en las anteriores clasificaciones, con un estadio A, B, C y D: no infección, no isquemia (A); infección sin isquemia (B); isquemia sin infección (C); e isquemia e infección (D).
Ha sido validada por sus autores demostrando que conforme aumenta el grado y el estadio de la lesión, empeora el pronóstico de la misma, siendo mucho más elevada la probabilidad de amputación85.
Para la categorización de las úlceras en subgrupos se han desarrollado sistemas de puntuación de gravedad basados en parámetros clínicos estandarizados de la herida, como el sistema S(AD)SAD, que valora tamaño (size) con área (area) y profundidad (depth), sepsis, arteriopatía y denervación, graduando cada parámetro de 0 a 3 de menor a mayor gravedad86, el sistema PEDIS (Perfusión, Extensión, Depth–profundidad, Infection y Sensation)87, el DUSS (Diabetic Ulcer Severity Score) basado en la existencia o no de 4 criterios de gravedad, valorando con un punto si se da dicho criterio y con cero puntos si no se da: ausencia de pulsos distales (1 punto), sondaje al hueso positivo (1 punto), úlcera localizada en cualquier parte del pie distinta de los dedos (1 punto) y la existencia de más de una úlcera (1 punto)88, y el sistema de puntuación de la herida de Strauss, que valora 5 parámetros y gradúa cada uno de ellos de 0 a 289.
Un aspecto fundamental para el manejo de las infecciones del PD es conocer la gravedad de la infección, que determina el pronóstico y la estrategia terapéutica.
Puede clasificarse por su profundidad en superficiales (piel y tejido celular subcutáneo [TCS]) y profundas (atraviesa la fascia superficial afectando estructuras profundas) o por su clínica en leves (sin riesgo para la extremidad, superficiales, con celulitis menor de 2cm), moderadas (con riesgo para la extremidad, profundas, con osteomielitis frecuente y celulitis más extensa, que suelen requerir hospitalización) y graves (amenazan la vida, se acompañan de sepsis, suelen presentar celulitis masiva, abscesos profundos, fascitis necrosante y/o mionecrosis y suelen requerir cirugía urgente)90.
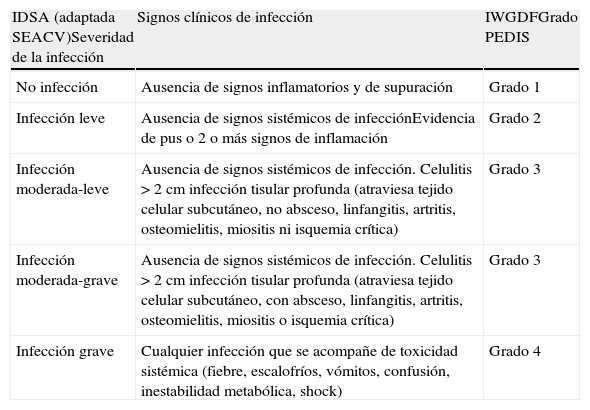
El Consenso Internacional sobre Pie Diabético (2003) clasificó la infección en 4 grados (PEDIS):1 (ausencia de signos de infección), 2 (infección leve con afectación exclusiva de piel y tejido celular subcutáneo), 3 (infección moderada, con celulitis extensa y/o infección profunda) y 4 (infección grave con presencia del síndrome de respuesta inflamatoria sistémica). Es similar a la de la IDSA (Infectious Diseases Society of America)91 y ha sido validada como de valor pronóstico en las infecciones del PD92.
La principal ventaja de esta clasificación probablemente sea que llama la atención sobre los signos de toxicidad sistémica como marcadores de la infección grave en estos pacientes. Sin embargo, la ausencia de estos signos no excluye una infección grave que pueda amenazar la vida, ya que, de hecho, más de la mitad de estos pacientes no presenta signos sistémicos de infección. Por otro lado, si existe isquemia asociada a la infección, independientemente del grado de esta última, se incrementa la gravedad.
A efectos prácticos, lo importante es saber qué infecciones pueden ser tratadas de modo ambulatorio con seguridad, cuáles precisan ingreso hospitalario porque amenazan la extremidad inferior y cuáles amenazan la vida y precisan un proceso ágil de toma de decisiones diagnóstico/terapéuticas.
En general se considera que existe una infección leve (grado 2 PEDIS) si existen dos o más signos clínicos de inflamación local (supuración, eritema, dolor, sensibilidad, calor o induración), pero no se extienden más allá de 2cm alrededor de la úlcera, la profundidad de ésta no supera el tejido celular subcutáneo y no se acompaña de otras complicaciones ni de afectación sistémica. No hay amenaza para la extremidad, aunque sí existe riesgo de osteomielitis (10-20%).
La infección es moderada (grado 3 PEDIS) cuando además de presentar dos o más signos clínicos de inflamación, tiene una o más de las siguientes características: la celulitis > de 2cm alrededor de la úlcera, signos de diseminación local (linfangitis y linfadenopatía), o alcanza los tejidos profundos: fascia (fascitis necrosante), músculo (mionecrosis), articulación (artritis), hueso (osteomielitis) o tendón; siempre con estabilidad sistémica y metabólica. En estos casos se corre el riesgo de perder la extremidad. Sin embargo, éste es un grupo muy amplio que engloba un gran espectro de infecciones con distinto pronóstico, matizado además por la presencia o no de isquemia asociada. En él se pueden diferenciar además dos subtipos de infección:a) «moderada-leve», definida por la presencia de celulitis > 2cm, limitada a la dermis, sin linfangitis ni isquemia crítica, que no requeriría ingreso hospitalario, pero sí una reevaluación precoz; y b) moderada-grave si la celulitis es > 2cm, se acompaña de linfangitis o de isquemia crítica, o se extiende profundamente, que sí requeriría hospitalización.
La infección «grave» (grado 4 PEDIS) es una moderada que se acompaña de toxicidad sistémica o inestabilidad metabólica (fiebre, escalofríos, taquicardia, hipotensión, confusión, vómitos, leucocitosis, acidosis metabólica, hiperglucemia severa o uremia). Supone una amenaza para la extremidad y para la vida (tabla 2).
Clasificación IDSA de la gravedad de la infección de pie diabético (adaptación SEACV)
| IDSA (adaptada SEACV)Severidad de la infección | Signos clínicos de infección | IWGDFGrado PEDIS |
| No infección | Ausencia de signos inflamatorios y de supuración | Grado 1 |
| Infección leve | Ausencia de signos sistémicos de infecciónEvidencia de pus o 2 o más signos de inflamación | Grado 2 |
| Infección moderada-leve | Ausencia de signos sistémicos de infección. Celulitis >2cm infección tisular profunda (atraviesa tejido celular subcutáneo, no absceso, linfangitis, artritis, osteomielitis, miositis ni isquemia crítica) | Grado 3 |
| Infección moderada-grave | Ausencia de signos sistémicos de infección. Celulitis >2cm infección tisular profunda (atraviesa tejido celular subcutáneo, con absceso, linfangitis, artritis, osteomielitis, miositis o isquemia crítica) | Grado 3 |
| Infección grave | Cualquier infección que se acompañe de toxicidad sistémica (fiebre, escalofríos, vómitos, confusión, inestabilidad metabólica, shock) | Grado 4 |
IWGDF: International Working Group on the Diabetic Foot; PEDIS System: perfusión, extensión, profundidad (Depth), infección, sensibilidad.
Se considera que una úlcera de pie diabético está infectada cuando presenta supuración o hay dos o más signos inflamatorios (eritema, calor, dolor, induración o sensibilidad a la presión). El diagnóstico de osteomielitis subyacente requiere pruebas de imagen compatibles.
Puerta de entradaLa infección en el PD ocurre casi invariablemente en pacientes que son portadores de una úlcera de mayor o menor tiempo de evolución o han sufrido una lesión aguda en el pie con ruptura de la barrera cutánea93.
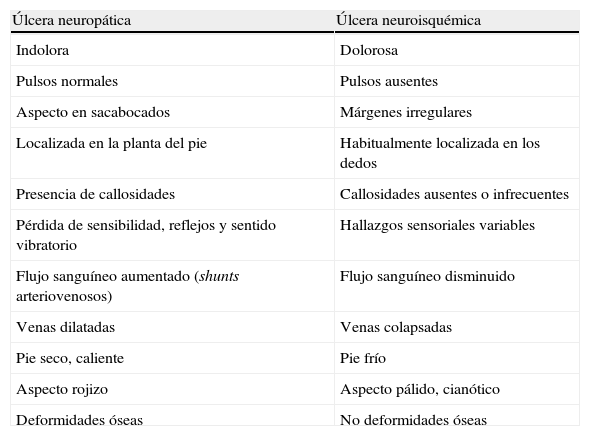
Esto implica que casi siempre podremos identificar cuál ha sido la puerta de entrada de los microorganismos para desarrollar la infección. La primera fase del diagnóstico es determinar si es neuropática o neuroisquémica, ya que es esencial para conocer el pronóstico y plantear el tratamiento, y puede realizarse mediante una exploración clínica (tabla 3)94. Una causa importante de infecciones, a menudo graves, de la extremidad inferior es la sobreinfección por cocos grampositivos de las grietas dérmicas de los espacios interdigitales a su vez infectadas por dermatofitos95. El diagnóstico de la causa de la úlcera es básico para planear el tratamiento y favorecer la curación de la misma.
Diagnóstico diferencial entre las úlceras neuropáticas y neuroisquémicas
| Úlcera neuropática | Úlcera neuroisquémica |
| Indolora | Dolorosa |
| Pulsos normales | Pulsos ausentes |
| Aspecto en sacabocados | Márgenes irregulares |
| Localizada en la planta del pie | Habitualmente localizada en los dedos |
| Presencia de callosidades | Callosidades ausentes o infrecuentes |
| Pérdida de sensibilidad, reflejos y sentido vibratorio | Hallazgos sensoriales variables |
| Flujo sanguíneo aumentado (shunts arteriovenosos) | Flujo sanguíneo disminuido |
| Venas dilatadas | Venas colapsadas |
| Pie seco, caliente | Pie frío |
| Aspecto rojizo | Aspecto pálido, cianótico |
| Deformidades óseas | No deformidades óseas |
Las úlceras que aparecen en el dorso de la articulación interfalángica de los dedos en garra o martillo, sobre la zona más prominente de los juanetes del primer o quinto dedos, en los bordes laterales o en el dorso del pie, se deben a la presión y al roce repetitivo sobre dicha zona generalmente provocado por el calzado. En las zonas en que se ha producido una protuberancia ósea, como en las úlceras neuropáticas que aparecen en la planta del pie (mal perforante plantar), en la punta de los dedos en garra o martillo, en la zona de prominencia de las cabezas de los metatarsianos o en el mediopié cuando se ha generado un «pie en mecedora» en la artropatía de Charcot, las úlceras se producen por el aumento de presión generado al caminar.
En el paciente diabético con neuropatía y pérdida de sensación protectora también pueden ocurrir heridas penetrantes en la planta del pie y pasar totalmente desapercibidas, hasta que más tarde aparecen los signos de infección. Estas lesiones se producen principalmente por agresiones mecánicas y térmicas o por yatrogenia (actuaciones podológicas sobre callosidades). También pueden ser debidas a lesiones interdigitales por onicomicosis u onicocriptosis.
La isquemia es otra causa de ulceración del pie diabético, afectando a menudo a los dedos del pie y al talón. La infección de estas úlceras progresa rápidamente y supone con frecuencia un grave riesgo de amputación. La reacción inflamatoria no es la adecuada, ya que su capacidad de vasodilatación, formación de edema e infiltración leucocitaria está disminuida. Los microorganismos que se desarrollan en los focos necróticos proliferan sin control por la escasa actividad fagocítica leucocitaria, por lo que son especialmente frecuentes las infecciones de rápida evolución con tendencia a la necrosis. Por otra parte, las úlceras isquémicas tienen muy escasa tendencia a la cicatrización porque este proceso lleva consigo unas necesidades metabólicas muy superiores a las necesarias para mantener la integridad de la piel, por lo cual, su tendencia natural es hacia la gangrena.
Dependiendo de la lesión inicial y su localización anatómica la infección puede evolucionar según varias formas clínicas. En la piel y tejidos blandos se distinguen:a) superficiales (dermis y epidermis) como la celulitis y erisipela; y b) profundas como las fascitis necrosantes localizadas en el tejido celular subcutáneo, y mionecrosis y abscesos que asientan en la fascia profunda y músculo. También pueden extenderse a las articulaciones subyacentes (artritis) y hueso (osteomielitis).
Ante un PD hinchado y caliente con lesiones ulceradas es preciso establecer el diagnóstico diferencial entre neuroartropatía aguda de Charcot y un cuadro infeccioso, incluyendo celulitis, absceso plantar y osteomielitis96. Otras posibilidades diagnósticas a descartar serían crisis gotosa, artritis y trombosis venosa profunda. Además de la valoración clínica, las pruebas de imagen como la radiografía simple, la tomografía computarizada (TC) y sobre todo la resonancia magnética (RM) pueden ser necesarias para establecer el diagnóstico, así como la eco-doppler para descartar la trombosis venosa.
Colonización vs infecciónTodas las úlceras crónicas acaban con el tiempo y de manera irremediable siendo invadidas por los microorganismos que forman parte de la microbiota de la piel circundante (Staphylococcus spp. y Streptococcus spp.), y más adelante desde cualquier otra fuente.
La simple presencia de bacterias o cualquier otro agente patógeno se denomina contaminación. Pero el lecho ulceroso, rico en proteínas y otras sustancias nutritvas, constituye un buen caldo para que los microorganismos se reproduzcan, lo que da lugar al fenómeno de la colonización.
El siguiente paso a la colonización es la infección; es la invasión tisular de los microorganismos que desencadena una respuesta inflamatoria con aparición de los clásicos signos locales y secreción purulenta, con o sin manifestaciones clínicas sistémicas.
El motivo por el cual las bacterias colonizantes adquieren la capacidad de invadir los tejidos no se conoce en profundidad97. Parece intervenir la carga bacteriana. Se ha señalado un punto crítico (≥ 105 ufc/g de tejido), que puede estar influido por el tipo de microorganismo y la situación del huésped (grado de inmunodepresión), a partir del cual se pasaría de la colonización a la infección. Es la denominada colonización crítica98.
El significado clínico de la colonización bacteriana siempre ha estado en entredicho99. No obstante, la persistencia de una densidad bacteriana subinfectiva en una úlcera junto a las toxinas que producen los microorganismos podría retrasar la cicatrización tisular y ser la causa de algunos signos no atribuidos a la infección, como son la presencia de un tejido de granulación friable y una secreción de tipo seroso100.
En aquellos casos en que los clásicos signos de infección no se observan, pero la cicatrización no sigue una correcta evolución, podría estar indicada la realización de cultivos cuantitativos a partir de tejidos de las úlceras, con la finalidad de detectar esa colonización crítica que explicaría el curso inadecuado101.
Este novedoso concepto microbiológico de colonización crítica, con todas sus limitaciones actuales, también ha modificado la indicación de tratamiento antimicrobiano de las úlceras crónicas. Hasta ahora, el uso de antibióticos solo estaba indicado en las infecciones propiamente dichas, pero hoy en día quizás sería conveniente plantearlo en las úlceras con retraso en la cicatrización no justificado por otros motivos, siempre y cuando los cultivos cuantitativos sean significativos, aun a costa de hacer sobretratamiento a algunos pacientes.
En definitiva, la colonización crítica sería un estado entre la colonización y la infección, que explicaría ciertas situaciones hasta ahora no aclaradas y que podría tener influencia en las indicaciones del tratamiento antimicrobiano.
Toma de muestrasLa colonización estandar de las úlceras crónicas hace que el diagnóstico microbiológico sólo esté indicado cuando hay criterios de infección clínica.
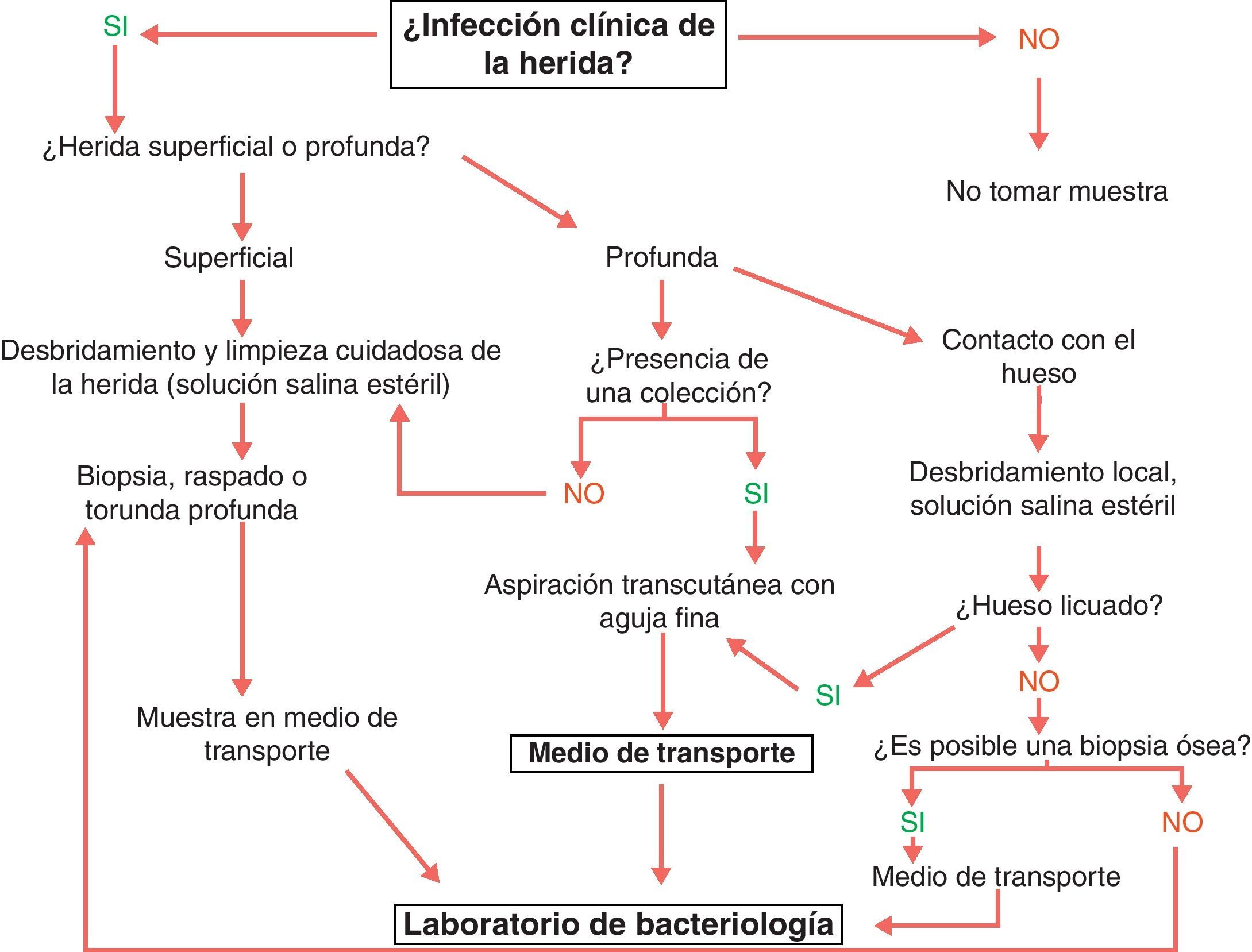
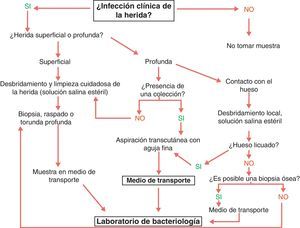
La recogida de una muestra adecuada es determinante para que el diagnóstico microbiológico sea útil. El cultivo de muestras no representativas proporciona resultados sin valor que pueden conducir a tratamientos inadecuados. La toma de los tejidos debe incluir los agentes implicados en la infección y evitar el material superficial que puede reflejar tan solo la flora colonizante. Las opciones disponibles son la biopsia, el raspado, la aspiración percutánea y la recogida con torunda (fig. 4). Si la infección es grave, con manifestaciones sistémicas, se deben extraer y procesar hemocultivos47.
Recogida de muestra en las infecciones del pie del diabético. Fuente: SPILF102.
La biopsia se realiza del fondo de la úlcera, eliminando en lo posible las bacterias colonizantes superficiales. Para ello, tras realizar un desbridamiento quirúrgico, se procede a una limpieza con una gasa empapada con suero fisiológico. Opcionalmente tras el desbridamiento se puede hacer una desinfección con un desinfectante que se elimina con suero fisiológico102.
En la osteomielitis la biopsia ósea es la muestra de referencia. Puede ser tomada por cirugía abierta o por aspiración percutánea guiada por imagen (fluoroscopia o TC). Se lleva a cabo fuera de heridas o úlceras para evitar la contaminación por la flora que las coloniza. El primer método proporciona menos resultados negativos. El paciente debe haber estado, idealmente, sin recibir antibióticos de 2 a 4 semanas antes de la realización de la toma, porque los antimicrobianos pueden mantenerse prolongadamente en el hueso. Sin embargo, a veces la situación clínica no permite la suspensión del tratamiento tanto tiempo, por lo que hay que interpretar el cultivo en el contexto de la situación clínica55.
El raspado se realiza preparando la úlcera como se ha descrito para la biopsia. Si se opta por una desinfección del fondo de la úlcera se puede emplear una solución de povidona yodada al 50% que se elimina con suero fisiológico. Tras dejarse secar se toma con una cureta estéril una muestra de tejido (1-1,5mm3) del fondo. Este procedimiento es superior al hisopo, evita colonizantes y permite la recuperación de más anaerobios103.
La aspiración percutánea con aguja fina se puede utilizar en casos de celulitis, colecciones purulentas y osteomielitis cuando haya hueso licuado (precisa guía por imagen). Requiere desinfección de la piel y limpieza ulterior con suero fisiológico antes de realizarse.
Aunque sería deseable no recoger las muestras con torundas es el método más empleado por su sencillez y amplia disponibilidad. Se puede utilizar en úlceras y cavidades que se puedan abrir. La preparación previa es la misma que para la biopsia. La muestra se toma del fondo rotando con una cierta presión el hisopo para conseguir exprimir los tejidos. Si se quiere hacer un estudio cuantitativo o semicuantitativo, la rotación se hace en una superficie de 1cm2 durante 5 segundos104.
Las muestras tisulares son en principio preferibles y con ellas se recuperan más microorganismos47,56,105. Cuando se compara cuantitativamente la concordancia de diversos tipos de tomas, los raspados dan mejores resultados que las torundas o los aspirados. El cultivo de las torundas tiende a sobreestimar y el de los aspirados a subestimar el número de aislamientos presentes en los tejidos profundos106. Los cultivos tomados con torundas en comparación con los realizados con muestras tisulares profundas han mostrado una baja sensibilidad (49%), especificidad (62%), cociente de probabilidad positivo (1,1) y negativo (0,67)107. Dentro de un enfoque multidisciplinar del manejo de las infecciones del PD en el que el hecho fundamental fue eliminar las tomas superficiales con torundas, obviar en lo posible las tomas profundas con hisopo y recurrir fundamentalmente a tomas tisulares se observó en el periodo de 2003 a 2007 cambios importantes desde un punto de vista microbiológico, terapéutico y económico60. Hubo una disminución significativa del número de especies de bacterias por muestra (de una media de 4,1 se pasó a una de 1,6). La prevalencia de microorganismos considerados colonizadores cayó drásticamente del 23,1 al 5,8% (p<0,001). Se aislaron más grampositivos, especialmente S. aureus, menos gramnegativos, tanto enterobacterias como P. aeruginosa y los aislamientos de anaerobios se mantuvieron en niveles bajos (5%). Existió una disminución de la prevalencia de microorganismos multirresistentes (35,2 frente 16,3%) y de SAMR (de 52,2 a18,9%) (p<0,001). El impacto de estas medidas supuso un ahorro de 14.914 euros relacionados con el trabajo microbiológico y 109.305 euros debido a la reducción de la prescripción de antibióticos de amplio espectro.
Tras su obtención las muestras deben colocarse en un sistema de transporte para tejidos, raspados o torundas que permita la supervivencia de las bacterias anaerobias. Es imprescindible identificarlas adecuadamente y enviarlas rápidamente al laboratorio manteniéndolas a temperatura ambiente.
Recomendaciones- 1.
En infecciones de PD la muestra para estudio microbiológico ideal es la biopsia de tejido profundo.
- 2.
Otras opciones son el raspado y la aspiración percutánea.
- 3.
Las muestras con torunda, de hacerse, deben ser del fondo de la úlcera, mediante presión del hisopo sobre los tejidos para exprimirlos.
Los estudios microbiológicos deben identificar o detectar antigénica o genómicamente los microorganismos presentes en las muestras, comprobar su sensibilidad a los antimicrobianos de forma fiable y·ofrecer datos, si es posible, que orienten hacia la implicación clínica de estos microorganismos. Todo de la forma más rápida posible para que tenga una repercusión eficaz a la hora de ajustar un tratamiento empírico.
Las muestras se procesarán en el laboratorio con la mayor celeridad posible. La tinción de Gram tiene poca correlación con el cultivo, aunque puede permitir la valoración de la calidad de la muestra por la presencia de PMN. Siempre se buscarán bacterias anaerobias. El procesamiento se basará en métodos microbiológicos tradicionales. Es de referencia la siembra en medios enriquecidos, selectivos, diferenciales (incluidos los cromogénicos) que permitan no solo recuperar las especies implicadas, sino incluso hacer una identificación presuntiva y, en ciertos casos, valorar la sensibilidad a los antimicrobianos (medios cromogénicos para SARM). Puede utilizarse una técnica cualitativa, cuantitativa o semicuantitativa108. Los medios para anaerobios se incubarán en jarra o en cámara. Tras la identificación se determina la sensibilidad a los antimicrobianos de la forma más segura y rápida posible. Este punto es crucial, pues permite ajustar los tratamientos empíricos y variarlos cuando fracasan.
En el horizonte próximo está la introducción de técnicas moleculares (proteína C reactiva [PCR] en tiempo real, microarrays, hibridación fluorescente in situ [FISH], secuenciación del ADN [ARN]r) para el estudio de la microbiología (etiología, patogenicidad y sensibilidad a los antimicrobianos) de las infecciones de PD. Estas técnicas permitirán, cuando se establezcan de rutina, la detección de los agentes causales, sus determinantes de virulencia y su sensibilidad a los antibióticos en horas y no en días, como ocurre con los estudios microbiológicos tradicionales. Además, otra de sus ventajas es su mayor sensibilidad59,62,109.
No es fácil precisar el significado clínico de las bacterias aisladas110. Es claro el de microorganismos de gran virulencia, como Streptococcus pyogenes, pero no el de la mayoría de las otras especies recuperadas que habitualmente son patógenos oportunistas o comensales. Para dar respuesta a esta cuestión se han propuesto diversas soluciones. Un recuento bacteriano superior a 105 UFC por cm2 o gramo marca la diferencia entre colonización e infección111, por lo que los métodos cuantitativos que determinan la carga bacteriana son muy útiles, pero al ser muy engorrosos y consumir mucho tiempo no se realizan de rutina en los laboratorios de microbiología. Los semicuantitativos también han demostrado su utilidad104,112. Son más sencillos, pero no tanto como para que gocen de una aceptación generalizada. Por eso es necesario tener algunos criterios microbiológicos que ayuden a la valoración de los resultados cualitativos que son los que habitualmente recibe el clínico de microbiología. A bacterias como S aureus, estreptococos β hemolíticos, enterobacterias o anaerobios habría que darle valor de entrada113 mientras que al resto solo se le otorgaría cuando se encuentren en cultivo puro o se aíslen repetidamente110,113. El desarrollo de procedimientos moleculares puede ayudar en esta labor. Se ha desarrollado una PCR que demuestra la presencia de 5 genes de virulencia (sea, sei, lukE, hlgv y cap8) que están presentes en un porcentaje significativamente mayor en los S. aureus aislados de úlceras de grado 2-4 que en los de grado 162. No obstante, no debe desdeñarse ninguna especie48 dada la naturaleza polimicrobiana de la biopelícula de las úlceras crónicas del pie diabético72.
Los estudios microbiológicos deben repetirse ante una evolución desfavorable.
Papel de los biomarcadores en el diagnóstico, pronóstico y monitorización del tratamientoLos marcadores serológicos de inflamación, como el aumento de la velocidad de sedimentación globular y la PCR desde antaño o bien la procalcitonina (PCT) de uso más reciente, pueden ser de utilidad para distinguir entre colonización e infección, sospechar la presencia de infección más grave y/o osteomielitis, conocer el pronóstico en las formas graves y sobre todo valorar la respuesta al tratamiento114–116.
Si bien no existe información detallada de su uso en la infección del PD, la información puede ser extrapolada de otras áreas de la patología infecciosa, en especial de las infecciones bacterianas graves, sea cual sea el foco infeccioso causante del proceso.
La PCR es una proteína de fase aguda liberada por las células hepáticas tras su estimulación por mediadores de la inflamación como interleuquinas (IL-6, IL-8). Su pico máximo se alcanza en plasma alrededor de 48 horas de comenzado el proceso. Sus niveles plasmáticos pueden permanecer elevados días incluso tras la eliminación del foco infeccioso y se incrementan en distintas enfermedades no infecciosas. La concentración plasmática media en adultos sanos es de 0,08mg/dl. Niveles >20mg/dl en pacientes con clínica compatible orientarían a un origen bacteriano del proceso, y niveles <0,5mg/ml se asocian a una probabilidad de bacteriemia/sepsis por debajo del 1-2% (salvo en pacientes con hepatopatía)117.
La PCR no ha demostrado correlaciones con la severidad de la respuesta del huésped ni diferencia entre supervivientes y no supervivientes en los procesos de sepsis. Así mismo tiene un pobre valor predictivo y no ha demostrado potencia como marcador de severidad. La determinación seriada de PCR puede ser útil para el diagnóstico precoz de las infecciones nosocomiales en la UCI (aumento a niveles >5mg/dl o >25% del valor previo) ya que es menos costosa, más accesible, más sencilla y rápida que la de otros marcadores118. La PCR desempeña un importante papel en la orientación de la terapia antibiótica en las enfermedades localizadas, teniendo mayor valor diagnóstico que los ascensos térmicos en el diagnóstico de infección, por lo que se propone en algunos textos como prueba de realización rutinaria en la evaluación inicial en el paciente con sospecha de sepsis119.
Sin embargo, su eficacia parece estar más claramente establecida en el seguimiento y monitorización de la respuesta al tratamiento antibiótico, por lo que algunos autores recomiendan la realización de determinaciones seriadas, habiéndose demostrado que su utilización es asimismo sensible como indicador de resolución de la sepsis en los casos microbiológicamente probados117,120,121. La PCT es un péptido de 116 aminoácidos, prohormona de la calcitonina, cuyos niveles en sangre se elevan en pacientes sépticos, de forma selectiva en infecciones bacterianas, al inhibir las citocinas y endotoxinas liberadas por ellas el paso final en la síntesis de calcitonina. Posee una vida media de 24 horas. Se detectan elevaciones de PCT en las dos horas posteriores a una endotoxinemia o bacteriemia, siendo muy estable in vivo con un tiempo de vida media de 24 horas
La detección de PCT se confirma como marcador de sepsis en infección severa en múltiples ensayos. En comparación con otras pruebas diagnósticas la PCT tiene la ventaja de ser más temprana y más específica en infecciones bacterianas importantes (frente a PCR y leucocitosis), y niveles bajos en sangre de PCT descartan bacteriemia. En cuanto a sus puntos de corte pacientes con niveles menores a 0,5ng/ml es improbable que presenten sepsis ni shock séptico, mientras que determinaciones por encima de 2ng/ml identifican pacientes de alto riesgo, y concentraciones por encima de 10ng/ml van asociadas a pacientes que presentan fallo de órganos. Los focos de infección localizada sin inflamación sistémica no presentan elevación de los niveles de PCT. Con las técnicas de determinación de PCT recientes se puede excluir la infección bacteriana con un alto valor predictivo negativo. En consecuencia, parece que la PCT es una prometedora prueba diagnóstica para monitorizar la progresión y el pronóstico de enfermedades bacterianas122,123. Además se desprende que las guías para el uso de antibióticos usando los valores de PCT hacen disminuir la duración de la exposición a antibióticos sin efectos perjudiciales para el paciente. Este hecho tiene ventajas tanto en cuanto al coste ecológico (selección de bacterias multirresistentes cuando utilizamos antibióticos de amplio espectro) como al económico124.
OsteomielitisLa diseminación de la infección por contigüidad desde los tejidos blandos puede afectar al hueso subyacente. Aunque la infección del hueso puede ser la consecuencia de una herida penetrante o una úlcera isquémica, habitualmente aparece en una úlcera neuropática que se hace cada vez más profunda y acaba exponiendo el hueso. Así, los lugares más frecuentemente afectados son los dedos del pie, las cabezas de los metatarsianos y el calcáneo.
La ulceración o infección del tejido blando suprayacente alcanza el periostio y provoca su destrucción, lo que desvitaliza el córtex superficial (osteítis). Cuando la infección alcanza el sistema de Havers se produce la invasión del hueso medular y la médula ósea, extendiéndose con rapidez (osteomielitis). La lesión del periostio provoca la necrosis del hueso subyacente (secuestros) y la reacción perióstica formando hueso nuevo (involucrum). La respuesta del huésped limita la infección dentro de un área del hueso, favoreciendo la separación de los secuestros, que pueden encontrarse en la base de la úlcera o eliminarse en forma de pequeños fragmentos hasta la superficie de la piel, consiguiendo a veces detener el proceso infeccioso con aparición de un tejido de granulación sano, siendo entonces posible la curación. Por el contrario, si persiste la infección ósea aparecen nuevas áreas de necrosis ósea con diseminación de la infección al tejido blando circundante. La persistencia de la infección en el hueso se asocia muchas veces a la adherencia de los microorganismos a los secuestros, en comunidades mono o polimicrobianas (biopelículas) que contienen fenotipos que resisten las defensas del huésped y la mayoría de los agentes antibióticos125.
Aproximadamente un 10-20% de las infecciones de partes blandas del PD clasificadas como leves se asocian a osteomielitis, mientras que la moderadas/graves lo pueden hacer hasta en un 50-60%126.
No se dispone de un amplio consenso sobre la mejor táctica diagnóstica para la osteomielitis del PD (OPD). Un aspecto que complica el diagnóstico de la OPD es el difícil diagnóstico diferencial con la neuroosteoartropatía de Charcot, muy frecuente en el PD, pues puede producir cambios óseos no infecciosos difíciles de diferenciar de los atribuibles a la osteomielitis.
Clínicamente puede aparecer con signos inflamatorios agudos de las partes blandas adyacentes, bien limitados a un dedo, edematoso, rojo y caliente («dedo en salchicha»), bien afectando a todo el pie. En este último caso habrá que diferenciarlo del cuadro agudo de neuroartropatía de Charcot. También se puede presentar de forma subaguda o crónica, formando fístulas, desde el hueso a la piel, o impidiendo la curación de la úlcera suprayacente. En este caso los signos clínicos típicos incluyen una úlcera sobre una prominencia ósea profunda y de larga duración, que no cura tras 6 semanas de tratamiento, en ausencia de isquemia y a pesar de una antibioterapia correcta, adecuados cuidados locales y descarga de presión sobre la zona. En un grupo de pacientes con infección que amenazaba la extremidad, en los que la probabilidad de OPD se calculó en torno al 66%, se vio que cuando se palpaba hueso en el fondo de la úlcera, al explorarla suavemente con un estilete metálico, el valor predictivo positivo de OPD fue del 89%126. Sin embargo, en un estudio posterior, con un grupo de pacientes en los que la incidencia de OPD era del 20%, el valor predictivo positivo del «test de sondaje óseo» fue solo del 53%127. Recientemente se ha evaluado este test en un grupo de 199 pacientes con infección de pie diabético, obteniéndose un valor predictivo positivo del 57%, y negativo del 98%128. Es decir, el test positivo tiene escasa capacidad diagnóstica, pero el test negativo hace improbable el diagnóstico de OPD.
La radiografía simple puede ser normal en los estadios iniciales, aunque las realizadas pocas semanas después pueden mostrar engrosamiento del periostio y destrucción ósea. Cualquier foco de destrucción ósea junto a una úlcera debería considerarse potencialmente una OPD, mientras no se pruebe otra cosa. Ni el «test de sondaje óseo» ni la radiografía simple pueden excluir el diagnóstico de OPD con seguridad129.
La gammagrafía ósea con 99Tc se considera poco específica y no se recomienda, y la gammagrafía con leucocitos marcados se puede usar cuando la RM esté contraindicada.
La RM es la técnica de imagen más útil para el diagnóstico de la OPD, tanto para valorar su extensión y la afectación de partes blandas asociadas, como para planificar la cirugía130,131. Sin embargo, no permite distinguir entre infección y neuroosteoartropatía de Charcot.
El ‘gold standard para diagnosticar OPD es el aislamiento de bacterias en una muestra de hueso, adecuadamente obtenida para evitar la contaminación, junto con hallazgos histológicos de células inflamatorias y osteonecrosis. Cuando sea posible debe suspenderse la antibioterapia 2 a 4 semanas antes, pero puede que la situación clínica no permita esta suspensión, por lo que hay que interpretar el cultivo en este contexto clínico. Cuando el clínico sospecha o quiere descartar el diagnóstico de osteomielitis, el primer paso es obtener una radiografía simple. Si en la radiografía inicial hay signos sugestivos de osteomielitis se deberían obtener muestras para cultivo microbiológico y después iniciar tratamiento antibiótico. Si la radiografía no es diagnóstica debería tratarse durante una a dos semanas como una infección de partes blandas, y si la sospecha persiste repetir la radiografía a las 2-4 semanas. Si la radiografía es compatible pero no diagnóstica de osteomielitis puede optarse por realizar una RM para establecer o descartar el diagnóstico o iniciar un tratamiento empírico durante otras 2-4 semanas.
La biopsia ósea se recomienda cuando el diagnóstico de osteomielitis permanece dudoso, después de las pruebas de imagen, así como si se demuestra osteomielitis pero se desconoce el agente etiológico y/o su sensibilidad a los antibióticos. Cuando el hueso afectado está en el mediopié o retropié, resulta especialmente indicado realizar la biopsia ósea antes de realizar un tratamiento, ya que si fracasa la probabilidad de amputación mayor es más alta que en las lesiones del antepié. Los cultivos de los trayectos fistulosos muestran poca correlación con los cultivos del hueso, por lo que no se recomiendan. Es importante identificar el agente causante de la infección, así como su sensibilidad a los antimicrobianos, ya que se ha demostrado que la antibioterapia, basada en el cultivo de una muestra ósea, se asocia con mejores resultados clínicos (80% de remisiones) que la antibioterapia basada en el cultivo de una muestra obtenida con torunda de los tejidos blandos adyacentes (50% de remisión).
En la biopsia ósea se deben obtener al menos dos muestras si es posible, para estudio anatomopatológico y microbiológico.
No se han publicado complicaciones de esta técnica, por lo que se considera un procedimiento bastante seguro.
Desafortunadamente, la biopsia ósea no se usa ampliamente. En la mayoría de los casos los clínicos se basan más en los síntomas y signos, combinados con las técnicas de imagen y los datos del laboratorio (aumento de la velocidad de sedimentación globular y de la PCR).
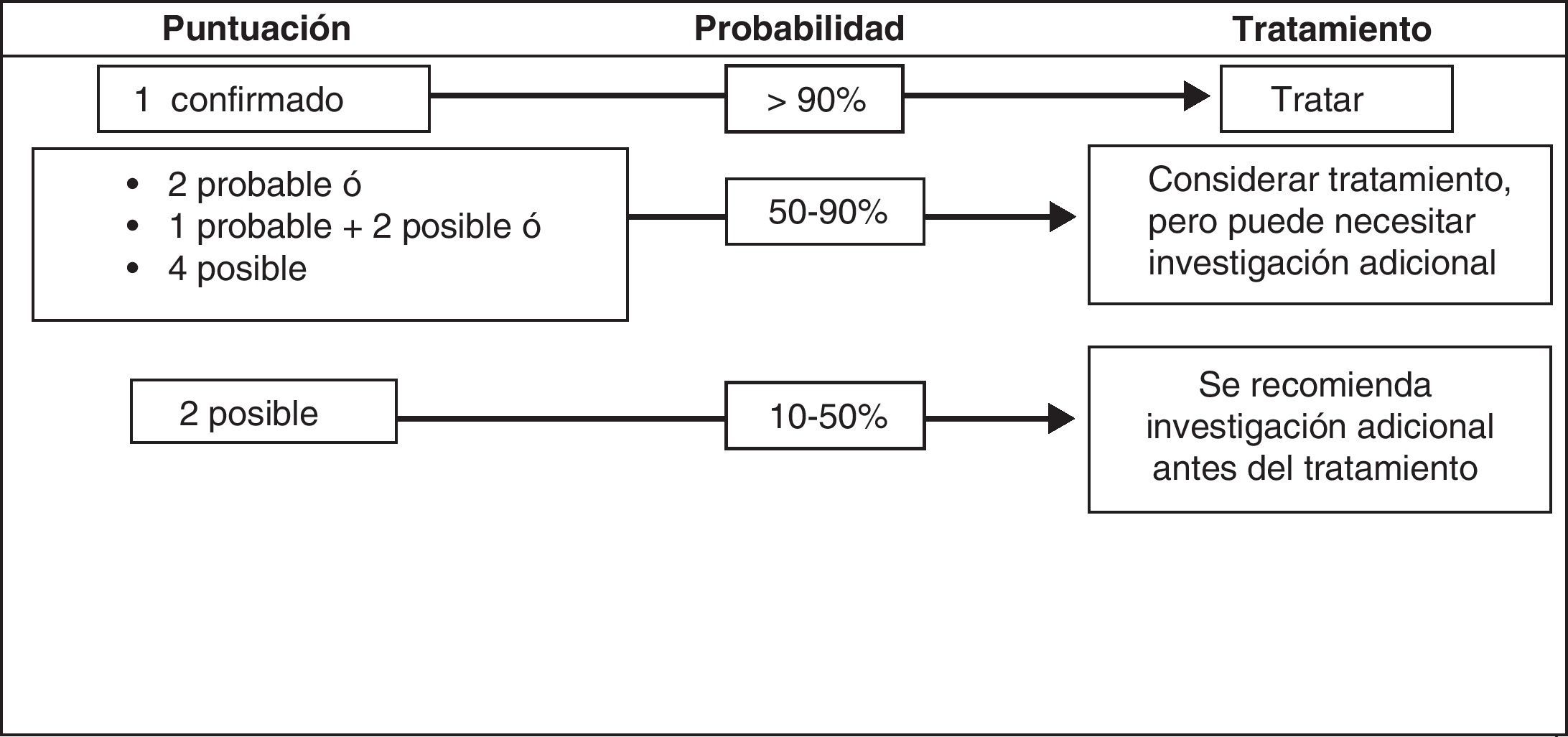
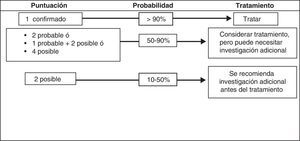
El Grupo Internacional de Trabajo del Pie Diabético (IWGDF) ha propuesto recientemente un esquema que agrupa distintos criterios reunidos según 4 categorías de probabilidad para establecer el diagnóstico de OPD125 (tabla 4) (fig. 5). Esta aproximación diagnóstica no ha sido validada en la práctica, pero representa un salto hacia delante en cuanto a la estandarización del diagnóstico y la decisión de tratamiento132.
Criterios diagnósticos osteomielitis
| Diagnóstico confirmado («más allá de una duda razonable») |
| Histología+y cultivo del hueso+ |
| Pus en el hueso en la exploración quirúrgica |
| Desprendimiento atraumático de fragmentos óseos eliminados de una úlcera |
| Abscesos intraóseos en MRI |
| Diagnóstico probable («más probable que no») |
| Visible hueso esponjoso en una úlcera |
| MRI: edema óseo con otros signos de OM |
| Muestra ósea con cultivo positivo pero histología negativa o ausente |
| Muestra ósea con histología positiva pero cultivo negativo o ausente |
| Diagnóstico posible («baja probabilidad») |
| Rx simple: destrucción cortical |
| MRI muestra edema óseo o cloaca |
| Sondaje al hueso positivo |
| Cortical ósea viable |
| VSG >70mm sin otra causa posible que la explique |
| Úlcera que no cura a pesar de adecuada descarga y perfusión tras 6 semanas oúlcera de más de 2 semanas de duración con evidencia clínica de infección |
Fuente: Berendt AR et al.125.
Score diagnóstico de osteomielitis. Fuente: Berendt AR et al.125.
- 1.
La OPD suele ser por contigüidad.
- 2.
La persistencia de una OPD se asocia a biofilm.
- 3.
La RM es la técnica más útil para el diagnóstico de la OPD.
- 4.
El gold standard para el diagnóstico de la OPD es el aislamiento de bacterias en una muestra de tejido óseo, con hallazgos histológicos de células inflamatorias y osteonecrosis.
- 5.
La biopsia ósea se debe realizar si el diagnóstico por imagen es dudoso.
La evaluación de la perfusión arterial constituye un componente esencial del diagnóstico del paciente diabético con una lesión trófica infectada en el pie. El diagnóstico de isquemia crítica asociado a un PD infectado requiere una confirmación por métodos objetivos133.
Examen clínicoLa anamnesis debe estar dirigida a los principales síntomas característicos de la isquemia crónica de miembros inferiores, en particular los antecedentes de claudicación intermitente y el dolor en reposo. La exploración física debe incluir la palpación de pulsos (femorales, poplíteos, tibiales y pedios) así como la eventual percepción de soplos o frémitos a nivel femoral.
Exámenes complementariosEl índice tobillo/brazo (ITB) debe ser sistemáticamente realizado en todos los pacientes diabéticos, para lo que suele utilizarse un esfigmomanómetro y un dispositivo doppler continuo. El ITB es el cociente de presión sistólica entre el tobillo y el brazo, siendo normal cualquier valor situado entre 0,9 y 1,4. Un ITB por debajo de 0,9 es indicativo de arteriopatía obliterante de extremidades inferiores y su repercusión hemodinámica es directamente proporcional a la disminución del mismo. Así por ejemplo, las úlceras isquémicas suelen aparecer a presiones sistólicas en tobillo de 50-70mm Hg, y el dolor en reposo a 30-50mm Hg. Los ITB superiores a 1,4, por el contrario, son indicativos de incompresibilidad arterial, habitualmente por calcificación arterial, y no permiten evaluar la presencia de lesiones oclusivas arteriales subyacentes. Se desconoce si la calcificación arterial desempeña algún papel en la obtención de valores de ITB falsamente elevados pero dentro del rango de normalidad (0,9-1,4) o patológicos (<0,9).
La presión digital en el primer dedo (nivel crítico <50mm Hg), los registros de volumen de pulso y la presión parcial transcutánea de oxígeno (nivel crítico<30mm Hg) constituyen métodos diagnósticos alternativos al ITB cuando se sospecha que el resultado de éste se halla artefactado por calcificación arterial.
La eco-doppler constituye una exploración no invasiva que proporciona información morfológica y hemodinámica de las diversas lesiones estenóticas y oclusivas localizadas en la extremidad afecta de un pie diabético infectado. A diferencia del ITB, la eco-doppler no proporciona información alguna sobre la repercusión hemodinámica global a la que se halla sometida el pie o la lesión trófica, y se halla indicada, al igual que otras exploraciones morfológicas, cuando ya se contempla la posibilidad de revascularización.
La angio-RM y la angio-TC constituyen exploraciones morfológicas (anatómicas) que informan sobre la topografía lesional y permiten establecer la estrategia de revascularización endovascular o quirúrgica más conveniente. La angio-RM y la angio-TC son mínimamente invasivas (punción venosa), pero su resultado es poco fiable en vasos de pequeño calibre (RM y TC), por ejemplo por debajo de la rodilla y en presencia de calcificaciones arteriales (TAC) o stents intraluminales (RM); además su indicación se halla limitada en casos de alergia a contrastes o insuficiencia renal.
La angiografía por sustracción digital (DIVAS) constituye el patrón oro del diagnóstico morfológico de la arteriopatía obliterante asociada a un PD infectado. Al igual que otras exploraciones morfológicas, no proporciona información hemodinámica y, por consiguiente, no puede utilizarse para sentar el diagnóstico de isquemia crítica en el paciente con un PD infectado. Requiere una punción arterial y la administración de contraste yodado, por lo que suele reservarse como examen previo o simultáneo a una revascularización endovascular o quirúrgica.
Recomendaciones- 1.
En toda úlcera de pie diabético debe realizarse una palpación de pulsos para detectar la presencia de isquemia.
- 2.
Los métodos hemodinámicos (ITB, presión digital) en general se utlizan para cuantificar el grado de isquemia.
- 3.
Los métodos morfológicos (eco-doppler, angio-TC, angio-RM, arteriografía) se deben utlizar para planear la estrategia quirúrgica si va a realizarse una revascularización.
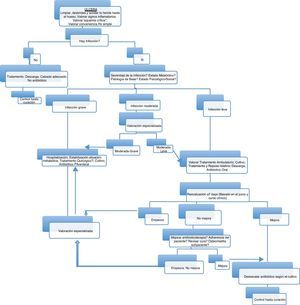
No existen datos que avalen el tratamiento antibiótico de las úlceras crónicas, aun con un cultivo positivo. El tratamiento antimicrobiano se indicará si existen criterios clínicos de infección sistémicos o locales47. Los datos de laboratorio tienen una utilidad limitada para el diagnóstico de infección, excepto en los casos de osteomielitis61. El tratamiento antimicrobiano de las infecciones del pie diabético está condicionado por la isquemia que dificulta la llegada de los antibióticos al foco séptico, el deterioro de la función leucocitaria y la posible insuficiencia renal en este tipo de pacientes90. La isquemia y las alteraciones de los leucocitos hacen que la respuesta de la infección al tratamiento sea peor en los diabéticos y haya empeoramientos rápidos, en horas o pocos días90,134. Los defectos funcionales de los neutrófilos en los diabéticos hacen aconsejable el uso de antibióticos bactericidas y durante largo tiempo; la isquemia condiciona el empleo de dosis elevadas y la prevalencia de la insuficiencia renal conduce a evitar fármacos nefrotóxicos, como son los aminoglucósidos, la vancomicina y la anfotericina B47,90,134–136. La gravedad de la infección, el tiempo de evolución de las lesiones y los factores de riesgo relacionados con la aparición de resistencias bacterianas, junto a los patrones de sensibilidad local, condicionan la selección del tratamiento antimicrobiano empírico, el lugar donde se realiza y la vía de administración. No obstante, los cocos grampositivos son los patógenos predominantes en cualquier circunstancia, por lo que siempre deben ser cubiertos. SARM debe ser considerado en las siguientes circunstancias:a) colonización o infección previa del paciente por este microorganismo;b) prevalencia de la infección por SARM en el centro o unidad de hospitalización superior al 10%; yc) si se cumplen dos o más de los siguientes aspectos: ingreso hospitalario en el último año o procedencia de una residencia geriátrica o centro sociosanitario con endemia de SARM; tratamiento con una quinolona en los 6 meses previos; paciente mayor de 65 años; y enfermo en programa de diálisis por insuficiencia renal crónica137. Hay que hacer lo propio con E. coli productor de BLEE en caso de: edad superior a 65 años, si es mujer, hospitalización en el año anterior, infección urinaria recurrente y uso previo de quinolonas. La diabetes en sí misma ya es un factor de riesgo para este microorganismo138. Las úlceras crónicas politratadas también constituyen un factor de riesgo para Enterococcus spp., ECN y P. aeruginosa, sobre todo en úlceras húmedas y maceradas y otros bacilos gramnegativos no fermentadores49.
Según estos aspectos, en las infecciones leves se recomienda tratamiento oral domiciliario con amoxicilina-clavulánico, y en caso de riesgo de SARM o ECN cotrimoxazol o linezolid. En pacientes alérgicos a betalactámicos puede utilizarse levofloxacino, moxifloxacino, clindamicina o cotrimoxazol, excepto si hay sospecha de estreptococos. La duración del tratamiento en estos casos puede ser suficiente con 7 a 14 días47,91. Esta misma pauta terapéutica es válida para las infecciones moderadas-leves, aunque la vigilancia debe ser más estrecha por el mayor riesgo de mala evolución.
En las infecciones moderadas-graves con riesgo de pérdida de la extremidad se aconseja la hospitalización y tratamiento intravenoso de amplio espectro durante dos a cuatro semanas.
Por su gran prevalencia los antibióticos deben ser activos frente a los siguientes microorganismos: cocos grampositivos aerobios (Staphylococcus spp. y Streptococcus spp.), bacilos gramnegativos aerobios (enterobacterias) y anaerobios (Streptococcus spp., Peptostreptococcus spp. y Bacteroides spp.)47,91,136. En esta situación se puede emplear ertapenem71, una cefalosporina de tercera generación más metronidazol139 o amoxicilina-ácido clavulánico140. En caso de alta sospecha de participación de P. aeruginosa se puede administrar piperacilina-tazobactam o un carbapenem antipseudomónico141. Ertapenem, por el alto de riesgo de E. coli BLEE en estos pacientes, su facilidad de uso (monoterapia y dosis única diaria por vía intravenosa e intramuscular), penetración en los tejidos blandos y experiencia clínica favorable, parece la primera opción por vía parenteral71,142. Se debe añadir daptomicina, linezolid o en contadas ocasiones vancomicina (si no hay insuficiencia renal) en caso de existir alta probabilidad de SARM.
Por último, en las infecciones graves con repercusión sistémica y riesgo vital143,144 deben cubrirse todas las posibilidades con betalactámicos de actividad antipseudomónica (carbapenem o piperacilina-tazobactam) asociados también a daptomicina, linezolid o vancomicina si hay riesgo de SARM. En caso de alergia a betalactámicos la alternativa pasa por el empleo de tigeciclina asociada a una quinolona (ciprofloxacino o levofloxacino) o amicacina (tabla 5). Una vez conocido el agente causal y su sensibilidad se procederá al ajuste del tratamiento antimicrobiano145.
Tratamiento antibiótico empírico de las infeciones del pie diabético
| Infección | Primera elección | Alternativa |
| LeveModerada-leve | Amoxicilina - ácido clavulánico v.o. | Levofloxacino o moxifloxacino v.o. clindamicina v.o. cotrimoxazol v.o. linezolid v.o. |
| Moderada-grave | Ertapenem i.v.± daptomicina i.v. o linezolid i.v./v.o. o glucopéptido i.v.a | Amoxicilina-ácido clavulánico i.v. o cefalosporina de tercera generación i.v.+metronidazol i.v. o fluoroquinolonab i.v./v.o.+metronidazol i.v./v.o. o piperacilina-tazobactam i.v.c oimipenem i.v. o meropenem i.v.c ± linezolid i.v./v.o. o. o daptomicina i.v o glucopéptido i.v.a |
| Grave | Imipenem o meropenem i.v. O piperacilina-tazobactam i. v. + linezolid i.v. o daptomicina i.v. o glucopéptido i.v.a | Tigeciclina i.v.d + fluoroquinolonab i.v. o amikacina i.v. |
En infecciones de piel y partes blandas moderadas-graves y graves por SARM, el tratamiento de elección es daptomicina, a dosis de 8-10mg/kg en caso de isquemia, por el riesgo de bacteriemia, su rápida acción bactericida, actividad en las biopelículas de las úlceras crónicas y bacterias en fase vegetativa y respeto por el riñón143,146–150. Linezolid es otra excelente opción por su penetración tisular, aunque es bacteriostático y en caso de insuficiencia renal los tratamientos prolongados acentúan la trombopenia151–153, teniendo además la ventaja de poder ser administrado tanto por vía parenteral como oral. Vancomicina tiene una acción bactericida más lenta que la de daptomicina y requiere el uso de altas dosis cuando la CMI en SARM es ≥1, lo que no es muy recomendable en los pacientes diabéticos con potencial o manifiesta insuficiencia renal68,154–156.
En las infecciones por E. coli BLEE el tratamiento de elección son los carbapenems, entre ellos ertapenem, especialmente si no está presente P. aeruginosa, para no ejercer presión selectiva sobre este microorganismo. Su actividad sobre los anaerobios involucrados en este de tipo de infecciones y su acción es rápidamente bactericida y poco influida por el efecto inóculo157,158, y su eficacia clínica y seguridad ya demostrada en el PD71,159 hacen que deba considerarse su uso en estas infecciones.
Aunque el papel patogénico de P. aeruginosa no está claro, pues en infecciones mixtas en las que se aisló en el estudio SIDESTEP se ha comunicado una respuesta clínica similar entre ertapenem y piperacilina- tazobactam71, deberemos considerar su tratamiento tanto de forma empírica como dirigida en aquellas infecciones que comprometan la vida del paciente y/o existan factores de riesgo para su presencia tales como úlceras de evolución crónica49, úlceras exudativas o tratadas con vendajes húmedos o hidroterapia4,160–163, en climas cálidos en personas en las que sude el pie con calzado inadecuado sin uso de calcetines164 y tras haber recibido tratamiento antibiótico en el último mes50.
La monoterapia con betalactámicos a dosis elevadas, a saber, un carbapenem, piperacilina tazobactam o cefalosporinas de cuarta generación165 o quinolonas (especialmente en pacientes alérgicos a la penicilina) es tan eficaz como el tratamiento combinado con aminoglucósidos y más segura, según datos de series clínicas no aleatorizadas47,166, por lo que no hay razones para mantener la recomendación tradicional de tratamiento combinado de betalactámicos con aminoglucósidos. La eficacia clínica de otras combinaciones, betalactámicos con quinolonas, o con macrólidos, o rifampicina no ha sido evaluada. No obstante, hay que guiarse por los resultados del antibiograma y por la epidemiología local166. La administración de piperacilina-tazobactam167 o carbapenem en perfusión continua168,169 mejora los resultados clínicos frente a la administración habitual en dosis periódicas, reduciendo la mortalidad y la estancia hospitalaria en pacientes con infecciones graves por P. aeruginosa. El fundamento de este beneficio es la modificación favorable de los parámetros farmacodinámicos y farmacocinéticos4.
La colistina por vía intravenosa y/o tópica sola o en combinación con rifampicina o imipenem es la única opción disponible en las infecciones por P. aeruginosa panresistente, también descritas en este tipo de infecciones, aunque la experiencia clínica es limitada170,171.
Los antimicrobianos con mayor actividad in vitro frente a A. baumannii son los carbapenems, sulbactam, aminoglucósidos, rifampicina y tigeciclina. Los carbapenems, excepto ertapenem y sulbactam se consideran los antimicrobianos de elección frente a las infecciones graves por A. baumannii166. La sensibilidad de A. baumannii a los antimicrobianos es diferente entre países, entre centros y entre áreas de un mismo hospital. En nuestro país el 41% de los aislamientos clínicos de A. baumannii son resistentes a carbapenems y la estancia en UCI es un factor de riesgo independiente para ello166.
Colistina intravenosa, asociada o no a rifampicina es la única opción frente a las infecciones causadas por A. baumannii por cepas resistentes a los anteriores fármacos172. Tigeciclina es activa in vitro frente a cepas resistentes a carbapenems, si bien la experiencia clínica es limitada172.
Finalmente, el desarrollo de multirresistencias ha hecho rescatar fármacos que estaban en el olvido, tales como fosfomicina173 con resultados comparables a otros fármacos, por lo que en estos casos vuelven a ser una adecuada opción terapéutica174.
El fracaso de un tratamiento antibiótico correcto puede deberse al desarrollo de resistencias, sobreinfección o extensión al hueso. Debemos de recordar que los enfermos hospitalizados y previamente tratados con antibióticos de amplio espectro durante un tiempo prolongado suelen presentar bacterias resistentes.
Tratamiento quirúrgico de la infecciónCuando la infección afecta a planos superficiales el tratamiento local con desbridamiento y limpieza suele ser suficiente. Sin embargo, en presencia de infección grave es necesario realizar un desbridamiento quirúrgico más agresivo. Este tipo de desbridamiento quirúrgico debe hacerse en presencia de abscesos en campos profundos, fascitis necrotizante, gangrena gaseosa, afectación extensa de partes blandas o el síndrome compartimental175.
Los objetivos de este tratamiento serían evitar la progresión de la infección, preservar la vida del paciente, la extremidad y la funcionalidad del miembro.
Por todo ello, antes de realizar el desbridamiento debemos valorar la vascularización del pie. En ausencia de isquemia el desbridamiento será amplio para eliminar todo el tejido necrótico presente en un solo tiempo, ya que en ausencia de isquemia la cicatrización se produce rápidamente. Por el contrario, en presencia de isquemia se realizará drenaje de los abscesos y desbridamiento de tejido necrótico, dejando zonas dudosas para eliminarlas posteriormente, si es necesario, una vez realizada la revascularización.
Antes de realizar cualquier incisión debemos tener en cuenta los compartimentos del pie que pueden estar afectados y que pueden implicarse en el desbridamiento. Dada la posibilidad de que sea necesario realizar amputaciones parciales ante el hallazgo de osteomielitis, la incisión inicial nos coincidirá con la incisión necesaria para dicha amputación. De esta manera planificaremos la incisión con vistas al tratamiento posterior que realizaremos para conservar la funcionalidad del pie en la medida de lo posible176.
Por tanto, antes de entrar en quirófano el paciente debe ser informado del tratamiento al que va a ser sometido y firmar consentimiento que incluya la necesidad de eventuales amputaciones menores o de ampliación del nivel de amputación planificado inicialmente.
Ya en quirófano se realizará una incisión que permita alcanzar el tejido sano proximal y distal a la herida. En profundidad, debemos llegar hasta un plano de fascia o músculo libre de infección. Se explorará la presencia de fístulas y /o cavidades, se drenarán los abscesos presentes y se procederá al desbridamiento, aprovechando para tomar muestras para microbiología y biopsia ósea para anatomía patológica.
Tras el desbridamiento se procederá al lavado con solución salina o con solución antibiótica (aunque no hay estudios concluyentes en PD)176.
El lavado puede hacerse mediante jeringa con suero o con jet a presión, aislando el miembro con bolsa de lavado para evitar pulverización de microorganismos al exterior177.
Completado el lavado se planificará el cierre con instrumental limpio que no se haya utilizado en la fase de desbridamiento. Antes del cierre algunos autores utilizan perlas impregnadas en antibiótico (vancomicina, tobramicina o gentamicina)178 para rellenar el espacio muerto que pueda quedar y permitir la liberación sostenida de antibiótico en zonas de resección de hueso con osteomielitis.
El cierre puede realizarse de forma directa, por segunda intención o directo diferido. El cierre directo no es recomendable en pacientes isquémicos ni en infecciones graves, para poder seguir vigilando el lecho de la herida con las curas. El cierre por segunda intención es el más utilizado; en ausencia de isquemia, el tejido de granulación consigue cubrir el defecto de forma rápida si no existen otras razones que lo impidan (zonas de hiperpresión o deformidades). El cierre directo diferido se realiza aprovechando injertos cutáneos o colgajos musculares. Es el más empleado en los casos con gran pérdida de sustancia para favorecer el alta.
La última alternativa es la amputación179. Las amputaciones de un dedo o las transmetatarsianas cerradas tras la revascularización permiten una buena funcionalidad del pie. Por el contrario, si existe una gran pérdida de sustancia que impida la funcionalidad del pie, o si existen úlceras que no cicatrizan a pesar de permeabilidad del injerto o en los casos de sepsis que amenaza la vida del paciente, debe plantearse la amputación infracondílea. La amputación supracondílea se reservará para pacientes muy debilitados sin capacidad para deambular160.
RecomendaciónToda úlcera infectada debe ser desbridada. Si la úlcera es superficial bastará con un pequeño curetaje que elimine restos necróticos y ayude a estimular el crecimiento de los bordes. En los casos de infecciones que afecten a campos más profundos, el desbridamiento debe ser más agresivo e incluir resección de todos los tejidos necróticos e infectados, puesta a plano de abscesos y amputaciones menores.
Tratamiento de la isquemiaLos objetivos principales del tratamiento de la úlcera neuroisquémica del PD son aliviar el dolor isquémico si existe, cicatrizar las úlceras, prevenir la pérdida de la extremidad, mejorar la función del paciente y la calidad de vida y prolongar la supervivencia, sin amputaciones.
En algunos pacientes que presentan comorbilidades graves o con una posibilidad muy limitada de revascularización satisfactoria, la amputación primaria puede ser el tratamiento más apropiado.
El control de los factores de riesgo cardiovascular es imprescindible en todos los pacientes diabéticos con úlcera, al igual que en todos los pacientes con enfermedad arterial obstructiva de extremidades inferiores (EAOEEII). Por ello, un enfoque multidisciplinar es óptimo para el control del dolor, los factores de riesgo cardiovascular y otras enfermedades comórbidas.
Tratamiento médico de la isquemiaLa farmacoterapia o cualquier otro tratamiento para la isquemia tiene mayores probabilidades de dar resultados en los pacientes que estaban asintomáticos antes de la aparición de las lesiones del pie, y en los que presentan lesiones superficiales con presiones de perfusión más elevadas.
Puede utilizarse cilostazol, un inhibidor de la fosfodiesterasa III, si existe claudicación intermitente asociada, siempre que el paciente pueda caminar, lo que depende de la localización de la úlcera y de que disponga de una buena descarga180.
El acido acetil salicílico (AAS) y otros fármacos antiagregantes plaquetarios (clopidogrel) son importantes para el tratamiento a largo plazo de la EAOEEII para reducir el riesgo de eventos aterotrombóticos181. Aunque se ha demostrado su efecto beneficioso sobre la permeabilidad de la cirugía revascularizadora y sobre la progresión de la aterosclerosis femoral, no hay evidencia alguna de que estos fármacos mejoren la evolución de la isquemia crítica.
Ni la heparina ni los antagonistas de la vitamina K han demostrado eficacia en el tratamiento de la isquemia crítica y úlceras.
Los prostanoides, fármacos de uso parenteral que impiden la activación plaquetaria y leucocitaria y protegen al endotelio vascular, mejoran la cicatrización de las úlceras isquémicas y reduccen el número de amputaciones sin aumentar la supervivencia libre de amputación182.
AnalgesiaEl control del dolor es esencial para mejorar la función y la calidad de vida. Lo ideal es que este alivio se consiga mediante la revascularización de la extremidad, pero mientras ésta se lleva a cabo y en aquellos casos en que no es posible, a menudo es necesario el uso de narcóticos.
En función de la intensidad del dolor se administrará la analgesia de forma regular en lugar de a demanda, y se favorecerán mediadas higiénico-posturales como la colocación de la extremidad en declive.
Entre los fármacos a utilizar se incluye el paracetamol, metamizol o fármacos antiinflamatorios no esteroideos, teniendo cuidado en pacientes hipertensos y con insuficiencia renal. A menudo estos fármacos no son suficientes y es necesario el uso de opiodes débiles (tramadol, codeína) o mayores (fentanilo, oxicodona o bupremorfina)133.
RevascularizaciónLa evolución natural hacia la amputación de una úlcera neuroisquémica en el PD hace que esté indicada la revascularización para la salvación de la extremidad. La determinación del mejor método de revascularización se basa en el balance entre el riesgo de una intervención específica y el grado y durabilidad de la mejoría clínica que se espera derivada de ella. Los resultados de la revascularización dependen de la extensión de la enfermedad en el árbol arterial (inflow, outflow y diámetro y longitud del segmento enfermo), el grado de enfermedad sistémica (comorbilidades que afectan a la esperanza de vida e influyen en la permeabilidad de la técnica de revascularización) y del tipo de procedimiento llevado a cabo. Las conclusiones de los grandes ensayos clínicos deben ser consideradas en el contexto de la situación individual de cada paciente y sin olvidar que los resultados de las técnicas de revascularización dependen de factores tanto anatómicos como clínicos.
La enfermedad aterosclerótica de las arterias distales, asociada a la diabetes, puede encontrarse en combinación con otros territorios proximales o como enfermedad predominante infrapoplítea. Estos pacientes suelen permanecer asintomáticos gracias a una excelente red colateral; cuando presentan clínica de isquemia crítica es que poseen una severa y extensa enfermedad de tres vasos, y solo el 20-30% sufren una lesión focal con un buen run-off.
Morfológicamente se caracterizan por una afectación difusa y segmentaria, sobre todo de los vasos tibiales, donde solo el 50% tiene un vaso permeable hasta el pie, generalmente la arteria peronea. Existe una alta prevalencia de oclusiones largas (mayores de 10cm) y la afectación proximal suele ser mínima a nivel iliaco (1%) y aproximadamente del 10% a nivel del sector femoropoplíteo183.
La revascularización mediante cirugía abierta de la enfermedad oclusiva de las arterias distales se realiza principalmente mediante bypass con material autólogo (preferentemente vena safena). Por su parte, las técnicas de cirugía endovascular incluyen principalmente la angioplastia transluminal percutánea (ATP), pudiéndose asociar a stenting, láser y técnicas de reducción del volumen de la placa. El incremento exponencial del uso de estas técnicas endovasculares, en comparación con la revascularización quirúrgica abierta, se debe principalmente al mayor beneficio respecto al riesgo secundario a los bajos porcentajes de morbilidad y mortalidad asociados a las técnicas percutáneas. Pueden usarse técnicas mixtas (cirugía abierta+endovascular).
Aunque las lesiones específicas estratificadas se van modificando, la morfología de la lesión no queda lo suficientemente especificada en la clasificación de las lesiones del consenso TASC. Las lesiones tipo A representan lesiones con excelentes resultados de tratamiento endovascular; las lesiones tipo B son aquellas que ofrecen resultados suficientemente buenos con métodos endovasculares, lo que convierte a este abordaje como de primera elección, al menos que se requiera una revascularización abierta para otra lesión asociada en la misma área anatómica; en las lesiones tipo C se obtienen resultados a largo plazo superiores con la revascularización abierta y los métodos endovasculares y solo deben utilizarse en pacientes con un elevado riesgo quirúrgico para la reparación abierta; las lesiones tipo D, por su parte, no han obtenido resultados óptimos de tratamiento con técnicas endovasculares como para considerarlos un tratamiento primario (tabla 6).
Estratificación morfológica TASC de las lesiones infrapoplíteas
| Lesiones tipo A | Lesiones únicas menores de 1cm en los vasos tibiales o peroneos |
| Lesiones tipo B | Estenosis focalesmúltiples de los vasos tibiales o peroneos, cada una inferior a 1cm de longitud |
| Una o dos estenosis focales, cada una inferior a 1cm de longitud, en trifurcacion tibial | |
| Estenosis tibial o peronea corta junto a PTA femoropoplítea | |
| Lesiones tipo C | Estenosis de 1-4cm de longitud |
| Oclusiones de 1-2cm de longitud de los vasos tibiales o peroneos | |
| Estenosis extensas de la trifurcación tibial | |
| Lesiones tipo D | Oclusiones tibiales o peroneas superiores a 2cm |
| Enfermedad difusa en los vasos tibiales o peroneos |
Las guías de actuación establecidas en el TASC II133 recomiendan la cirugía endovascular en la enfermedad infrapoplítea para casos de salvamiento de la extremidad, que es lo que ocurre en los casos de una infección de una úlcera neuroisquémica El éxito técnico dependerá de la longitud de la lesión a tratar y del número de vasos tratados, entre otros.
En cuanto al empleo del stenting primario en los troncos distales, no tenemos el nivel de evidencia adecuado que lo justifique, siendo la angioplastia la primera estrategia endovascular, con una tasa de salvamento de extremidad a tres años del 91%, un bajo coste y una longitud de lesión mayor que las series de stents184. Estaría indicado el stenting infrapoplíteo en aquellos casos con resultados subóptimos de la PTA (estenosis residual >50%) y disecciones limitantes de flujo que no mejoran tras dilataciones prolongadas.
En relación con las técnicas quirúrgicas convencionales, el tratamiento de elección es el bypass o la amputación primaria. La cirugía revascularizadora femorodistal con vena safena interna se caracteriza por su complejidad técnica y la morbimortalidad asociada (hasta del 18% en algunas series) con una tasa de permeabilidad primaria a 5 años entre el 60-70%, secundaria del 70 y 80% y un salvamento de extremidad entre el 74 y el 85%185,186.
Los resultados a medio plazo en estos pacientes, en los que es posible tratamiento endovascular y cirugía convencional, son similares en ambos grupos en cuanto al tiempo de supervivencia libre de amputación, calidad de vida y mortalidad, por lo que muchos grupos han optado por las técnicas endovasculares. A corto plazo, sin embargo, la cirugía se asocia a una mayor morbilidad y mayor coste sanitario, a expensas de largas estancias hospitalarias y utilización de recursos.
Por lo tanto, en pacientes con una esperanza de vida menor de dos años y con una comorbilidad importante añadida, o en los que no hay vena útil, la angioplastia debe ser ofrecida como primera opción terapéutica; y en pacientes con expectativa de vida mayor de dos años y buenas condiciones de vida la cirugía ofrece mejores resultados a largo plazo con menor número de reintervenciones187.
Recomendaciones- 1.
La revascularización precoz es el tratamiento óptimo de la isquemia en la úlcera del pie diabético.
- 2.
Los objetivos principales del tratamiento de revascularización en las úlceras del pie diabético son aliviar el dolor isquémico, cicatrizar las úlceras, prevenir la pérdida de la extremidad y mejorar la calidad de vida y la función del paciente.
- 3.
Si se opta por una revascularización endovascular y abierta deben utilizarse técnicas endovasculares.
Los dos componentes fundamentales de las úlceras en el PD son la neuropatía y el aumento de presión local. Por tanto, es necesario que una vez eliminada la infección de la úlcera intentemos disminuir la presión en la zona para conseguir la cicatrización y evitar recidivas.
La descarga se puede conseguir mediante férulas (férulas de contacto total o calzado moldeado a medida), mediante calzado (modificaciones en el zapato, plantillas, ortesis, calcetines), mediante cirugía (alargamiento del tendón de Aquiles, inyecciones de silicona, eliminación de callosidades, cirugía ósea—resección de la cabeza de lso metatarsales, osteotomías, artroplastias, ostectomías, exostectomía, fijaciones externas—)188–190.
También puede usarse silla de ruedas, andadores, fieltros de descarga plantar, cerclajes al nivel de la rodilla o de la articulación del tobillo, incluso el reposo en cama supone una descarga.
La forma más sencilla y barata de eliminar la presión en una determinada zona es la eliminación de callosidades, y sin embargo no hay ningún estudio que se haya diseñado con este método188.
Las férulas de contacto total han demostrado ser el mejor método para disminuir la presión. La guía NICE concluye que no hay diferencia significativa entre el uso de la férula de contacto total, las férulas no fijas y el zapato de apoyo posterior191. Lo que cabe destacar de este tipo de descarga frente a otros dispositivos no fijos es la adhesión al tratamiento, que depende en gran medida de la posibilidad que tenga el paciente de modificar el dispositivo de descarga (a mayor posibilidad de modificarlo, menos lo usará), de la capacidad para realizar su vida cotidiana y de la estabilidad para la marcha que perciba utilizando el dispositivo192. Por tanto, cualquier dispositivo que utilice el paciente, si lo usa de forma continua, será eficaz en aliviar la presión.
La disminución de la presión plantar en el antepié se consigue mediante zapatos de apoyo posterior, plantillas diseñadas específicamente para el paciente con descarga en la zona de la úlcera o modificaciones exteriores del zapato (suela en mecedora). Los materiales y el diseño de las plantillas son muy variables, por lo que no es posible comparar resultados en las revisiones hechas sobre el tema. Cualquier dispositivo que utilicemos para descargar debe llevar asociado un estudio biomecánico del pie. De esta forma, no trasladaremos la carga que aliviamos a otra zona, en donde la sobrecarga pueda provocar una nueva úlcera193.
Por tanto, es necesario que un profesional realice una valoración clínica del paciente y adapte las necesidades clínicas a las posibilidades técnicas, evaluando en cada caso diferentes aspectos (neuropatía, rango de movilidad articular, deformidades y amputaciones parciales). Se debe elegir el tipo de calzado con las modificaciones necesarias y los materiales que mejor se adapten a la necesidad de cada paciente. Por tanto, puede ser el cirujano vascular, el enfermero, el podólogo o el médico de familia quien detecte el pie de riesgo, pero ha de ser un rehabilitador, podólogo o técnico ortopédico quien diseñe y adapte el tratamiento más adecuado194.
RecomendaciónLa descarga es necesaria para conseguir el cierre de la úlcera. Se debe aplicar el dispositivo que mejor se adapte al paciente y que permita seguir realizando las curas adecuadas, siempre implicando al paciente en el cumplimiento estricto del uso de la descarga.
Estrategias terapéuticas localesDesbridamientoEl desbridamiento es una parte esencial de las estrategias terapéuticas locales (ETL) en una úlcera. En los casos de úlceras agudas para retirar restos de tejido necrótico e infectado y en el caso de las infecciones crónicas para estimular y promover la cicatrización.
CurasEn caso de úlceras isquémicas o infectadas se recomienda una cura seca para reducir la posibilidad de progresión de la infección y la necrosis, aunque también retrase la cicatrización. Una vez tratada la infección y la isquemia y la úlcera esté limpia, se recomienda una cura húmeda. Se recomienda utilizar apósitos para cubrir la herida y prevenir sobreinfección, si bien no existe evidencia en cuanto al uso de uno sobre otro, por lo se recomienda el uso del apósito que tenga el coste más bajo dentro de las indicaciones clínicas de uso del mismo, la experiencia del profesional que lo use y las preferencias del paciente.
Factores de crecimientoSolo el G-CSF ha demostrado efectos positivos sin que exista evidencia clínica de efectividad en lo que se refiere a PDGF, EGF y TGF-beta.
En cualquier caso el grupo de revisión de NICE recomienda que el G-CSF debería aplicarse exclusivamente a heridas que estuvieran estabilizadas y sin signos de infección moderada o severa, por lo que no se debería utilizar en paciente hospitalizados, sino en los pacientes ya remitidos a Atención Primaria. Por tanto, su uso hospitalario quedaría limitado a pacientes que participen en ensayos clínicos.
Oxigenoterapia hiperbáricaVarios estudios retrospectivos y descripción de casos abogan por el de uso de oxigenoterapia hiperbárica165,195–197, aunque no es hasta la última década cuando se realizan estudios prospectivos198, demostrando beneficios tanto a nivel individual como en un metaanálisis que concluye en un clara mejoría en la reducción de amputaciones mayores. Debido a problemas metodológicos en alguno de los estudios, a la dificultad de acceso al tratamiento en la mayoría de nuestros centros y a su coste, junto con la no demostrada eficacia en el tratamiento de las fascitis necrotizantes199,200, y la falta de estudios de coste-efectividad, hacen de la consideración de esta terapia una decisión individual en cada caso, hasta que se realice un ensayo prospectivo y aleatorizado que valide dicha actuación en estos enfermos165,201, no aconsejándose su uso de forma sistemática
Sustitutos cutáneosTanto el Dermagraft como el Graftskin han demostrado efectos positivos en el cierre de la úlcera (50%) y en disminuir el tiempo de cicatrización, pero sin disminuir el riesgo de amputación. Sin embargo, dada la baja calidad de la evidencia, la falta de evidencia sobre prevención de amputaciones u otras intervenciones quirúrgicas y su alto coste, recomiendan no ofrecer dicho tratamiento para pacientes hospitalizados excepto que formen parte de un ensayo clínico.
Terapia de presión negativaAunque con evidencia de baja calidad, los estudios han demostrado efectos positivos en reducir el número de amputaciones. Falta por realizar estudios económicos a largo plazo para determinar el coste-efectividad de la terapia.
Otras terapias localesNo existe evidencia de efectividad y, por tanto, no se recomienda ofrecer como terapia adyuvante a los paciente hospitalizados, salvo que se incluyan en un ensayo clínico los siguientes tratamientos: estimulación eléctrica, gel de plasma autólogo rico en plaquetas, regenerador de matriz tisular y dalteparina191,202.
Antibioticoterapia tópicaAunque clásicamente se han utilizado agentes como neomicina, polimixina, gentamicina y mupirocina de forma tópica, no existen estudios de calidad que apoyen el uso de estos antibióticos de forma tópica en lo que se refiere a cicatrización de la herida o disminución del número de amputaciones203,204. Sin embargo, en pies isquémicos sin posibilidad de revascularización y en caso de bacterias multirresistentes podrían usarse, ya que en la úlcera alcanza una mayor concentración que por vía sistémica205.
RecomendaciónNo se ha demostrado claro beneficio en cuanto al uso de un apósito determinado. La terapia por vacío y la oxigenoterapia hiperbárica parecen relacionarse con menor número de amputaciones, pero no deben indicarse de forma sistemática.
Tratamiento no antibiótico en infecciones gravesEntre los tratamientos no antibióticos propuestos en la literatura cabe destacar por su importancia en la evolución clínica e impacto en su pronóstico, y en especial en los pacientes más graves, el uso de los factores estimulantes de colonias (G-CSF)165,206–212, el tratamiento con inmunoglobulinas y finalmente los paquetes de medidas aplicadas en el tratamiento de la sepsis grave y el shock séptico promovidas por la Surviving Sepsis Campaing.
Basados en el hecho documentado de la mejoría de la función de los neutrófilos in vitro213, se han realizado 5 ensayos clínicos para valorar la eficacia del uso de G-CSF en estos pacientes206–211, no demostrándose beneficios de forma particular en cada uno de ellos en sus diversos end points. Sin embargo, un metaanálisis realizado con el conjunto de los estudios, si bien no corroboró su influencia en el acortamiento del tiempo de resolución de la infección, sí demostró una menor incidencia de amputaciones y de otros procedimientos quirúrgicos165,212.
Después de los resultados publicados por un grupo europeo de un ensayo clínico doble ciego, del uso de inmunoglulinas en el shock tóxico estreptocócico, en el que se objetivó una clara disminución de una forma estadísticamente significativa en la mortalidad basada en el bloqueo de los superantígenos, su uso debe considerarse siempre en aquellos casos que corra peligro la vida214,215.
Finalmente, no debemos olvidar la importancia del cumplimiento de los paquetes de medidas terapéuticas basadas en la obtención de una serie de objetivos en las 6 primeras horas de evolución en aquellos pacientes que se encuentren en situación de sepsis severa y shock séptico ideadas por la Surviving Sepsis Campaing216, que si bien exceden el propósito de este consenso, sí deben ser tenidas en cuenta en el manejo de los pacientes con infecciónes graves de PD.
Vías de actuaciónEl tratamiento óptimo de las infecciones del PD requiere a un mismo tiempo celeridad en la valoración del paciente y adecuación de ésta al profesional más adecuado del sistema sanitario que aúne la disponibilidad y el expertise suficientes. El diseño de un algoritmo de actuación resulta de especial importancia en el manejo práctico de estos pacientes, que incluye a especialistas de referencia (internista, infectólogo, endocrinólogo, ortopeda, cirujano general, cirujano vascular, microbiólogo, rehabilitador), en estrecha relación con profesionales de podología y Atención Primaria, tanto personal médico como de enfermería (fig. 6).
El primer paso ante la sospecha de infección de PD es su confirmación diagnóstica, que se establece por los criterios clínicos de la clasificación clínica y que distingue entre los distintos grados de infección y la ausencia de ésta. A continuación, esto es, ante una infección clínicamente confirmada, debe establecerse su gravedad, de nuevo por medio de los criterios clínicos referidos. De especial importancia en este punto resulta identificar aquellos pacientes que precisan ser derivados de forma inmediata a un centro hospitalario para recibir antibioterapia parenteral de amplio espectro y/o una eventual valoración quirúrgica.
La clasificación distingue entre infecciones leves, moderadas-leves, moderadas-graves y graves, y mientras que las dos primeras son abordables ambulatoriamente, las dos últimas requieren una atención inmediata del paciente en el hospital. De todas las infecciones aquellas que plantean más dudas respecto a su manejo y a la posibilidad de ser tratadas ambulatoriamente son las infecciones moderadas. Las infecciones moderadas incluyen un amplio espectro de presentaciones clínicas, desde aquellas francamente próximas a una infección leve a aquellas otras que pueden poner en riesgo la extremidad del paciente, por lo que se han subdividido las moderadas en moderadas-leves y moderadas-graves, y deben ser evaluadas por especialistas.
De forma genérica debe considerarse la hospitalización cuando hay signos de toxicidad sistémica (fiebre, leucocitosis), inestabilidad metabólica (hipoglucemia severa, acidosis), infección de planos produndos o rápidamente progresiva), necrosis extensa, isquemia crítica, necesidad de un abordaje diagnóstico o terapéutico urgente, o en aquellos casos en que el paciente no puede cuidar de sí mismo o carece de un soporte social adecuado. Los criterios de la clasificación, por consiguiente, aúnan factores locales del pie, repercusión sistémica en el paciente y otros aspectos médicos, psicológicos y sociales.
Criterios de derivaciónAquellos pacientes con úlcera de PD en los que exista sospecha o certeza de la existencia de situaciones que puedan comprometer la extremidad y no puedan ser resueltas en Atención Primaria, deben ser evaluados y en su caso tratados idealmente en Unidades de pie diabético y, si no existen, en atención especializada. En general, en los casos de infección moderada-leve, moderada-grave, grave o si existe isquemia (tabla 7).
Criterios de derivación del pie diabético
| Derivación normal |
| Úlcera neuropática no infectada |
| Úlcera neuropática con infección leve |
| Derivación preferente |
| Úlcera neuroisquémica (o sospecha) sin dolor en reposo o dolor que cede con analgésicos menores |
| Sospecha o evidencia de osteomielitis |
| Úlcera que no cicatriza tras dos meses de medidas adecuadas (curas, descargas, desbridamiento) |
| Infección leve que no mejora tras 7 días de tratamiento adecuado |
| Derivación urgente |
| Úlcera neuroisquémica (o sospecha) con dolor en reposo que no cede con analgésicos menores |
| Sospecha o evidencia de infección moderada-leve, moderada-grave o grave |
La diabetes mellitus, con una prevalencia del 10-15% de la población217, es la causa más frecuente de amputación de las extremidades inferiores. Mediante la identificación y educación de los pacientes de riesgo y la detección precoz y tratamiento adecuado de las complicaciones se puede disminuir la tasa de amputaciones en un 80%218, e incrementar la cicatrización de las úlceras en un 70-85%219.
Para la aplicación de una buena prevención y tratamiento es necesario el conocimiento de la fisiopatología de la úlcera del PD, del «camino a la amputación». La úlcera es la precursora de más del 85% de las amputaciones18. Cuanto más tiempo permanezca abierta la úlcera, más probable es que se infecte, siendo la infección el «golpe de gracia» que conduce a la amputación220.
Una organización efectiva requiere sistemas y guías para educación, screening, reducción del riesgo, tratamiento y evaluación de resultados. Las variaciones locales en recursos y personal determinarán la forma en que se aplica. De forma ideal, debe incluir:
- 1.
Educación de los pacientes, cuidadores y personal sanitario en hospitales y Atención Primaria.
- 2.
Sistema de detección de pacientes de riesgo, con examen periódico de los pacientes.
- 3.
Tratamiento rápido y efectivo.
- 4.
Estructura para cubrir las necesidades de los pacientes crónicos.
Las Unidades de PD deben englobar todo el proceso del pie de un diabético desde que es diagnosticado. Incluye el screening de todo diabético y sobre todo de aquellos con pie de alto riesgo, sobre todo mediante educación y calzado adecuado, el tratamiento de las lesiones triviales del pie, como la resección de callos, patologías ungueales y limpieza de ampollas, y por último la actuación ante la aparición de una úlcera.
Pero el screening y el manejo de las lesiones triviales del PD se escapa al objetivo de estas guías, por lo que nos centraremos en las unidades para prevención de la amputación a partir de la aparición de una úlcera.
Existiendo muchos modelos de unidades, lo prioritario es el tratamiento de la infección y la revascularización para conseguir la cicatrización de la úlcera, sin olvidar la cura de la úlcera, la descarga del pie y el control metabólico y prevención cardiovascular de los pacientes.
Las habilidades que requiere el equipo según las guías DRAFT (Diabetic Rapid Response Acute Foot Team) son: valoración de la úlcera y gradación de la infección y/o isquemia en ella; adecuada toma de muestras y cultivos microbiológicos; valoración vascular hemodinámica y anatómica y revascularización abierta y endovascular si procede; valoración neurológica; desbridamiento y amputaciones; iniciar y modificar en función de la lesión, el paciente y el cultivo el tratamiento antibiótico apropiado; y monitorización postoperatoria apropiada para reducir el riesgo de reulceración y reinfección221.
Las recomendaciones generales para una unidad para el tratamiento del PD complicado, es decir, aquellos con úlcera o pérdida de la continuidad de la piel del pie, inflamación o edema de alguna parte del pie o algún signo de infección, fractura o luxación del pie sin historia de traumatismo significativo, dolor inexplicable del pie, o gangrena de parte o de todo el pie son129:
- 1.
Cada área sanitaria debe tener una guía de cuidados para los pacientes con PD complicado.
- 2.
Un equipo multidisciplinario debe tratar a los pacientes con PD complicado.
- 3.
El equipo multidisciplinario debe estar compuesto por profesionales de la salud con las habilidades especializadas y competencias necesarias para asistir a los pacientes con PD complicado.
- 4.
El equipo multidisciplinario puede variar en función de las características de cada área, pero debe incluir un cirujano vascular con habilidades diagnósticas y terapéuticas de revascularización abierta y endovascular y un cirujano general, un internista o un especialista en enfermedades infecciosas, un endocrino, un podólogo y/o personal de enfermería con conocimiento del cuidado de las lesiones del pie diabético. El equipo debe tener acceso a servicios y especialistas que permitan llevar a cabo los cuidados necesarios en estos pacientes.
- 5.
El equipo multidisciplinario de cuidados del pie debe: a) valorar y tratar la diabetes del paciente, lo que debe incluir intervenciones para minimizar el riesgo cardiovascular, tratar la insuficiencia renal o anemia que pueda presentar; b) valorar, revisar y evaluar la respuesta inicial del paciente al tratamiento médico, quirúrgico y de la diabetes; c) valorar el pie y determinar la necesidad de cuidados especiales de la herida, desbridamiento, descarga y otras intervenciones quirúrgicas; d) valorar el dolor del paciente y determinar la necesidad de su tratamiento e incluso remisión a la unidad del dolor; e) realizar una valoración vascular y una revascularización si es necesario; f) revisar el tratamiento de la infección; g) determinar la necesidad de intervenciones para prevenir el desarrollo de contracturas del tendón de Aquiles y otras deformidades del pie; h) valoración y tratamiento ortopédico para facilitar la cicatrización y prevenir las recurrencias; i) acceso a fisioterapia; y j) planificar el alta, lo que debe incluir asegurar la valoración y cuidado del paciente en Atención Primaria y seguimiento por especialistas.
Los autores declaran no tener ningún conflicto de intereses.
Coordinadores: Francisco Lozano y Albert Clara (SEACV). Integrantes del comité ad hoc: Diego Alcalá (AEC); Albert Clará, José Ignacio Blanes, Esther Doiz, Rocío Merino, Francisco Lozano (SEACV); Juan González del Castillo (SEMES); José Barberán (SEMI); Rafael Zaragoza (SEMICYUC) y José Elías García Sánchez (SEQ).
Representantes de la Asociación Española de Cirujanos (AEC), Sociedad Española de Angiología y Cirugía Vascular (SEACV), Sociedad Española de Medicina de Urgencias y Emergencias (SEMES), Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) y Sociedad Española de Quimioterapia (SEQ).