Puntos clave
Las infecciones por Mycoplasma pneumoniae pueden producir gran variedad de síntomas respiratorios, siendo el cuadro más frecuente la traqueobronquitis y el más importante la neumonía atípica.
La edad más frecuente son niños entre 5 y 15 años, aunque se puede producir a cualquier edad.
La mayoría de los cuadros son muy leves y no suelen requerir tratamiento, aunque se han descrito cuadros graves en pacientes imunodeprimidos.
Puede producir manifestaciones extrarrespiratorias muy diversas, ya sea antes, durante o después de la infección, la mayoría de ellas son reacciones inmunitarias por las características antigénicas del M. pneumoniae.
El tratamiento de elección son los macrólidos, ya que al carecer de pared celular los micoplasmas son resistentes a los betalactámicos.
El diagnóstico se realiza mediante serología o más recientemente mediante reacción en cadena de polimerasa (PCR)
Lectura rápida
El M. pneumoniae es una causa común de infección respiratoria a todas las edades, pero especialmente en niños. La incidencia de la enfermedad no varía mucho en distintas estaciones, aunque las epidemias suelen producirse en verano y otoño.
La transmisión se produce persona-persona por medio de aerosoles y es facilitada por la tos, por lo que suele producir brotes epidémicos escuelas, guarderías y en comunidades cerradas. El M. pneumoniae penetra en el organismo por vía aérea y el periodo de incubación varía entre 4 y 23 días.
Los micoplasmas pertenecen a la familia Mycoplasmataceae de la clase Mollicutes (molli cutis: piel blanda). Son bacterias de pequeño tamaño, de hecho son las bacterias más pequeñas con capacidad de división autónoma y vida libre1. La falta de pared celular condiciona muchas de las características del microorganismo, como su polimorfismo, que no se tiñan por la tinción de Gram, su resistencia a los antibióticos betalactámicos y su elevada sensibilidad a las variaciones de pH, temperatura, la tensión osmótica y los detergentes. Su pequeño genoma y sus limitadas capacidades biosintéticas son responsables de muchas de sus características biológicas y de las particulares exigencias de suplementación de los medios de cultivo para que pueda cultivarse in vitro. Por carecer de pared celular son muy frágiles, pero pueden cultivarse en medios de cultivo especiales, aunque con dificultad, por lo que habitualmente no se cultivan en muchos laboratorios. Actúan como parásitos extracelulares de células y tejidos, aunque algunas especies pueden penetrar en las células. La única protección externa es su membrana citoplásmica, la cual posee un gran número de lipoproteínas denominadas lipid-associated membrane proteins, muy antigénicas, y que son reconocidas por las células inmunitarias con unos receptores tipo Toll (toll-like receptors). Estas lipoproteínas pueden modular el sistema inmunitario e inducir la apoptosis celular o la muerte de las células inmunitarias. Además, poseen un citoesqueleto que forma un recubrimiento de elementos proteicos organizado helicoidalmente en forma de una red regular que envuelve por completo el citoplasma. Poseen una organela polar terminal multifuncional, asociada al citoesqueleto, compuesta por varias proteínas, que es esencial para la adherencia a las células del huésped, pero que participa, además, en el movimiento deslizante de estas bacterias y en su división celular1,2.
La mayoría de las especies de micoplasmas no son patógenas y son habitantes comunes de las mucosas respiratorias o genitales. La especie de mayor importancia es M. pneumoniae, causante de infecciones respiratorias.
Patogenicidad de Mycoplasma pneumoniaeM. pneumoniae es una bacteria patógena exclusivamente humana y de distribución universal. Penetra por vía aérea y se adhiere a las células epiteliales respiratorias a través de las proteínas de su organela terminal: la proteína P1 es una adhesina (citadhesina) de especial importancia en la patogenia y también es la diana de los principales anticuerpos que produce la respuesta inmunitaria del huésped3. También produce peróxidos que alteran el movimiento ciliar y daña a las células. Algunas de las proteínas de su membrana inducen la producción de citocinas proinflamatorias, entre ellas la interleucina 8, potente quimiocina para neutrófilos, que hace que las células epiteliales recluten células inflamatorias hacia las vías aéreas, dando lugar a la infiltración celular propia de estas infecciones. Esta respuesta neutrofílica se ha implicado en el papel que esta bacteria podría tener en la patogénesis del asma, ya que en este existe una inflamación de vías aéreas que da lugar a una hiperrespuesta bronquial y a síntomas de obstrucción aérea, con posibilidad de provocar la limitación irreversible al flujo aéreo. En algunos asmáticos se detecta M. pneumoniae mediante técnicas de moleculares reacción en cadena de la polimerasa (PCR).
Epidemiología de las infecciones por Mycoplasma pneumoniaeLas infecciones causadas por M. pneumoniae afectan al tracto respiratorio superior e inferior en personas de todas las edades y son de distribución mundial4.
Las personas con infección activa tienen los organismos en nariz, garganta, traquea y esputo, indicando una afectación difusa. La transmisión persona-persona se realiza por aerosoles y es facilitada por la tos. Al estar los micoplasmas fijados a las células, la transmisión se facilita por gotitas gruesas, hecho corroborado por el contacto íntimo típico de los brotes (p. ej., colegios, convivencia en instituciones, comunidades cerradas, hospitales, etc.). El periodo de incubación puede ser de 4 a 23 días, dependiendo de los inóculos transmitidos.
No parece que los varones y las mujeres tengan diferencias de susceptibilidad para las infecciones por M. pneumoniae.
Clásicamente, se ha considerado que las infecciones respiratorias agudas son más frecuentes en niños a partir de los 5 años y en adultos jóvenes5,6. M. pneumoniae podría llegar a producir hasta el 40% de las neumonías comunitarias1.
Estudios previos con serología y cultivo señalaban que la incidencia era rara en niños de menos de 5 años y mayor en niños de 5 a 15 años, disminuyendo después de la adolescencia6,7. Sin embargo, con los actuales métodos diagnósticos de amplificación genómica se ha comprobado que las infecciones por M. pneumoniae puede ocurrir de forma endémica en general, pero también presentarse con carácter epidémico, también en personas mayores y no es infrecuente en niños menores de 5 años1,4.
Aunque la incidencia de enfermedad no varía mucho en las distintas estaciones y ni el clima ni la localización geográfica parecen importantes, la proporción de pacientes con neumonía en climas templados es mayor en verano, debido a la menor incidencia de otros patógenos respiratorios en esta época1. Las epidemias por M. pneumoniae suelen producirse en verano y otoño. El largo periodo de incubación (2–3 semanas) y la relativamente baja tasa de transmisión se han relacionado con la prolongada duración de las epidemias8.
En un estudio realizado en Francia durante un periodo de 5 años, Layani Milon et al.9 demostraron que M. pneumoniae era el segundo agente etiológico de infecciones respiratorias, por detrás del virus de la influenza A y por delante de muchos otros virus. En algunos casos, M. pneumoniae y virus se detectaron simultáneamente en las mismas muestras clínicas.
Algunos estudios9–11 han descrito cambios recientes en la incidencia de infecciones por M. pneumoniae con un incremento notable de estas infecciones entre periodos epidémicos y sin retorno a los niveles de los periodos endémicos. Jacobs12 ha sugerido al respecto que el mejor conocimiento funcional del genoma de M. pneumoniae y de sus factores de virulencia, además de la adhesina P1, puede ayudarnos a comprender por qué se están produciendo estos cambios.
Estudios realizados en Japón13 y Alemania14 han demostrado que la expresión de diferentes subtipos de adhesinas P1 puede ser relevante en el desarrollo de epidemias cíclicas. Las variaciones en los genes que codifican para la adhesina P1 y la producción de anticuerpos subtipoespecíficos podrían explicar las reinfecciones por otros subtipos.
M. pneumoniae ha sido considerado históricamente como un microorganismo patógeno primario que no forma parte de la flora comensal del tracto respiratorio. Sin embargo, se ha demostrado que puede persistir durante periodos variables en las vías respiratorias de pacientes que han tenido una infección activa por este microorganismo y han sido adecuadamente tratados con antibióticos6. Esta persistencia se ha tratado de explicar por la fuerte adherencia del microorganismo a las células epiteliales del tracto respiratorio y porque los antibióticos bacteriostáticos de elección serían incapaces de destruir todas las bacterias presentes.
En algunos estudios de vigilancia6,15,16, utilizando técnicas de cultivo y PCR, se ha comprobado que en algunas personas puede producirse un prolongado estado de portador, con gran fluctuación en el tiempo de persistencia del microorganismo en secreciones respiratorias, constituyéndose en reservorios capaces de transmitir el microorganismo a otras personas.
Manifestaciones respiratorias de Mycoplasma pneumoniaeLa neumonía puede ser la forma más grave de infección por M. pneumoniae, pero el síndrome más típico, especialmente en niños, es la traqueobronquitis acompañada de una amplia variedad de manifestaciones respiratorias superiores, como faringitis. También puede ocasionar manifestaciones en áreas próximas a las vías respiratorias como conjuntivitis o miringitis.
La infección por M. pneumoniae suele ser leve, incluso en adultos en ocasiones es asintomática, mientras que las formas asintomáticas son más raras en niños, probablemente por algún grado de inmunidad protectora en los adultos.
La enfermedad sintomática propia del tracto respiratorio inferior es la neumonía (neumonía atípica). Esta neumonía se desarrolla gradualmente durante un periodo de varios días y persiste durante semanas o meses. Sus manifestaciones más frecuentes incluyen faringitis, fiebre, tos, cefaleas, escalofríos, mialgias, artralgias y malestar general. La disnea puede ser evidente en los casos más graves y la tos puede ser pertusoide, haciendo que el paciente presente dolor torácico por la tos. Los niños menores de 5 años manifiestan más coriza y estornudos, y la progresión hacia la neumonía suele ser infrecuente, mientras que los niños de 5 a 15 años son más propensos a desarrollar una bronconeumonía que afecta a uno o más lóbulos, y a veces requieren hospitalización. Las infecciones leves y las asintomáticas son frecuentes en adultos. La auscultación torácica puede mostrar roncus localizados y estertores respiratorios. En los casos no complicados el periodo febril agudo dura alrededor de una semana, mientras que la
Lectura rápida
La infección puede ser asintomática y puede causar gran variedad de síntomas respiratorios, aunque el cuadro más frecuente es la traqueobronquitis y el más importante la neumonía atípica (causando hasta el 40% de las neumonías atípicas en niños mayores de 5 años y adolescentes). La mayoría de las veces produce cuadros leves que no requieren tratamiento. En otras ocasiones (excepcionales) puede producir cuadros graves, como el síndrome del distrés respiratorio o incluso fallo multiorgánico, especialmente en pacientes inmunodeprimidos. También parece estar implicado en la patogenia del asma, debido a la respuesta neutrofílica que produce, causando inflamación de la vía aérea que da lugar a una hiperrespuesta bronquial.
Lectura rápida
También son frecuentes las manifestaciones extrapulmonares (prácticamente se han descrito manifestaciones en todos los órganos), favorecidas por la gran capacidad de inducción de la producción de citocinas proinflamatorias de algunas proteínas de la membrana. De estas manifestaciones extrapulmonares, las más frecuentes son las neurológicas e incluyen cuadros de encefalitis, mielitis, neuritis óptica, ataxia, síndrome de Guillain Barré, etc.
DiagnósticoDado que el cultivo es muy difícil y lento, el diagnóstico se realiza mediante serología (ya sea IgM o demostración de seroconversión en 2 muestras de suero separadas al menos 15 días), y más recientemente mediante técnicas de amplificación de ácidos nucleicos (PCR). Estas técnicas son de gran sensibilidad, permiten un diagnóstico precoz y rápido a partir de muestras respiratorias, aunque no están disponibles en todos los laboratorios.
La presentación clínica de la enfermedad respiratoria por M. pneumoniae suele ser similar a la observada con otros patógenos respiratorios, como C. pneumoniae, varios virus respiratorios y bacterias como S. pneumoniae. Los niños con asplenia funcional y afectación inmunitaria por enfermedad de células falciformes, síndrome de Down y varios estados inmunosupresivos pueden tener una neumonía grave, y en raras ocasiones, incluso en individuos sanos puede producir una enfermedad fulminante con elevada mortalidad17,18. Aunque los determinantes de virulencia se conocen de forma parcial, Kannan et al.19 han demostrado que la gravedad de la enfermedad pulmonar puede estar relacionada con la cepa infectante y la concentración de la toxina producida por algunas cepas (toxina del síndrome del distrés respiratorio agudo).
Se ha considerado, además, a M. pneumoniae como causa de asma en niños, tanto precediendo a la instauración del asma, como exacerbando los síntomas de asma, por lo que se ha valorado el uso de macrólidos en pacientes con asma e infección por M. pneumoniae. En un estudio prospectivo realizado en Francia detectaron una incidencia de infección por M. pneumoniae del 50% en niños con una primera crisis de asma y del 20% en niños asmáticos con episodio de reagudización. Además, los niños con infección por M. pneumoniae en su primera crisis asmática, tenían mayor tasa de recurrencia de sibilancias que los niños que no presentaban la infección20.
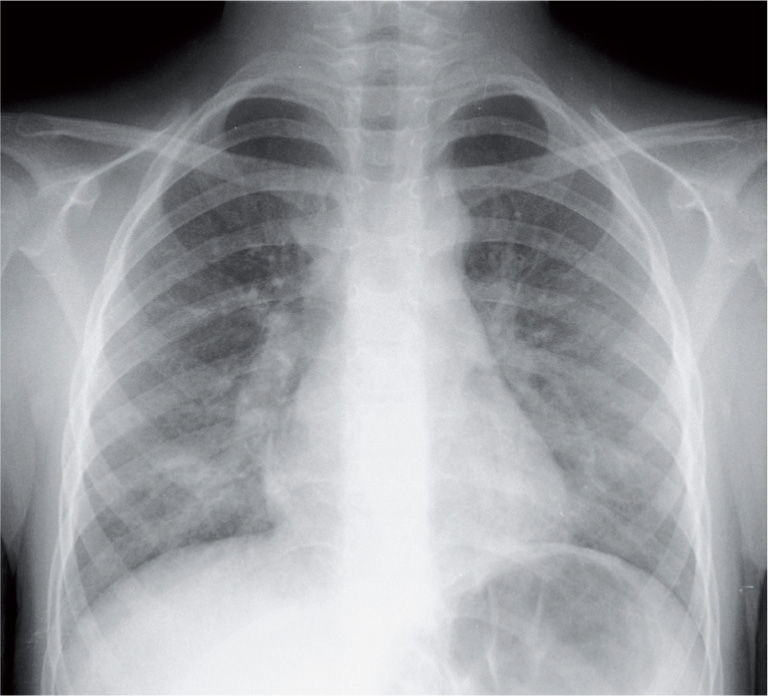
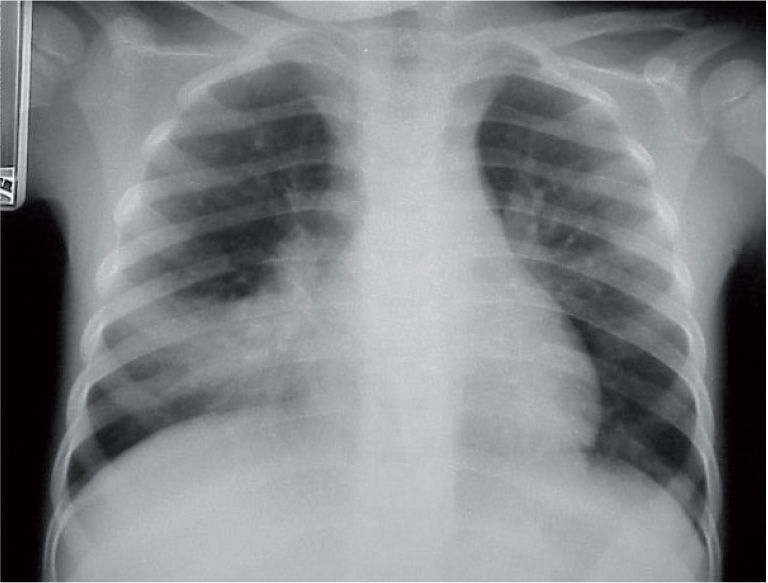
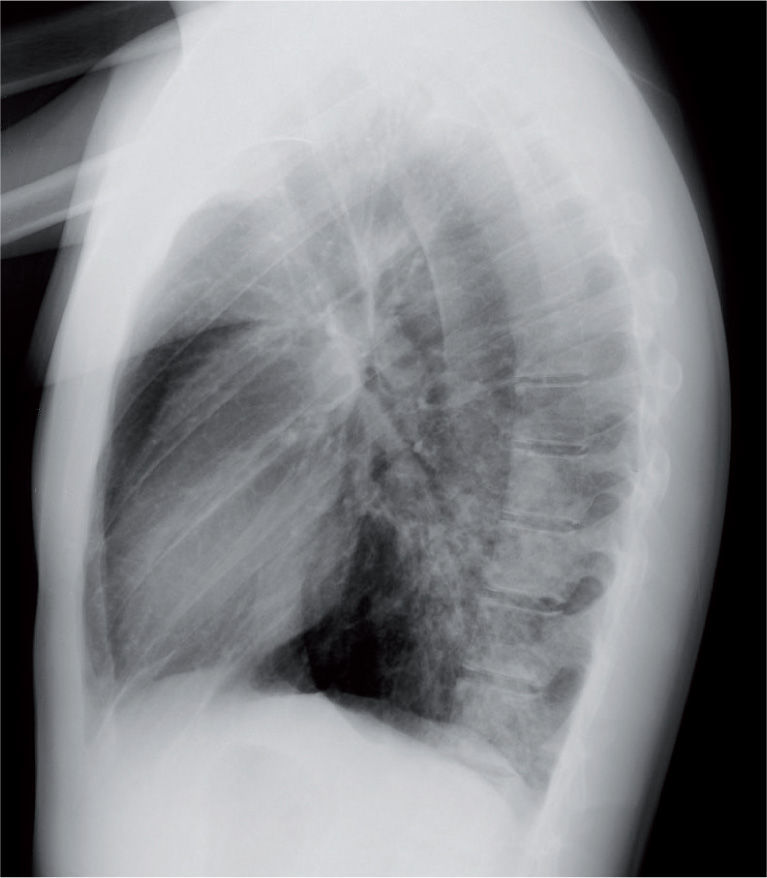
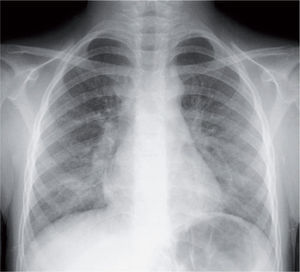
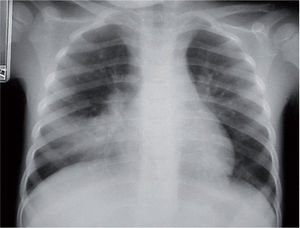
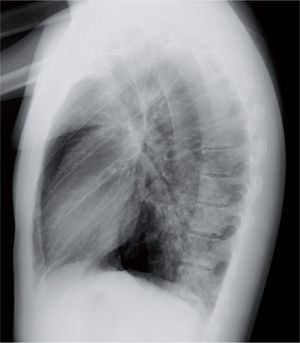
La radiografía de tórax suele evidenciar un infiltrado heterogéneo y poco denso, con aspecto de vidrio deslustrado, que tiende a estar situado cerca del hilio, sobre todo en los lóbulos inferiores; en ocasiones el infiltrado afecta a varios lóbulos, y de ambos pulmones. Así, el patrón radiológico más frecuente es el de un infiltrado parahiliar peribronquial uni o bilateral (fig. 1). Pero también es posible un aumento de densidad por ocupación del espacio aéreo limitado a un segmento o a un lóbulo (fig. 2). Aunque se ve pocas veces, es muy característica de la infección por M. pneumoniae la presencia de un infiltrado reticulonodulillar localizado en un solo lóbulo inferior21 (fig. 3). En el 20–25% de los casos pueden observarse pequeños derrames pleurales, que acostumbran a tener poca expresión clínica; de forma excepcional aparece un importante derrame pleural21.
Las complicaciones extrarrespiratorias pueden verse antes, durante o después de las manifestaciones pulmonares, pero también pueden ocurrir en ausencia completa de cualquier síntoma respiratorio.
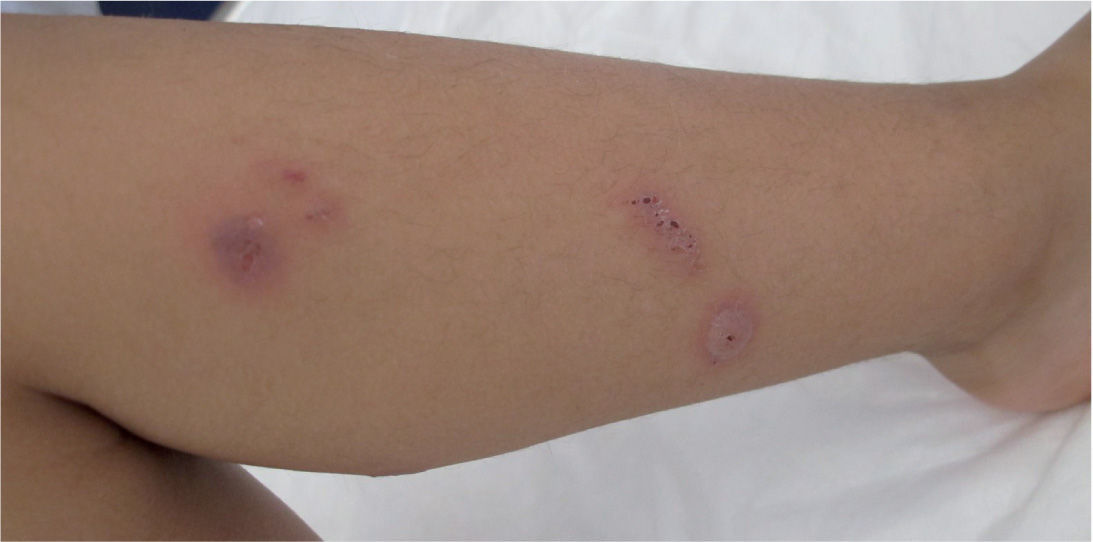
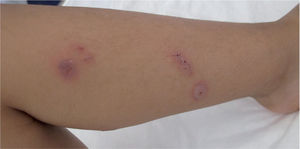
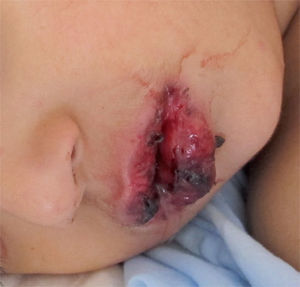
Hasta el 25% de los infectados por M. pneumoniae pueden tener complicaciones extrapulmonares, que pueden ser neurológicas, cardiacas, musculoesqueléticas, hematológicas, renales, gastrointestinales, cutáneas u oculares1,4,22. En estas complicaciones, a veces, se ha podido encontrar el agente en el foco extrapulmonar, pero en otras no se ha encontrado, por lo que se piensa que son debidas a reacciones autoinmunitarias.
Las complicaciones neurológicas son las más frecuentes (del 6 al 7% de los pacientes con neumonía hospitalizados). Estas complicaciones incluyen cuadros de encefalitis, síndrome cerebelar, polirradiculitis, parálisis de pares craneales, mielitis transversa aguda, meningitis aséptica o meningoencefalitis, neuritis óptica, diplopía, confusión mental, psicosis aguda secundaria a encefalitis, neuropatía del plexo braquial, ataxia, coreoatetosis o síndrome de Guillain-Barré. La encefalitis es lo más común en niños; cuando aparece, lo hace 1 a 2 semanas después de comenzar los síntomas respiratorios pero un 20% de los casos, o más, no tienen una infección precedente o concomitante respiratoria. Se han encontrado anticuerpos frente a galactocerebrósido, un componente de la mielina, en todos los pacientes con M. pneumoniae y afectación del sistema nervioso central (SNC) y solo en un 25% de aquellos sin afectación cerebral. Como complicaciones cardiacas tardías se han descrito miocarditis, endocarditis y pericarditis, con o sin taponamiento cardiaco. Las complicaciones musculoesqueléticas se manifiestan como mialgias inespecíficas, artralgias, poliartropatías
Lectura rápida
Aunque se ha considerado innecesaria la terapia antibiótica de las infecciones respiratorias por tratarse, la mayoría de las veces, de una infección leve y autolimitada, la administración de antibióticos reduce la duración de los síntomas respiratorios y la transmisión de la enfermedad. Al carecer de pared celular, los micoplasmas son resistentes a los betalactámicos. Son sensibles a macrólidos, tetraciclinas y fluoroquinolonas. El tratamiento de elección en pediatría son los macrólidos.
M. pneumoniae no pertenece a la flora habitual de las vías respiratorias pero pueden existir estados transitorios de portador asintomático. El diagnóstico por cultivo de las infecciones por M. pneumoniae únicamente suele realizarse en las formas graves o durante encuestas epidemiológicas debido a las dificultades y lentitud (2 a 3 semanas) para su aislamiento. Para el cultivo, las muestras más utilizadas son las faríngeas, el aspirado nasofaríngeo en niños pequeños, y los lavados broncoalveolares en las formas graves. La detección de aglutininas frías es una prueba inespecífica que se considera significativa con títulos ≥ 1:64. El procedimiento más utilizado de forma habitual es la detección de anticuerpos con serconversión, a pesar de que la seroprevalencia es elevada, detectando anticuerpos específicos en 2 muestras de suero tomadas con 10 a 15 días de intervalo. Entre los métodos serológicos, la prueba de fijación de complemento es fiable si se obtiene un título ≥ 1:64. Los métodos de enzimoinmunoanálisis (ELISA) tienen la ventaja de permitir detectar anticuerpos de clases IgG e IgM. Aunque la detección de anticuerpos de clase IgM sería el método ideal para realizar un diagnóstico precoz, esta prueba es útil en niños y adolescentes, pero es difícil encontrar anticuerpos IgM en adultos.
Hoy en día, la amplificación genómica mediante PCR, en sus distintas versiones, proporciona resultados excelentes, ofrece elevada sensibilidad, se puede realizar en muestras respiratorias fáciles de obtener y con resultados muy rápidos, y en fases precoces de la enfermedad23 pero aun no se realiza en todos los laboratorios. Las técnicas de amplificación genómica, mucho más sensibles que el cultivo, nos han permitido saber que existe el estado de portador, pero al mismo tiempo nos han puesto en evidencia las lagunas existentes en el conocimiento de la epidemiología de este patógeno y nos obligan a redefinir los criterios «gold standard» para diagnosticar las infecciones causadas por M. pneumoniae. Además, la utilización de estas técnicas permite diferenciar diferentes cepas y esto podría ser de gran importancia para la vigilancia epidemiológica y la investigación de brotes epidémicos.
TratamientoAlgunos autores han considerado innecesaria la terapia antibiótica de las infecciones respiratorias por tratarse, la mayoría de las veces, de una infección autolimitada, la administración de antibióticos reduce la duración de los síntomas respiratorios y la transmisión de la infección. Las dudas para valorar la utilidad de la terapia está motivada por no incluirse en los ensayos un brazo de control sin tratamiento y porque en los ensayos comparativos con antibióticos betalactámicos muchas infecciones se resuelven espontáneamente.
Los micoplasmas son resistentes a los antibióticos betalactámicos por carecer de pared celular y son sensibles a los macrólidos, las tetraciclinas y las fluoroquinolonas. Se prefieren los nuevos macrólidos a la eritromicina por su mejor tolerancia, su administración una o 2 veces al día y la menor duración de tratamiento cuando se usa azitromicina (10mg/kg cada 24h [máximo 500mg/día], 3 días). Las fluoroquinolonas no están recomendadas para niños y las tetraciclinas no están aprobadas para niños menores de 8 años.
Cuando existen síntomas neurológicos, como en niños con complicaciones, se recomiendan antibióticos que penetren en el SNC, como la doxiciclina, junto con corticoides a dosis elevadas. No obstante, aunque los macrólidos no penetran bien en el SNC, se han demostrado útiles para las infecciones de esa localización, quizá debido a que las manifestaciones neurológicas sean debidas a la respuesta inmunitaria del huésped más que a un efecto directo del micoplasma, y por eso es eficaz y suficiente para reducir esa respuesta eliminar la bacteria de allí donde esté.
La resistencia adquirida al M. pneumoniae es excepcional, pero se han descrito cepas con resistencia adquirida de tipo MLSK (macrólidos, lincosamidas, estreptograminas y cetólidos) in vivo24,25 y estas se están extendiendo en Japón.