Existe cierta variabilidad de práctica clínica en España sobre las intervenciones preventivas para evitar la infección respiratoria infantil por el virus respiratorio sincitial (VRS), entre las que se incluyen medidas higiénicas e inmunoprofilaxis intramuscular con palivizumab. Esta tarea implica varias especialidades pediátricas, que pueden tener distinta percepción de la magnitud del problema y distinto criterio profesional sobre las actuaciones apropiadas.
ObjetivosDesarrollar un consenso multidisciplinar español sobre la prevención de la infección por VRS, con participación de las sociedades científicas pediátricas implicadas: Sociedad Española de Neonatología (SEN), Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC), Sociedad Española de Neumología Pediátrica (SENP) y Sociedad Española de Hematología y Oncología Pediátrica (SEHOP).
MétodosConsenso Delphi modificado en dos rondas. El estudio se efectuó en cuatro fases: 1) constitución de un comité científico multidisciplinar, a propuesta de las sociedades científicas participantes, para la revisión bibliográfica y formulación de las recomendaciones a debate; 2) constitución de un panel experto con 77 representantes de las especialidades; 3) encuesta postal en dos rondas con procesamiento intermedio de opiniones e informe a los panelistas, y 4) discusión de resultados en sesión presencial del comité científico.
ResultadosSe consensúan 48 de las 57 recomendaciones preventivas analizadas. En las nueve cuestiones restantes no se consigue acuerdo, bien por disparidad de opinión profesional, bien por falta de criterio establecido en la mayoría de los expertos. Sólo en tres recomendaciones, la opinión de los expertos se asocia a la especialidad de procedencia.
ConclusionesSe presenta una lista de recomendaciones profilácticas anti-VRS, cualificadas según el grado de acuerdo profesional en que se sustentan, que pueden considerarse vigentes hasta la aparición de nueva información científica que indique su revisión.
A certain degree of feasibility exists in Spanish clinical practice with respect to interventions performed to prevent paediatric respiratory infection by RSV, including hygienic measures and intramuscular immunoprophylaxis with palivizumab. This task involves different paediatric specialties that may have a different perception of the magnitude of the problem and different professional criteria regarding the most appropriate actions.
ObjectivesTo develop Spanish multidisciplinary consensus on preventing infection by RSV with the participation of the paediatric scientific societies involved (SNS, SSPC, SSPP and SSHPO).
MethodsDelphi Consensus modified in two rounds was used. The study was conducted in four phases: 1) constitution of a multidisciplinary Scientific Committee at the recommendation of the scientific entities participating in the study, for bibliographic review and submission of the recommendations to discussion; 2) constitution of an Expert Panel with 77 speciality representatives; 3) postal survey organised in two rounds and intermediate processing of opinions and issuing of a report for the panellists, and 4) discussion of the results in a meeting of the Scientific Committee.
ResultsConsensus was reached on 48 of the 57 preventive recommendations analysed. With respect to the 9 remaining issues, no consensus was reached, due to differences in professional opinion and the absence of established criteria among the majority of the experts. Only in 3 recommendations was the opinion of the experts associated with the speciality of origin.
ConclusionsA list of anti-RSV prophylactic recommendations was submitted, rated in accordance with the degree of professional consensus on which they were based. These can be considered valid until such time as new scientific information emerges that warrants a review thereof.
Las posibilidades de actuación efectiva frente a las infecciones respiratorias graves infantiles por el virus respiratorio sincitial (VRS) siguen siendo la prevención, dada su significativa morbimortalidad en los grupos de riesgo, y sus limitadas opciones terapéuticas. Su posible vinculación patogénica al desarrollo de cuadros de sibilancias recurrentes y asma, que según diversos trabajos publicados parece existir, refuerza el interés asistencial y epidemiológico para reducir la incidencia de estas infecciones.
Esta problemática es multidisciplinaria, ya que concierne a distintos especialistas pediátricos que deben informar a las familias y tomar decisiones clínicas sobre la prevención del VRS en los pacientes que atienden en su práctica habitual: neonatólogos, neumólogos, cardiólogos y oncólogos pediátricos, entre otros. Sin embargo, la distinta percepción de la magnitud del problema y ciertas especificidades de criterio entre especialistas pueden estar motivando una variabilidad de prácticas que debe ser objeto de examen y reconsideración.
Junto con las medidas higiénicas básicas, la inmunoprofilaxis intramuscular con anticuerpos monoclonales humanizados (palivizumab) se ha mostrado efectiva en la prevención de la infección aguda en lactantes de alto riesgo y en disminuir el porcentaje de hospitalizaciones e ingresos en las unidades de cuidados intensivos (UCI). Respecto a su perfil farmacoterapéutico e indicaciones de uso, se dispone de un amplio abanico de guías y recomendaciones en los aspectos clave, sustancialmente congruentes. No obstante, en nuestro país se observa cierta heterogeneidad en la utilización de palivizumab entre distintas comunidades autónomas y hospitales.
Con el presente estudio se ha pretendido promover y desarrollar un consenso multiprofesional en torno a las recomendaciones preventivas sobre la infección por VRS y el uso clínico del palivizumab en España, sometiendo a la consideración de un grupo experto multiprofesional de especialistas implicados en las tomas de decisión en esta cuestión una amplia batería de cuestiones objeto de distinto grado de controversia profesional, todo ello bajo el impulso y la supervisión institucional de sus respectivas sociedades científicas: Sociedad Española de Neonatología (SEN), Sociedad Española de Neumología Pediátrica (SENP), Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECP) y Sociedad Española de Hematología y Oncología Pediátrica (SEHOP).
MATERIAL Y MÉTODOSDiseñoSe empleó el método Delphi modificado, técnica no presencial desarrollada originalmente en la RAND Corporation (Santa Mónica, California) por Helmer y Dalkey1 para lograr el consenso de un grupo heterogéneo de expertos sobre un tema de interés sometido a variabilidad de criterio o a controversia profesional.
Para ello se solicita la opinión individual y anónima de cada experto mediante la respuesta a una encuesta escrita vehiculada postalmente. La repetición individual de una segunda ronda de encuestas, con difusión a los participantes de los resultados grupales obtenidos en el primer cuestionario, permite reconsiderar y aproximar posturas divergentes, y así, lograr el máximo consenso posible en el grupo. El grado de dispersión en las respuestas finales se analiza estadísticamente para determinar en qué cuestiones se ha logrado el consenso del panel experto, bien sea en el acuerdo o en el desacuerdo con los temas propuestos en la encuesta.
El estudio se efectuó en 4 fases: 1) constitución de un comité científico multidisciplinar, a propuesta de las sociedades científicas participantes, para la revisión bibliográfica y formulación de las recomendaciones a debate; 2) constitución de un panel experto con representantes de todas las especialidades implicadas; 3) encuesta postal en dos rondas con procesamiento intermedio de opiniones e informe a los panelistas, y 4) recopilación y análisis de resultados definitivos y discusión de resultados en sesión presencial del comité científico.
Elaboración del cuestionarioSe constituyó un comité científico multiprofesional con dos representantes de cada una de las asociaciones científicas impulsoras del proyecto (SEN, SENP, SECP, SEHOP) y un miembro independiente como asesor metodológico.
Tras una reunión inicial del comité en la que se definió el procedimiento sistemático de elaboración del cuestionario, se comenzó el trabajo recogiendo las aportaciones libres de todos los miembros del comité, a quienes se solicitó la propuesta de un número indeterminado de ítems de encuesta (aseveraciones que recogiesen, cada una, un criterio profesional o una recomendación clínica sobre la profilaxis del VRS propia de su ámbito especializado). Se recopiló también el material bibliográfico empleado por cada miembro del comité para la redacción de sus propuestas2–47.
Tras un proceso de revisión y agrupación temática de los ítems recibidos, efectuado por dos consultores externos, se elaboró un primer borrador del cuestionario que se hizo circular para su revisión hasta en tres ocasiones a través de correo electrónico a los representantes designados por las sociedades participantes. Las últimas modificaciones y la redacción del cuestionario definitivo se debatieron durante una reunión presencial del comité científico celebrada en Madrid el 25 de octubre de 2007.
La versión final del cuestionario incluyó 57 ítems (tabla 1), agrupados en las siguientes cinco áreas temáticas: epidemiología y repercusión de las infecciones respiratorias infantiles por VRS (4 ítems), población en riesgo de infección respiratoria grave por VRS (9 ítems), medidas higiénicas preventivas generales (20 ítems), indicaciones y recomendaciones de inmunoprofilaxis con palivizumab (21 ítems) y otras consideraciones (3 ítems).
Resultados del consenso
| A. | Epidemiología y repercusión de las infecciones infantiles por VRS | Media | LI-IC | LS-IC | % en contra |
| 1. | En mi medio, el VRS es una causa principal de infecciones de las vías aéreas inferiores en lactantes, especialmente bronquiolitis y neumonía, durante los períodos epidémicos | 1,28 | 1,11 | 1,46 | 3,2 |
| 2. | En mi medio, las infecciones por VRS en niños menores de 2 años son un motivo frecuente de visitas a Urgencias y motivan un gran número de hospitalizaciones cada año | 1,28 | 1,17 | 1,39 | 0 |
| 3. | En mi medio, el VRS muestra una alta contagiosidad entre los lactantes | 1,36 | 1,18 | 1,54 | 4,7 |
| 4. | A falta de un tratamiento eficaz, la morbimortalidad por el VRS en niños de alto riesgo hace imprescindible emprender intervenciones preventivas sobre este agente | 1,23 | 1,12 | 1,35 | 0 |
| B. | Población en riesgo e infección respiratoria grave por VRSConsidero a los niños con las siguientes patologías como grupo de riesgo para que la infección por VRS progrese a las vías respiratorias inferiores y origine cuadros de mayor gravedad (asistencia de urgencia, hospitalizaciones, mayor necesidad de oxigenoterapia, de ingreso en UCI y de ventilación mecánica) que en la población pediátrica general (ítems 5–13): | Media | LI-IC | LS-IC | % en contra |
| 5. | Niños con neumopatías crónicas (displasia broncopulmonar, fibrosis quística, discinesia ciliar primaria, hernia diafragmática, atresia de esófago, otras malformaciones pulmonares, etc.) | 1,20 | 1,10 | 1,30 | 0 |
| 6. | Niños pretérmino con edad gestacional inferior o igual a 35 semanas durante su primer año de vida | 1,73 | 1,50 | 1,96 | 4,8 |
| 7. | Niños con cardiopatías congénitas con repercusión hemodinámica durante los primeros 2 años de vida | 1,23 | 1,12 | 1,35 | 0 |
| 8. | Niños con inmunodeficiencias primarias o secundarias (trasplante de órganos) | 1,38 | 1,21 | 1,55 | 0 |
| 9. | Niños con síndromes polimalformativos o cromosomopatías (síndrome de Down, delección 22q11, etc.) | 2,08 | 1,85 | 2,31 | 4,8 |
| 10. | Niños entre 35 y 37 semanas, sin patología de base | 3,72 | 3,51 | 3,94 | 12,3 |
| 11. | Recién nacido a término sin patología de base | 4,09 | 3,88 | 4,30 | 8,7 |
| 12. | Niños sometidos a trasplante de progenitores hematopoyéticos* | 2,49 | 1,97 | 3,00 | – |
| 13. | Leucemia mieloblástica aguda en fase de inducción* | 2,79 | 2,54 | 3,04 | – |
| C. | Medidas higiénicas eficaces para prevenir la infección por VRSEn mi entorno sociosanitario y durante mi práctica diaria, resulta generalmente viable y efectivo aconsejar a las familias las siguientes medidas profilácticas para disminuir el riesgo de infección en la población de riesgo (ítems 14–23): | Media | LI-IC | LS-IC | % en contra |
| 14. | Evitar entornos contagiosos (como asistir a guarderías y a cualquier aglomeración pública, incluidas salas de espera de centros sanitarios) | 1,41 | 1,25 | 1,56 | 1,6 |
| 15. | Evitar toda exposición del niño al humo de tabaco | 1,34 | 1,18 | 1,51 | 1,6 |
| 16. | Efectuar un lavado de manos en períodos epidémicos antes de tocar al niño en riesgo | 1,20 | 1,08 | 1,33 | 1,6 |
| 17. | Limpiar a fondo los juguetes del bebé | 1,98 | 1,74 | 2,23 | 9,4 |
| 18. | Mantenerse alejado del bebé si se tiene un resfriado o fiebre (o usar mascarilla en caso contrario). Como el contagio es más por contacto que respiratorio, una distancia superior a 2m puede resultar protectora | 1,53 | 1,32 | 1,74 | 4,8 |
| 19. | Evitar el contacto con hermanos mayores en riesgo de infección por VRS (si tienen un resfriado o fiebre) | 1,70 | 1,46 | 1,94 | 7,8 |
| 20. | Recomendar el uso de pañuelos desechables y tirar inmediatamente los pañuelos usados | 1,45 | 1,27 | 1,63 | 3,2 |
| 21. | La educación familiar sobre los factores de riesgo debe efectuarse antes del alta hospitalaria y en cada visita de seguimiento en la época del VRS | 1,26 | 1,11 | 1,40 | 1,6 |
| 22. | Las medidas higiénicas deben indicarse de forma explícita en el informe de alta hospitalaria de los niños de alto riesgo | 1,59 | 1,38 | 1,79 | 4,8 |
| 23. | Limitar el acceso –a las unidades de hospitalización– en época epidémica de aquellos niños o adultos con sintomatología respiratoria | 1,52 | 1,32 | 71 | 4,7 |
| En mi entorno hospitalario, y en la práctica habitual, resulta generalmente viable y efectivo concienciar a los profesionales sanitarios sobre las siguientes medidas higiénicas de control de la infección nosocomial por VRS (ítems 24–33): | Media | LI-IC | LS-IC | % en contra | |
| 24. | Efectuar un diagnóstico precoz de los posibles casos en profesionales y pacientes | 1,65 | 1,46 | 1,84 | 3,2 |
| 25. | Realizar un lavado de manos antes y después de la exploración de cualquier niño | 1,47 | 1,25 | 1,69 | 6,3 |
| 26. | Realizar un lavado de manos antes y después de cualquier manipulación a los niños de riesgo e infectados por VRS | 1,17 | 1,03 | 1,31 | 1,6 |
| 27. | Usar sistemáticamente batas, guantes y mascarilla en la atención a niños infectados por VRS | 1,85 | 1,62 | 2,09 | 11,8 |
| 28. | Reagrupar a los pacientes afectados y sus cuidadores en unidades o zonas especiales bien delimitadas para limitar el contagio de nuevos casos | 1,54 | 1,33 | 1,75 | 6,3 |
| 29. | Limitar las visitas externas y los ingresos programados en caso de brote epidémico | 1,78 | 1,55 | 2,01 | 7,8 |
| 30. | Ingresar a estos pacientes en zonas de aislamiento | 1,87 | 1,62 | 2,13 | 8,0 |
| 31. | Se deberían efectuar acciones educativas y de divulgación sobre la infección por VRS y sus barreras higiénicas de protección destinadas a todos los padres de niños lactantes | 1,36 | 1,20 | 1,52 | 1,6 |
| 32. | Los programas educativos y de divulgación sobre el VRS destinados a los padres de niños de alto riesgo deberían incluir, además, información sobre el beneficio-riesgo de la inmunoprofilaxis con palivizumab | 1,98 | 1,69 | 2,28 | 14 |
| 33. | Se deberían efectuar acciones educativas y de divulgación sobre la infección por VRS y sus barreras higiénicas de protección destinadas a todo el personal sanitario en contacto con la población pediátrica | 1,25 | 1,14 | 1,36 | 0 |
| D. | Indicaciones/recomendaciones de la profilaxis con palivizumab De acuerdo al beneficio y a la eficiencia demostrada del fármaco, considero recomendable la profilaxis con palivizumab en los siguientes grupos de riesgo (ítems 34–40): | Media | LI-IC | LS-IC | % en contra |
| 34. | Niños menores de 2 años con displasia broncopulmonar que han requerido tratamiento (suplementos de oxígeno, broncodilatadores, diuréticos o corticoides) en los 6 meses anteriores al inicio de la estación del VRS o que son dados de alta durante la misma | 1,17 | 1,07 | 1,28 | 0 |
| 35. | Niños menores de 2 años con cardiopatía congénita con alteración hemodinámica significativa (no corregida o paliada), en tratamiento por insuficiencia cardíaca, hipertensión pulmonar moderada o grave o cardiopatías cianógenas | 1,20 | 1,08 | 1,32 | 0 |
| 36. | Niños prematuros nacidos a las 286 semanas de gestación o menos, que tengan 12 meses de edad o menos al inicio de la estación del VRS o sean dados de alta durante la misma | 1,14 | 1,04 | 1,24 | 0 |
| 37. | Niños prematuros nacidos entre las 290 y 320 semanas de gestación, que tengan 6 meses de edad o menos al inicio de la estación del VRS, o sean dados de alta durante la misma | 1,40 | 1,20 | 1,61 | 4,8 |
| 38. | Niños prematuros nacidos entre las 321 y 350 semanas de gestación y menores de 6 meses al comienzo de la estación o dados de alta durante la misma, que presenten dos o más factores de riesgo para sufrir hospitalización por infección VRS | 1,87 | 1,64 | 2,10 | 7,2 |
| 39. | Pacientes trasplantados durante la primera estación de VRS posterior al trasplante | 2,02 | 1,77 | 2,26 | 4,8 |
| 40. | Pacientes con inmunodeficiencia primaria o secundaria durante el período epidémico del VRS | 1,97 | 1,72 | 2,22 | 6,7 |
| A partir de la información disponible y de la experiencia profesional en mi práctica habitual, considero situaciones epidemiológicas de riesgo para sufrir infección grave por VRS (hospitalización) para los niños prematuros nacidos en las 321–350 semanas de gestación, las siguientes circunstancias (ítems 41–53): | Media | LI-IC | LS-IC | % en contra | |
| 41. | Edad cronológica inferior a 10 semanas al comienzo de la estación epidemiológica del VRS | 1,92 | 1,69 | 2,15 | 4,8 |
| 42. | No haber recibido lactancia materna o por un período inferior a 2 meses* | 2,71 | 2,39 | 3,02 | – |
| 43. | Tener al menos un hermano en edad escolar | 2,21 | 2,01 | 2,40 | 6,3 |
| 44. | Tener ≥ 4 adultos residiendo en la casa* | 2,84 | 2,64 | 3,05 | – |
| 45. | Tener antecedentes familiares de sibilancias* | 2,77 | 2,51 | 3,03 | – |
| 46. | Nacer en las primeras 10 semanas de la estación epidemiológica del VRS | 2,03 | 1,80 | 2,26 | 7,4 |
| 47. | Tener bajo peso para su edad gestacional* | 2,72 | 2,51 | 2,94 | – |
| 48. | Asistir a guardería | 1,62 | 1,42 | 1,82 | 3,2 |
| 49. | Fumar en el hogar | 2,06 | 1,84 | 2,29 | 8,1 |
| 50. | Tener malformaciones de vías aéreas o enfermedad neuromuscular | 1,69 | 1,51 | 1,88 | 1,6 |
| 51. | Ser varón* | 2,93 | 2,69 | 3,16 | – |
| 52. | Exposición a contaminación ambiental* | 2,88 | 2,72 | 3,05 | – |
| 53. | Antecedente de madre fumadora durante la gestación | 2,45 | 2,25 | 2,65 | 7,2 |
| 54. | Valorando los análisis fármaco-económicos disponibles y las circunstancias socioeconómicas del entorno asistencial habitual (comunidad autónoma), considero eficiente (rentable) la profilaxis con palivizumab en todos los niños prematuros nacidos entre las 321 y 350 semanas de gestación, con 2 o más factores de riesgo, y menores de 6 meses al comienzo de la estación, o dados de alta durante la misma | 2,38 | 2,15 | 2,60 | 14,4 |
| E. | Otras consideraciones finales | Media | LI-IC | LS-IC | % en contra |
| 55. | En términos generales, considero conveniente seguir las recomendaciones de práctica clínica, siempre y cuando estén basadas en niveles de evidencia científica adecuados | 1,19 | 1,09 | 1,29 | 0 |
| 56. | Los términos “recomendable” y “muy recomendable” que aparecen en las guías de práctica clínica indican la existencia de evidencia clínica suficiente que avala las recomendaciones propuestas | 2,02 | 1,75 | 2,28 | 14 |
| 57. | Según la información disponible y la experiencia profesional en mi práctica diaria, considero conveniente llevar a cabo el tratamiento de las infecciones graves por VRS ya establecidas en pacientes de alto riesgo mediante el uso de ribavirina y palivizumab i.v.* | 2,97 | 2,69 | 3,25 | – |
LI-C y LS-IC: límite inferior y superior, respectivamente, del intervalo de confianza del 95 % del promedio; % en contra: porcentaje de panelistas con opiniones contrarias a la dirección del consenso logrado (Σ opciones 3 y 4 en caso de acuerdo grupal, Σ opciones 1 y 2 en caso de desacuerdo grupal). i.v.: intravenoso; VRS: virus respiratorio sincitial.
Se propuso un solo tipo de escala valorativa para todas las cuestiones, ordinal de tipo Likert con cinco categorías de respuesta detalladas mediante un cuantificador lingüístico y un descriptor numérico para cada opción: 1: total acuerdo con el ítem; 2: acuerdo; 3: ni acuerdo ni desacuerdo (“no tengo un criterio definido”); 4: en desacuerdo, y 5: total desacuerdo con el ítem. En cada cuestión se ofreció la posibilidad de añadir observaciones libres a los panelistas y un apartado final para recoger, si lo deseaban, nuevas propuestas de ítems. Si las cuestiones no eran contestadas por considerarse el panelista no cualificado en la materia, se analizaron como casos perdidos a efectos estadísticos.
Selección del panel expertoLos expertos fueron propuestos para formar parte del panel en representación de cada sociedad científica participante según el criterio de sus respectivos equipos directivos. Se invitó mediante carta a 98 profesionales de reconocido criterio y experiencia en el tema de estudio. Aceptaron y completaron su participación en el proyecto 77 panelistas, con la siguiente distribución: 35 neonatólogos, 18 cardiólogos, 16 neumólogos y 8 oncohematólogos. La tasa de aceptación y participación en el panel final (el 78,6 % de la invitación inicial) respetó de forma aproximada la ratio compositiva de especialidades acordada inicialmente por el comité científico (4:2:2:1, respectivamente).
El trabajo de campo del proyecto se desarrolló en las seis últimas semanas del año 2007, empleando el correo electrónico como vía de distribución y recogida de formularios.
Análisis e interpretación de resultadosSe analizaron las respuestas de la primera ronda del cuestionario mediante el cálculo de los valores promedio de puntuaciones de cada ítem y su correspondiente intervalo de confianza del 95 % (IC 95 %). Se consideraron consensuados por el panel los ítems en los que el límite superior del IC 95 % resultó inferior a 3 (acuerdo del panel con la afirmación) y en los que el límite inferior del IC 95 % resultó superior a 3 (desacuerdo con la afirmación). Los ítems restantes en los que el IC 95 % incluyó el valor 3 se seleccionaron para ser propuestos a reconsideración del panel en la segunda ronda Delphi.
Se informó a los panelistas de los resultados preliminares y de la distribución de respuestas en la primera ronda a cada ítem no consensuado mediante los correspondientes gráficos de barras (con el porcentaje de respondedores a cada categoría de respuesta). Asimismo, se distribuyeron los comentarios libres y aclaraciones aportados por los panelistas de forma anónima.
Tras la segunda ronda de encuesta, se aplicaron idénticos criterios para discriminar los ítems definitivamente consensuados de aquéllos en los que no fue posible lograr consenso del panel. A efectos comparativos, cuanto más extremo resulte el promedio de puntuaciones de un ítem (más próximo a 1 o a 5), más manifiesto se considera el consenso logrado, bien en el acuerdo o en el desacuerdo, respectivamente, sobre la propuesta expresada. Cuanto más estrecho resulte el intervalo de confianza, mayor unanimidad existe en las opiniones del grupo. Los ítems en los que no se logró un consenso tras completar el proceso descrito se analizaron descriptivamente para distinguir aquéllos en los que existían opiniones marcadamente diferentes entre los panelistas, de aquéllos en los que una mayoría del grupo opinó no tener un criterio definitivo al respecto.
Aunque esta metodología de análisis está muy difundida en estudios previos48,49, a modo de comprobación se verificó el consenso resultante bajo otros criterios estadísticos alternativos empleados por otros autores en estudios con similares escalas de evaluación50–52, a saber: coeficiente de variación menor de 0,3, promedio de las puntuaciones inferior a 2,5 o superior a 3,5, suma de los porcentajes de los valores extremos (1 + 2 o 4 + 5) superior al 70 % de la respuestas (respectivamente, para el acuerdo y el desacuerdo) y mediana distinta al punto central (3).
Para identificar posibles diferencias relevantes de criterio entre los distintos especialistas participantes en el proyecto, se empleó un test de Kruskal Wallis (variedad no paramétrica de análisis de la varianza por rangos), apropiado para variables ordinales. Cuando se apreciaban diferencias significativas entre especialidades se comprobó si los resultados del consenso cambiarían en caso de que los grupos de panelistas hubieran sido de idéntico tamaño (ponderando las especialidades para ajustar de forma equiproporcionada su participación).
Como cierre del proyecto, el 17 de enero de 2007 el comité científico del proyecto celebró una reunión presencial para debate de las conclusiones del consenso, que se presentan en este artículo.
RESULTADOSLos 77 expertos consultados completaron las dos rondas de evaluación y no propusieron nuevos ítems. En la primera ronda se consensuaron 41 de las 57 cuestiones analizadas según los criterios de evaluación preestablecidos, todas ellas en términos de acuerdo grupal con las cuestiones planteadas. De los 16 ítems restantes pasados para reconsideración de los expertos en la segunda ronda se lograron consensuar 7 más (2 de ellos en desacuerdo grupal con el ítem planteado). Globalmente considerados, el panel logró un consenso suficiente en el 84 % de los contenidos propuestos. En 9 ítems (el 16 % del cuestionario) no se consiguió un consenso unánime del panel, bien por disparidad de opinión profesional, bien por falta de criterio establecido en una mayoría de los expertos. En la tabla 1 se detallan los resultados globales con sus estadísticos correspondientes y con el porcentaje de panelistas que se manifiestan contra el consenso grupal, en los ítems en los que éste se logra.
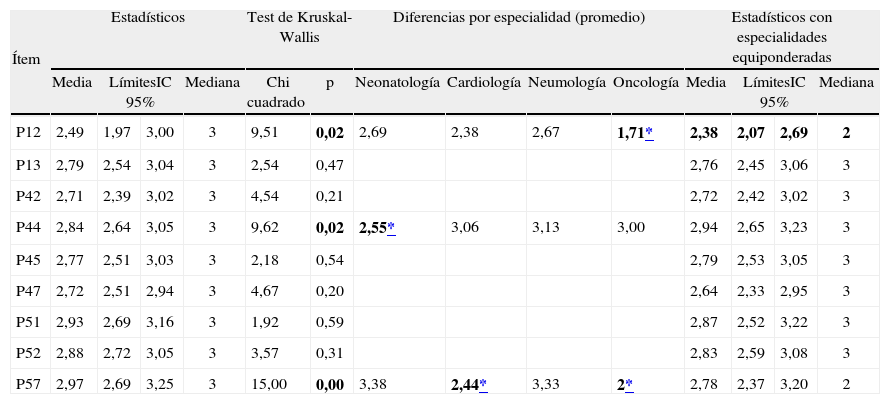
Sólo se hallaron diferencias estadísticamente significativas de opinión en los expertos, según su especialidad de procedencia, en 3 ítems del cuestionario: los numerados 12, 44 y 57 (Kruskal-Wallis p < 0,05). Se volvieron a analizar todos los resultados tras una ponderación de las puntuaciones de cada panelista con el fin de representar en la misma medida las cuatro especialidades presentes en el consenso. Tras ello, sólo el ítem 12 cambiaría de consideración si el panel experto estuviese conformado por subgrupos idénticos de cada especialidad. En este supuesto, se alcanzaría el consenso grupal respecto a este ítem. Este cambio se produciría por la opinión marcadamente diferente hacia el acuerdo con el ítem de los panelistas oncólogos respecto al resto de especialistas. Estos resultados se detallan en la tabla 2.
Diferencias entre especialidades en los ítems no consensuados
| Ítem | Estadísticos | Test de Kruskal-Wallis | Diferencias por especialidad (promedio) | Estadísticos con especialidades equiponderadas | ||||||||||
| Media | LímitesIC 95% | Mediana | Chi cuadrado | p | Neonatología | Cardiología | Neumología | Oncología | Media | LímitesIC 95% | Mediana | |||
| P12 | 2,49 | 1,97 | 3,00 | 3 | 9,51 | 0,02 | 2,69 | 2,38 | 2,67 | 1,71* | 2,38 | 2,07 | 2,69 | 2 |
| P13 | 2,79 | 2,54 | 3,04 | 3 | 2,54 | 0,47 | 2,76 | 2,45 | 3,06 | 3 | ||||
| P42 | 2,71 | 2,39 | 3,02 | 3 | 4,54 | 0,21 | 2,72 | 2,42 | 3,02 | 3 | ||||
| P44 | 2,84 | 2,64 | 3,05 | 3 | 9,62 | 0,02 | 2,55* | 3,06 | 3,13 | 3,00 | 2,94 | 2,65 | 3,23 | 3 |
| P45 | 2,77 | 2,51 | 3,03 | 3 | 2,18 | 0,54 | 2,79 | 2,53 | 3,05 | 3 | ||||
| P47 | 2,72 | 2,51 | 2,94 | 3 | 4,67 | 0,20 | 2,64 | 2,33 | 2,95 | 3 | ||||
| P51 | 2,93 | 2,69 | 3,16 | 3 | 1,92 | 0,59 | 2,87 | 2,52 | 3,22 | 3 | ||||
| P52 | 2,88 | 2,72 | 3,05 | 3 | 3,57 | 0,31 | 2,83 | 2,59 | 3,08 | 3 | ||||
| P57 | 2,97 | 2,69 | 3,25 | 3 | 15,00 | 0,00 | 3,38 | 2,44* | 3,33 | 2* | 2,78 | 2,37 | 3,20 | 2 |
Los neonatólogos se manifiestan más de acuerdo que el resto de especialistas con el ítem 44, mientras que, por el contrario, neonatólogos y neumólogos expresan más desacuerdo que cardiólogos y oncohematólogos respecto al ítem 57, aunque en ninguno de los casos la equiponderación de opiniones permitiría lograr un consenso grupal unánime.
DISCUSIÓNEn términos generales, el criterio profesional de los distintos especialistas sobre la prevención de las infecciones graves por el VRS es bastante uniforme, como resulta esperable a la luz de la evidencia disponible sobre buena parte de los temas sometidos a la consideración de panel, que ha logrado el consenso pretendido en más de 4 de cada 5 ítems propuestos.
Así, respecto a la epidemiología y repercusión de las infecciones respiratorias infantiles por VRS, con independencia de su procedencia geográfica, los expertos muestran un alto grado de consenso sobre la responsabilidad etiológica del VRS como causa común en su medio de infección de la vía respiratoria baja en lactantes y como determinante de numerosas consultas urgentes y hospitalizaciones en este grupo poblacional. Por su elevada contagiosidad y su potencial morbimortalidad en niños de alto riesgo, la práctica totalidad de panelistas percibe como prioritaria la necesidad de emprender intervenciones preventivas sobre este agente.
En cuanto a la consideración de la población predispuesta a la infección respiratoria grave por VRS, los expertos muestran un claro acuerdo en considerar grupos de alto riesgo para la progresión de este agente a la vía respiratoria inferior y para desencadenar cuadros subsidiarios de cuidados especializados a los niños con neumopatías crónicas, pretérmino de edad gestacional de hasta 35 semanas durante su primer año de vida, cardiopatías congénitas con repercusión hemodinámica en sus primeros 2 años de vida, inmunodeficiencias primarias o secundarias y los afectados de síndromes polimalformativos o cromosomopatías.
En sentido contrario, los panelistas se manifiestan en desacuerdo unánime en considerar de alto riego a los niños sanos nacidos tras la semana 35 de gestación si no presentan alguna de las patologías de base referidas.
El panel no logra un consenso suficiente en la consideración del riesgo que sufren los niños sometidos al trasplante de progenitores hematopoyéticos, ni los que están en fase de inducción de una leucemia mieloblástica aguda. Sin embargo, muchos panelistas ajenos a la oncohematología manifiestan no tener experiencia profesional en estas circunstancias, mientras que la primera situación es un criterio unánimemente compartido por los especialistas en oncohematología pediátrica. Recientemente, Saleeyby16, en 2008, destaca la especial gravedad y frecuencia de muerte por virus respiratorio sincitial en pacientes sometidos a trasplante de médula ósea por leucemia linfoide aguda, leucemia mieloide aguda y con síndrome de inmunodeficiencia combinada, y en pacientes menores de 2 años de edad con leucemia mieloide aguda. En estas enfermedades, la linfopenia absoluta (< 100 céls./μl) y la edad menor de 2 años son predictores de infección de vías bajas por VRS. Bajo el criterio de los representantes de la oncohematología pediátrica en el comité, esta recomendación se dirigiría especialmente a los trasplantes alogénicos realizados justo antes o durante la época estacional de VRS.
La eficacia de las medidas higiénicas generales para prevenir la infección por VRS habitualmente recomendadas a las familias y a los cuidadores de la población en riesgo resulta aceptada sin excepción, con distinto grado de acuerdo. Con independencia del entorno sociodemográfico de procedencia, los expertos logran el consenso respecto al valor preventivo de todos los consejos higiénicos familiares propuestos. El grado de acuerdo oscila entre el máximo en lo referido al lavado de manos en períodos epidémicos antes de tocar al niño y el mínimo respecto al lavado de juguetes. En la misma línea, los panelistas muestran su acuerdo unánime con la viabilidad y efectividad de concienciar a los profesionales sanitarios sobre todas las medidas higiénicas planteadas para el control de la infección nosocomial por VRS. El acuerdo es máximo respecto al lavado de manos del profesional, previo y posterior a la manipulación del niño en riesgo y a la necesidad de abordar acciones educativas sobre prevención del VRS con las familias de niños en riesgo y con el personal sanitario que los atiende.
En cuanto a las recomendaciones de inmunoprofilaxis con palivizumab, el panel logra un consenso unánime respecto a todas las indicaciones de uso del fármaco propuestas, sin que se aprecien diferencias de criterio significativas entre los distintos colectivos especializados que lo componen. No obstante, la representación oncohematológica en el comité científico del proyecto señala la falta de información disponible para poder recomendar de forma general las indicaciones de palivizumab recogidas en los ítems 39 y 40 (recomendaciones que podrían resultar aceptables en algunos subgrupos muy específicos de pacientes oncohematológicos). Asimismo, los representantes cardiológicos en el comité señalan la práctica habitual de profilaxis sistemática en los niños menores de 2 años con trasplante cardíaco en la primera estación de VRS tras el trasplante.
El acuerdo logrado es máximo en lo referente a la indicación durante los primeros 2 años de vida en los niños con displasia broncopulmonar o cardiopatía congénita (en las condiciones establecidas) y en la profilaxis a los lactantes más prematuros (nacidos hasta la 286 semana, durante el primer año de vida, y nacidos entre las 290 y la 320 semanas, durante los primeros 6 meses).
El panel también consensúa mayoritariamente la indicación de profilaxis en los nacidos entre las 321 y la 350 semanas de gestación, con menos de 6 meses y dos factores de riesgo, con un bajo grado de desacuerdo (el 7,2 % de los panelistas, sin diferencias por especialidad), y la consideración de esta indicación como rentable desde el punto de vista farmacoeconómico. El 14,4 % de los expertos encuestados expresan una postura contraria a esta última valoración.
Se consideran factores de riesgo en este último grupo poblacional tener menos de 10 semanas al inicio de la estación, nacer en las primeras 10 semanas de la misma, tener al menos un hermano escolarizado o asistir a guardería, tener malformaciones de las vías aéreas o enfermedad neuromuscular y el tabaquismo en convivientes o materno durante su gestación.
No obstante, el comité científico considera la necesidad de intervenir sobre los factores de riesgo modificables (tabaquismo de convivientes) en vez de decidir la indicación de un tratamiento profiláctico con palivizumab. En el resto de factores (ser varón, no haber recibido lactancia materna, hacinamiento familiar, tener antecedente familiar de sibilancias, bajo peso para la edad gestacional y estar expuesto a contaminación ambiental) no se logra un consenso unánime, en algún caso en consonancia con el reciente conocimiento disponible (resultados del estudio FLIP-2, en prensa).
Por último, los expertos no logran consenso en su posición frente a la conveniencia de llevar a cabo el tratamiento de las infecciones graves ya establecidas por VRS en pacientes de alto riesgo mediante ribavirina y palivizumab intravenosos. Neonatólogos y neumólogos expresan un criterio menos favorable a esta indicación que los restantes especialistas, mientras que los representantes oncohematológicos y cardiológicos del comité destacan, pese a la falta de una evidencia suficientemente establecida, el uso en la práctica clínica de palivizumab y ribavirina nebulizada o intravenosa para el tratamiento de los cuadros graves establecidos en pacientes con trasplantes de progenitores hematopoyéticos y con leucemias y en los niños con cardiopatía menores de 2 años.
Como cabe esperar, los expertos expresan por unanimidad su convicción sobre la conveniencia de seguir las recomendaciones de los consensos y de las guías de práctica clínica, siempre que estén basadas en niveles de evidencia científica adecuados.
Las presentes recomendaciones deben considerarse vigentes en la fecha de elaboración de este consenso y hasta la aparición de nuevos datos científicos que justifiquen su futura revisión.
Conflicto de interesesAbbott Laboratories, S.A. ha subvencionado las reuniones del Comité Científico Multiprofesional, pero no ha participado en ninguna medida en el diseño, análisis de datos, ni en la redacción del presente artículo.
La SECPCC ha realizado con la colaboración de Abbott Laboratories, S.A. el estudio CIVIC, relacionado con las infecciones respiratorias en niños con cardiopatías congénitas menores de 24 meses.
EGP ha recibido honorarios por conferencias, asesorías y ayudas para participar en reuniones internacionales por parte de Abbott Laboratories, S.A.
La SENP ha recibido ayudas para investigación de Abbott Laboratories, S.A.
La SEN no objetiva conflicto de intereses alguno para la publicación del artículo.
A los 77 panelistas encuestados, miembros de las sociedades científicas anteriormente citadas, por su participación como expertos en la encuesta Delphi.
A Fernando Caballero Martínez y a la Unidad de Investigación Clínico-Epidemiológica L5 (Madrid), por la asistencia al Comité Científico en las tareas de diseño del proyecto, análisis estadístico y redacción del borrador de este original.