La angioplastia transluminal percutánea (ATP) es un tratamiento establecido para el tratamiento de la isquemia crítica de la extremidad inferior. El objetivo del presente estudio fue definir la respuesta inflamatoria sistémica a través de la determinación de los marcadores de inflamación tras ATP.
MétodosSe compararon 25 pacientes sometidos a ATP con otros 20 sometidos sólo a angiografía. Se determinaron secuencialmente la concentración de interleucina 6 (IL-6), IL-8, IL-10 y factor alfa de necrosis tumoral (TNF-alfa). Se comparó estadísticamente la diferencia entre la concentración basal pre y post procedimiento de los dos grupos establecidos (angiografía sola y ATP). Los pacientes fueron seguidos durante un año después del procedimiento. Así mismo se registró la tasa de fracaso de la PTA.
ResultadosLa concentración de IL-6 y TNF-alfa fue significativamente más alta en pacientes sometidos a ATP al cabo de una hora del procedimiento (p<0,05), y la concentración de IL-6 sólo fue significativamente más alta en las 24h posteriores (p<0,05) comparado con la angiografía sola (prueba de Mann-Whitney). La concentración de IL-8 e IL-10 no difirió significativamente en el grupo de la ATP. Al año, la tasa de fracaso de la angioplastia fue del 45%. No se evidenció una correlación estadísticamente significativa entre el fracaso de la ATP y la respuesta inflamatoria.
ConclusiónLa ATP parece causar una respuesta inflamatoria sistémica significativa comparada con la angiografía sola. Esto demuestra una manifestación sistémica del proceso de isquemia/reperfusión localizado. Se recomienda una investigación adicional de la respuesta inflamatoria debida a esta lesión y su correlación con la reestenosis.
En todo el mundo, la patología isquémica sigue siendo una importante causa de morbilidad y mortalidad. En particular, en el mundo occidental la vasculopatía periférica aterosclerótica (VPA) se ha convertido en uno de los problemas más importantes de salud. La claudicación intermitente (CI) es la manifestación más frecuente y precoz. En el Reino Unido, al final de la edad media de la vida, alrededor del 5% de hombres y mujeres manifiestan síntomas de esta enfermedad1,2 y, cada año, en Inglaterra y en Gales se ingresan alrededor de 50.000 pacientes debido a una afectación discapacitante grave3. El objetivo principal de los médicos que tratan la patología isquémica es restablecer el flujo sanguíneo hasta las áreas isquémicas, para recuperar la función. Hoy día, la angioplastia transluminal percutánea (ATP) es una opción terapéutica para el tratamiento de la arteriopatía periférica en las extremidades inferiores4, pero la reestenosis sigue siendo una complicación frecuente del procedimiento, disminuyendo la permeabilidad a largo plazo. La tasa de reestenosis a los 6-12 meses en las arterias ilíacas es del orden del 20% y en las arterias femoropoplíteas es del 30-50%5-7.
En la actualidad se ha hecho evidente que, paradójicamente, el restablecimiento del flujo sanguíneo en estas regiones isquémicas se traduce en una lesión adicional de estas áreas, y dicho proceso se ha denominado lesión de reperfusión. Hoy día, la lesión de isquemia/reperfusión (LIR) es un problema clínico relevante, orientado desde diversos aspectos de las consultas de medicina y cirugía siendo objeto de una intensa investigación. Esta lesión es un proceso dinámico que afecta a múltiples sistemas orgánicos y en muy diversas situaciones clínicas, incluido el trasplante, los traumatismos y la cirugía. La investigación efectuada en este campo ha identificado vías moleculares y de señalización clave que median, modulan o aumentan la lesión celular, tisular y orgánica durante este proceso patológico. Una aclaración más profunda de los mecanismos moleculares proporcionará la base para identificar las opciones nuevas terapéuticas para prevenir o mejorar la lesión orgánica debida a la isquemia y la reperfusión en la práctica clínica8. Esta lesión es un acontecimiento clínico conocido en pacientes que se someten a procedimientos de revascularización en forma de angioplastia o derivaciones quirúrgicas para restablecer el flujo sanguíneo en la extremidad, distal a la oclusión arterial9. La propia reperfusión induce anomalías metabólicas sustanciales adicionales, lo que incrementa considerablemente la morbilidad y la mortalidad10. La gravedad de esta lesión varía desde síntomas menores hasta la necrosis tubular aguda, arritmias cardíacas súbitas e incluso la muerte. Todavía no se ha aclarado el mecanismo exacto responsable de estos acontecimientos.
Los mecanismos de la reestenosis son complejos y todavía no son conocidos por completo. Diversos factores, como el factor tisular y la trombina, que participan en la trombosis, también revisten importancia en el desarrollo de la reestenosis11,12. La inflamación desempeña un papel decisivo en la reestenosis13, la aterosclerosis14 y la trombosis15. Una concentración elevada de proteína C reactiva (PCR), un marcador de inflamación sistémica, predice el futuro riesgo de arteriopatía periférica sintomática16. El fibrinógeno, una proteína de fase aguda, al igual que un componente de la cascada de la coagulación, y la PCR se asocian con reestenosis tras ATP de las arterias ilíacas y femoropoplíteas6,17. Sigue siendo difícil el encontrar un tratamiento médico eficaz para prevenir la reestenosis y mejorar la permeabilidad después de ATP.
El objetivo del presente estudio clínico prospectivo fue caracterizar la respuesta inflamatoria sistémica debida a LIR, causada por revascularización periférica satisfactoria mediante ATP. Se realizó a través de la investigación de la concentración plasmática de interleucina 6, IL-8, IL-10 y factor alfa de necrosis tumoral (TNF-alfa) en sangre venosa periférica así como su significado en la reestenosis tardía de la ATP.
MétodosPacientesLa investigación fue un estudio prospectivo, observacional. Durante abril de 2004 hasta diciembre de 2005, se abordó y reclutó en el estudio a los pacientes consecutivos ingresados en el servicio de cirugía vascular para una angiografía diagnóstica o una angioplastia de una lesión definida de la extremidad inferior. Se definieron dos grupos: grupo 1 (grupo de control), al que sólo se le sometió a una angiografía diagnóstica, y grupo 2 (grupo de estudio), que fue sometido a angioplastia/stent de un segmento arterial de la extremidad inferior. Aprobó el estudio el comité de investigación del Hammersmith Hospital, y todos los pacientes que participaron aceptaron el consentimiento informado por escrito.
Se excluyeron del estudio aquellos pacientes sometidos a angioplastia de bypass previos, angioplastias o cirugías repetidas y aquellos con infarto de miocardio reciente (<6 semanas), angina inestable, ictus o insuficiencia cardíaca congestiva, disfunción renal o hepática y en tratamiento con cumarínicos.
En nuestro hospital los criterios de la angiografía femoral con o sin angioplastia para revascularización del miembro inferior son CI incapacitante y/o isquemia crítica (p. ej., dolor en reposo isquémico con o sin pérdida de tejido). La CI y la isquemia crítica se definieron de acuerdo con los criterios propuestos por la Society for Vascular Surgery y la International Society for Cardiovascular Surgery18 (SVS/ISCVS).
Muestras de sangreSe obtuvo una muestra de sangre venosa periférica en tres cortes temporales del siguiente modo:
Muestra 1 (M1): antes de la angiografía o de la angioplastia
Muestra 2 (M2): una hora después de la angiografía o de la angioplastia
Muestra 3 (M3): 24h después de la angiografía o de la angioplastia
La sangre venosa periférica se extrajo de una vena antecubital mediante punción venosa utilizando una aguja de calibre 21 directamente en un sistema Vacutainer (Becton Dickinson, Franklin Lakes, NJ). Se obtuvo una muestra de sangre (9ml) en dos Vacutainers de 4,5ml con ácido etilenodiaminotetraacético (EDTA) K3. Las muestras de plasma se centrifugaron a 3.000rpm durante 20min a 10°C, y, acto seguido, se separó de inmediato el plasma sobrenadante y se almacenó a –70°C para un análisis posterior de los lotes.
Protocolo de intervenciónUn radiólogo vascular intervencionista efectuó la angiografía y/o la angioplastia en el área quirúrgica de angiografía. Se efectuó una punción percutánea de la arteria femoral, anterógrada del mismo lado a tratar o retrógrada contralateral. Los pacientes recibieron 5.000 U de heparina por vía intraarterial antes de la angioplastia. El resultado técnico se definió como una angioplastia que dio lugar a una estenosis residual<30% después de la dilatación. La mejora hemodinámica se definió como un aumento del índice de presión tobillo-brazo (IPTB)>0,104. Antes y después de la angioplastia, se efectuó examen clínico y determinación del IPTB.
Análisis plasmático de la concentración de IL-6, IL-8, IL-10, y TNF-alfaUn operador efectuó el análisis plasmático con una técnica estándar de enzimoinmunosorbencia (ELISA). R&D Systems (Oxford, Reino Unido) suministró los equipos ELISA. El análisis utilizaba la técnica cuantitativa de enzimoinmunoanálisis sándwich según lo descrito en otras publicaciones. En el laboratorio de los autores se han establecido previamente los intervalos de referencia en adultos para todos los análisis.
Análisis estadísticoLa estadística descriptiva se documenta como medianas con límites intercuartil (LIC). Se calcularon las diferencias de las concentraciones plasmáticas entre el período previo al procedimiento (M1) y una hora después del procedimiento (M2), es decir, D1=M2–M1 y entre M3 y M1, es decir, D2=M3–M1. Se investigó el significado de estas diferencias (D1, D2) entre los grupos de angiografía diagnóstica y angioplastia femoral. Se usó la prueba no paramétrica de la U de Mann-Whitney y se aceptó una significación con un valor de p<0,05. Los datos se analizaron con la ayuda de un bioestadístico. El programa informático usado fue el STATA, versión 8.0 (Stata Corp, College Station, Estados Unidos).
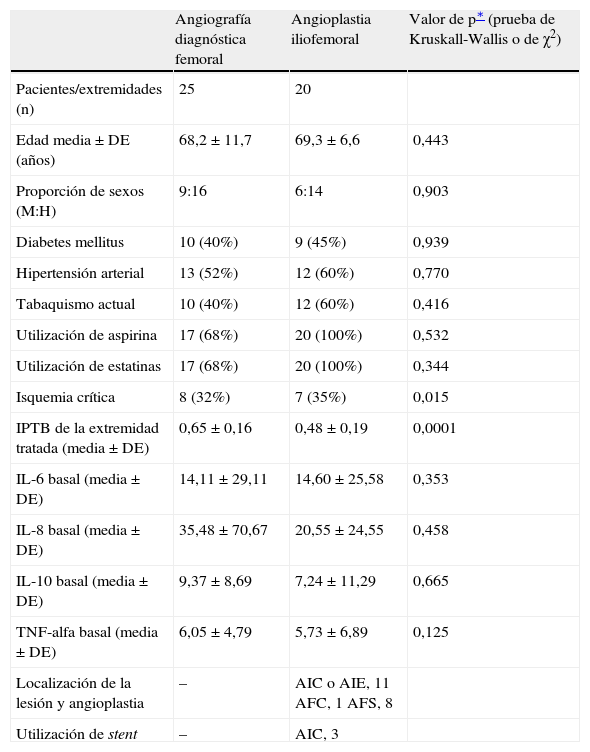
ResultadosDemografía basalEn la tabla I se muestran las características basales de los pacientes de ambos grupos.
Demografía basal a través de los dos grupos
| Angiografía diagnóstica femoral | Angioplastia iliofemoral | Valor de p∗ (prueba de Kruskall-Wallis o de χ2) | |
| Pacientes/extremidades (n) | 25 | 20 | |
| Edad media±DE (años) | 68,2±11,7 | 69,3±6,6 | 0,443 |
| Proporción de sexos (M:H) | 9:16 | 6:14 | 0,903 |
| Diabetes mellitus | 10 (40%) | 9 (45%) | 0,939 |
| Hipertensión arterial | 13 (52%) | 12 (60%) | 0,770 |
| Tabaquismo actual | 10 (40%) | 12 (60%) | 0,416 |
| Utilización de aspirina | 17 (68%) | 20 (100%) | 0,532 |
| Utilización de estatinas | 17 (68%) | 20 (100%) | 0,344 |
| Isquemia crítica | 8 (32%) | 7 (35%) | 0,015 |
| IPTB de la extremidad tratada (media±DE) | 0,65±0,16 | 0,48±0,19 | 0,0001 |
| IL-6 basal (media±DE) | 14,11±29,11 | 14,60±25,58 | 0,353 |
| IL-8 basal (media±DE) | 35,48±70,67 | 20,55±24,55 | 0,458 |
| IL-10 basal (media±DE) | 9,37±8,69 | 7,24±11,29 | 0,665 |
| TNF-alfa basal (media±DE) | 6,05±4,79 | 5,73±6,89 | 0,125 |
| Localización de la lesión y angioplastia | – | AIC o AIE, 11 AFC, 1 AFS, 8 | |
| Utilización de stent | – | AIC, 3 |
AFC: arteria femoral común; AFS: arteria femoral superficial; AIC: arteria ilíaca común; AIE: arteria ilíaca externa; DE: desviación estándar; H: hombre; IL: interleucina; IPTB: índice de presión tobillo-brazo (la mayor de tres presiones arteriales periféricas; M: mujer; TNF: factor de necrosis tumoral.
El resultado técnico inmediato después de la angioplastia fue del 100% y no se produjeron complicaciones mayores. Los pacientes fueron seguidos hasta un año después del procedimiento. Se planificó un seguimiento sistemático a las 6 semanas, 3 meses, 6 meses y un año. En todas las visitas de seguimiento, se obtuvo la anamnesis, se efectuó una exploración física con determinación del IPTB, y se practicó un eco-Doppler arterial de la extremidad inferior. El fracaso del procedimiento se definió como la ausencia de mejoría sintomática o la agravación asociada con una disminución del IPTB y un eco-Doppler arterial que demostrara una disminución del diámetro luminal>50% en el segmento sometido a angioplastia, lo que se consideró como prueba de reestenosis.
A los 6 meses del procedimiento, habían fracasado el 45% (9/20) de las angioplastias, y al año, el 40% (8/20) de pacientes habían fallecido. La causa de la muerte fue la cardiopatía isquémica o el accidente vascular cerebral (AVC) mayor.
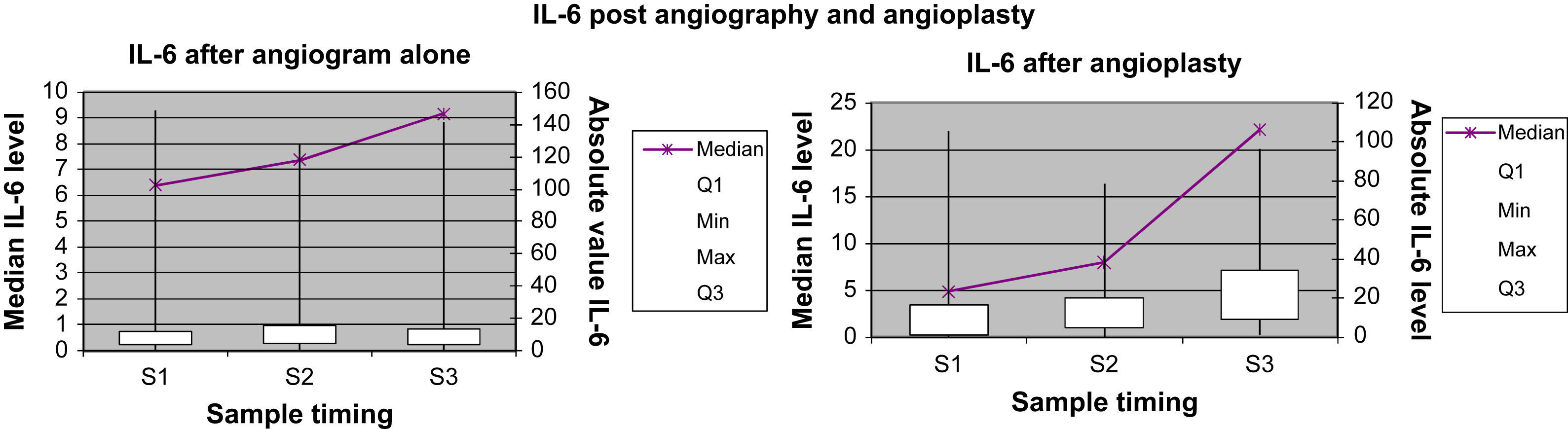
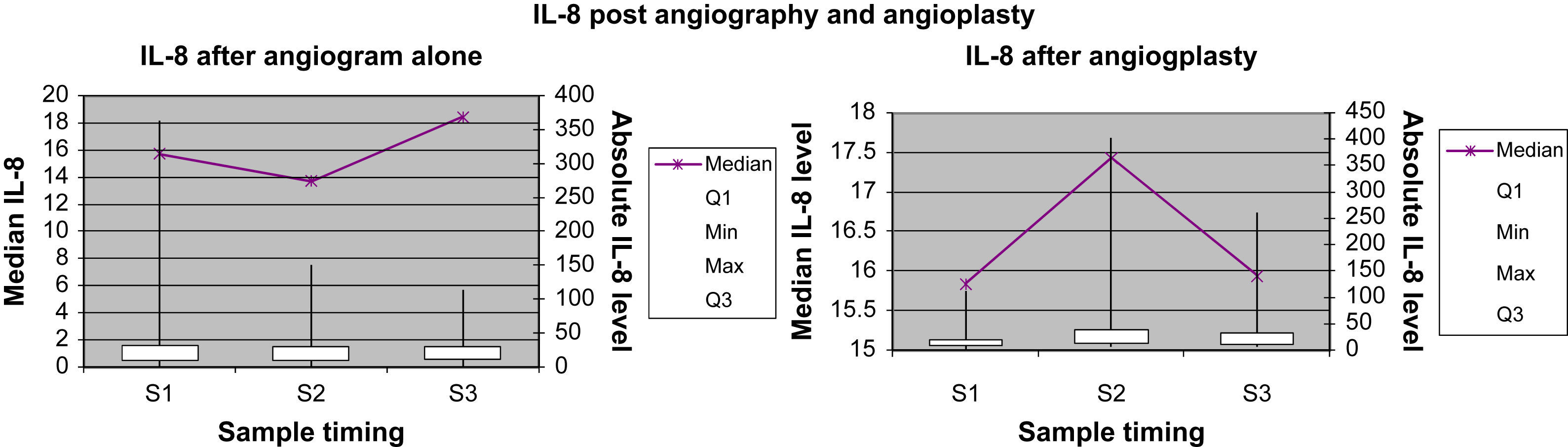
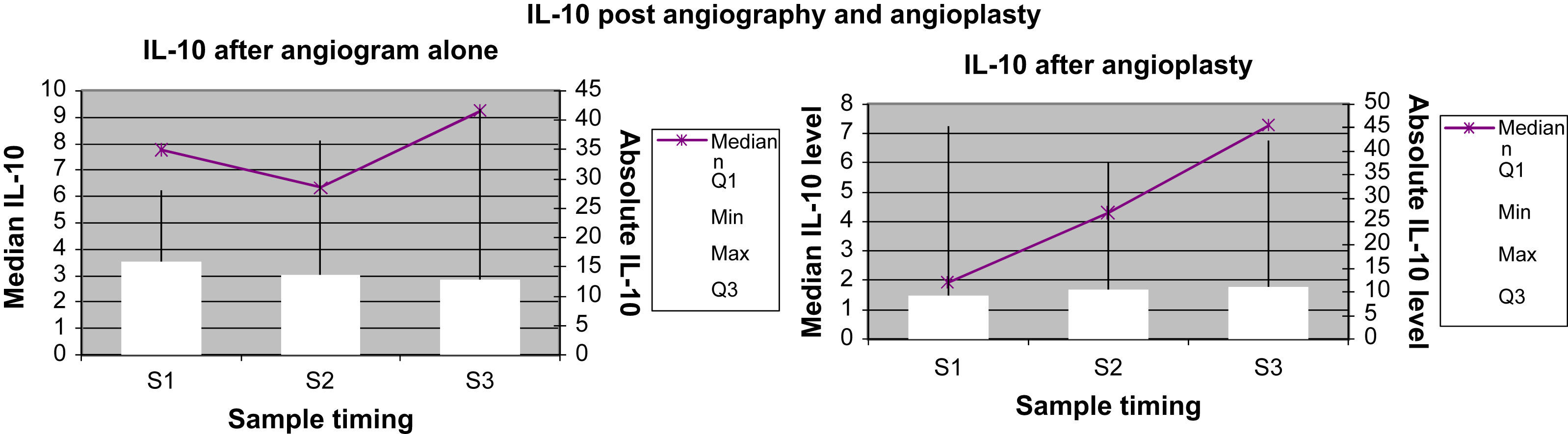
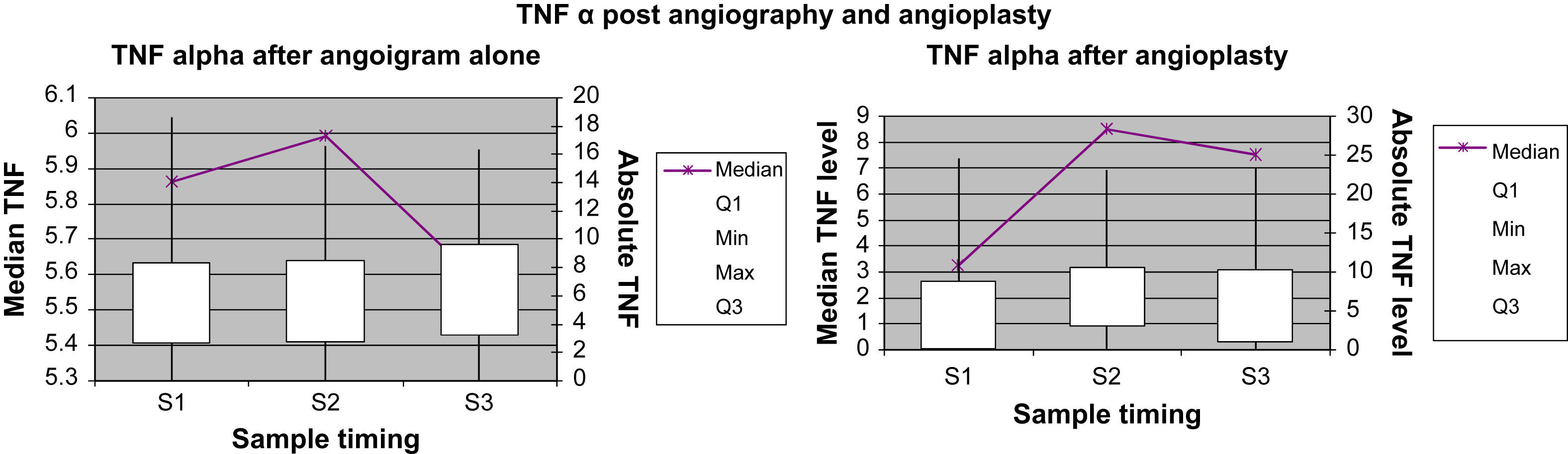
Marcadores inflamatorios: representación gráficaEn las Figuras 1 a 4 se muestran los valores absolutos de IL-6, IL-8, IL-10 y TNF-alfa, representando el eje X el momento de la obtención de la muestra (M1, M2 y M3), y mostrando el eje Y la concentración mediana del marcador determinado; el eje Y secundario muestra los valores absolutos del marcador determinado, donde las cajas (box) representan los LIC y los bigotes (whiskers) representan el intervalo de la distribución de datos.
Concentración de IL-6 para el grupo angiografía y el grupo angioplastia. Absolute value IL-6: concentración absoluta de IL-6; IL-6 after angiogram alone: IL-6 después de angiografía diagnóstica; IL-6 after angioplasty: IL-6 después de angioplastiadiagnóstica; IL-6 post angiography and angioplasty: IL-6 después de angiografía diagnóstica y angioplastia; Median IL-6 level: concentración mediana de IL-6; Sample timing: momento de obtención de la muestra; Max: máximo; Median: mediana; Min: mínimo.
Concentración de IL-8 para el grupo angiografía diagnóstica y el grupo angioplastia. Absolute IL-8 level: concentración absoluta de IL-8; IL-8 after angiogram alone: IL-8 después de angiografía diagnóstica; IL-8 after angioplasty: IL-8 después de angioplastiadiagnóstica; IL-8 post angiography and angioplasty: IL-8 después de angiografía diagnóstica y angioplastia; Median IL-8 level: concentración mediana de IL-8; Sample timing: momento de obtención de la muestra; Max: máximo; Median: mediana; Min: mínimo.
Concentración de IL-10 para el grupo angiografía diagnóstica y el grupo angioplastia. Absolute IL-10 level: concentración absoluta de IL-10; IL-10 after angiogram alone: IL-10 después de angiografía diagnóstica; IL-10 after angioplasty: IL-10 después de angioplastiadiagnóstica; IL-10 post angiography and angioplasty: IL-10 después de angiografía diagnóstica y angioplastia; Median IL-10 level: concentración mediana de IL-10; Sample timing: momento de obtención de la muestra; Max: máximo; Median: mediana; Min: mínimo.
Concentración de TNF-alfa para el grupo angiografía diagnóstica y el grupo angioplastia. Absolute TNF level: concentración absoluta de TNF; TNF alpha after angiogram alone: TNF después de angiografía diagnóstica; TNF alpha after angioplasty: TNF después de angioplastiadiagnóstica; TNF α post angiography and angioplasty: TNF después de angiografía diagnóstica y angioplastia; Median TNF level: concentración mediana de TNF; Sample timing: momento de obtención de la muestra; Max: máximo; Median: mediana; Min: mínimo.
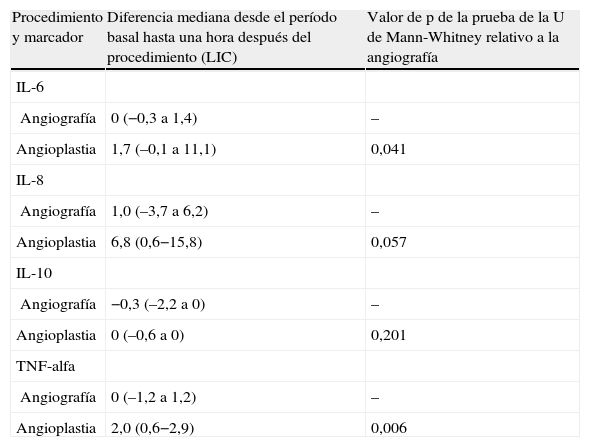
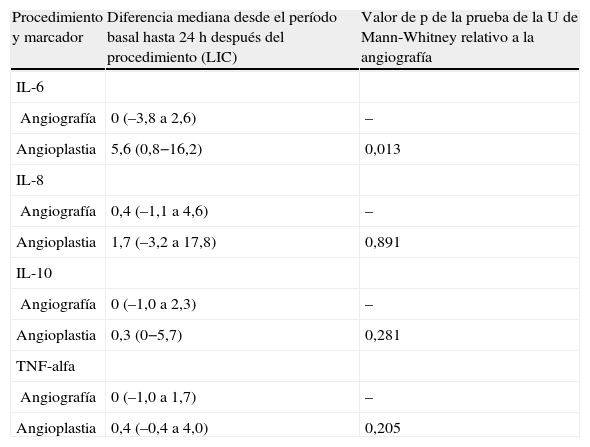
La concentración plasmática de IL-6 y TNF-alfa fue significativamente más alta una hora después de la angioplastia comparado con la angiografía (p=0,041 y 0,006, respectivamente; tabla II). Para la concentración plasmática de IL-8 e IL-10 no se demostró esta respuesta significativa al cabo de una hora de la angioplastia. Sólo la concentración de IL-6 siguió siendo significativamente más alta a las 24h de la angioplastia (p=0,013, tabla III). La concentración de IL-8, IL-10 y TNF-alfa no demostró esta respuesta significativa a las 24h de la angioplastia. Ninguno de los marcadores inflamatorios fue una variable pronóstica de reestenosis tardía tras la angioplastia.
Comparación de las diferencias entre el período basal y una hora después del procedimiento en relación con la angiografía para la concentración plasmática de IL-6, IL-8, IL-10 y TNF-alfa
| Procedimiento y marcador | Diferencia mediana desde el período basal hasta una hora después del procedimiento (LIC) | Valor de p de la prueba de la U de Mann-Whitney relativo a la angiografía |
| IL-6 | ||
| Angiografía | 0 (−0,3 a 1,4) | – |
| Angioplastia | 1,7 (–0,1 a 11,1) | 0,041 |
| IL-8 | ||
| Angiografía | 1,0 (–3,7 a 6,2) | – |
| Angioplastia | 6,8 (0,6−15,8) | 0,057 |
| IL-10 | ||
| Angiografía | −0,3 (–2,2 a 0) | – |
| Angioplastia | 0 (–0,6 a 0) | 0,201 |
| TNF-alfa | ||
| Angiografía | 0 (–1,2 a 1,2) | – |
| Angioplastia | 2,0 (0,6−2,9) | 0,006 |
IL: interleucina; LIC: límites intercuartil; TNF: factor de necrosis tumoral.
Comparación de las diferencias entre el período basal y 24h después del procedimiento en relación con la angiografía para la concentración plasmática de IL-6, IL-8, IL-10 y TNF-alfa
| Procedimiento y marcador | Diferencia mediana desde el período basal hasta 24h después del procedimiento (LIC) | Valor de p de la prueba de la U de Mann-Whitney relativo a la angiografía |
| IL-6 | ||
| Angiografía | 0 (–3,8 a 2,6) | – |
| Angioplastia | 5,6 (0,8−16,2) | 0,013 |
| IL-8 | ||
| Angiografía | 0,4 (–1,1 a 4,6) | – |
| Angioplastia | 1,7 (–3,2 a 17,8) | 0,891 |
| IL-10 | ||
| Angiografía | 0 (–1,0 a 2,3) | – |
| Angioplastia | 0,3 (0−5,7) | 0,281 |
| TNF-alfa | ||
| Angiografía | 0 (–1,0 a 1,7) | – |
| Angioplastia | 0,4 (–0,4 a 4,0) | 0,205 |
IL: interleucina; LIC: límites intercuartil; TNF: factor de necrosis tumoral.
La lesión vascular inducida por angioplastia puede traducirse en hiperplasia neointimal mediada por el depósito de plaquetas y la proliferación y migración de células musculares lisas vasculares (CMLV), así como la síntesis y depósito de matriz extracelular. Los procesos inflamatorios desempeñan un papel decisivo en la respuesta vascular a la lesión13. La inflamación puede inducir una trombosis local, que puede amplificar el primer acontecimiento19. Las CMLV no sólo producen sustancias procoagulantes sino que también experimentan una activación inflamatoria. La estimulación de la trombina provoca la producción de IL-6 por parte de estas células, que, a su vez, induce la PCR20.
La IL-6, IL-8 y TNF-alfa son potentes mediadores proinflamatorios, mientras que la IL-10 es pleiotrópica pero tiene una actividad antiinflamatoria predominante21. Estas citocinas no se han estudiado en el contexto de la LIR debida a revascularización periférica. Se ha demostrado que potencialmente desempeñan un papel mayor en la lesión de órganos a distancia después de la corrección de un aneurisma aórtico abdominal (AAA), que, más tarde, da lugar a una insuficiencia multiorgánica22 (IMO). Norwood et al23 demostraron que, durante la corrección de un AAA, la isquemia y reperfusión se asociaron con un aumento marcado de la concentración de IL-6 en la vena porta, lo que sugiere que esta citocina fue producida por el tracto gastrointestinal. Se ha demostrado que la concentración de IL-8 aumenta después del ejercicio en pacientes con AVP estable24. Esta citocina asociada con una lesión grave es un posible marcador de IMO y una potente quimiotaxina neutrófila25. El TNF-alfa es un potente quimioatrayente que estimula la producción de otras citocinas y de radicales libres. También es un mediador clave en las vías proapoptóticas26.
En el presente estudio, en los dos grupos las características de los pacientes no difirieron sustancialmente excepto por la presencia de un bajo IPTB en el grupo sometido a angioplastia. Los pacientes con isquemia avanzada del miembro inferior se caracterizan por una mayor activacion de los procesos inflamatorios27, pero, en el presente estudio, en ambos grupos se identificaron valores basales similares de los marcadores de inflamación. La razón de esto sigue por aclarar. Los resultados del presente estudio sugirieron que la revascularización periférica en forma de angioplastia causa una respuesta inflamatoria sustancial. El procedimiento parece provocar una respuesta inflamatoria sistémica significativa tanto de forma inmediata como a las 24h según lo demostrado por el aumento de la concentración de IL-6 y TNF-alfa (tablas II y III, Figs. 1 y 4). La IL-8 se caracteriza por una semivida plasmática muy breve, que puede ser responsable del cambio no significativo de su concentración plasmática. La IL-10 es un mediador antiinflamatorio cuya liberación requiere un traumatismo o agresión significativamente mayor para contrarrestar la respuesta inflamatoria. Esto podría explicar los valores hallados en el presente estudio.
En la actualidad, la angioplastia arterial periférica con el mejor tratamiento médico es la modalidad establecida de elección para los casos apropiados de isquemia (crítica o no) del miembro inferior4. El procedimiento confiere beneficios evidentes sobre la revascularización quirúrgica y ofrece beneficios sustanciales a los pacientes, en particular los efectos cardioprotectores del consiguiente aumento de la tolerancia al ejercicio. En un estudio reciente se demostró una mejora a medio plazo del estado procoagulante e hipofibrinolítico en reposo, lo que puede traducirse en una disminución de la morbilidad y mortalidad de los acontecimientos vasculares trombóticos en este grupo de pacientes28. A pesar de sus beneficios evidentes, sigue asociándose con una respuesta inflamatoria, como se ha demostrado en el presente estudio; y todavía han de investigarse las implicaciones a largo plazo en la futura permeabilidad del procedimiento. También se asocia con una LIR transitoria; aunque es un acontecimiento conocido después de la revascularización, apenas se conoce su patogenia, su tratamiento actual es insatisfactorio y no se dispone de guías nacionales actualizadas. En parte, esto se debe a los conocimientos incompletos sobre el mecanismo exacto de la lesión y, en parte, la razón es que sólo se dispone de una estrecha ventana de oportunidad clínica después de la lesión en la que puede administrarse eficazmente un tratamiento.
El aumento transitorio de estos mediadores de la inflamación puede tener pertinencia clínica, en particular en pacientes en alto riesgo, como los portadores de insuficiencia renal. Se desconoce el efecto a largo plazo de esta respuesta inflamatoria en el grupo de pacientes sometidos a angioplastia, pero podría guardar una relación significativa con la permeabilidad a largo plazo de las lesiones sometidas al procedimiento. En estudios recientes se han correlacionado reestenosis clínicamente pertinentes con una respuesta inflamatoria tras angioplastia coronaria29. Se ha demostrado que la IL-8 y el TNF-alfa son marcadores de riesgo de reestenosis precoz después de una intervención coronaria percutánea30-32. La correlación entre la inflamación y la reestenosis de la angioplastia arterial periférica no está ni mucho menos clara. En un estudio reciente se demostró una correlación en los límites entre la reestenosis del segmento femoropoplíteo sometido a angioplastia y el aumento de la concentración de PCR después de ella33. Se recomienda un estudio adicional para verificar la permeabilidad a largo plazo de la angioplastia o los injertos en pacientes que demuestran una respuesta inflamatoria máxima. Así mismo, los stents recubiertos con propiedades anticoagulantes, antiproliferación y antiinflamatorias podrían ser una opción para prevenir las reestenosis. En la actualidad se está evaluando el papel de los scavengers de los radicales libres, como el alopurinol, para estudiar sus efectos en pacientes con arteriopatía oclusiva periférica sometidos a angioplastia.
En el grupo de pacientes sometidos a ATP, el grado de isquemia era más grave, según IPTB y por una mayor presencia de isquemia crítica del miembro inferior. La respuesta inflamatoria demostrada por el grupo sometido a angioplastia podría guardar relación con la presencia o grado de isquemia antes de la angioplastia. Ésta es una limitación del presente estudio. Nuestro análisis de subgrupos no demostró una diferencia significativa en los marcadores inflamatorios determinados entre pacientes con isquemia crítica que requerían angioplastia, comparado con el grupo que requería el procedimiento y no presentaba isquemia.
En conclusión, observamos una respuesta inflamatoria sustancial después de la ATP. Los marcadores bioquímicos, antes y después de ella, no guardaron relación con la reestenosis. Las interleucinas y el TNF-alfa podrían participar causalmente en la aterotrombosis después de angioplastia. Las limitaciones del presente estudio fueron un grupo reducido de pacientes heterogéneos con algunos valores atípicos en los marcadores inflamatorios después de la angioplastia. Por esta razón, nuestros resultados deben interpretarse con la debida precaución. Se requieren estudios futuros para definir los mecanismos moleculares que son la base de estas observaciones y su participación en la trombosis y la reestenosis. Si se definieran con más detalle estas vías, podrían adaptarse mejores estrategias terapéuticas, incluidos tratamientos antitrombóticos, estatinas y antioxidantes, para modular la inflamación después del procedimiento.