Sunitinib (SUN) y pazopanib (PAZ) son 2 inhibidores orales de la tirosina cinasa que actúan contra el factor de crecimiento endotelial vascular. Su eficacia y seguridad en el carcinoma de células renales metastásico se ha demostrado con estudios de fase iii. Sin embargo, la evidencia real es escasa. El objetivo de este análisis es evaluar el beneficio clínico de SUN y PAZ en la práctica clínica habitual.
MétodosRevisamos los registros médicos de 79 pacientes con carcinoma de células renales metastásico tratados con SUN (50mg/día en el régimen 4/2) o PAZ (800mg/día continuo). Los pacientes fueron evaluados retrospectivamente en 2 hospitales turcos entre 2006 y 2016.
ResultadosLa mediana de edad de toda la cohorte fue de 60 (28-87) años y el 70% de ellos eran hombres. La tasa de respuesta objetiva y la tasa de control de la enfermedad en los grupos SUN/PAZ fueron 34/37% (p=0,96) y 78/87% (p=0,046), respectivamente. Con una mediana de seguimiento de 15 meses, las medianas de supervivencia libre de progresión y de supervivencia global en los grupos SUN/PAZ fueron de 8/8 meses (p=0,83) y 22/21 meses (p=0,53), respectivamente. La toxicidad común entre SUN vs. PAZ incluía fatiga (59 vs. 74%), cambios en la piel (44 vs. 44%), anemia (35 vs. 42%), hipotiroidismo (37 vs. 19%; p=0,02) e hipertensión (33 vs. 50%). En los pacientes tratados con SUN, la toxicidad total de grado 3-4 (número medio de eventos tóxicos por paciente) fue de 0,71, mientras que en los pacientes tratados con PAZ, la toxicidad total de grado 3-4 fue de 0,11 (p<0,001). SUN se asoció con una mayor incidencia de fatiga de grado 3-4 (p=0,007), anemia (p=0,001) e hipotiroidismo, requiriendo tratamiento (p=0,02). Fue necesario reducir la dosis en los grupos SUN y PAZ en el 49 y el 24% de los pacientes (p=0,02), y el cese del tratamiento en el 37 y el 26% de los pacientes (p=0,37), respectivamente.
ConclusionesEn nuestro estudio no hubo diferencias en términos de supervivencia entre los 2 agentes. Sin embargo, en los pacientes tratados con SUN se dieron más eventos adversos de grado 3-4, siendo necesaria la reducción de la dosis.
Sunitinib (SUN) and pazopanib (PAZ) are 2 oral tyrosine kinase inhibitors against vascular endothelial growth factor. Their efficacy and safety in metastatic renal cell carcinoma has been proven with phase iii studies. However, real world data is limited. The objective of this study is to assess the clinical benefit of SUN and PAZ in routine practice.
MethodsWe reviewed the medical records of 79 metastatic renal cell carcinoma patients treated with SUN (50mg/day on 4/2-schedule) or PAZ (800mg/day continuously). Patients were assessed retrospectively at 2 Turkish hospitals between 2006 and 2016.
ResultsFor the entire cohort median age of patients was 60 (28-87) years and 70% of them were male. The objective response rate and disease control rate in SUN/PAZ groups were 34/37% (P=.96) and 78/87% (P=.046), respectively. With a median follow up duration of 15 months, median progression-free survival and overall survival in SUN/PAZ groups were 8/8 months (P=.83) and 22/21 months (P=.53), respectively. The common all grade toxicities for SUN vs. PAZ were fatigue (59 vs. 74%), skin changes (44 vs. 44%), anemia (35 vs. 42%), hypothyroidism (37 vs. 19%; P=.02) and hypertension (33 vs. 50%). In patients treated with SUN, total grade 3-4 toxicities (mean number of toxic events per patients) were 0.71, whereas in patients treated with PAZ, total grade 3-4 toxicities were 0.11 (P<.001). SUN was associated with an increased incidence of grade 3-4 fatigue (P=.007), anemia (P=.001) and hypothyroidism that needed therapy (P=.02). Dose reduction in 49 and 24% of patients (P=.02), and treatment cessation in 37 and 26% of patients (P=.37) were required in the SUN and PAZ groups, respectively.
ConclusionsIn our study, there was no difference in terms of survival outcomes between 2 agents. However, patients treated with SUN had more grade 3-4 adverse events which prompted dose reduction.
Gracias al desarrollo de terapias dirigidas contra el factor de crecimiento endotelial vascular se han logrado avances significativos en el tratamiento del carcinoma de células renales metastásico (CCRm) durante los últimos 20 años. Sunitinib (SUN) fue el primer inhibidor de tirosina cinasa (ITC) con actividad antiangiogénica y antitumoral multidiana en ser aprobado para tratamiento1. En el ensayo de Motzer et al., este agente se asoció a una mayor tasa de respuesta y a una supervivencia libre de progresión (SLP) más larga en comparación con interferón alfa, el tratamiento estándar anterior2. Más adelante, los resultados actualizados de este estudio mostraron una mejora significativa de la mediana de supervivencia global (SG) con SUN sobre interferón alfa (26,4 vs. 21,8 meses, respectivamente)3. Pazopanib (PAZ), otro ITC multidiana, también fue aprobado para el tratamiento de primera línea de los pacientes con CCRm tras un ensayo pivotal de fase iii comparándolo con placebo. En este estudio, PAZ prolongó significativamente la SLP en comparación con el placebo4. Por lo tanto, estos 2 ITC contra el factor de crecimiento endotelial vascular se convirtieron en la terapia de primera línea para el manejo de CCRm.
Con el fin de facilitar la elección del tratamiento para CCRm, se diseñaron 2 grandes ensayos aleatorios comparando estos 2 ITC en todos los aspectos. El primer ensayo, COMPARZ, fue un ensayo de no inferioridad para evaluar el tratamiento en la indicación en primera línea, y reveló que PAZ no se asocia con una peor SLP que SUN5. El otro estudio, PISCES, aleatorizado, doble ciego, con diseño cruzado, tuvo en cuenta las preferencias de los pacientes. Este estudio, con su diseño innovador, demostró que PAZ tenía un mejor perfil de seguridad y significativamente más pacientes lo preferían sobre SUN6.
A pesar de los resultados de estos ensayos clínicos aleatorizados, la realidad es que los médicos continúan seleccionando los medicamentos de acuerdo con sus propias experiencias y el estado clínico de los pacientes. Esto es debido a que, en la práctica diaria, la población de pacientes es más heterogénea y no está suficientemente representada en los ensayos clínicos. Por lo tanto, los datos de eficacia y toxicidad en estas cohortes diversas de pacientes son muy importantes. Existe poca información real que analice retrospectivamente la eficacia y la toxicidad de SUN y PAZ7,8. El objetivo de nuestro estudio fue revisar nuestros propios hallazgos en CCRm entre una muestra de pacientes más amplia que la de un ensayo clínico.
Pacientes y métodosDiseño del estudio, pacientes y procedimientosEn este estudio retrospectivo de base poblacional, incluimos 79 pacientes que recibieron SUN o PAZ como tratamiento de primera línea para CCRm. Se administraron 800mg por día de PAZ de manera continua o SUN con una dosis de 50mg una vez al día durante 4 semanas, seguido de un período de descanso de 2 semanas (régimen 4/2). La información de los pacientes provenía de series de pacientes consecutivos no seleccionados de 2 centros oncológicos en Turquía, entre 2006 y 2016. Las juntas de revisión institucional de cada centro participante aprobaron el estudio. Se recogieron las características demográficas basales de los pacientes y los datos de resultados de las terapias dirigidas con fichas iguales de recolección de datos. Los datos de supervivencia se obtuvieron retrospectivamente de revisiones de historias clínicas y registros disponibles.
Los pacientes se agruparon según los criterios del centro oncológico Memorial Sloan Kettering evaluando los 5 factores pronósticos: concentración sérica de lactato deshidrogenasa de más de 1,5 veces sobre el límite superior del rango normal, concentración de hemoglobina por debajo del límite inferior, calcio sérico corregido>10mg/dl, un intervalo inferior a un año desde el diagnóstico inicial de CCR hasta el tratamiento y una puntuación en la escala de Karnofsky≤70. Los pacientes se clasificaron como de bajo riesgo si no tenían ningún factor de riesgo, de riesgo intermedio con uno o 2 factores, y de alto riesgo si presentaban 3 o más factores de riesgo.
Para determinar la respuesta al tratamiento, se realizó un examen radiológico con tomografía computarizada o resonancia magnética al inicio del estudio, y cada 3 meses después del tratamiento hasta la progresión. La respuesta al tratamiento se evaluó de acuerdo con los Criterios de Evaluación de Respuesta en Tumores Sólidos, versión 1.1.
Los datos relativos a la toxicidad se clasificaron según los Criterios de Terminología Común para Eventos Adversos, versión 4.0. Los efectos secundarios observados durante cada visita se obtuvieron de las historias clínicas de los pacientes. Estos fueron evaluados como toxicidad sintomática (síndrome mano-pie, mucositis, náuseas, fatiga y diarrea) y asintomática (función hepática elevada y toxicidad hematológica) para cada terapia dirigida. Se realizó una reducción de dosis según el grado del evento adverso.
Análisis estadísticoSe llevó a cabo un análisis descriptivo de los pacientes y las características de la enfermedad. La prueba exacta de Fisher se utilizó para comparar grupos. La comparación entre curvas se realizó mediante la prueba de log-rank y se informaron intervalos de confianza (IC) del 95% para cada mediana de tiempo. La tasa de respuesta se recopiló utilizando los criterios RECIST 1.1. Evaluamos la SG, definida como el tiempo desde el inicio de la terapia dirigida de primera línea hasta la muerte o censura estadística en el último seguimiento. La SLP se definió como el tiempo desde el inicio de la terapia dirigida de primera línea hasta la progresión, la muerte, el cese del tratamiento o la censura estadística en el último seguimiento. Realizamos un resumen estadístico y estimamos los resultados censurados utilizando las curvas de Kaplan-Meier.
Todos los valores p fueron bilaterales o de 2 colas, con p<0,05 indicando la significación estadística. Todos los análisis estadísticos se realizaron con el paquete SPSS (versión 20.0).
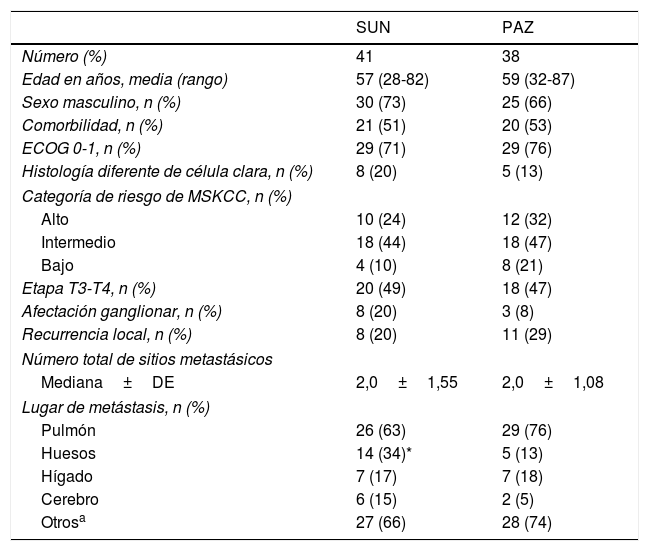
ResultadosCaracterísticas del paciente (tabla 1)Obtuvimos datos de 79 pacientes con CCRm tratados con SUN (n=41) o PAZ (n=38) como tratamiento de primera línea. Para toda la cohorte, la mediana de edad fue de 60 (28-87) años y el 70% eran varones. Diabetes mellitus, hipertensión, cardiopatía coronaria e insuficiencia renal crónica se evaluaron como enfermedades comórbidas. El 52% de los pacientes presentó comorbilidades. El estado funcional según la escala Eastern Cooperative Oncology Group ?ECOG? fue 0 y 1 en el 73% de los pacientes. Se realizó una biopsia para el diagnóstico al 22% de los pacientes. Trece pacientes (17%) tenían histología diferente a célula clara. Las características basales del paciente y del tumor según el grupo de tratamiento individual se resumen en la tabla 1. En el grupo SUN, 4 pacientes mostraron una histología cromófoba y otros 4, papilar. En el grupo PAZ, 5 pacientes fueron diagnosticados con histología diferente a célula clara: 3 con papilar, uno con sarcomatoide y otro con deficiencia de succinato deshidrogenasa. No hubo diferencias estadísticamente significativas en cuanto a las características del paciente y del tumor entre los 2 ITC, excepto en el caso de la metástasis ósea. El 34% de los pacientes tratados con SUN presentaron metástasis ósea, mientras que en el grupo tratado con PAZ dicho porcentaje fue del 13% (p=0,03).
Características de los pacientes
| SUN | PAZ | |
|---|---|---|
| Número (%) | 41 | 38 |
| Edad en años, media (rango) | 57 (28-82) | 59 (32-87) |
| Sexo masculino, n (%) | 30 (73) | 25 (66) |
| Comorbilidad, n (%) | 21 (51) | 20 (53) |
| ECOG 0-1, n (%) | 29 (71) | 29 (76) |
| Histología diferente de célula clara, n (%) | 8 (20) | 5 (13) |
| Categoría de riesgo de MSKCC, n (%) | ||
| Alto | 10 (24) | 12 (32) |
| Intermedio | 18 (44) | 18 (47) |
| Bajo | 4 (10) | 8 (21) |
| Etapa T3-T4, n (%) | 20 (49) | 18 (47) |
| Afectación ganglionar, n (%) | 8 (20) | 3 (8) |
| Recurrencia local, n (%) | 8 (20) | 11 (29) |
| Número total de sitios metastásicos | ||
| Mediana±DE | 2,0±1,55 | 2,0±1,08 |
| Lugar de metástasis, n (%) | ||
| Pulmón | 26 (63) | 29 (76) |
| Huesos | 14 (34)* | 5 (13) |
| Hígado | 7 (17) | 7 (18) |
| Cerebro | 6 (15) | 2 (5) |
| Otrosa | 27 (66) | 28 (74) |
DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; MSKCC: Memorial Sloan Kettering Cancer Center; PAZ: pazopanib; SUN: sunitinib.
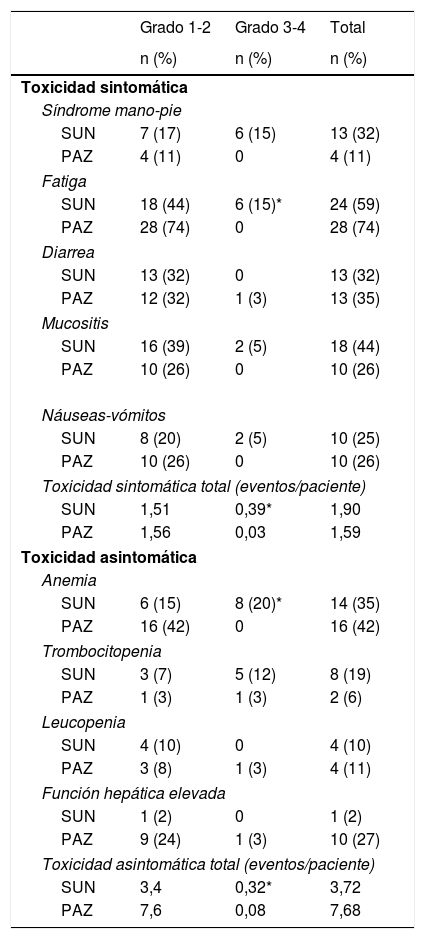
En el grupo SUN, las toxicidades no hematológicas más comunes fueron fatiga (59%), cambios en la piel (44%) e hipotiroidismo (37%). La toxicidad hematológica más frecuente fue la anemia (35%). Respecto al grupo PAZ, las toxicidades no hematológicas más comunes fueron fatiga (74%), hipertensión (50%) y cambios en la piel (44%), siendo de nuevo la anemia (42%) la toxicidad hematológica más común. Las otras toxicidades fueron edema pretibial, heridas genitales, insuficiencia renal aguda, hematuria, epistaxis y hemorragia gastrointestinal.
Comparación de la toxicidad observada
| Grado 1-2 | Grado 3-4 | Total | |
|---|---|---|---|
| n (%) | n (%) | n (%) | |
| Toxicidad sintomática | |||
| Síndrome mano-pie | |||
| SUN | 7 (17) | 6 (15) | 13 (32) |
| PAZ | 4 (11) | 0 | 4 (11) |
| Fatiga | |||
| SUN | 18 (44) | 6 (15)* | 24 (59) |
| PAZ | 28 (74) | 0 | 28 (74) |
| Diarrea | |||
| SUN | 13 (32) | 0 | 13 (32) |
| PAZ | 12 (32) | 1 (3) | 13 (35) |
| Mucositis | |||
| SUN | 16 (39) | 2 (5) | 18 (44) |
| PAZ | 10 (26) | 0 | 10 (26) |
| Náuseas-vómitos | |||
| SUN | 8 (20) | 2 (5) | 10 (25) |
| PAZ | 10 (26) | 0 | 10 (26) |
| Toxicidad sintomática total (eventos/paciente) | |||
| SUN | 1,51 | 0,39* | 1,90 |
| PAZ | 1,56 | 0,03 | 1,59 |
| Toxicidad asintomática | |||
| Anemia | |||
| SUN | 6 (15) | 8 (20)* | 14 (35) |
| PAZ | 16 (42) | 0 | 16 (42) |
| Trombocitopenia | |||
| SUN | 3 (7) | 5 (12) | 8 (19) |
| PAZ | 1 (3) | 1 (3) | 2 (6) |
| Leucopenia | |||
| SUN | 4 (10) | 0 | 4 (10) |
| PAZ | 3 (8) | 1 (3) | 4 (11) |
| Función hepática elevada | |||
| SUN | 1 (2) | 0 | 1 (2) |
| PAZ | 9 (24) | 1 (3) | 10 (27) |
| Toxicidad asintomática total (eventos/paciente) | |||
| SUN | 3,4 | 0,32* | 3,72 |
| PAZ | 7,6 | 0,08 | 7,68 |
PAZ: pazopanib; SUN: sunitinib.
Reducción de dosis y cese del tratamiento
| SUN | PAZ | |
|---|---|---|
| n (%) | n (%) | |
| Reducción de dosis | 20 (49)* | 9 (24) |
| Cese del tratamiento | 15 (37) | 10 (26) |
PAZ: pazopanib; SUN: sunitinib.
No hubo diferencias significativas en el número total de eventos adversos (media de eventos adversos/pacientes 5,62 vs. 9,27%) y la aparición de toxicidad sintomática para SUN y PAZ (media de eventos adversos/pacientes 1,90 vs. 1,59; p>0,05). Sin embargo, SUN se asoció con una mayor incidencia de toxicidad sintomática de grado 3-4 (valor medio de eventos tóxicos sintomáticos/pacientes 0,39 vs. 0,03; p<0,001). La fatiga fue significativamente más alta en el grupo SUN (p=0,007). La incidencia de toxicidad asintomática de grado 3-4 también fue mayor en SUN (valor medio de eventos adversos/pacientes 0,32 vs. 0,08; p<0,001). La anemia de grado 3-4 fue significativamente mayor en el grupo SUN (p=0,001). Para el grupo de pacientes tratados con SUN, la toxicidad total (asintomática y sintomática) grado 3-4 (número medio de eventos tóxicos/pacientes) fue 0,71. Sin embargo, en pacientes tratados con PAZ, la toxicidad total de grado 3-4 fue 0,11 (p<0,001) (tabla 2). Los casos de hipotiroidismo con necesidad de tratamiento fueron significativamente mayores en SUN en comparación con el grupo PAZ (37 vs. 19%; p=0,02). No hubo diferencias significativas relativas a la hipertensión entre los grupos SUN y PAZ (33 vs. 50%; p=0,48). Al 50% de los pacientes tratados con SUN y al 24% de los pacientes en PAZ se les redujo la dosis (p=0,02). Además, el 37% de los pacientes en SUN y el 26% de los pacientes en el grupo PAZ interrumpieron el tratamiento debido a los efectos secundarios (p=0,37) (tabla 3).
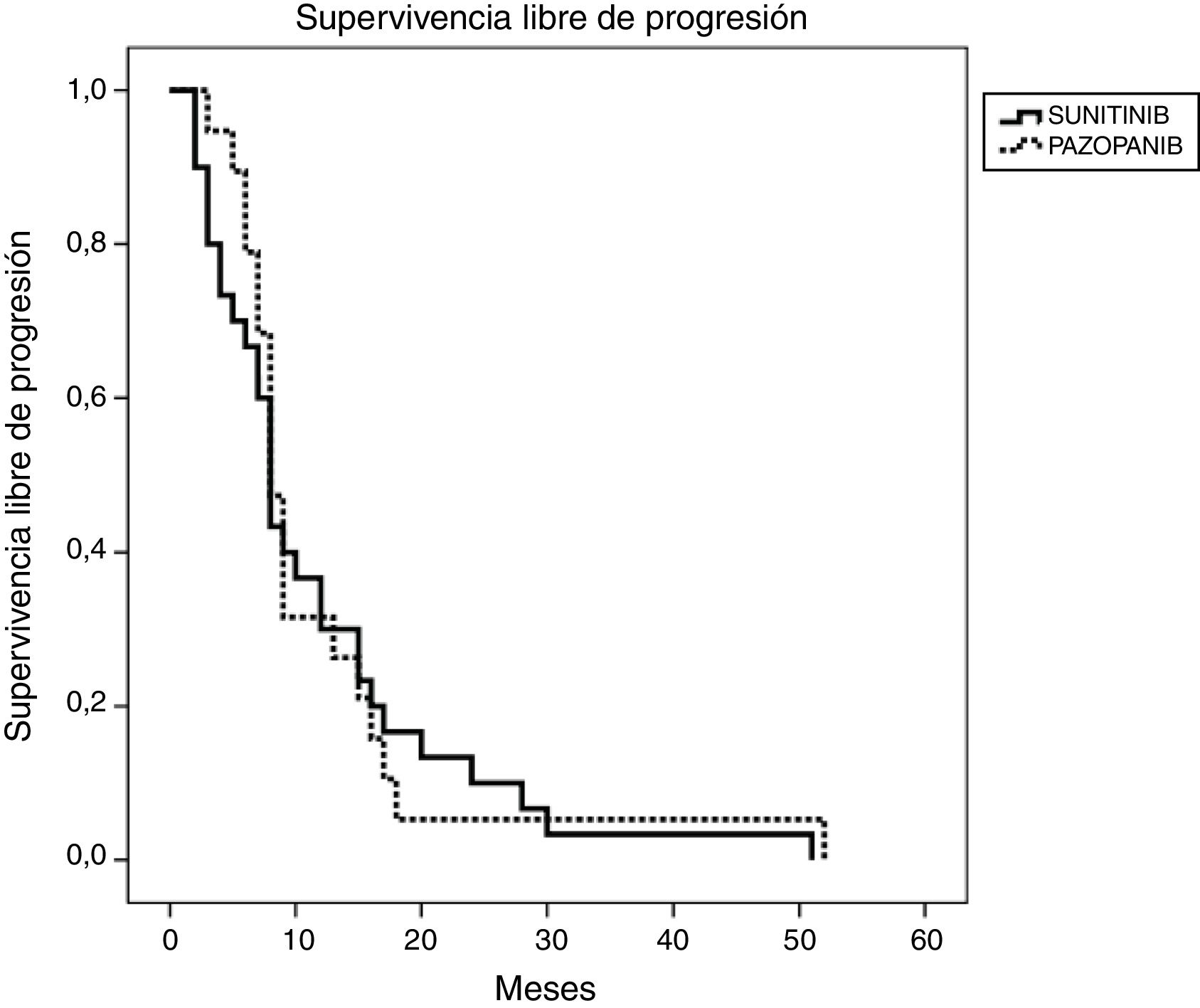
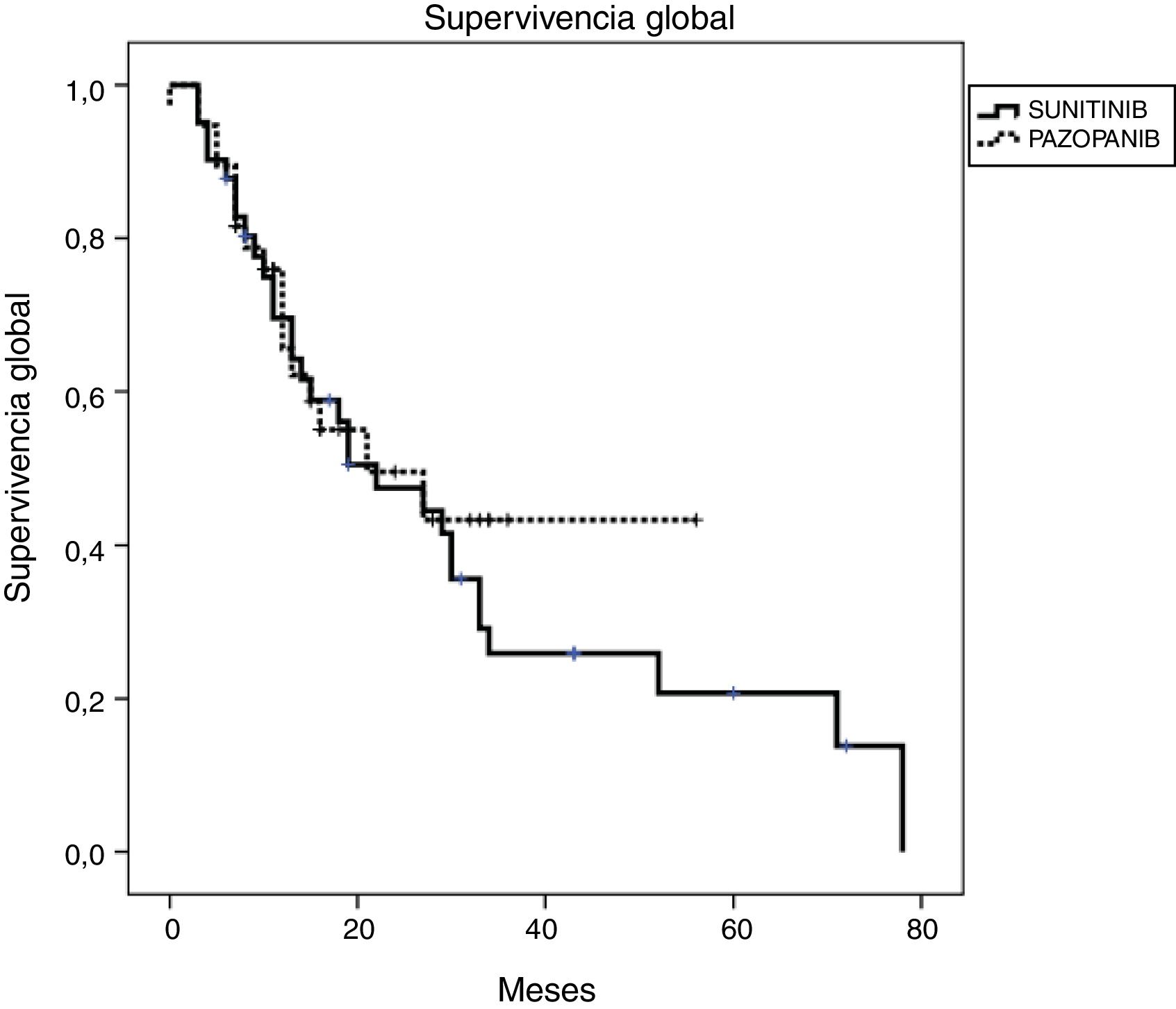
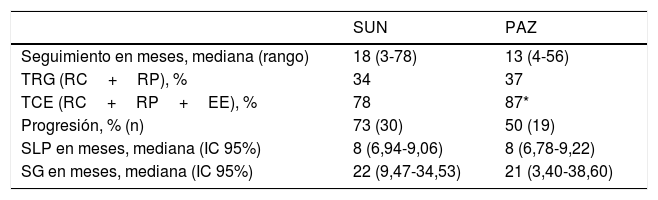
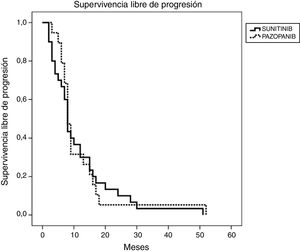
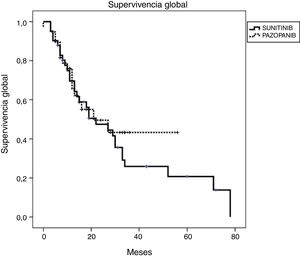
Resultados de eficacia y supervivenciaLa mediana del tiempo de seguimiento fue de 18 y 13 meses para los grupos SUN y PAZ, respectivamente (p=0,21). En el grupo SUN, el 73% de los pacientes presentó progresión tumoral y el 73% de estos murió, mientras que en el grupo PAZ, el 50% de los pacientes fueron identificados con progresión tumoral y el 45% de ellos murió (p=0,08). La tasa de respuesta objetiva fue del 34 y y el 37% (p=0,96) y la tasa de control de la enfermedad fue del 78 y el 87% (p=0,046) para los grupos SUN y PAZ, respectivamente. La mediana de SLP fue de 8 meses (IC 95% 6,9-9,1) en pacientes tratados con SUN y de 8 meses (IC 95% 6,8-9,2) en pacientes tratados con PAZ (p=0,83). La mediana de SG fue de 22 (IC 95% 9,5-34,5) meses en el grupo SUN y de 21 (IC 95% 3,4-38,6) meses en el grupo PAZ (p=0,53). (tabla 4, figuras 1 y 2)
Resultados de eficacia y supervivencia
| SUN | PAZ | |
|---|---|---|
| Seguimiento en meses, mediana (rango) | 18 (3-78) | 13 (4-56) |
| TRG (RC+RP), % | 34 | 37 |
| TCE (RC+RP+EE), % | 78 | 87* |
| Progresión, % (n) | 73 (30) | 50 (19) |
| SLP en meses, mediana (IC 95%) | 8 (6,94-9,06) | 8 (6,78-9,22) |
| SG en meses, mediana (IC 95%) | 22 (9,47-34,53) | 21 (3,40-38,60) |
EE: enfermedad estable; IC 95%: intervalo de confianza del 95%; PAZ: pazopanib; RC: respuesta completa; RP: respuesta parcial; SG: supervivencia global; SLP: supervivencia libre de progresión; SUN: sunitinib; TCE: tasa de control de la enfermedad; TRG: tasa de respuesta global.
Estos son los primeros datos reales sobre la eficacia y la toxicidad de nuestros pacientes con CCRm tratados con SUN o PAZ en Turquía. Los pacientes con PAZ tuvieron una mediana de SLP de 8 meses y una mediana de SG de 21 meses, mientras que para los pacientes con SUN, la mediana de SLP fue de 8 meses y la de SG, de 22 meses. En el grupo SUN hubo más pacientes con metástasis óseas en comparación con PAZ, pero no tuvo impacto en los análisis de supervivencia. No hubo diferencias entre ambos grupos en cuanto a la mediana de SLP y de SG.
Nuestros resultados de SG fueron menores en comparación con las tasas de supervivencia del estudio COMPARZ, cuyos análisis de supervivencia, revisados e interpretados de manera independiente, mostraron una mediana de SLP/SG de 8,4/28,4 meses para PAZ y de 9,5/29,3 meses para SUN, respectivamente5. Sin embargo, es muy difícil comparar estos 2 estudios, especialmente si se consideran las características de los pacientes. En el nuestro, los pacientes no fueron seleccionados de la misma manera que para ensayos clínicos. El 20% de ellos tenía metástasis cerebral y el 17% tenía histología diferente a célula clara. También incluimos en nuestro estudio a pacientes con puntuación de bajo rendimiento. Además, la mitad de los pacientes presentaba comorbilidades. Todas estas características desfavorables podrían comprometer los resultados de nuestra tasa de SG, pero ambos medicamentos controlaron la enfermedad en períodos similares a los del COMPARZ.
Recientemente se publicaron 2 estudios retrospectivos de grandes cohortes comparando la supervivencia entre SUN y PAZ en el tratamiento de CCRm en la práctica real. El primer ensayo, el Consorcio Internacional de Base de Datos de Carcinoma de Células Renales Metastásico, que incluye información retrospectiva de pacientes no seleccionados provenientes de 29 centros oncológicos diferentes, informó una mediana de SG similar (22,3 vs. 22,6 meses) y una mediana de SLP de 8,4 vs. 8,3 meses para SUN y PAZ, respectivamente. El porcentaje de histología diferente a célula clara fue de casi la mitad (10/7 vs. 20/13%) con respecto al de nuestro estudio. Además, el porcentaje de pacientes con Karnofsky<80 fue del 13/14%, mientras que el ECOG 2 y 3 fue de 29/24% en nuestros grupos SUN/PAZ7. A pesar de estas diferencias, los resultados de supervivencia informados fueron comparables con los nuestros. El otro ensayo retrospectivo fue el canadiense publicado por Lalani et al. En este estudio, los investigadores mostraron que los pacientes tratados con SUN mejoraban la SG en comparación con PAZ (mediana de 31,7 vs. 20,6 meses; p=0,028). En su cohorte, los pacientes tratados con SUN eran en su mayoría más jóvenes y con una mejor puntuación de rendimiento que los del grupo PAZ. Los autores afirman que la mejora en la SG podría estar relacionada con la selección de los pacientes y el uso de diferentes regímenes de SUN en su práctica habitual8. Actualmente hay estudios que introducen regímenes alternos para mantener a los pacientes el mayor tiempo posible con el tratamiento9–11. Estos regímenes alternos podrían promover un pronóstico favorable al disminuir los eventos adversos causados por SUN. Recientemente hemos comenzado a ofrecer diferentes regímenes de SUN o a cambiar a regímenes alternos, pero en este estudio solo se realizó una reducción de la dosis dependiendo del grado del evento tóxico.
Como los resultados de eficacia de estos 2 ITC son similares, el perfil de seguridad ha cobrado una mayor relevancia en la práctica clínica habitual. Los efectos secundarios de estos medicamentos son bastante diferentes al perfil de los de la quimioterapia a los que estamos acostumbrados. En el caso de SUN y PAZ, los efectos secundarios emergentes durante la terapia no se superan, debido a que estos medicamentos se toman de manera continua. Esta situación afecta negativamente tanto a la calidad de vida del paciente como al grado de cumplimiento terapéutico. Por lo tanto, es crucial distinguir las toxicidades sintomáticas y asintomáticas y manejarlas consecuentemente. En nuestro trabajo observamos tasas más altas del síndrome mano-pie, mucositis, trombocitopenia e hipotiroidismo con SUN, y mayores alteraciones en la función hepática con PAZ. Inicialmente no hubo diferencias en el número total de eventos tóxicos entre SUN y PAZ, pero al estudiar los resultados en detalle, vimos que la toxicidad sintomática y asintomática de grado 3-4 fue significativamente mayor con SUN. En concreto, la anemia de grado 3-4, la fatiga de grado 3-4 y el hipotiroidismo fueron más prevalentes en el grupo SUN.
En el ensayo COMPARZ, se encontraron efectos secundarios de grado 3-4 con mayor frecuencia, los cuales afectaban a la comodidad de los pacientes, como fatiga, síndrome mano-pie y mucositis. Otras anormalidades de laboratorio de grado 3-4, como anemia, trombocitopenia y neutropenia, aumentaron significativamente en el grupo SUN. También hubo más pacientes con hipotiroidismo en el grupo SUN, pero la diferencia entre los 2 medicamentos no fue estadísticamente significativa. Los investigadores detectaron un aumento significativo en la monitorización de la función hepática de grado 3-45. Recientemente se publicó otro ensayo que analizaba el perfil de seguridad de las subpoblaciones asiáticas vs. no asiáticas, utilizando los datos de COMPARZ. En este estudio se encontraron mayores incidencias de hipertensión, toxicidad hematológica, pruebas anormales de la función hepática y renal, y síndrome mano-pie en pacientes asiáticos. Por el contrario, en pacientes no asiáticos se observaron efectos secundarios gastrointestinales, dolor de cabeza y disnea con el tratamiento de ITC. Entre los pacientes asiáticos, el grupo tratado con SUN experimentó más toxicidad hematológica y no hematológica que el grupo tratado con PAZ12. Powles et al. también informaron una toxicidad sintomática más grave, como fatiga y mucositis, en el grupo SUN13. Se obtuvieron resultados similares en nuestro estudio en Turquía, que se encuentra en una región de paso entre Europa y Asia. Pero a diferencia de estudios previos, los efectos secundarios de nuestros pacientes del grupo PAZ con pruebas de función hepática elevada a menudo se evaluaron como toxicidad de grado 1-2, lo que es consistente con los resultados de otro estudio de Corea del Sur14. Los investigadores de Canadá observaron menos fatiga con SUN y relacionaron este hecho con el régimen alterno de SUN8.
En nuestro ensayo, los pacientes tratados con SUN tuvieron una reducción de dosis significativamente mayor (49%) en comparación con PAZ (24%). Sin embargo, la reducción de la dosis fue similar para SUN (51%) y PAZ (44%) en el COMPARZ5. También en otro informe que analiza la seguridad de SUN y PAZ en subpoblaciones asiáticas y no asiáticas, los autores informaron una reducción o interrupción de la dosis ligeramente mayor en la población asiática en comparación con la población no asiática, pero las tasas de reducción de dosis para SUN y PAZ fueron similares en las poblaciones asiáticas y no asiáticas12. También se informaron tasas de interrupción relativamente altas debido a eventos adversos entre la población de pacientes no asiáticos y los pacientes canadienses en PAZ8,12. Sin embargo, la interrupción de SUN debido a eventos adversos se observó un poco más en nuestro estudio, como en el informe de Powles et al. Esta toxicidad heterogénea entre grupos étnicos puede deberse al polimorfismo genético en la farmacocinética y la farmacodinamia de los ITC15. Conocer estos efectos secundarios en diferentes poblaciones de pacientes es particularmente importante. Como se puede ver en los resultados de estudios previos, existe una necesidad urgente de un manejo adecuado de estos efectos para lograr mejores pronósticos. La literatura indica que existe una correlación positiva entre la concentración plasmática de ITC y los resultados16.
Este estudio tiene algunas limitaciones debido a su naturaleza retrospectiva. El tamaño pequeño de la muestra y los datos incompletos sobre la puntuación del Memorial Sloan Kettering Cancer Center en el grupo SUN hacen que los resultados se deban interpretar con cautela. Dado que los médicos tienden a centrarse más en los efectos secundarios que perjudican la comodidad del paciente durante las visitas, la documentación exhaustiva de los efectos secundarios ha sido limitada en nuestros gráficos. Algunos, como el gusto alterado, no están reportados. A pesar de estas limitaciones, los pacientes fueron incluidos en este estudio de forma consecutiva. El tamaño de la muestra en ambos grupos de tratamiento fue bastante equilibrado. La población de pacientes fue heterogénea en ambos grupos de tratamiento, lo que refleja nuestra práctica clínica real. Hemos obtenido información de las gráficas sobre los efectos secundarios, lo que podría guiar nuestra elección de tratamiento en la práctica clínica real.
En conclusión, SUN y PAZ tuvieron una eficacia similar en términos de resultados de supervivencia, pero el perfil de efectos secundarios favoreció al tratamiento con PAZ en nuestra población de pacientes heterogéneos no seleccionados con CCRm. Sin embargo, estos datos no son suficientes para hacer una recomendación específica respecto a la elección adecuada de la terapia de primera línea en CCRm. Esto se debe a que el régimen alterno de SUN o la dosificación individualizada de ITC no se han evaluado en el presente estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.