La pandemia de COVID-19 alteró significativamente el acceso a la atención sanitaria a nivel mundial. Pocos estudios han evaluado si la pandemia afectó negativamente a los pacientes con tumores malignos de cabeza y cuello diagnosticados durante este periodo. Este estudio se propone determinar si existieron diferencias en los resultados oncológicos entre los pacientes diagnosticados durante la pandemia de COVID-19 y aquellos diagnosticados previamente.
Material y métodosSe realizó un estudio retrospectivo en pacientes con tumores malignos de cabeza y cuello diagnosticados durante la pandemia y en los cinco años anteriores en un centro terciario.
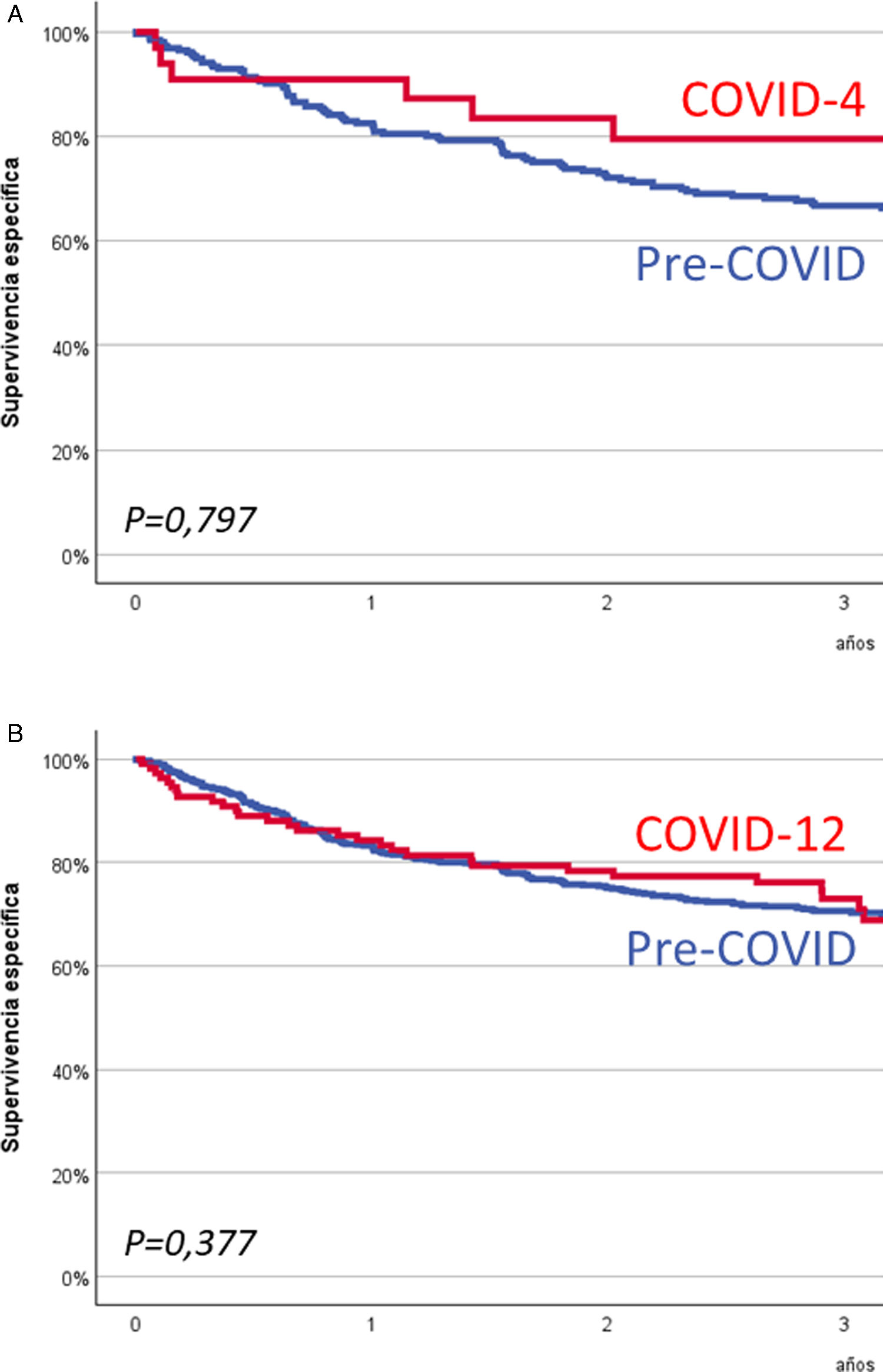
ResultadosLa cohorte analizada incluyó 872 pacientes diagnosticados entre marzo de 2015 y febrero de 2022. El menor número de diagnósticos ocurrió durante el trimestre que denominamos COVID-4 (marzo de 2020 a junio de 2020), coincidiendo con la fase más estricta del confinamiento. No hubo cambios significativos en las características de los pacientes ni en el tipo de tratamiento recibido debido a la pandemia. No se observaron diferencias significativas en la supervivencia específica a los 3años entre los pacientes diagnosticados y tratados durante el periodo COVID-12 (marzo de 2020 a febrero de 2021, 73,0% de supervivencia) y los tratados durante los cinco años anteriores (marzo de 2015 a febrero de 2020, 70,6% de supervivencia, p=0,377).
ConclusionesLa pandemia de COVID-19 condujo a una disminución en el número de diagnósticos de tumores malignos de cabeza y cuello durante la fase de confinamiento más estricto. Sin embargo, no se observaron diferencias significativas en los resultados oncológicos como consecuencia de la pandemia.
The COVID-19 pandemic significantly affected healthcare access worldwide. Few studies have analyzed whether the pandemic negatively impacted patients with head and neck malignant tumors diagnosed during this period. This study aims to determine if there were differences in oncological outcomes between patients diagnosed during the pandemic and those diagnosed previously.
Material and methodsA retrospective study was conducted on patients with malignant head and neck tumors diagnosed during the pandemic and the previous five years at a tertiary center.
ResultsThe study cohort included 872 patients diagnosed between March 2018 and February 2022. The quarter with the fewest diagnoses was the COVID-4 period (March-2020 to June-2020), coinciding with the strictest lockdown phases. There were no significant changes in patient characteristics or treatment types due to the pandemic. No significant differences in 3-year disease-specific survival were observed between patients diagnosed and treated during the COVID period (March-2020 to February-2021, disease-specific survival 73.0%) and those treated during the previous five years (March-2015 to February-2020, disease-specific survival 70.6%, P=.377).
ConclusionsThe COVID-19 pandemic led to a decrease in the number of diagnoses of malignant head and neck tumors during the strictest lockdown phases in our country. However, no statistically significant differences in oncological outcomes were observed as a consequence of the pandemic.
La pandemia de COVID-19 alteró de manera significativa el acceso a los servicios sanitarios, afectando notablemente el diagnóstico y tratamiento de los tumores malignos, especialmente durante la primera ola de la pandemia1,2. Aunque se han publicado estudios que analizan los cambios en la incidencia diagnóstica y el tratamiento de los pacientes con carcinoma de cabeza y cuello (CECC) debido a la pandemia (revisado en Pinto Pereira et al.3), pocos han evaluado los cambios en la supervivencia de los pacientes diagnosticados y tratados durante la fase más aguda de la pandemia.
El objetivo de este estudio es analizar la existencia de diferencias en las características de los pacientes, el manejo terapéutico y el control de la enfermedad de los pacientes con tumores malignos de cabeza y cuello durante la pandemia de COVID-19 en un hospital terciario en España.
Material y métodosLlevamos a cabo un estudio observacional retrospectivo a partir de la información incluida en una base de datos que recoge de forma prospectiva las características clínicas, oncológicas y de tratamiento de la totalidad de pacientes con un tumor maligno de cabeza y cuello tratados en nuestro servicio desde el año 19854.
El primer estado de alarma se decretó en España el 14 de marzo del 2020 y se mantuvo hasta el 21 de junio del 2020. Posteriormente se decretaron dos nuevos periodos de estado de alarma, que finalizaron el 9 de mayo del 2021.
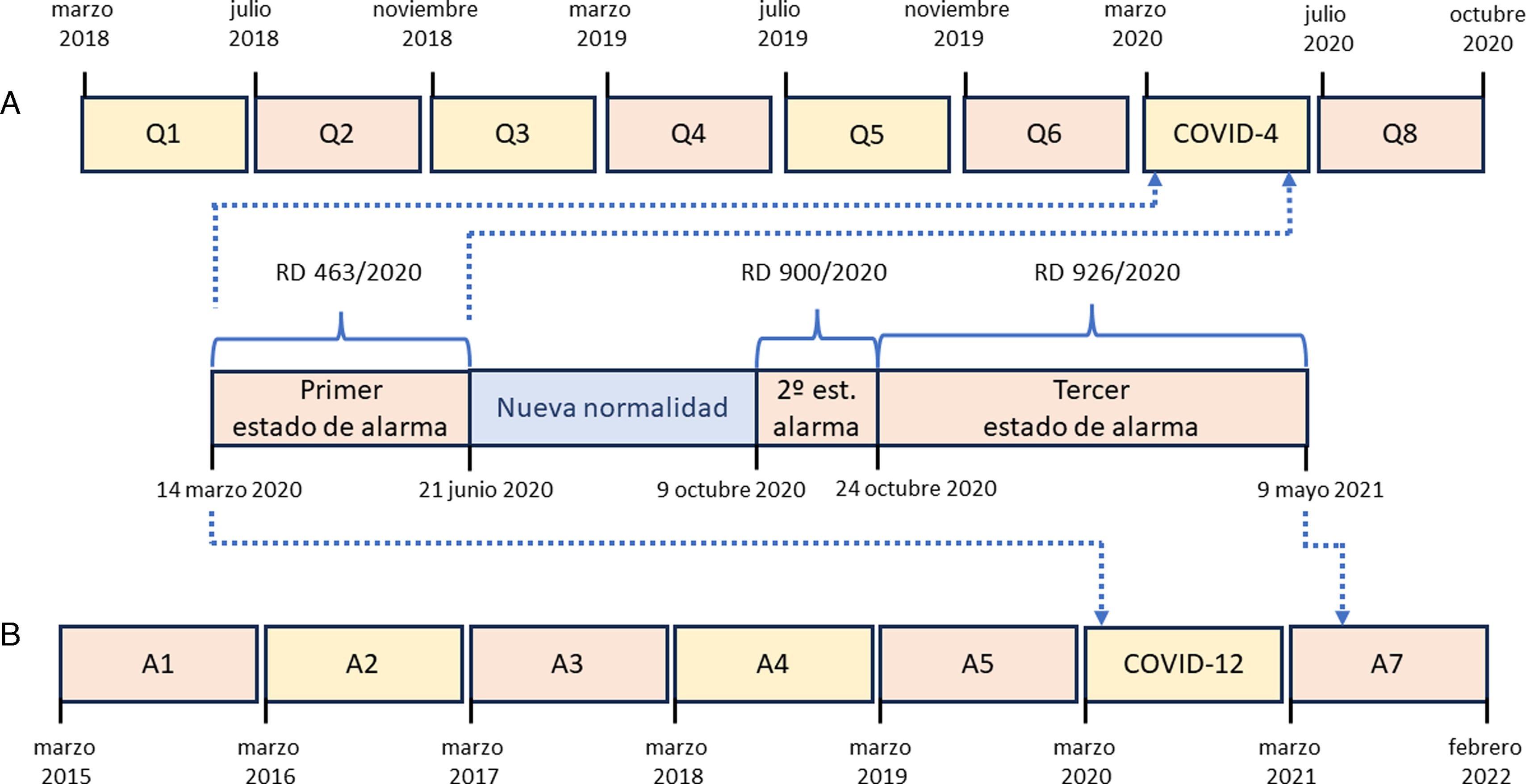
Con el objetivo de analizar las características de los pacientes diagnosticados y tratados durante la fase de mayor interferencia en la actividad sanitaria, analizamos el cuatrimestre marzo de 2020 a junio de 2020, que fue el periodo en el que se produjo en España la fase de confinamiento, y que coincidió con el primer estado de alarma, periodo que denominados COVID-4. El cuatrimestre COVID-4 se comparó con periodos cuatrimestrales de los 2años previos, comprendidos entre marzo de 2018 y febrero de 2020. Estos cuatrimestres recibieron una denominación de Q1 (marzo de 2018 a junio de 2018) a Q6 (noviembre de 2019 a febrero de 2020). Se incluyó además en esta parte del estudio a los pacientes diagnosticados en el cuatrimestre posterior al periodo COVID-4, que denominamos Q8 (julio de 2020 a octubre de 2020). La figura 1A esquematiza la cronología de los periodos cuatrimestrales analizados.
Esquema de los periodos de tiempo cuatrimestrales (A) y anuales (B) analizados.
A: periodos anuales; COVID-4: periodo comprendido entre el 1/03/2020 y el 30/06/2020, que incluyó el estado de alarma con confinamiento; COVID-12: periodo comprendido entre el 1/03/2020 y el 29/02/2020, que incluyó la mayoría de los tres estados de alarma decretados por el Gobierno de España; Q: periodos cuatrimestrales; RD: real decreto.
Por otra parte, analizamos el periodo anual comprendido entre marzo de 2020 y febrero de 2021, que incluyó la mayor parte de los tres estados de alarma decretados y un periodo intermedio denominado de «Nueva normalidad», periodo que denominamos COVID-12. El periodo anual COVID-12 se comparó con periodos anuales de los 5años anteriores, entre marzo de 2015 y febrero de 2020, y el año posterior, entre marzo de 2021 y febrero de 2022. Estos periodos recibieron una denominación de A1 (marzo de 2015 a febrero de 2016) a A5 (marzo de 2019 a febrero de 2020) y A7 (marzo de 2021 a febrero de 2022). La figura 1B esquematiza la cronología de los periodos anuales analizados.
Se evaluó la incidencia de nuevos tumores malignos de cabeza y cuello, las características epidemiológicas (edad, sexo), las características tumorales (localización, extensión, histología) y el tipo de tratamiento realizado. Todas estas variables se analizaron considerando tanto los periodos cuatrimestrales como los anuales. La clasificación de la extensión tumoral se realizó según la versión TNM vigente al diagnóstico. El tratamiento se clasificó como paliativo (incluyendo los pacientes tratados exclusivamente con quimioterapia o tratamiento de soporte), quirúrgico (incluyendo los pacientes tratados con radioterapia o quimio-radioterapia postoperatoria) o radioterápico (incluyendo a los pacientes tratados con quimio-radioterapia o bio-radioterapia). La histología se categorizó en función de si los pacientes presentaban un carcinoma escamoso, un tumor maligno de glándula salival, o bien otro tipo de tumor maligno de cabeza y cuello.
Durante la totalidad del periodo analizado (marzo de 2015 a febrero de 2022) se diagnosticaron y trataron en nuestro centro un total de 872 tumores malignos de cabeza y cuello. La tabla 1 del material suplementario muestra las características de los pacientes.
Para evaluar si la pandemia tuvo una repercusión sobre los resultados oncológicos, se comparó la supervivencia global y específica de los pacientes diagnosticados durante el periodo prepandémico (Q1 a Q6 y A1 a A5) con los pacientes diagnosticados durante el periodo pandémico (COVID-4 y COVID-12). De esta parte del estudio se excluyeron 7 pacientes que, en ausencia de recidiva de la enfermedad, no contaron con un periodo mínimo de seguimiento de 2años. El estudio de supervivencia se realizó en una cohorte de 759 pacientes, con un seguimiento mínimo de dos años.
De forma adicional, se analizó la supervivencia libre de enfermedad, definida como el periodo de tiempo libre de recidiva local, regional o a distancia tras el tratamiento del tumor. En este estudio de la supervivencia libre de enfermedad se incluyeron solo los 657 pacientes tratados con intención radical.
La comparación entre variables cualitativas se realizó con el test de chi-cuadrado o la prueba exacta de Fisher, dependiendo de las condiciones de aplicación. Se comparó la incidencia de nuevos pacientes con tumores malignos de cabeza y cuello en función de la cronología con un estudio de regresión lineal. El análisis de la edad de los pacientes en función del periodo de tiempo se llevó a cabo con un test de ANOVA. Las curvas de supervivencia se estimaron con el método de Kaplan-Meier, utilizando el test log-rank en la comparación de las curvas de supervivencia.
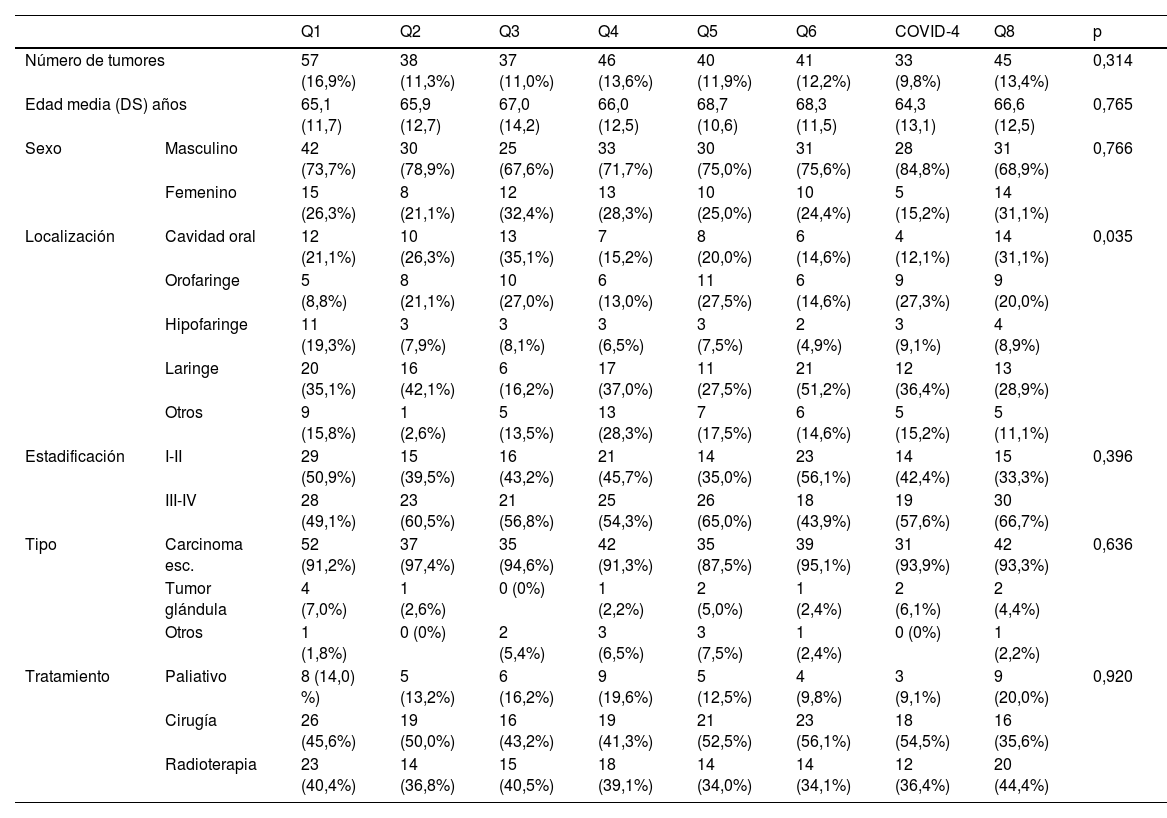
ResultadosLa tabla 1 muestra la incidencia de nuevos tumores y sus características teniendo en cuenta los periodos cuatrimestrales entre marzo de 2018 y octubre de 2020. El trimestre en el que se diagnosticó un menor número de nuevos tumores fue el correspondiente al periodo COVID-4, coincidiendo con el primer estado de alarma. No aparecieron diferencias significativas en las características de los pacientes diagnosticados a lo largo del periodo de estudio, salvo en la distribución de la localización primaria del tumor. Los pacientes diagnosticados durante el periodo COVID-4 no difirieron en cuanto a la extensión del tumor o el tipo de tratamiento en relación con el resto de pacientes. Si bien el menor número de pacientes diagnosticados en un cuatrimestre se correspondió con el periodo COVID-4, no aparecieron diferencias estadísticamente significativas en el número de pacientes en función de los cuatrimestres analizados (p=0,314). Durante el cuatrimestre COVID-4 se diagnosticaron 33 nuevos tumores, con una incidencia mensual de 10 en marzo, 4 en abril, 8 en mayo y 11 en junio.
Incidencia de nuevos tumores malignos de cabeza y cuello en función de los periodos cuatrimestrales
| Q1 | Q2 | Q3 | Q4 | Q5 | Q6 | COVID-4 | Q8 | p | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Número de tumores | 57 (16,9%) | 38 (11,3%) | 37 (11,0%) | 46 (13,6%) | 40 (11,9%) | 41 (12,2%) | 33 (9,8%) | 45 (13,4%) | 0,314 | |
| Edad media (DS) años | 65,1 (11,7) | 65,9 (12,7) | 67,0 (14,2) | 66,0 (12,5) | 68,7 (10,6) | 68,3 (11,5) | 64,3 (13,1) | 66,6 (12,5) | 0,765 | |
| Sexo | Masculino | 42 (73,7%) | 30 (78,9%) | 25 (67,6%) | 33 (71,7%) | 30 (75,0%) | 31 (75,6%) | 28 (84,8%) | 31 (68,9%) | 0,766 |
| Femenino | 15 (26,3%) | 8 (21,1%) | 12 (32,4%) | 13 (28,3%) | 10 (25,0%) | 10 (24,4%) | 5 (15,2%) | 14 (31,1%) | ||
| Localización | Cavidad oral | 12 (21,1%) | 10 (26,3%) | 13 (35,1%) | 7 (15,2%) | 8 (20,0%) | 6 (14,6%) | 4 (12,1%) | 14 (31,1%) | 0,035 |
| Orofaringe | 5 (8,8%) | 8 (21,1%) | 10 (27,0%) | 6 (13,0%) | 11 (27,5%) | 6 (14,6%) | 9 (27,3%) | 9 (20,0%) | ||
| Hipofaringe | 11 (19,3%) | 3 (7,9%) | 3 (8,1%) | 3 (6,5%) | 3 (7,5%) | 2 (4,9%) | 3 (9,1%) | 4 (8,9%) | ||
| Laringe | 20 (35,1%) | 16 (42,1%) | 6 (16,2%) | 17 (37,0%) | 11 (27,5%) | 21 (51,2%) | 12 (36,4%) | 13 (28,9%) | ||
| Otros | 9 (15,8%) | 1 (2,6%) | 5 (13,5%) | 13 (28,3%) | 7 (17,5%) | 6 (14,6%) | 5 (15,2%) | 5 (11,1%) | ||
| Estadificación | I-II | 29 (50,9%) | 15 (39,5%) | 16 (43,2%) | 21 (45,7%) | 14 (35,0%) | 23 (56,1%) | 14 (42,4%) | 15 (33,3%) | 0,396 |
| III-IV | 28 (49,1%) | 23 (60,5%) | 21 (56,8%) | 25 (54,3%) | 26 (65,0%) | 18 (43,9%) | 19 (57,6%) | 30 (66,7%) | ||
| Tipo | Carcinoma esc. | 52 (91,2%) | 37 (97,4%) | 35 (94,6%) | 42 (91,3%) | 35 (87,5%) | 39 (95,1%) | 31 (93,9%) | 42 (93,3%) | 0,636 |
| Tumor glándula | 4 (7,0%) | 1 (2,6%) | 0 (0%) | 1 (2,2%) | 2 (5,0%) | 1 (2,4%) | 2 (6,1%) | 2 (4,4%) | ||
| Otros | 1 (1,8%) | 0 (0%) | 2 (5,4%) | 3 (6,5%) | 3 (7,5%) | 1 (2,4%) | 0 (0%) | 1 (2,2%) | ||
| Tratamiento | Paliativo | 8 (14,0) %) | 5 (13,2%) | 6 (16,2%) | 9 (19,6%) | 5 (12,5%) | 4 (9,8%) | 3 (9,1%) | 9 (20,0%) | 0,920 |
| Cirugía | 26 (45,6%) | 19 (50,0%) | 16 (43,2%) | 19 (41,3%) | 21 (52,5%) | 23 (56,1%) | 18 (54,5%) | 16 (35,6%) | ||
| Radioterapia | 23 (40,4%) | 14 (36,8%) | 15 (40,5%) | 18 (39,1%) | 14 (34,0%) | 14 (34,1%) | 12 (36,4%) | 20 (44,4%) | ||
DE: desviación estándar.
Entre paréntesis aparece el porcentaje de los pacientes considerando las filas en el caso del número de tumores, y las columnas en el resto de las variables analizadas.
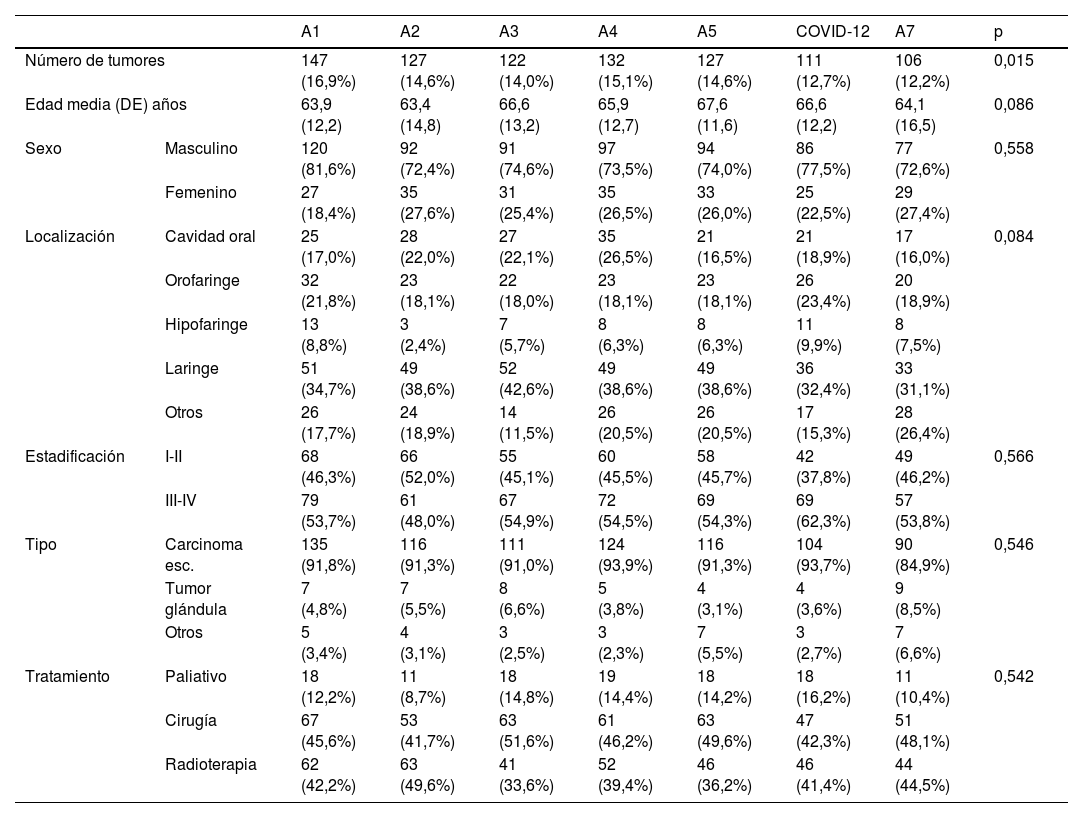
La tabla 2 presenta los resultados obtenidos al analizar los pacientes de acuerdo con periodos de tiempo anuales. Se observó una tendencia significativa a la disminución en el número de diagnósticos anuales durante el periodo analizado (p=0,015). No aparecieron diferencias significativas en función del periodo anual para el resto de las variables analizadas.
Incidencia de nuevos tumores malignos de cabeza y cuello en función de los periodos anuales
| A1 | A2 | A3 | A4 | A5 | COVID-12 | A7 | p | ||
|---|---|---|---|---|---|---|---|---|---|
| Número de tumores | 147 (16,9%) | 127 (14,6%) | 122 (14,0%) | 132 (15,1%) | 127 (14,6%) | 111 (12,7%) | 106 (12,2%) | 0,015 | |
| Edad media (DE) años | 63,9 (12,2) | 63,4 (14,8) | 66,6 (13,2) | 65,9 (12,7) | 67,6 (11,6) | 66,6 (12,2) | 64,1 (16,5) | 0,086 | |
| Sexo | Masculino | 120 (81,6%) | 92 (72,4%) | 91 (74,6%) | 97 (73,5%) | 94 (74,0%) | 86 (77,5%) | 77 (72,6%) | 0,558 |
| Femenino | 27 (18,4%) | 35 (27,6%) | 31 (25,4%) | 35 (26,5%) | 33 (26,0%) | 25 (22,5%) | 29 (27,4%) | ||
| Localización | Cavidad oral | 25 (17,0%) | 28 (22,0%) | 27 (22,1%) | 35 (26,5%) | 21 (16,5%) | 21 (18,9%) | 17 (16,0%) | 0,084 |
| Orofaringe | 32 (21,8%) | 23 (18,1%) | 22 (18,0%) | 23 (18,1%) | 23 (18,1%) | 26 (23,4%) | 20 (18,9%) | ||
| Hipofaringe | 13 (8,8%) | 3 (2,4%) | 7 (5,7%) | 8 (6,3%) | 8 (6,3%) | 11 (9,9%) | 8 (7,5%) | ||
| Laringe | 51 (34,7%) | 49 (38,6%) | 52 (42,6%) | 49 (38,6%) | 49 (38,6%) | 36 (32,4%) | 33 (31,1%) | ||
| Otros | 26 (17,7%) | 24 (18,9%) | 14 (11,5%) | 26 (20,5%) | 26 (20,5%) | 17 (15,3%) | 28 (26,4%) | ||
| Estadificación | I-II | 68 (46,3%) | 66 (52,0%) | 55 (45,1%) | 60 (45,5%) | 58 (45,7%) | 42 (37,8%) | 49 (46,2%) | 0,566 |
| III-IV | 79 (53,7%) | 61 (48,0%) | 67 (54,9%) | 72 (54,5%) | 69 (54,3%) | 69 (62,3%) | 57 (53,8%) | ||
| Tipo | Carcinoma esc. | 135 (91,8%) | 116 (91,3%) | 111 (91,0%) | 124 (93,9%) | 116 (91,3%) | 104 (93,7%) | 90 (84,9%) | 0,546 |
| Tumor glándula | 7 (4,8%) | 7 (5,5%) | 8 (6,6%) | 5 (3,8%) | 4 (3,1%) | 4 (3,6%) | 9 (8,5%) | ||
| Otros | 5 (3,4%) | 4 (3,1%) | 3 (2,5%) | 3 (2,3%) | 7 (5,5%) | 3 (2,7%) | 7 (6,6%) | ||
| Tratamiento | Paliativo | 18 (12,2%) | 11 (8,7%) | 18 (14,8%) | 19 (14,4%) | 18 (14,2%) | 18 (16,2%) | 11 (10,4%) | 0,542 |
| Cirugía | 67 (45,6%) | 53 (41,7%) | 63 (51,6%) | 61 (46,2%) | 63 (49,6%) | 47 (42,3%) | 51 (48,1%) | ||
| Radioterapia | 62 (42,2%) | 63 (49,6%) | 41 (33,6%) | 52 (39,4%) | 46 (36,2%) | 46 (41,4%) | 44 (44,5%) | ||
DE: desviación estándar.
Entre paréntesis aparece el porcentaje de los pacientes considerando las filas en el caso del número de tumores, y las columnas en el resto de las variables analizadas.
Un total de 759 pacientes fueron incluidos en el estudio de supervivencia. De los 657 pacientes tratados con intención radical, 127 (19,3%) tuvieron una recidiva local, 83 (12,6%), una recidiva regional, y 75 (11,4%), metástasis a distancia. De los 102 pacientes tratados con intención paliativa, 99 habían fallecido en el momento del cierre del estudio, con una mediana de supervivencia de 0,4 años, y 3 se encontraban vivos con enfermedad.
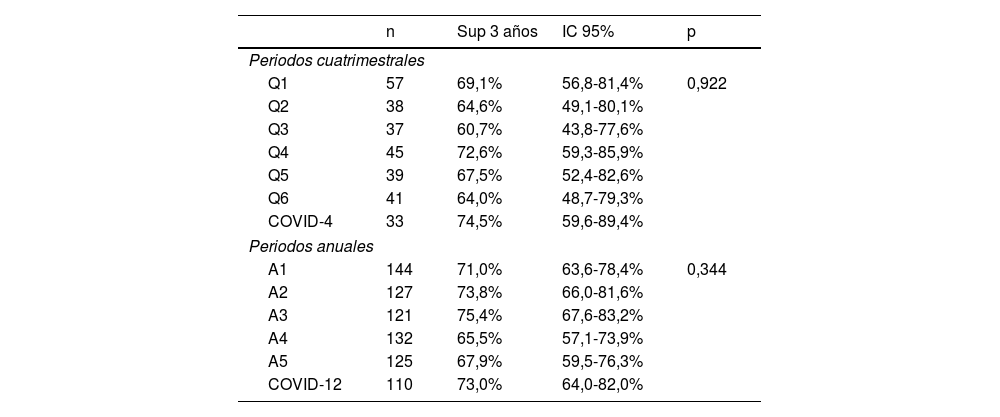
La tabla 3 muestra la supervivencia específica a los 3años de los pacientes incluidos en el estudio de supervivencia considerando tanto los periodos cuatrimestrales como los anuales. No aparecieron diferencias significativas en la supervivencia específica al considerar los periodos cuatrimestrales (p=0,922) o anuales (p=0,344). La figura 2 muestra las curvas de supervivencia específica de los pacientes diagnosticados durante los periodos COVID-4 y COVID-12 en comparación a las obtenidas al analizar de forma conjunta los pacientes tratados previamente (Q1 a Q6 y A1 a A5). En la tabla 2 del material suplementario se muestra la supervivencia global a los 3años en función de la cronología. Al igual que en el caso de la supervivencia específica, no aparecieron diferencias significativas en la supervivencia global al analizar los periodos cuatrimestrales (p=0,920) o los periodos anuales (p=0,600).
Supervivencia específica a los 3 años considerando los periodos cuatrimestrales (n=290) o anuales (n=759)
| n | Sup 3 años | IC 95% | p | |
|---|---|---|---|---|
| Periodos cuatrimestrales | ||||
| Q1 | 57 | 69,1% | 56,8-81,4% | 0,922 |
| Q2 | 38 | 64,6% | 49,1-80,1% | |
| Q3 | 37 | 60,7% | 43,8-77,6% | |
| Q4 | 45 | 72,6% | 59,3-85,9% | |
| Q5 | 39 | 67,5% | 52,4-82,6% | |
| Q6 | 41 | 64,0% | 48,7-79,3% | |
| COVID-4 | 33 | 74,5% | 59,6-89,4% | |
| Periodos anuales | ||||
| A1 | 144 | 71,0% | 63,6-78,4% | 0,344 |
| A2 | 127 | 73,8% | 66,0-81,6% | |
| A3 | 121 | 75,4% | 67,6-83,2% | |
| A4 | 132 | 65,5% | 57,1-73,9% | |
| A5 | 125 | 67,9% | 59,5-76,3% | |
| COVID-12 | 110 | 73,0% | 64,0-82,0% | |
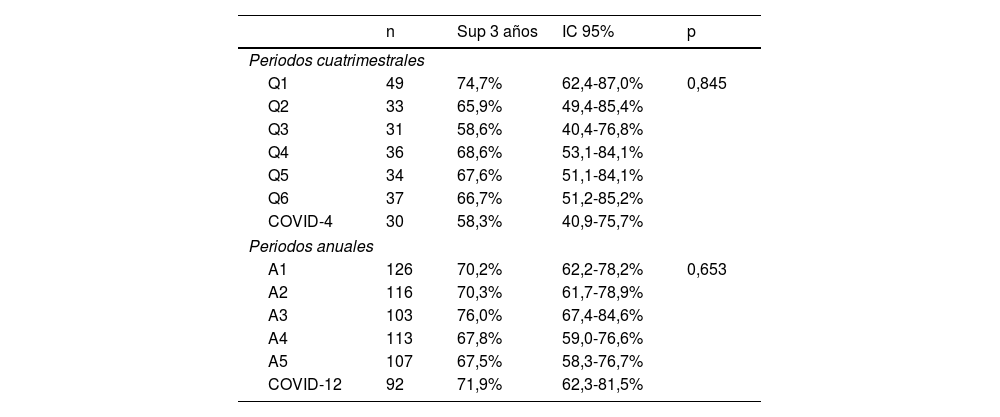
La tabla 4 muestra la supervivencia libre de enfermedad a los 3años para el grupo de pacientes que fueron tratados con intención radical (n=657). No aparecieron diferencias significativas en la supervivencia libre de enfermedad al analizar los periodos cuatrimestrales (p=0,845) o anuales (p=0,653).
Supervivencia libre de enfermedad a los 3 años considerando los periodos cuatrimestrales (n=250) o anuales (n=657) para los pacientes tratados con intención radical
| n | Sup 3 años | IC 95% | p | |
|---|---|---|---|---|
| Periodos cuatrimestrales | ||||
| Q1 | 49 | 74,7% | 62,4-87,0% | 0,845 |
| Q2 | 33 | 65,9% | 49,4-85,4% | |
| Q3 | 31 | 58,6% | 40,4-76,8% | |
| Q4 | 36 | 68,6% | 53,1-84,1% | |
| Q5 | 34 | 67,6% | 51,1-84,1% | |
| Q6 | 37 | 66,7% | 51,2-85,2% | |
| COVID-4 | 30 | 58,3% | 40,9-75,7% | |
| Periodos anuales | ||||
| A1 | 126 | 70,2% | 62,2-78,2% | 0,653 |
| A2 | 116 | 70,3% | 61,7-78,9% | |
| A3 | 103 | 76,0% | 67,4-84,6% | |
| A4 | 113 | 67,8% | 59,0-76,6% | |
| A5 | 107 | 67,5% | 58,3-76,7% | |
| COVID-12 | 92 | 71,9% | 62,3-81,5% | |
Un 91,3% de los tumores diagnosticados y tratados durante el periodo de estudio fueron carcinomas escamosos. La tabla 3 del material suplementario muestra la supervivencia específica a los 3años de los pacientes con un carcinoma escamoso en función de los periodos cuatrimestrales y anuales. No aparecieron diferencias significativas en función del periodo cuatrimestral o anual para supervivencia específica (p=0,803 y p=0,343).
DiscusiónDe acuerdo con nuestros resultados, no se produjeron modificaciones significativas en las características de los tumores, en el tipo de tratamiento realizado o en la supervivencia de los pacientes con tumores malignos de cabeza y cuello diagnosticados durante la fase más aguda de la época COVID, entre marzo de 2020 y mayo de 2021. La única variación sustancial fue la disminución en el número de diagnósticos durante la primera ola de la pandemia, lo cual se atribuye a las restricciones de acceso al sistema sanitario impuestas durante el confinamiento.
Diversos estudios han señalado una reducción en la incidencia de pacientes con CECC diagnosticados durante los periodos iniciales de la pandemia2,5,6. Un metaanálisis que analizó el impacto de la pandemia en el tratamiento de pacientes con CECC halló una reducción significativa en el número de cirugías y tratamientos oncológicos durante la era COVID-19 en comparación con el periodo pre-COVID, lo que vendría a reflejar una disminución en el número de pacientes diagnosticados (odds ratio=0,81; IC95%: 0,65-1,00; p=0,05)7.
Yao et al.8 reportaron un aumento en el tiempo hasta el diagnóstico, mientras que Metzger et al.9 señalaron un retraso en el inicio de tratamiento en los pacientes con CECC durante la pandemia COVID-19. Además, como consecuencia de la dificultad en el acceso a la atención sanitaria y el correspondiente retraso en el diagnóstico, algunos autores han descrito un aumento en el porcentaje de pacientes con tumores en estadios avanzados durante el periodo COVID6,10-13. En un estudio canadiense, Gete et al.13 encontraron que, en relación a pacientes pre-pandemia (1 de junio a 31 de diciembre de 2019), el intervalo entre el inicio de los síntomas y el diagnóstico, y el diagnóstico y el inicio del tratamiento, para los pacientes de una cohorte pandémica (1 de junio a 31 de diciembre de 2020) fue significativamente más prolongado, y que la razón de los retrasos fue mayoritariamente (en el 77% de las ocasiones) atribuible a la pandemia.
Sin embargo, otros estudios no han encontrado diferencias en el intervalo entre el diagnóstico y el inicio del tratamiento14 o en la extensión del tumor5,15 en los pacientes diagnosticados durante las fases iniciales de la pandemia, coincidiendo con los confinamientos nacionales.
De acuerdo con una revisión realizada por Clements et al.16 de 23 publicaciones que analizaban pacientes con CECC, en 16 de los estudios no se observaron diferencias significativas en el estadificación de los tumores diagnosticados durante la época pandémica en relación con el periodo pre-pandémico. Sin embargo, al analizar conjuntamente todas las series, el resultado de un metaanálisis mostró que los pacientes diagnosticados durante el periodo pandémico tuvieron una probabilidad un 32% superior de tener un tumor localmente avanzado cT3 o cT4 (odds ratio=1,32; IC95%: 1,08-1,62), un 16% superior de contar con una afectación ganglionar (odds ratio=1,16; IC95%: 1,00-1,35) y un 17% superior de presentar un estadio avanzado (odds ratio=1,17; IC95%: 1,01-1,36).
Algunos investigadores han especulado sobre la posibilidad de que el retraso en el diagnóstico y las modificaciones en los protocolos de tratamiento pudieran reducir la supervivencia de los pacientes diagnosticados y tratados durante las fases iniciales de la pandemia17-19. No obstante, los estudios que han evaluado directamente la supervivencia son escasos. Peacock et al.20 analizaron los datos incluidos en un registro oncológico de ámbito nacional, el Belgian Cancer Registry. De acuerdo con sus resultados, durante el año 2020 en Bélgica se diagnosticaron un 9,5% menos de pacientes con CECC que los previstos, con una tendencia a una reducción en el porcentaje de pacientes con tumores diagnosticados en estadioI y un incremento en estadioIII, especialmente en la segunda mitad del año. Aunque la supervivencia global a 1año fue menor de lo esperado en función de la tendencia obtenida al analizar las supervivencias de los años anteriores, las diferencias no alcanzaron significación estadística (p=0,103). Entre las limitaciones de este estudio destacan que el seguimiento de los pacientes incluidos fue muy corto, y que se aportan tan solo datos de supervivencia global, pero sin considerar la supervivencia específica o libre de enfermedad.
En un estudio muy preliminar realizado por Venkatasai et al.21 se analizaron los resultados obtenidos con radioterapia en pacientes con CECC. Se comparó una cohorte de 51 pacientes pre-COVID con 25 pacientes tratados durante las fases iniciales de la pandemia, coincidiendo con el confinamiento nacional en la India. Los autores no encontraron diferencias en la supervivencia libre de progresión a un año de realizado el tratamiento.
En otro estudio unicéntrico realizado en Estados Unidos en el que se compararon 54 pacientes con un CECC tratados durante la primera fase de la pandemia (1 de marzo a 30 de junio de 2020) con 74 pacientes tratados durante el año 2019, no aparecieron diferencias significativas en la supervivencia global a los 2años (p=0,607) ni en la supervivencia libre de recidiva a los 2años (p=0,136) en función del periodo de tratamiento22.
La mediana de seguimiento de los pacientes incluidos en nuestro estudio diagnosticados a lo largo del periodo COVID-12 fue de 2,84años, con un seguimiento mínimo para la totalidad de los pacientes de 2años. Investigaciones previas sugieren que más del 80% de los fracasos en el tratamiento de CECC ocurren dentro de los dos primeros años23,24. En consecuencia, consideramos que nuestro estudio cuenta con datos lo suficientemente maduros para evaluar los posibles cambios en el control de la enfermedad relacionados con la pandemia.
Al analizar nuestros resultados, la única variable en la que observamos una modificación sustancial relacionada con la pandemia de COVID-19 fue en el número de pacientes diagnosticados. Pudimos observar una reducción notable en el número de pacientes con un tumor maligno de cabeza y cuello durante abril y mayo del 2020, coincidiendo con las fases más estrictas del confinamiento en nuestro país, aunque la reducción en el número total de pacientes diagnosticados en el conjunto del cuatrimestre COVID-4 no difirió de forma estadísticamente significativa en relación con el número de pacientes diagnosticados en el resto de los cuatrimestres analizados.
En relación con la supervivencia o el control de la enfermedad a los 3años, no apreciamos diferencias significativas en los resultados entre el grupo de pacientes diagnosticados y tratados durante el periodo COVID y los obtenidos en pacientes tratados previamente. El posible retraso en el diagnóstico como consecuencia de las limitaciones impuestas por el confinamiento y la dificultad en acceder al sistema público de salud por la pandemia no parece haber influido de forma significativa en la extensión de los tumores diagnosticados ni en los resultados oncológicos. Es posible que este potencial retraso diagnóstico provocado por la pandemia no fuese lo suficientemente extenso para contar con relevancia clínica.
Un elemento a considerar en la valoración de estos resultados es que, al igual que sucedió en el resto de los hospitales de nuestro país, en todo momento en nuestro centro se prestó continuidad al tratamiento oncológico, incluidos los pacientes con tumores malignos de cabeza y cuello. Durante todo el periodo de pandemia mantuvimos los Comités Oncológicos, así como los diferentes tipos de tratamiento, adaptándonos a la situación epidemiológica y a las recomendaciones establecidas por las autoridades sanitarias y las sociedades científicas.
El presente estudio cuenta con una serie de limitaciones asociadas a su carácter retrospectivo. No contamos con información relativa a la duración de los síntomas previos al acceso de los pacientes a nuestro centro, por lo que no podemos analizar ni cuantificar los posibles retrasos en el diagnóstico de los pacientes atribuibles a la situación de pandemia. Además, en nuestra base de datos no se recogió de forma sistemática el estatus en relación con la infección COVID-19 de los pacientes.
Sin embargo, pensamos que aporta una información relevante, recogida de forma prospectiva, lo que asegura la calidad de los datos utilizados, y con un periodo de seguimiento suficiente como para ofrecer una apreciación de los posibles cambios en las características de los tumores y los resultados oncológicos de los pacientes con un tumor maligno de cabeza y cuello durante los periodos más intensos de la pandemia por COVID-19.
ConclusiónLa pandemia de COVID-19 llevó a una reducción en el número de pacientes diagnosticados con un tumor maligno de cabeza y cuello durante las fases más estrictas del confinamiento. Sin embargo, no se produjeron cambios significativos en las características de los pacientes, en los tipos de tratamiento o en los resultados oncológicos atribuibles a la pandemia.
FinanciaciónEste estudio ha sido financiado con una beca del Plan Estatal de I+D+I del Instituto de Salud CarlosIII: FIS PI19/01661 a XL (cofinanciado por el Fondo Europeo de Desarrollo Regional [FEDER], A Way to Build Europe).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.