En el paciente críticamente enfermo, la falla hepática aguda sobre crónica (FHAC) representa un reto clínico dado que las alternativas terapéuticas son limitadas, usualmente ineficaces y se enfocan en un abordaje sintomático. El trasplante hepático ortotópico (THO) es la opción terapéutica más adecuada, sin embargo, los escasos de donantes y la presencia de contraindicaciones es una limitante frecuente para este procedimiento. Frente a esta problemática, desde el año 2000 se ha venido implementando el uso de soportes de asistencia hepática extracorpórea como Molecular Adsorbent Recirculating System (MARS), para la estabilización de la condición clínica del paciente como puente a recuperación espontanea o a THO. Presentamos la primera experiencia con este dispositivo de asistencia hepática en Colombia.
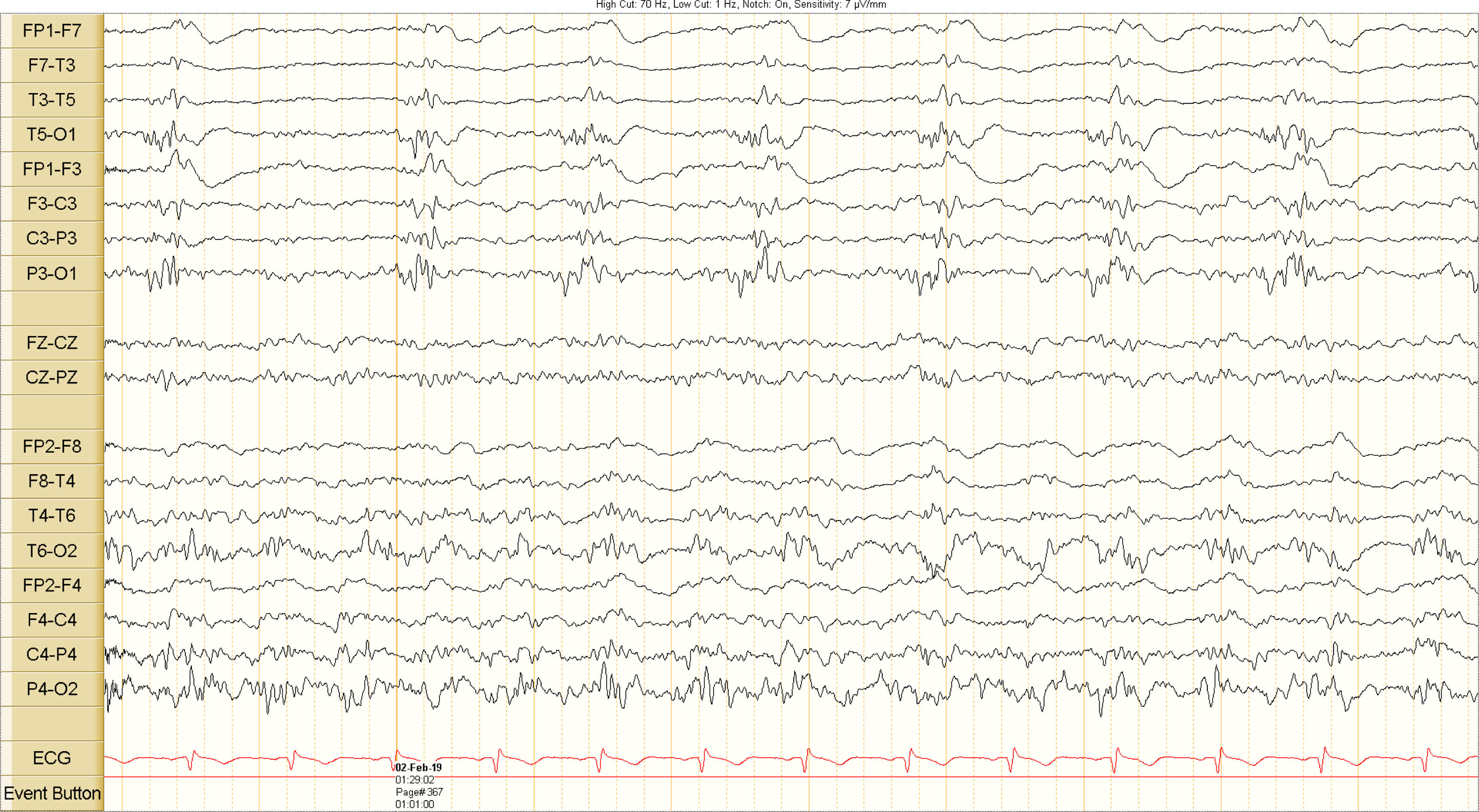
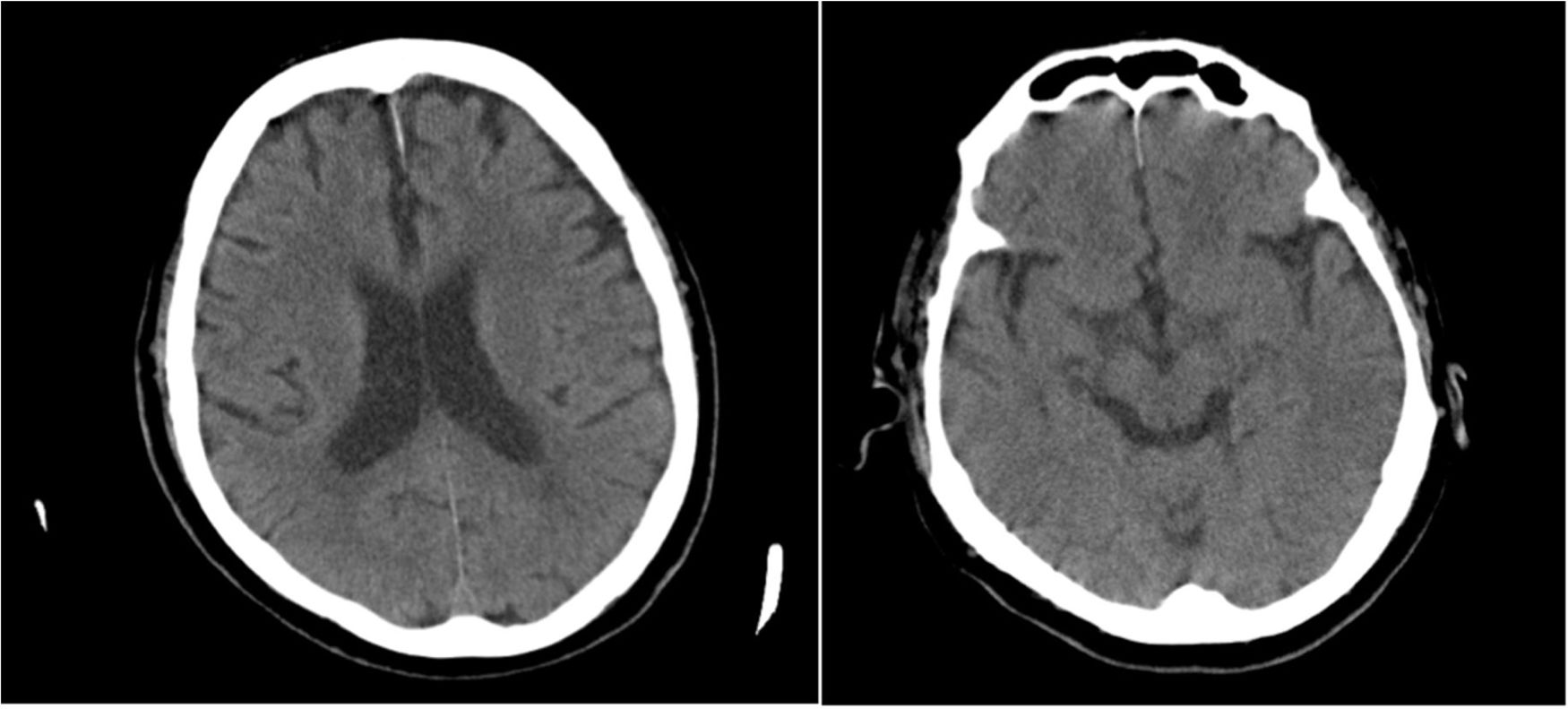
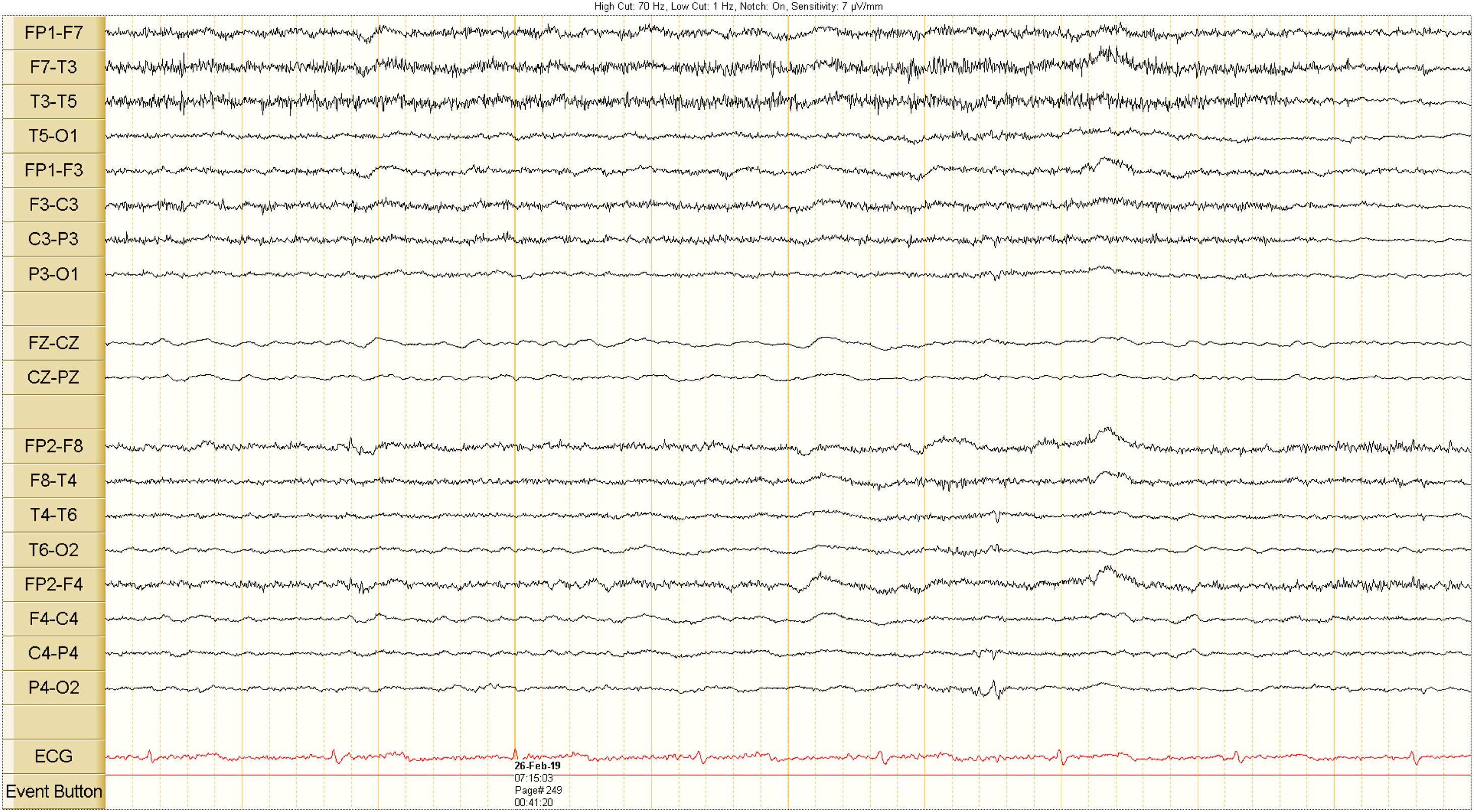
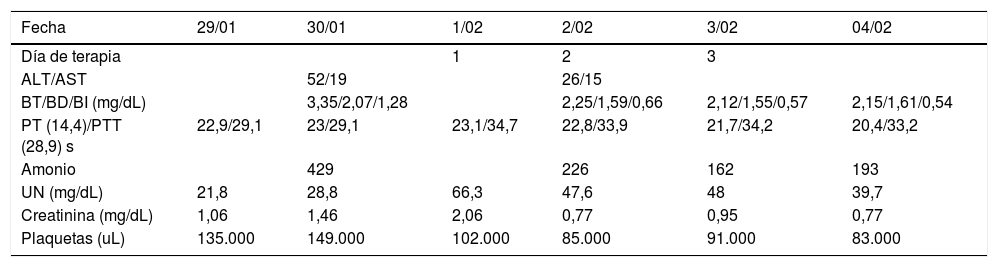
Presentamos el caso de un paciente de 69 años con antecedente de cirrosis enólica y cuadro agudo de obstrucción intestinal llevado a cirugía, quien en el posoperatorio desarrolló una FHAC, con progresión de la encefalopatía, convulsiones y deterioro de la función renal. Ante la falta de respuesta al tratamiento médico estándar se realizaron tres sesiones de asistencia hepática extracorpórea con MARS como soporte peritrasplante (antes terapia puente), con mejoría de la encefalopatía y resolución de las crisis convulsivas.
La implementación de un soporte de asistencia hepática extracorpórea, como el MARS, es una herramienta de gran ayuda, principalmente en el escenario de baja disponibilidad de donantes y en un subgrupo seleccionado de pacientes que cursan con falla hepática aguda o falla hepática aguda sobre crónica, como medida de mantenimiento como puente a resolución espontanea o THO.
In the critically ill patient, acute-on-chronic-liver failure (ACLF) represents a clinical challenge since the therapeutic alternatives are limited, usually ineffective, and focus on a symptomatic approach. Orthotopic liver transplantation (OLT) is the most appropriate therapeutic option. However, donor shortages and the presence of contraindications is a frequent limitation for this procedure. Faced with this problem, the use of extracorporeal liver support has been implemented since the year 2000, such as MARS (Molecular Adsorbent Recirculating System), for the stabilisation of the patient's clinical condition as a bridge to spontaneous recovery or liver transplant. A first experience with this liver support device in Colombia is presented
The case is presented of a 69-year-old patient with a history of alcoholic cirrhosis and an acute onset of intestinal obstruction. He was taken to surgery and subsequently developed ACLF in the postoperative period, with progression of encephalopathy, seizures, and deterioration of renal function. Due to the non-response to standard medical treatment, three extracorporeal liver assistance sessions were performed with MARS as peri-transplant support (previously bridge therapy), with improvement of encephalopathy and resolution of seizures.
The implementation of extracorporeal liver assistance supports, such as MARS, is a very helpful tool, mainly in the scenario of low availability of donors. It is indicated in a selected subgroup of patients that present with acute liver failure or ACLF, as a maintenance measure as a bridge to spontaneous resolution, or OLT.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora