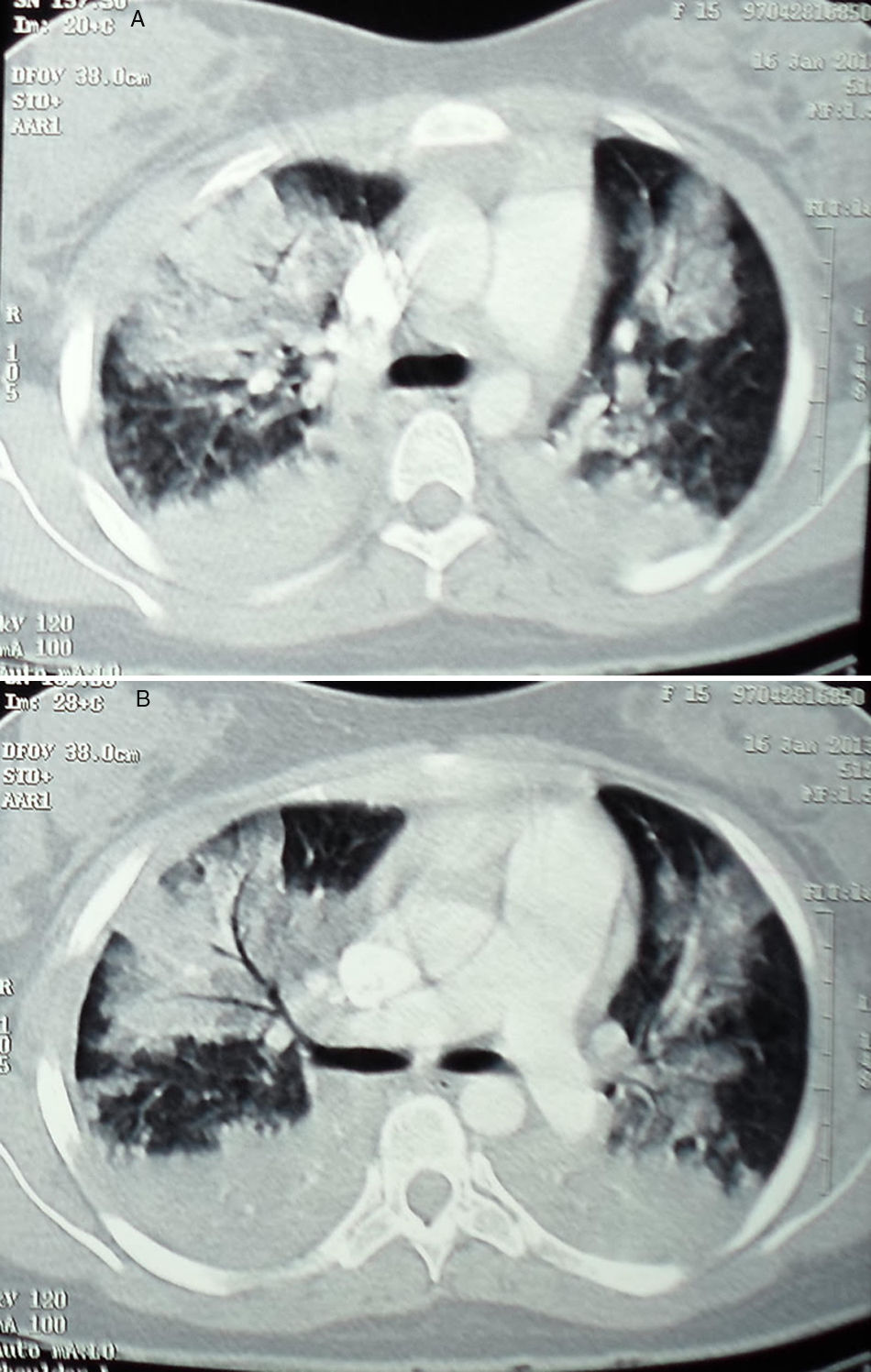
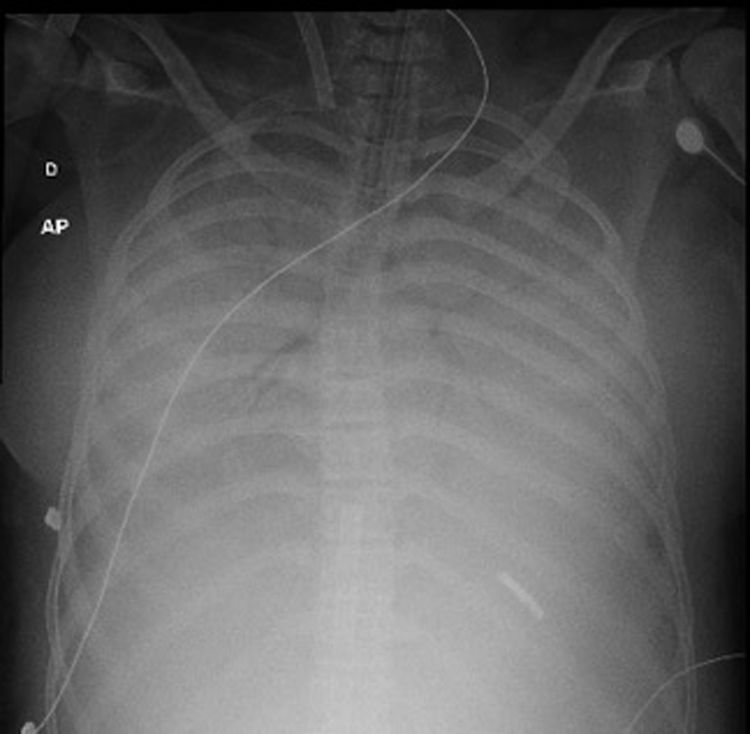
El síndrome torácico agudo es una de las complicaciones pulmonares potencialmente fatales en los pacientes con anemia de células falciformes, cuyo diagnóstico y tratamiento continúan siendo complejos. El uso de oxigenación con membrana extracorpórea ha sido reportado en algunos casos refractarios al tratamiento convencional con resultados exitosos, sin embargo, en Colombia no se ha informado del uso de dicha tecnología en pacientes con esta complicación. Presentamos el caso de una adolescente que requirió soporte con el uso de oxigenación con membrana extracorpórea para el manejo del síndrome torácico agudo.
The Acute Chest Syndrome constitutes one of the most potentially fatal pulmonary complications in patients with sickle cell anaemia, and its diagnosis and treatment is complex. The use of extracorporeal membrane oxygenation has been reported, in some cases, as a useful intervention for the management of cases refractory to conventional treatment. In Colombia, the use of such support in patients with this syndrome has not been reported. The case is presented of an adolescent with Acute Chest Syndrome, who required extracorporeal membrane oxygenation.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora