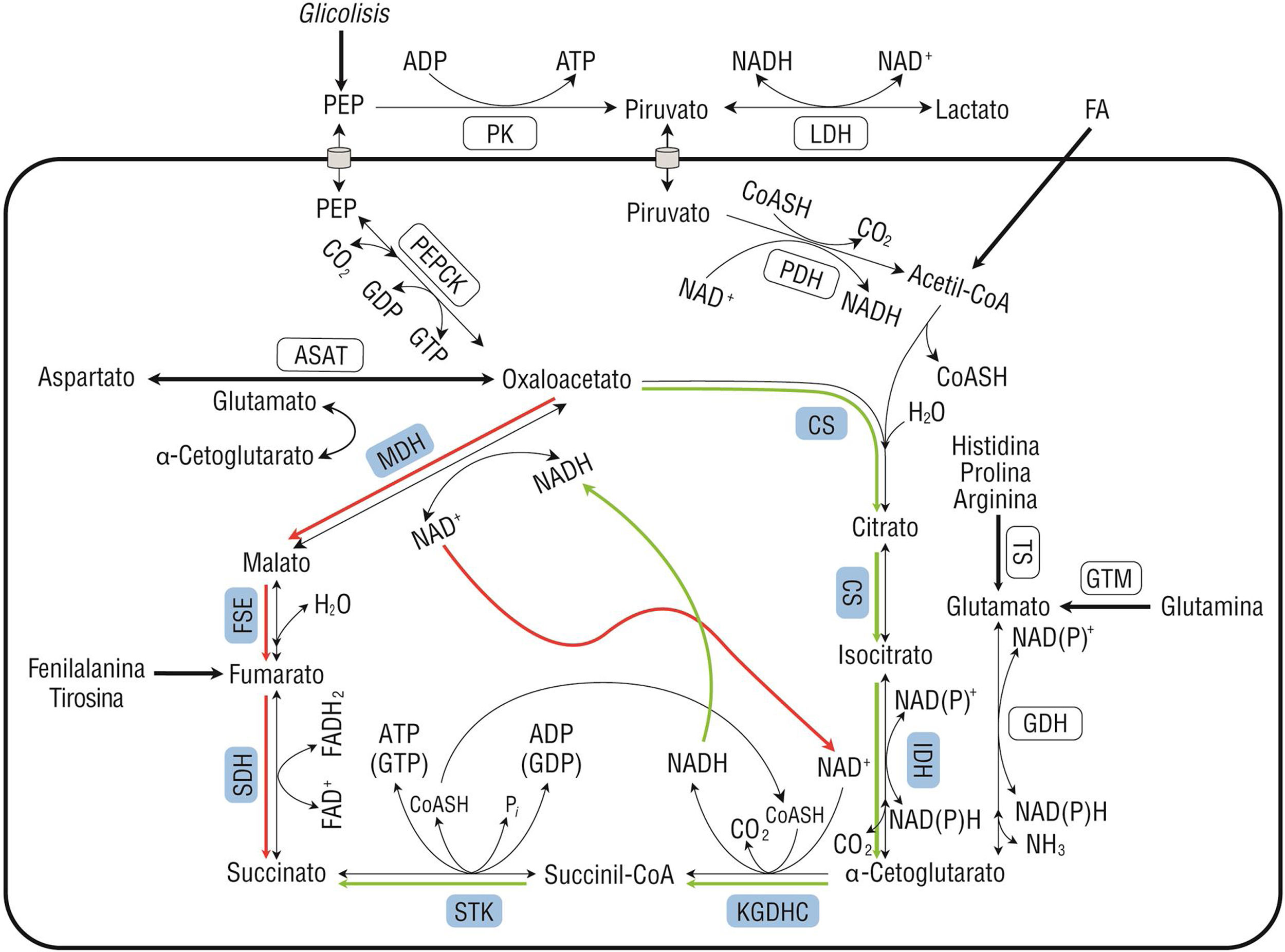
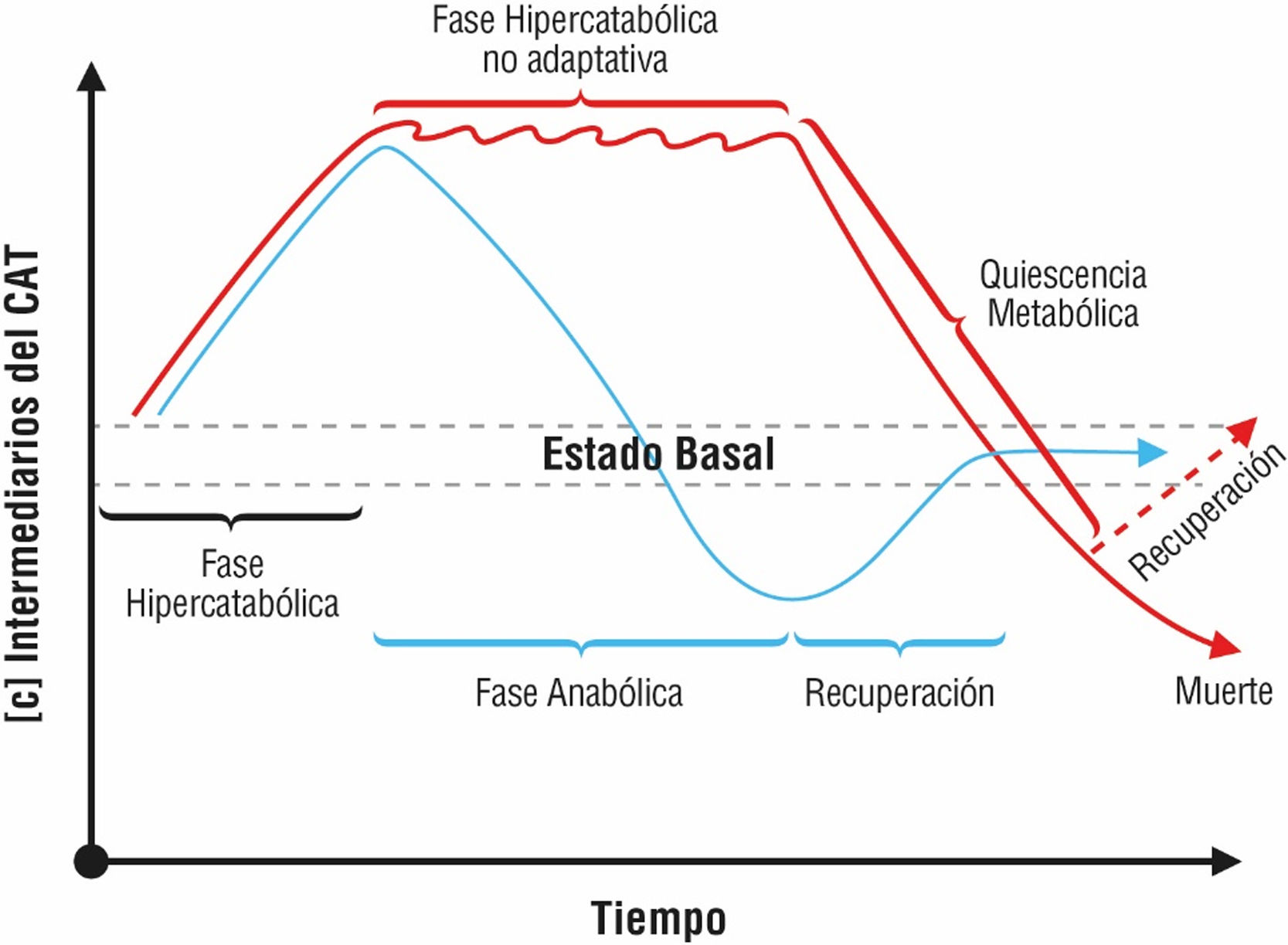
La persistencia del funcionamiento del ciclo de los ácidos tricarboxílicos (CAT) en estados de choque ha sido documentada, así como la «fragmentación» de sus reacciones enzimáticas en modelos celulares de hipoxia, lo que en conjunto permite la persistencia de reacciones catabólicas.
ObjetivoIdentificar estudios que cuantificaron intermediarios del CAT en modelos animales de sepsis y en pacientes sépticos.
Fuentes de datos: Búsqueda electrónica en PubMed, Embase, Cochrane y LILACS y revisión manual de bibliografía de artículos incluidos, hasta diciembre de 2018.
Criterios de selección: Investigaciones en las cuales se midieran intermediarios del CAT a nivel tisular o sanguíneo en pacientes sépticos o modelos animales de sepsis.
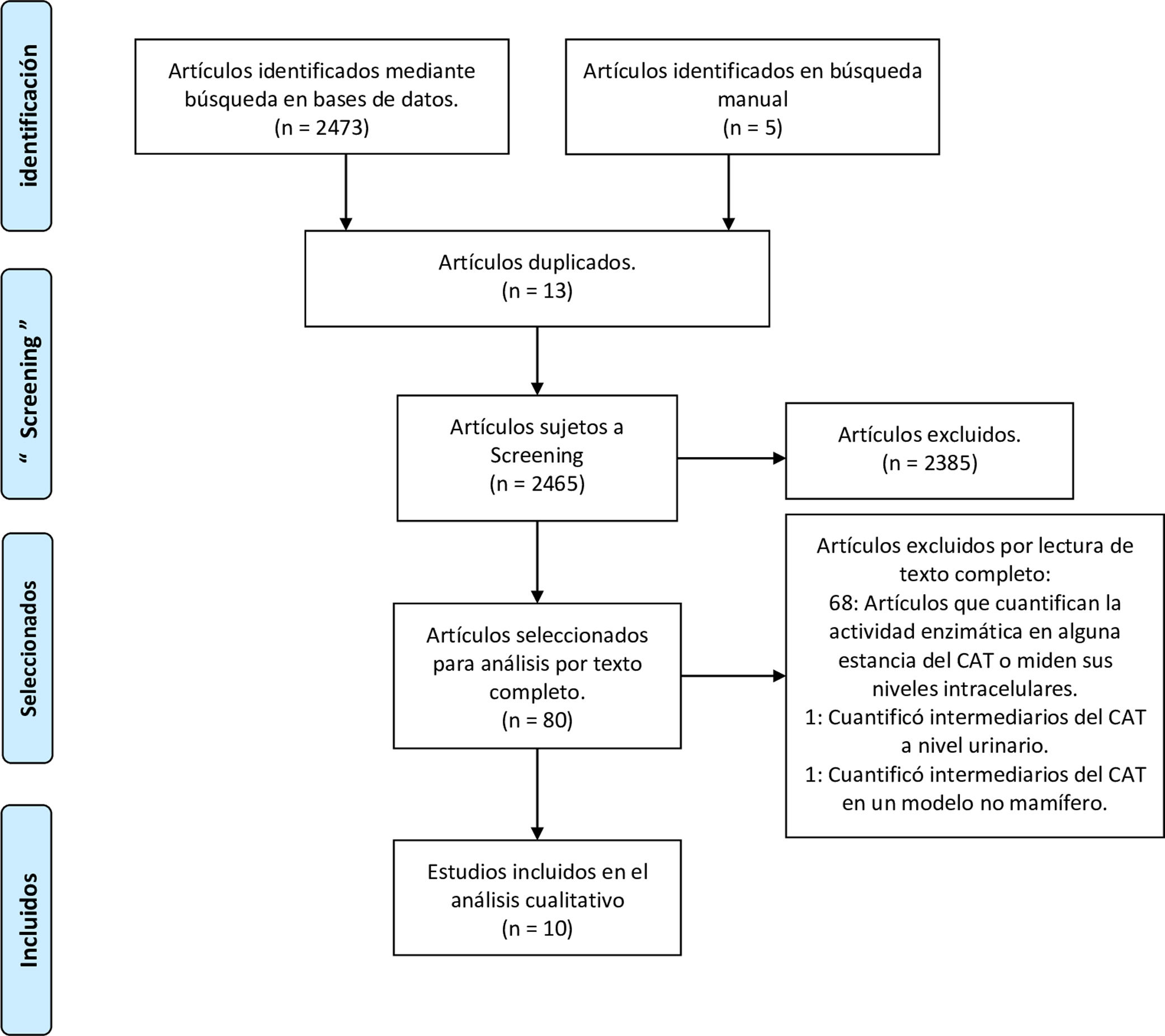
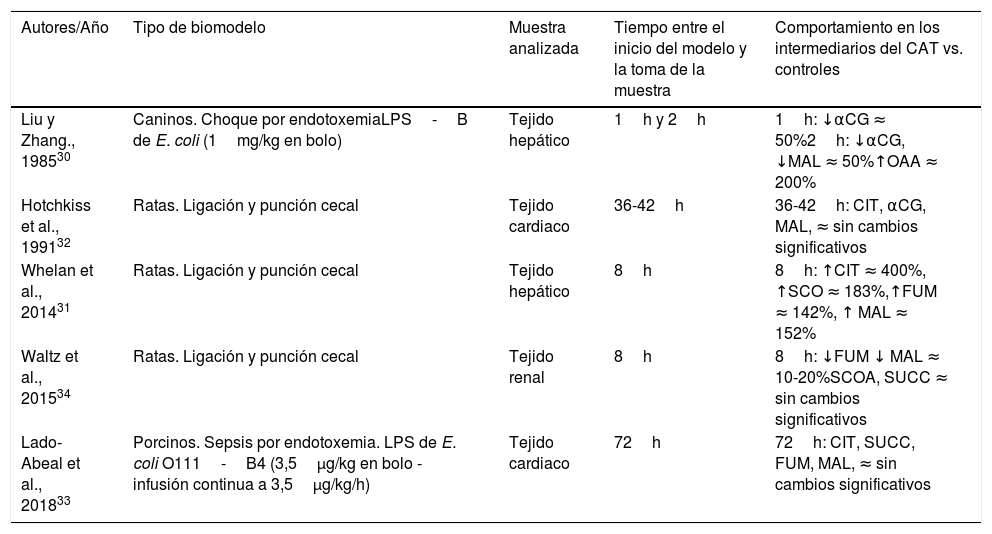
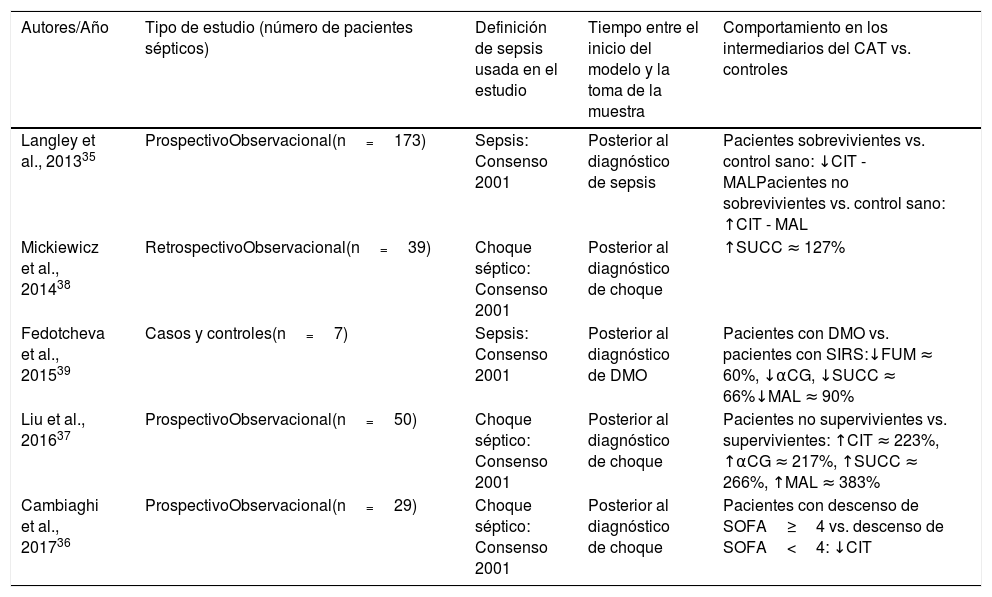
ResultadosSe identificaron 2.478 artículos, 10 de los cuales fueron incluidos. Cinco se realizaron en modelos animales, evaluaron los intermediarios en tiempos diferentes de evolución y en diferentes tejidos, encontrando concentraciones aumentadas, normales y disminuidas de los intermediarios. Los 5 restantes fueron en humanos y midieron los metabolitos en sangre. En 4 se identificaron incrementos de las concentraciones de intermediarios en pacientes no sobrevivientes y con peor pronóstico, y en 3 se reportaron descensos de las concentraciones en sobrevivientes o en pacientes con descenso de la severidad de la disfunción orgánica.
ConclusionesSe identificaron pocos artículos que evaluaran los metabolitos del CAT. Los resultados indican diferentes cambios en las concentraciones de estos intermediarios a nivel tisular y sanguíneo, lo cual puede corresponder a la respuesta metabólica órgano-específica que se observa en la sepsis y al comportamiento temporal y dinámico del metabolismo durante las diferentes fases de la sepsis.
The continued functioning of the tricarboxylic acids cycle (TAC) in shock states has been documented. Along with the ‘fragmentation’ of their enzymatic reactions in cellular models of hypoxia this enables the catabolic reactions to continue to take place.
ObjectiveTo identify studies that quantified TAC intermediaries in animal models of sepsis and in septic patients.
Data sources: Electronic search in PubMed, Embase, Cochrane and LILACS and manual review of bibliography of articles included, until December 2018.
Selection criteria: A study in which TAC intermediaries were measured at the tissue or blood level in septic patients or animal models of sepsis.
ResultsA total of 2,478 articles were identified, of which 10 were included. Five were performed in animal models. The intermediaries were evaluated at different times of evolution and in different tissues, finding increased, normal and decreased concentrations. The remaining 5 were in humans, and measured blood metabolites. In 4 of them, there was an increase in the concentrations of intermediaries in non-surviving patients and in those with a worse prognosis. In 3 decreases in concentrations were reported in survivors or in patients with a decrease in the severity of organic dysfunction.
ConclusionsFew articles were identified to evaluate CAT metabolites. The results indicate different changes in the concentrations of these intermediates at tissue and blood levels, which may correspond to the organ-specific metabolic response observed in sepsis and to the temporal and dynamic behaviour of metabolism during the different phases of sepsis.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora