Diversos estudios han reportado alteraciones tromboembólicas en los pacientes con neumonía por SARS-CoV-2, sin embargo, no se cuentan con datos definitivos acerca de los factores de riesgo para la aparición de dichos eventos. El objetivo de este estudio fue analizar la relación existente entre los factores personales, clínicos y paraclínicos con el desarrollo de complicaciones tromboembólicas venosas en pacientes hospitalizados con COVID-19.
MétodosEstudio de seguimiento a una cohorte retrospectiva de pacientes con COVID-19 ingresados, de agosto del 2020 a febrero del 2021, en la Clínica Antioquia de Itagüí. Se incluyeron 525 historias clínicas de pacientes mayores de 18 años con diagnóstico confirmado para SARS-CoV-2.
ResultadosSe identificó la presencia de eventos tromboembólicos en el 3% de los pacientes hospitalizados. De los pacientes con COVID-19, el 25,1% ingresó a Unidad de Cuidados Intensivos (UCI), el 18,9% requirió ventilación mecánica invasiva. La mortalidad por COVID-19 en nuestro estudio fue de 18,1%.
En los sujetos hospitalizados con SARS-CoV-2 se identificó asociación entre el desarrollo de eventos tromboembólicos con los niveles elevados de troponina I (HR 4,07; IC 95% 1,09-15,18), el antecedente de eventos tromboembólicos (HR 11,01; IC 95% 1,06-114,87) y trombocitopenia (HR 6,47; IC 95% 2,05-20,44).
ConclusionesSe encontró asociación entre las complicaciones tromboembólicas y el antecedente de ETV. Igualmente se concluyó que los valores de troponina ≧0,03 ngr/mL y niveles de plaquetas < 150.000/mm3 se asocian con ETV.
Several studies have reported on the thromboembolic alterations developed in patients with SARS-CoV-2 pneumonia, however, there are no definitive data on the risk factors for the appearance of these events. The aim of this study was to analyse the relationship between personal, clinical, and paraclinical factors and the development of venous thromboembolic complications in hospitalized patients with COVID-19.
MethodsFollow-up study of a retrospective cohort of COVID-19 patients admitted, from August 2020 to February 2021, to the Clínica Antioquia de Itagüí. 525 medical records of patients older than 18 years with a confirmed diagnosis of SARS-CoV-2 were included.
ResultsThe presence of VTE was identified in 3% of hospitalized patients. Of the patients with COVID-19, 25.1% were admitted to the intensive care unit, 18.9% required invasive mechanical ventilation. Mortality from COVID-19 in our study was 18.1%. In patients hospitalized with SARS-CoV-2, an increased risk of development of thromboembolic events was identified in those with elevated levels of troponin I (HR 4.07; 95% CI 1.09-15.18), a history of prior thromboembolic events (HR 11.01; 95% CI 1.06-114.87), and thrombocytopenia (HR 6.47; 95% CI 2.05-20.44).
ConclusionsAn association was found between thromboembolic complications and a history of VTE. Likewise, it was concluded that troponin values ≧ .03 ng/ml and platelet levels < 150,000/mm3 are associated with VTE.
En diciembre de 2019 fue reportado en Wuhan China, la existencia de un nuevo betacoronavirus perteneciente a una subfamilia de virus ARN monocatenario, capaz de producir en las personas neumonía e insuficiencia respiratoria1, que actualmente se conoce como severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) por su similitud filogenética al SARS-CoV2. En enero de 2020, los Centers for Disease Control and Prevention (CDC) de EE. UU. anunciaron que los ciudadanos provenientes de la provincia Hubei debían cumplir una cuarentena obligatoria de 14 días3.
Pacientes con COVID-19 exhiben una predisposición a los eventos tromboembólicos tanto arteriales como venosos debido a la hipoxia, inflamación severa, inmovilización y coagulación intravascular diseminada (CID), en especial en los procesos infecciosos severos4–8. La fisiopatología de la trombosis en COVID-19 es aún incierta, sin embargo, la respuesta inflamatoria sistémica, la endotelialitis y la hipoxemia juegan un papel importante en presentación de estas complicaciones9–12. Pacientes con COVID-19 a nivel hospitalario presentan alto riesgo de eventos tromboembólicos venosos (ETV), como la trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP)13–15 y estos se han asociado a una importante morbimortalidad, altas tasas de reingresos hospitalarios, pobre calidad de vida y un considerable impacto económico16–22.
La comprensión de los mecanismos fisiopatológicos subyacentes, así como la evaluación del riesgo para el desarrollo de estas entidades son esenciales para desarrollar estrategias diagnósticas y terapéuticas6. La creciente evidencia sobre la presencia de eventos tromboembólicos de origen venoso como complicación en los pacientes con infección por COVID-19 y su enmascaramiento con los síntomas propios de la enfermedad, ha puesto de manifiesto la importancia de identificar sus causas precipitantes. Este estudio tuvo como objetivo explorar la relación entre factores personales, clínicos y paraclínicos con el desarrollo de complicaciones tromboembólicas venosas en los pacientes con COVID-19.
MétodosSe realizó un estudio de seguimiento a una cohorte retrospectiva, se revisaron las historias clínicas de pacientes que ingresaron a la institución con diagnóstico de COVID-19, durante el período de agosto del 2020 a febrero del 2021, en la Clínica Antioquia, una institución de tercer nivel de complejidad, que durante la pandemia ha atendido pacientes con diagnóstico de COVID-19, tanto en sala general como en unidades de alta dependencia (cuidados especiales [UCE] o UCI).
Se incluyeron todos los pacientes mayores de 18 años con diagnóstico confirmado por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) para SARS-CoV2, o prueba inmunológica más estudios imagenológicos sugestivos de infección viral. Se excluyeron los pacientes con diátesis hemorrágica, así como las historias clínicas que no tuvieran información imprescindible para el estudio.
El desenlace primario (eventos tromboembólicos venosos) fue un desenlace compuesto, conformado por tromboembolismo pulmonar (TEP) y trombosis venosa profunda (TVP), diagnosticados mediante angiotomografía de arterias pulmonares y ecografía Doppler venosa de miembros inferiores, respectivamente. Teniendo en cuenta que algunos pacientes con alta sospecha clínica de TEP no pudieron ser llevados a estudios imagenológicos que confirmaran el diagnóstico, se tomó la decisión de incluirlos en el desenlace primario. Como variables independientes se evaluaron las siguientes: variables sociodemográficas como edad y sexo, antecedentes personales como diabetes mellitus (DM), hipertensión arterial (HTA), enfermedad renal crónica (ERC) y fibrilación auricular (FA); variables clínicas como signos vitales, escala de Glasgow y RASS; además, variables paraclínicas como troponina I, dímero D, leucocitos y plaquetas.
Se diseñó un instrumento de recolección en Excel, para los datos. Se recogió la información revisando de manera minuciosa cada historia clínica sistematizada en el software institucional.
Análisis estadísticoPara las variables cuantitativas se reportan la media con su desviación estándar (DE) o mediana con su cuartil 1 y 3, dependiendo de la distribución de cada variable (Kolmogorov-Smirnov). En cuanto a las variables cualitativas se reportan sus frecuencias absolutas y relativas. Para la comparación entre los que presentaron ETV y los que no los presentaron, se utilizó la prueba de χ2 o la prueba exacta de Fisher, para las variables cualitativas y la prueba t de Student o U de Mann-Whitney para las variables cuantitativas.
Se desarrolló un modelo explicativo mediante el análisis de supervivencia por el método de Kaplan-Meier y un modelo multivariado de regresión de Cox (método Backward). Se reportan los hazard ratio (HR) con sus IC del 95%. Los análisis se realizaron en el programa estadístico Jamovi versión 1.6.23.0.
El proyecto fue aprobado por el Comité de Investigación e Innovación de la Facultad de Medicina de la Universidad CES y por la Dirección Técnico Científica de la Clínica Antioquia S.A.
ResultadosSe revisaron un total de 525 historias clínicas, se identificó la presencia de complicaciones tromboembólicas venosas (ETV) en el 3% de los pacientes hospitalizados, (10 TEP confirmados por angiotomografía de arterias pulmonares, una TVP confirmada por Doppler venoso y cinco con alta sospecha de TEP, pero sin confirmación imagenológica). El 58% eran mujeres y la edad promedio fue de 62,5 años (± 18,6 años); las comorbilidades más frecuentes fueron hipertensión, diabetes y enfermedad pulmonar obstructiva crónica (EPOC). De los pacientes estudiados, 2,3% sufrieron eventos tromboembólicos previos. El 25,1% de los pacientes ingresó a UCI, el 18,9% requirió ventilación mecánica invasiva (VMI); al 76,6% se le prescribió corticoides. La mortalidad por COVID-19 estudio fue de 18,1% (95 pacientes) (tabla 1).
Características de la población
| Variable | n | % |
|---|---|---|
| Sexo | ||
| Masculino | 217 | 41,3 |
| Edad x̄, (± DE) | 62,5 | (± 18,6) |
| Diagnóstico | ||
| IgM/Ag - Imagen (+) | 105 | 20 |
| RT-PCR (+) | 420 | 80 |
| Comorbilidades | n | % |
|---|---|---|
| HTA | 251 | 47,8 |
| Diabetes | 120 | 22,9 |
| Fibrilación auricular | 13 | 2,5 |
| Insuficiencia cardiaca | 24 | 4,6 |
| EPOC | 78 | 14,9 |
| ERC | 38 | 7,2 |
| EVC | 14 | 2,7 |
| Enfermedad coronaria | 23 | 4,4 |
| EVP | 11 | 2,1 |
| Obesidad | 58 | 11 |
| Cáncer activo | 13 | 2,5 |
| ETV previo | 12 | 2,3 |
| Enfermedad reumática | 13 | 2,5 |
| Medicamentos | n | % |
|---|---|---|
| ASA | 43 | 8,2 |
| Clopidogrel | 6 | 1,1 |
| NOAC | 17 | 3,2 |
| Warfarina | 3 | 0,6 |
| Paraclínicos | ||
|---|---|---|
| Dímero D Me (Q1-Q3) | 496 | (273-1.093) |
| Ferritina Me (Q1-Q3) | 766 | (377-1.277) |
| Troponina I Me (Q1-Q3) | 0,01 | (0,00-0,02) |
| LDH Me (Q1-Q3) | 353 | (275-455) |
| Leucocitos Me (Q1-Q3) | 8.144 | (5.951-11.495) |
| Plaquetas Me (Q1-Q3) | 225.637 | (162.750-275.250) |
| PAFI Me (Q1-Q3) | 214 | (157-274) |
| TAC de tórax simple n (%) | 91 | 17,3 |
| Angiotomografía n (%) | 44 | 8,4 |
| Otras terapias | ||
|---|---|---|
| VMI n (%) | 99 | 18,9 |
| VMNI n (%) | 48 | 9,1 |
| Vasoactivos n (%) | 71 | 13,5 |
| Otros tratamientos | ||
|---|---|---|
| Corticoides n (%) | 402 | 76,6 |
| Antibiótico n (%) | 344 | 65,5 |
| Sitio de hospitalización | ||
|---|---|---|
| Sala general n (%) | 351 | 66,9 |
| UCE n (%) | 42 | 8 |
| UCI n (%) | 132 | 25,1 |
| Estado final | ||
|---|---|---|
| Alta médica n (%) | 355 | 67,6 |
| Muerte n (%) | 95 | 18,1 |
| Remisión n (%) | 75 | 14,3 |
| Tiempo de hospitalización (días) Me (Q1-Q3) | 4 | (3-7) |
|---|---|---|
| Desenlace compuesto n (%) | 16 | 3 |
| TEP n (%) | 10 | 1,9 |
| TVP n (%) | 1 | 0,2 |
| Casos sospechosos de TEP n (%) | 5 | 1 |
HTA: hipertensión arterial; DM: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; EVC: enfermedad cerebrovascular; EVP: enfermedad vascular periférica; ETV: eventos tromboembólico previo; ASA: ácido acetilsalicílico; NOAC: nuevos anticoagulantes orales; LDH: lactato deshidrogenasa; PAFI: presión arterial de oxígeno/fracción inspirada de oxígeno; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva; UCE: Unidad de Cuidados Especiales; UCI: Unidad de Cuidados Intensivos; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; DE: desviación estándar.
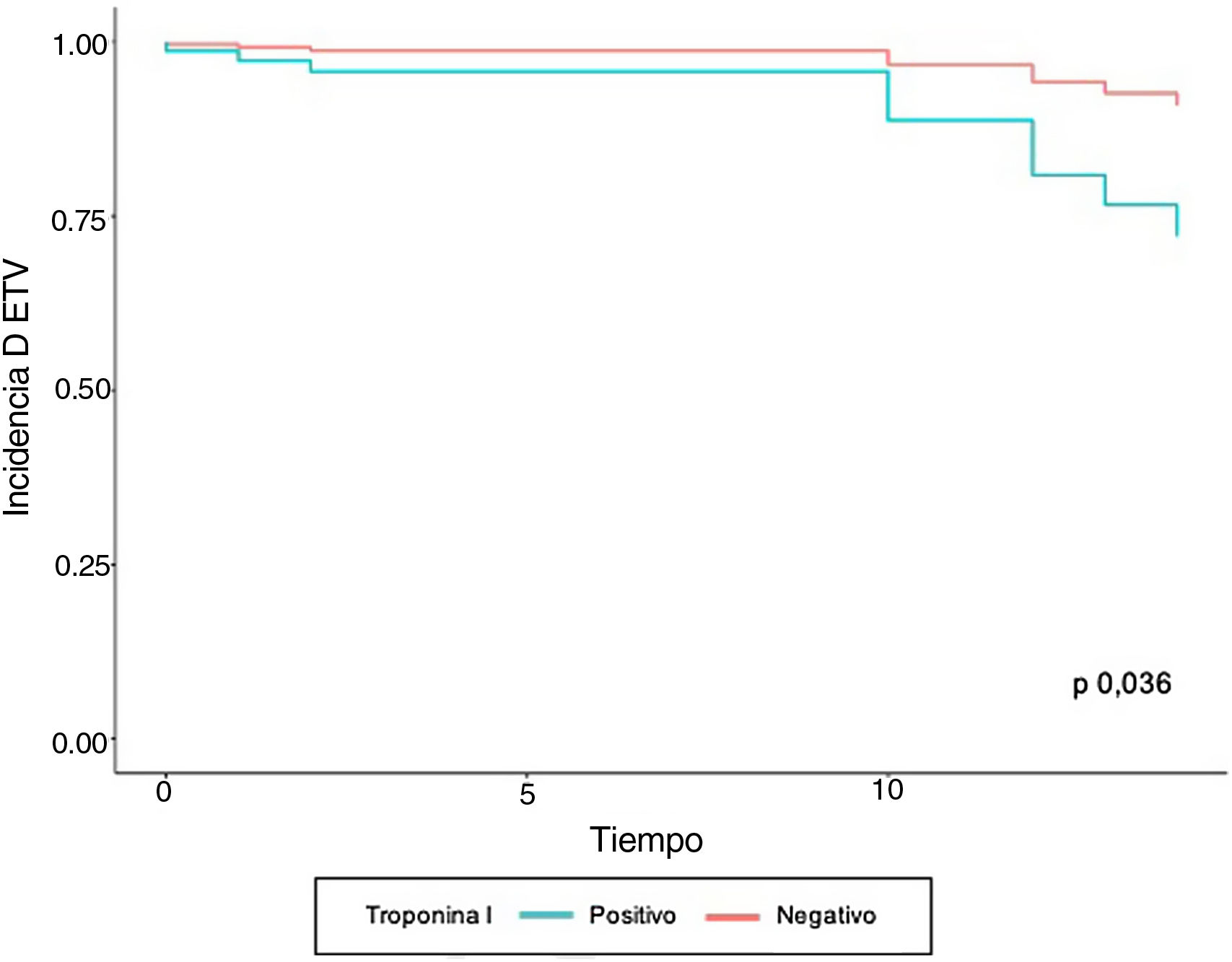
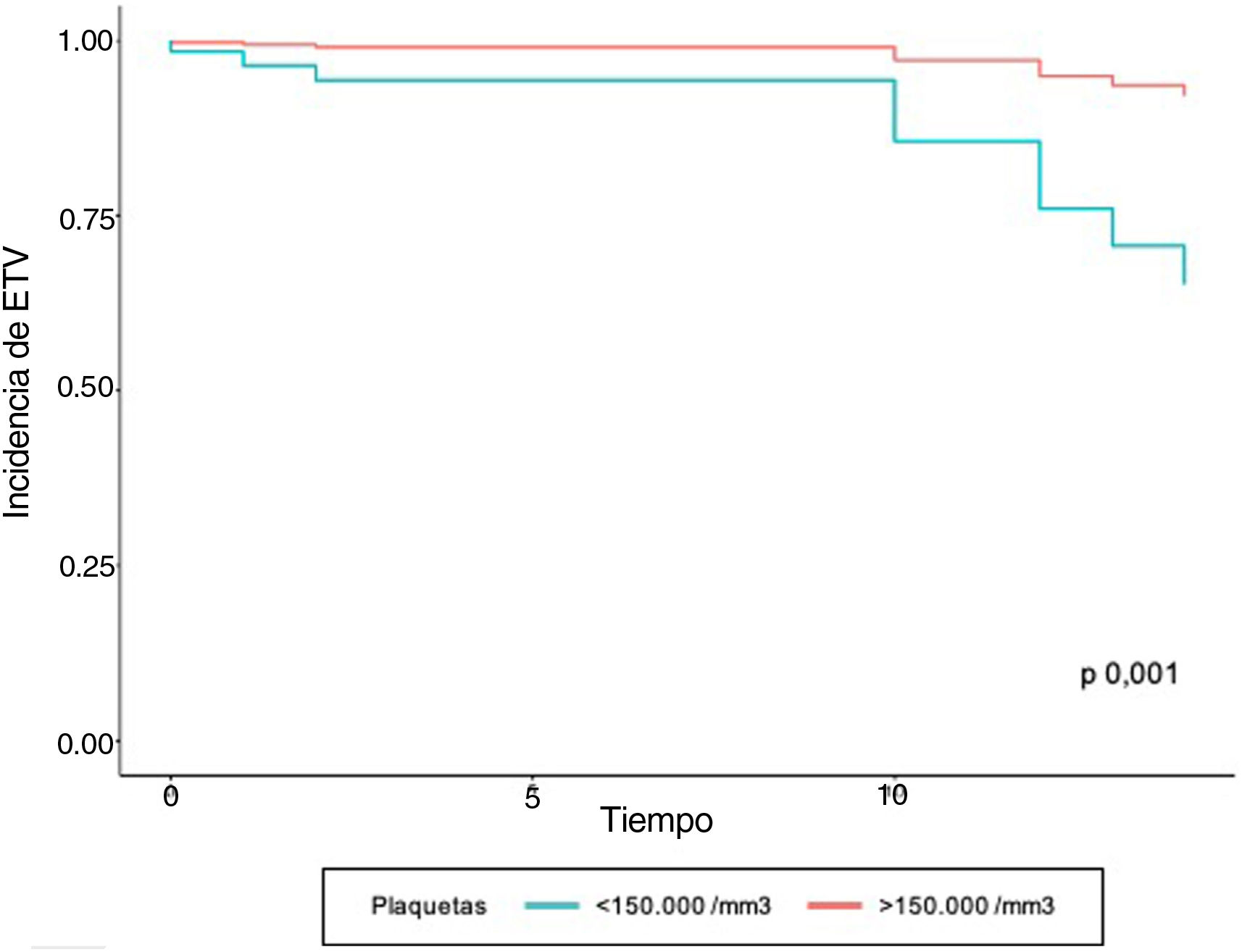
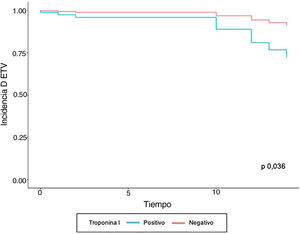
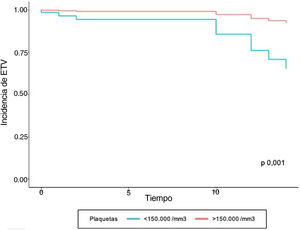
Al analizar los factores que se relacionan con las complicaciones tromboembólicas, los valores de dímero D elevado (> 1.000 mcg/dL), no se encontró asociación con la presentación de ETV (p = 0,156). Los valores de troponina I positiva al ingreso (> 0,03 ng/mL) y la trombocitopenia mostraron un incremento de 1,05 veces el riesgo de ETV (tabla 2).
Características de los pacientes hospitalizados por COVID-19
| Totaln (%) | Desenlace compueston (%) | IC 95% | |||||
|---|---|---|---|---|---|---|---|
| Variable | n = 525 | Sí (n = 16) | No (n = 509) | RR | Inf | Sup | p |
| Sexo | |||||||
| Masculino | 308 (58,7) | 12 (75) | 296 (58.2) | 1,02 | 0,992 | 1,05 | 0,178 |
| Edad (> 65 años) | 231 (44) | 9 (56,3) | 222 (43,6) | 1,02 | 0,984 | 1,05 | 0,316 |
| HTA | 251 (47,8) | 9 (56,3) | 242 (47,5) | 1,01 | 0,98 | 1,04 | 0,492 |
| DM | 120 (22,9) | 6 (37,5) | 114 (22,4) | 1,03 | 0,983 | 1,07 | 0,221 |
| Fibrilación auricular | 13 (2,5) | 0 (0) | 13 (2,6) | 0,969 | 0,954 | 0,984 | 0,984 |
| Insuficiencia cardiaca crónica | 24 (4,6) | 0 (0) | 24 (4,7) | 0,968 | 0,953 | 0,984 | 1 |
| EPOC | 78 (14,9) | 5 (31,3) | 73 (93,6) | 1,04 | 0,982 | 1,11 | 0,073 |
| Enfermedad renal crónica | 38 (7,2) | 1 (6,3) | 37 (7,3) | 0,995 | 942 | 1,05 | 1 |
| Evento cerebrovascular | 14 (2,7) | 0 (0) | 14 (2,8) | 0,969 | 0,954 | 0,984 | 1 |
| Enfermedad coronaria | 23 (4,4) | 2 (12,5) | 21 (4,1) | 1,06 | 0,938 | 1,21 | 0,152 |
| Enfermedad vascular periférica | 11 (2,1) | 1 (6,3) | 10 (2) | 1,07 | 0,885 | 1,29 | 0,291 |
| Obesidad | 58 (11) | 0 (0) | 58 (11,4) | 0,966 | 0,949 | 0,982 | 0,238 |
| ASA | 43 (8,2) | 1 (6,3) | 42 (8,3) | 0,992 | 0,945 | 1,04 | 1 |
| Clopidogrel | 6 (1,1) | 0 (0) | 6 (1,2) | 0,969 | 0,954 | 0,984 | 1 |
| Warfarina | 3 (0,6) | 1 (6,3) | 2 (0,4) | 1,46 | 0,654 | 3,24 | 0,089 |
| Cáncer activo | 13 (2,5) | 1 (6,3) | 12 (2,4) | 1,05 | 0,898 | 1,23 | 0,334 |
| Evento tromboembólico previo | 12 (2,3) | 2 (12,5) | 10 (2) | 1,17 | 0,906 | 1,5 | 0,048 |
| Enfermedad reumática | 13 (2,5) | 2 (12,5) | 11 (2,2) | 1,15 | 0,911 | 1,45 | 0,056 |
| Dímero D (> 1.000 mcg/dL) | 125 (27,5) | 7 (43,8) | 118 (26,9) | 0,97 | 0,927 | 1,02 | 0,156 |
| Ferritina (> 300 mg/dL) | 332 (80,4) | 12 (85,7) | 320 (802) | 0,988 | 0,949 | 1,03 | 1 |
| Troponina I (> 0,03 ngr/mL) | 69 (17,8) | 5 (41,7) | 64 (17) | 1,05 | 0,985 | 1,13 | 0,044 |
| LDH (> 220 U/lt) | 352 (88,2) | 12 (92,3) | 340 (88,1) | 0,987 | 0,942 | 1,03 | 1 |
| Leucocitos (> 12.000/mm3) | 118 | 2 (1,7) | 116 (98,3) | 0,982 | 0,953 | 1,01 | 0,544 |
| Plaquetas (< 150.000/mm3) | 91 (17,8) | 6 (6,6) | 85 (93,4) | 1,05 | 0,988 | 1,11 | 0,047 |
| PAFI (< 100) | 67 (13,4) | 2 (13,3) | 65 (13,4) | 1 | 0,956 | 1,05 | 1 |
| VMI | 99 (18,9) | 9 (56,3) | 90 (17,7) | 1,08 | 1,02 | 1,15 | < 0,001 |
| Vasoactivos | 71 (13,5) | 4 (25) | 67 (13,2) | 1,03 | 0,973 | 1,09 | 0,252 |
| Corticoides | 402 (76,6) | 16 (100) | 386 (75,8) | 1,04 | 1,02 | 1,06 | 0,03 |
| Antibióticos | 344 (65,5) | 11 (68,8) | 333 (65,4) | 1 | 0,974 | 1,04 | 0,783 |
| Hospitalización (UCI/UCE) | 174 (33,1) | 11 (68,8) | 163 (32) | 1,05 | 1,01 | 1,1 | 0,002 |
HTA: hipertensión arterial; DM: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; ASA: ácido acetilsalicílico; LDH: lactato deshidrogenasa; PAFI: presión arterial de oxígeno/fracción inspirada de oxígeno; VMI: ventilación mecánica invasiva; UCE: Unidad de Cuidados Especiales; UCI: Unidad de Cuidados Intensivos.
En el modelo de regresión de Cox se encontró que el grupo de pacientes con ETV previo tuvieron 10,01 veces más complicaciones tromboembólicas, con respecto a quienes no tenían el antecedente ajustado a las demás variables. En aquellos que tenían valores positivos de troponina I y trombocitopenia se observó un aumentó 4,07 y 6,47 veces la velocidad de la aparición de ETV, respectivamente, al ser ajustado por el resto de variables. A pesar de que la variable edad no fue significativa, los estimadores se ajustaron por dicha variable para controlar un posible efecto confusor (tabla 3). Las curvas de supervivencia de ETV estratificado por troponina I positiva y trombocitopenia se muestran en las figuras 1 y 2, respectivamente.
Regresión de Cox - Complicación tromboembólica venosa
| Variables | HR crudo [IC 95%] | p | HR ajustado [IC 95%] | p |
|---|---|---|---|---|
| ETV previo | 13,06 (2,77-61,59) | 0,001 | 11,01 (1,06-114,87) | 0,045 |
| Troponina I (positiva) | 3,22 (1,02-10,16) | 0,046 | 4,07 (1,09-15,18) | 0,036 |
| Plaquetas (< 150.000) | 3,07 (1,11-8,45) | 0,03 | 6,47 (2,05-20,44) | 0,001 |
| Enfermedad reumática | 8,03 (1,78-36,15) | 0,007 | 5,85 (0,57-59,55) | 0,136 |
| Edad (> 65 años) | 1,47 (0,55-3,97) | 0,442 | 0,66 (0,18-2,36) | 0,519 |
ETV: evento tromboembólico previo; HR: hazard ratio; IC 95%: intervalo de confianza al 95%.
En este estudio se identificaron algunos factores de riesgo para ETV en adultos hospitalizados con COVID-19 en una institución de tercer nivel. La proporción de ETV en nuestro estudio fue del 3% comparable con publicaciones como la de Dalager-Pedersen et al.23 y Rali et al.24. Sin embargo, la frecuencia de ETV fue mucho más baja que en los observadas en otras cohortes15,25–30. Esto sugiere un subdiagnóstico de estos eventos, que podría relacionarse a limitaciones en los recursos durante la pandemia (escaso personal de salud, sobrecarga laboral, etc.), o a inestabilidad del paciente, entre otros, lo que lleva a pensar en la necesidad de nuevas estrategias diagnósticas de fácil acceso y a la cabecera del paciente como la ecocardiografía, que posibilita la detección de signos indirectos de TEP y facilita la búsqueda activa de este tipo de complicaciones.
En concordancia con nuestros hallazgos, varios estudios no encontraron asociación entre la edad y el riesgo de presentar ETV25,26,28,31, sin embargo, Cui et al.32 y Klok et al.13 reportaron que a mayor edad se incrementa la probabilidad de padecer de ETV. Esta discrepancia podría atribuirse, por un lado, a una mayor incidencia de ETV en tales estudios, en comparación con nuestra cohorte y, por otro lado, a que solo incluyeron pacientes hospitalizados en UCI, con mayor riesgo de base, de presentar ETV en COVID-1915,25,33 y añade morbilidad en los pacientes con mayor edad.
En nuestra cohorte, el antecedente de enfermedad neoplásica, un clásico factor de riesgo para enfermedad tromboembólica, no mostró asociación con ETV en pacientes con infección por SARS-CoV-2, hallazgo compatible con otras cohortes25,26. Aunque una baja frecuencia de neoplasias en nuestra población impide sacar conclusiones, es posible que el mecanismo para activar los factores de la coagulación podría diferir entre enfermedades.
Otros reportes no han evidenciado relación entre antecedentes como obesidad, EPOC, HTA, DM25,26,34, enfermedad cerebrovascular, fibrilación auricular, ERC y cáncer activo26 con los ETV en pacientes hospitalizados por COVID-19; sin embargo, algunos estudios reportan que la FA, ECV25, HTA y ERC15 podrían ser factores de riesgo para presentar ETV.
Nuestra cohorte evidenció asociación entre eventos tromboembólicos previos con el riesgo de presentar ETV durante la hospitalización por COVID-19, aunque este hallazgo no se ha evidenciado en otras cohortes25,26,33,35. Ya se ha reportado, además, la no asociación de ETV con biomarcadores como la ferritina y la DHL36.
Consistente con nuestros resultados, varias cohortes no encontraron asociación del dímero D elevado con ETV en pacientes con COVID-1933,36,37. Una cohorte francesa encontró que el dímero D se asoció a ETV25, al igual que otros estudios observacionales15,26,28. Los elevados niveles de dímero D al ingreso de la hospitalización en la población francesa, limitan la comparabilidad con este estudio donde la mediana era más baja. Los niveles de dímero D elevados al ingreso, asociado a recuentos normales de plaquetas y tiempos de coagulación sugieren un estado inflamatorio de base secundario a SARS-CoV-230. En una cohorte donde se analizó la sensibilidad y especificidad de diferentes niveles de dímero D para el diagnóstico de ETV, se encontró que puntos de corte > 500 μg/L exhibieron alta sensibilidad, pero baja especificidad, y los niveles > 1.000 μg/L redujeron la sensibilidad, lo que en resumen puede limitar su aplicación clínica en la detección de ETV en COVID-1938.
En nuestra cohorte se encontró que la trombocitopenia es un factor asociado a ETV, a diferencia de otros estudios25,33 donde la trombocitosis se comportó como un factor de riesgo. Se requieren estudios que evalúen el papel de las plaquetas en este escenario. Se sabe que la trombocitopenia puede ser un signo indirecto del consumo plaquetario secundario a la activación plaquetaria y de la cascada de coagulación, lo que finaliza en la coagulación intravascular diseminada (CID) y, por consiguiente, en eventos tromboembólicos35,39–43.
Este estudio evidenció una asociación de los ETV con los niveles de troponina I positiva al ingreso de la hospitalización por COVID-19, lo que contrasta con los resultados de Loffi et al.26 y Fauvel et al.25, estudios posteriores podrían aclarar el comportamiento de la troponina en el tiempo, de acuerdo al momento de presentación del evento trombótico.
Este estudio fue realizado en una institución de tercer nivel, referencia para pacientes COVID-19 en el municipio de Itagüí, lo que permitió la recolección de un número considerable de sujetos en el período de estudio. El proceso de recolección de información fue acucioso y detallado, además haciendo uso de un instrumento diseñado por los investigadores para recabar datos, todo esto con el fin de disminuir es sesgo de información.
La baja frecuencia de ETV en nuestro estudio podría denotar un alto riesgo de sesgo de clasificación, sin embargo, se usaron definiciones soportadas en las guías internacionales para las variables dependientes e independientes, con el objetivo de minimizar su impacto. Para controlar el sesgo de selección, se incluyeron a todos los pacientes con prueba RT-PCR positiva para SARS-CoV-2, o pruebas inmunológicas (antigénica o serológica) positivas e imágenes diagnósticas (radiografía de tórax/TACAR de tórax/angiotomografía de tórax), que sugieran patrón de neumonía viral; se realizó una verificación cruzada de la información de las pruebas RT-PCR para SARSCoV-2 de la historia clínica y los reportes de la página de SISMUESTRAS y PROLAB, respectivamente.
La baja frecuencia de eventos tromboembólicos se convierte en una limitación, pero permite evidenciar la necesidad de una búsqueda de vigilancia activa de este tipo de complicaciones en los pacientes hospitalizados por COVID-19.
Pese a las limitaciones dadas por una fuente de información secundaria y el carácter retrospectivo, se resalta como uno de los primeros estudios en la población colombiana, en busca de factores asociados al desarrollo de complicaciones tromboembólicas, abriendo la puerta para futuras investigaciones de carácter prospectivo.
ConclusionesEn esta cohorte de pacientes con neumonía por COVID-19 se encontró una incidencia del 3% de ETV. Se evidenció una fuerte asociación entre el desarrollo de complicaciones tromboembólicas y el antecedente de ETV previo. Así mismo, valores de troponina ≧ 0,03 ngr/mL y niveles de plaquetas < 150.000/mm3 guardan relación con la aparición de eventos tromboembólicos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Clínica Antioquia S.A. de Itagüí por permitir el acceso a las historias clínicas de pacientes atendidos en sus diferentes servicios.