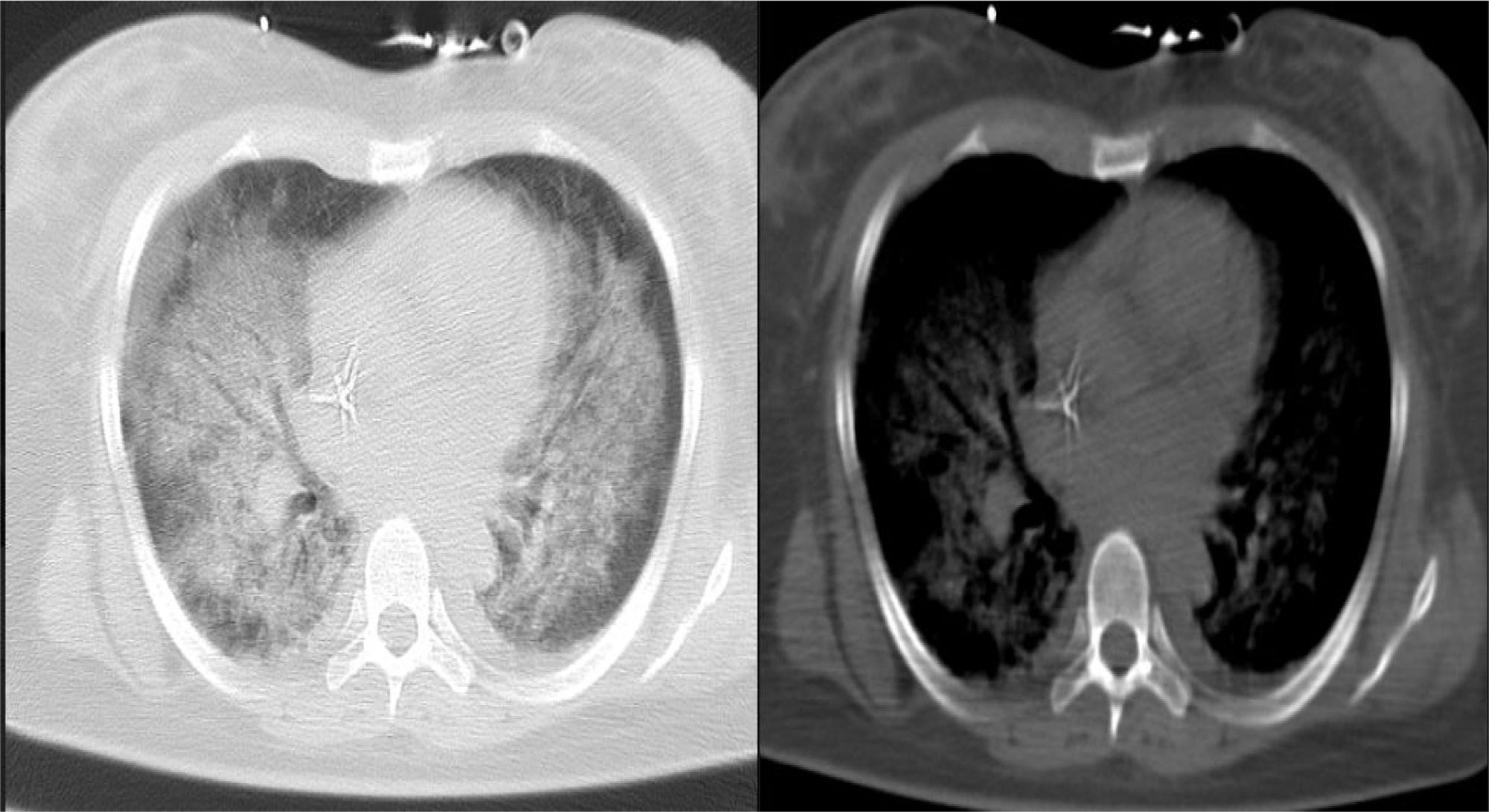
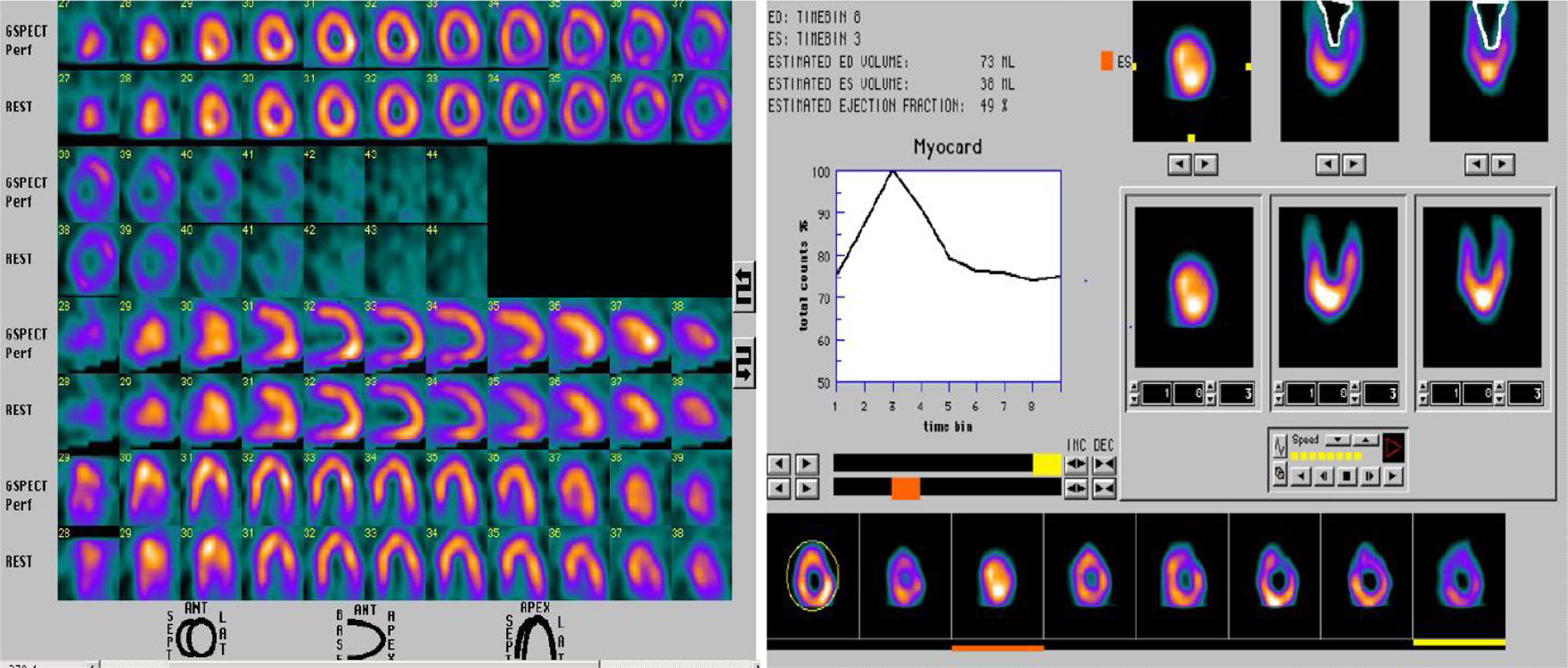
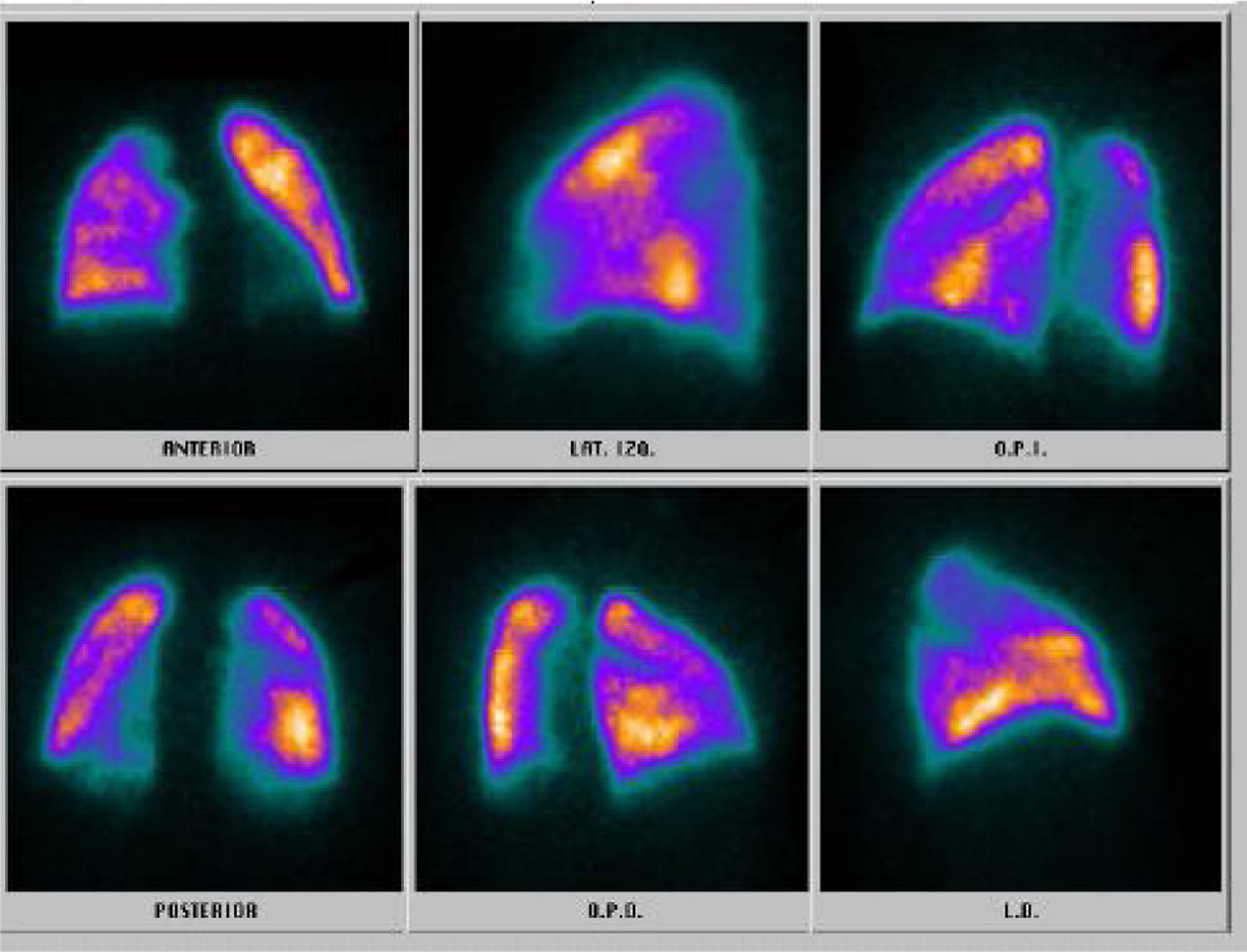
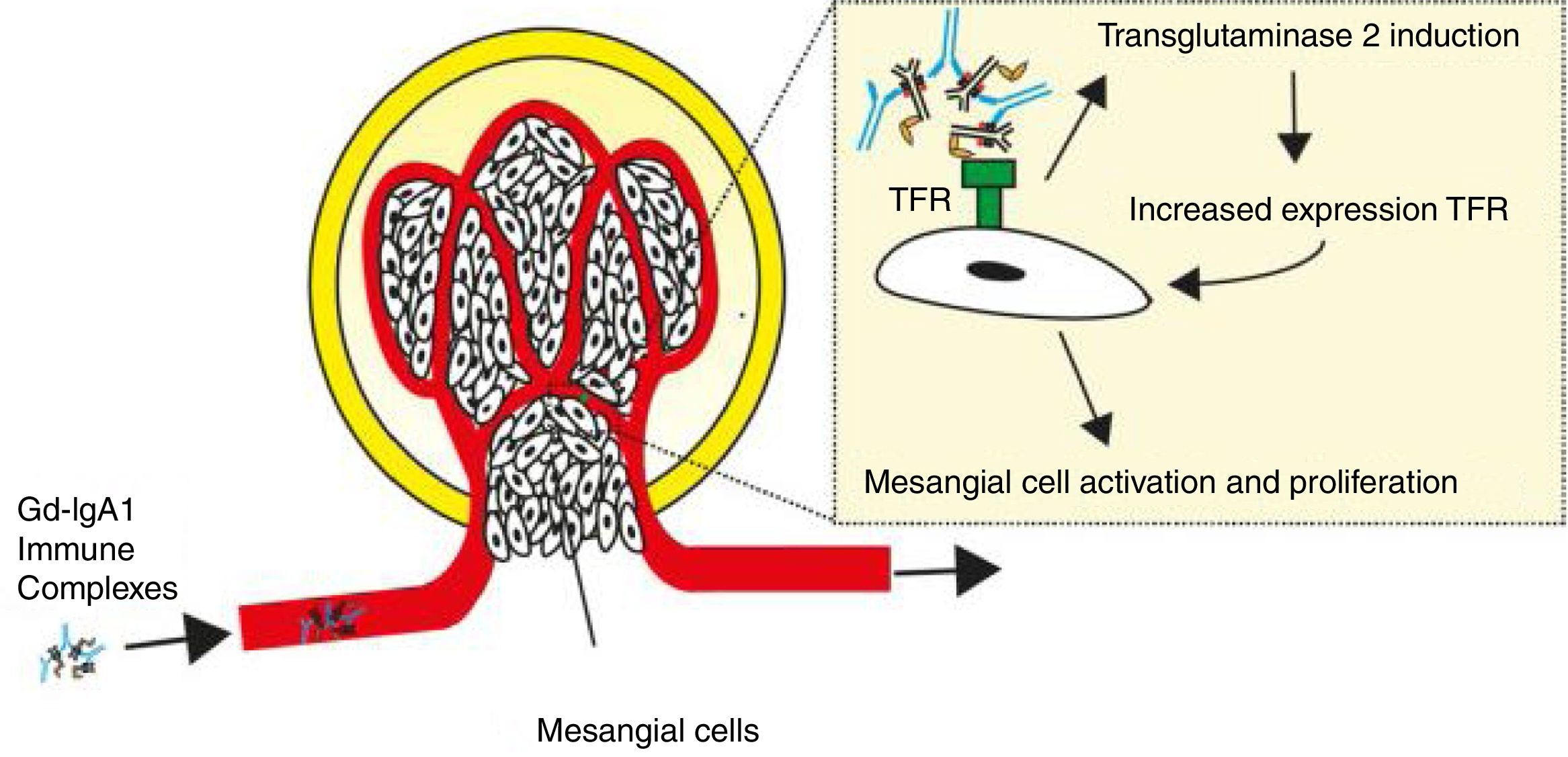
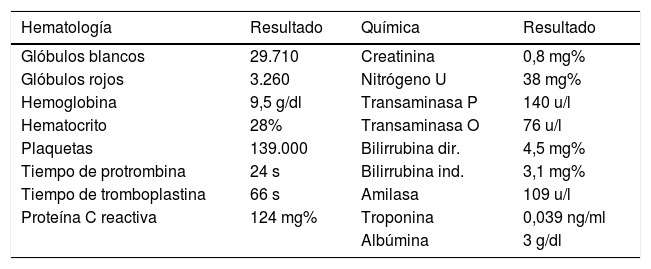
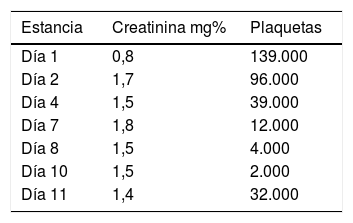
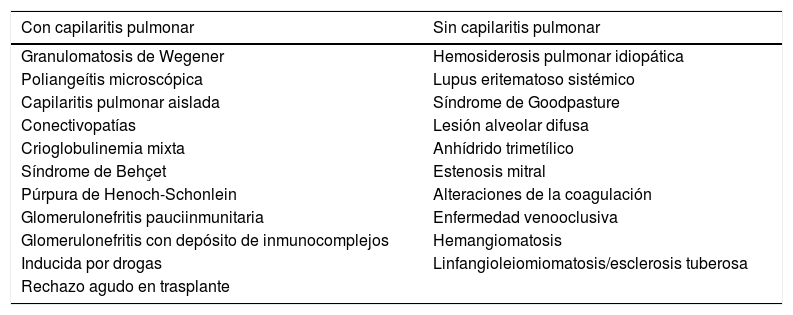
El shock séptico al interior de la unidad de cuidados intensivos produce múltiples disfunciones orgánicas de manera aguda, las cuales son diversas y variadas en su presentación y dependen mucho del tipo del huésped, predisposición genética y grado de injuria; sin embargo, algunos agentes etiológicos generadores del síndrome en subgrupos de pacientes están íntimamente ligados con manifestaciones específicas que, de no tenerse en cuenta, podrían pasarse por alto y empeorar el desenlace de nuestros pacientes. Presentamos el caso clínico de una mujer de 39 años de edad con alteración en la inmunidad humoral y en la estructura endotelial, condicionantes de vasculitis de pequeño vaso.
Septic shock in intensive care units produces several acute onset organic dysfunctions, which are diverse and varied in their presentation and depends on the host, genetic predisposition and injury. However, some aetiological agents that cause syndromes in certain patient groups are closely linked with specific settings that if not clearly identified could be worse for the patients. The case is presented of a 39 year-old female with impaired humoral immunity and impaired endothelial structure due to small vessels vasculitis.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora