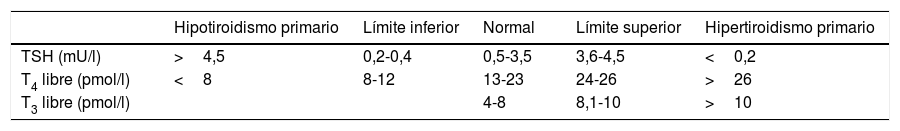
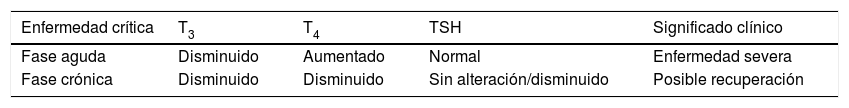
La disfunción tiroidea es una condición que puede estar presente en la unidad de cuidados intensivos (UCI). Algunos medicamentos utilizados con frecuencia en la UCI conllevan una disminución de las hormonas tiroideas, debido a que generan una disfunción en el eje hipotálamo-hipófisis-tiroides. La comprensión de la fisiopatología tiroidea permite una interpretación adecuada de las pruebas para la evaluación de la glándula tiroides. Debido a su alta disponibilidad, la identificación de las alteraciones tiroideas se realiza de forma oportuna. Aunque se han realizado diversos estudios respecto a las alteraciones de la glándula tiroides en el paciente crítico, el tratamiento aún no está totalmente descrito y es controversial, por lo cual se considera que el paciente debe ser individualizado.
Thyroid dysfunction is a condition that can be present in the intensive care unit (ICU). Some medications frequently used in the ICU lead to a decrease in thyroid hormones, due to leading to a dysfunction in the hypothalamus-pituitary-axis. An understanding of the thyroid pathophysiology enables the tests to be interpreted appropriately for the evaluation of the thyroid gland. Due to the high availability of these tests, the identification of the thyroid alterations is done in a timely manner. Although several studies have been conducted regarding alterations of the thyroid gland in the critically ill patient, the treatment is not yet fully described and is controversial, which is why it is considered that the patient treatment should be individualised.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora