La sepsis es un factor asociado con disfunción muscular respiratoria en cuidado intensivo.
ObjetivoDeterminar el cambio en la presión inspiratoria máxima (Pimáx) y factores asociados en pacientes sépticos y no sépticos con ventilación mecánica.
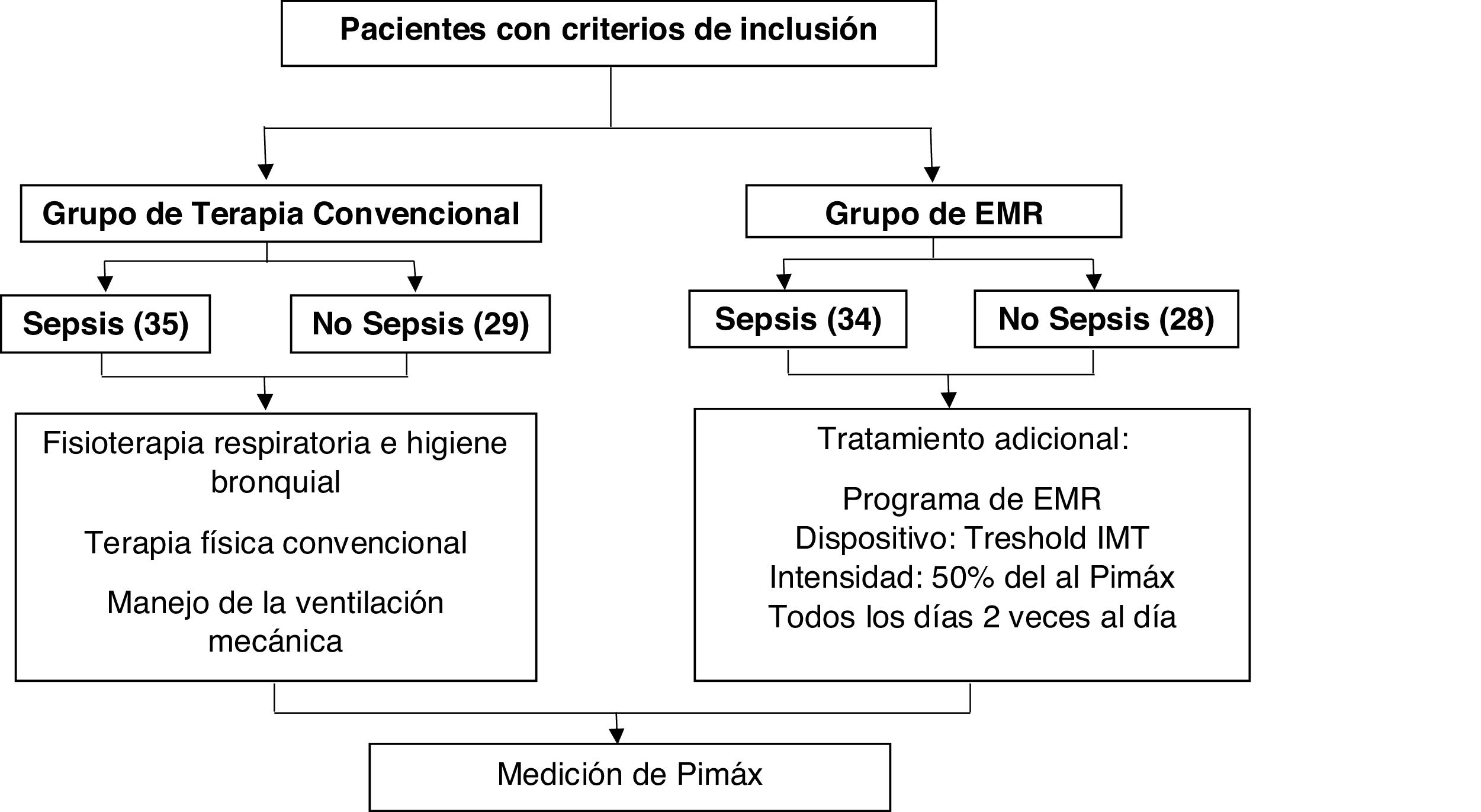
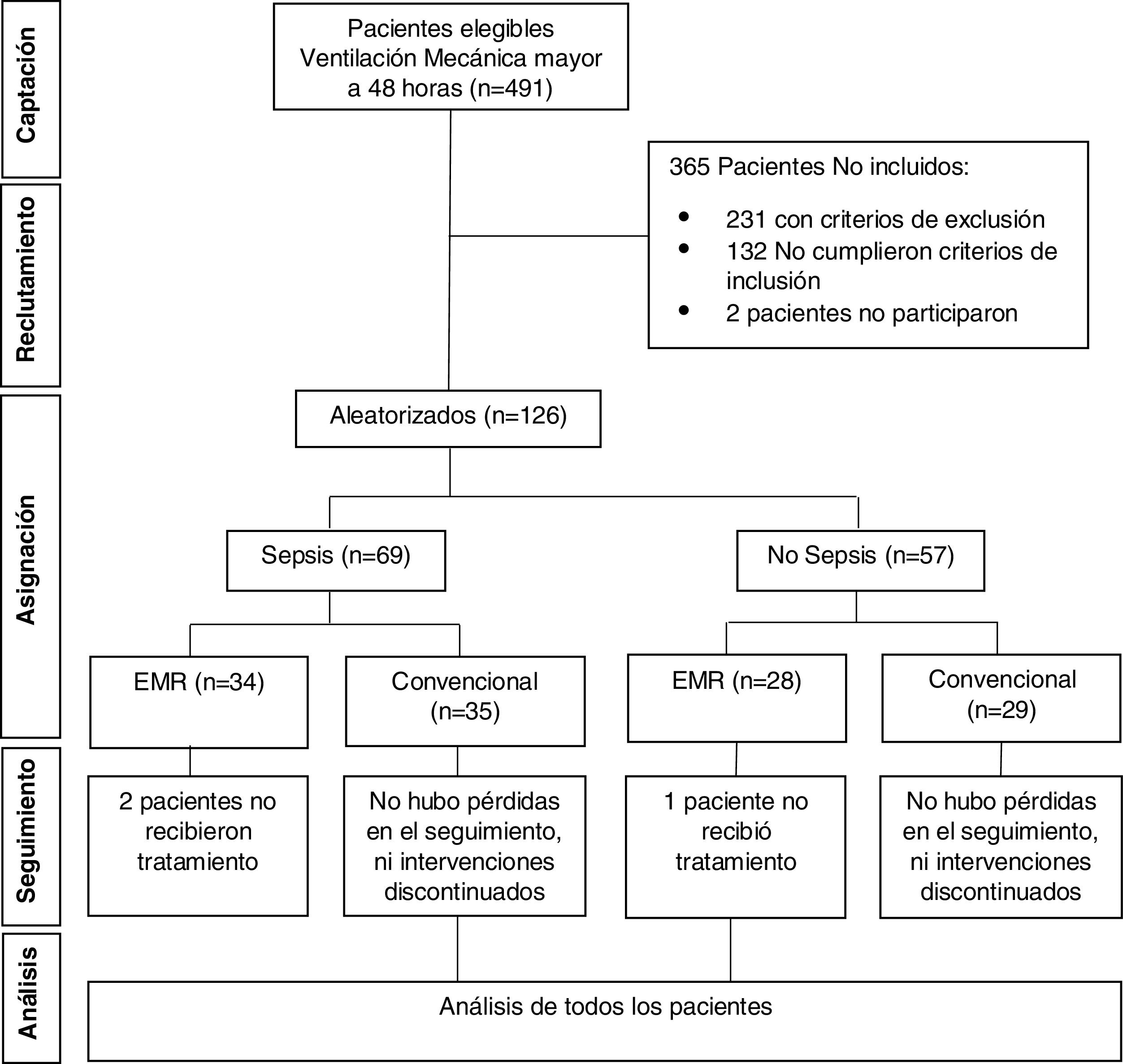
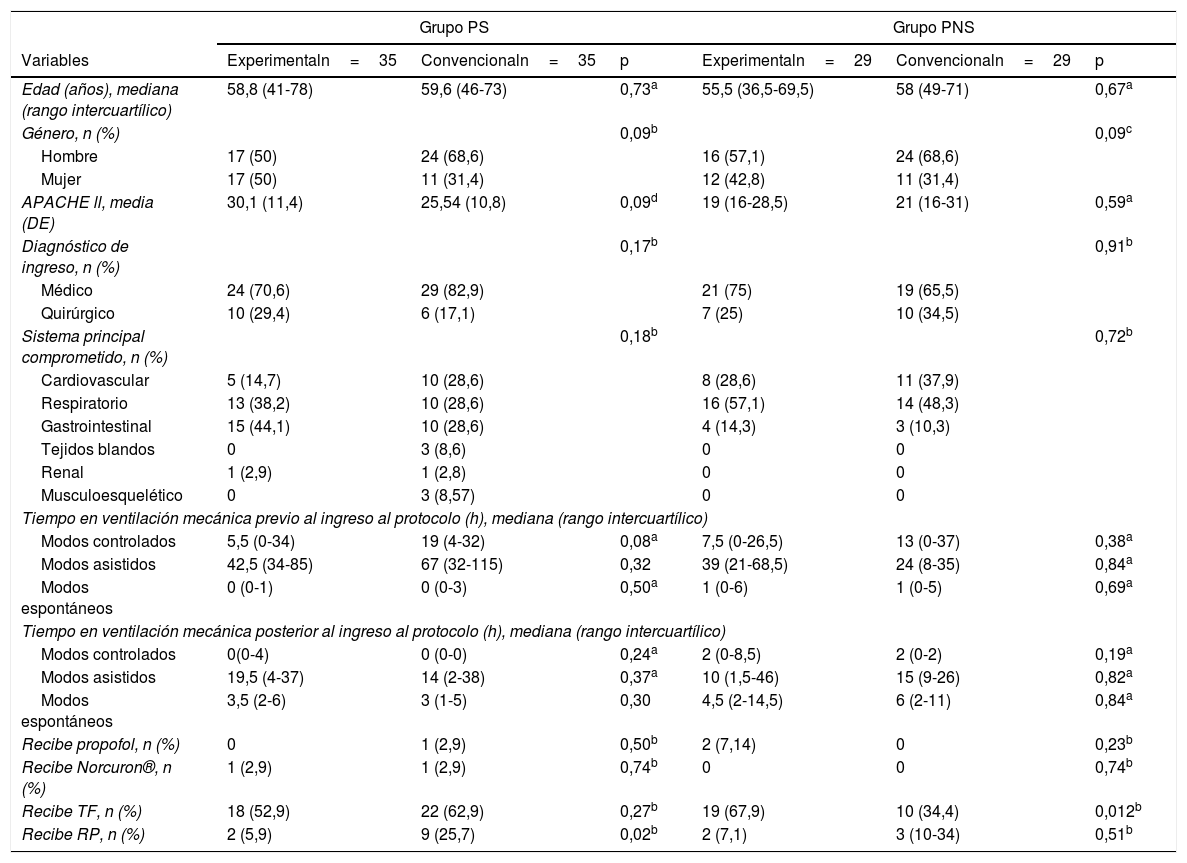
MétodosEstudio descriptivo que analizó la base de datos del ensayo clínico «Eficacia del entrenamiento muscular respiratorio en el destete de la ventilación mecánica en pacientes con ventilación mecánica por 48 o más horas». Se identificó la diferencia en la mediana de la Pimáx final entre grupos de intervención según condición de sepsis y no sepsis, y los factores asociados en cada grupo.
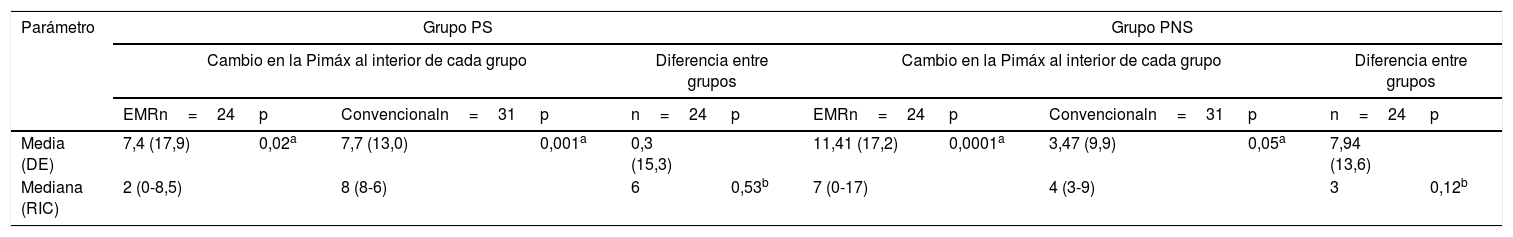
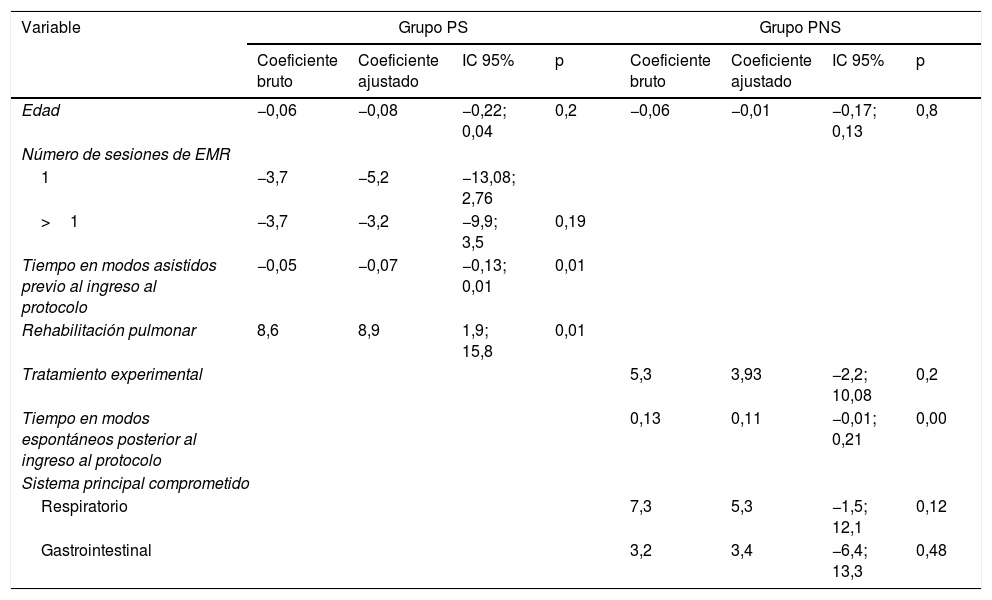
ResultadosTanto en los pacientes sépticos como en los no sépticos la diferencia en el promedio del cambio en la Pimáx al interior de cada grupo (intervención y control) fueron significativas: grupo de sepsis (p=0,02 y p=0,001) y no sepsis (p=0,0001 y p=0,05). En los pacientes sépticos el cambio en la Pimáx disminuyó 0,07cmH2O (p=0,01; IC 95% −0,13; 0,01) con el tiempo en modos asistidos previo al ingreso al protocolo, y se incrementó 8,9cmH2O al recibir rehabilitación pulmonar. En los no sépticos el cambio en la Pimáx disminuyó 0,11cmH2O con el tiempo en modos espontáneos posterior al ingreso al protocolo.
ConclusiónEn pacientes sépticos el cambio en la Pimáx disminuyó con el tiempo en ventilación mecánica en modos asistidos y se incrementó al recibir rehabilitación pulmonar; en pacientes no sépticos, disminuye con el tiempo en ventilación mecánica en modos espontáneos.
Sepsis is a factor associated with respiratory muscle dysfunction in intensive care.
ObjectiveTo determine change in maximal inspiratory mouth pressure (Pimax) and associated factors in septic and non-septic patients with mechanical ventilation.
MethodsDescriptive study that analysed the clinical trial database “Efficacy of respiratory muscle training in weaning of mechanical ventilation in patients with mechanical ventilation for 48hours or more”. The difference in the median of the final Pimax between intervention groups according to sepsis and non-sepsis conditions, and the associated factors in each group were identified.
ResultsIn both septic and non-septic patients, the difference in the mean change in Pimax within each group (intervention and control) was significant: sepsis group (P=.02 and P=.001) and non sepsis group (P=.0001 and P=.05). In septic patients the change in Pimax decreased by .07cmH2O (P=.01; 95% CI −.13; .01) over time in assisted modes before entering the protocol, and increased by 8.9cmH2O on receiving pulmonary rehabilitation. In non-septic patients, the change in Pimax decreased .11cmH2O over time in spontaneous modes after entering the protocol.
ConclusionIn septic patients the change in Pimax decreased over time on mechanical ventilation in assisted modes and increased when receiving pulmonary rehabilitation; in non-septic patients, spontaneous modes decreased with mechanical ventilation over time.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora