De entre as alternativas existentes, o tratamento de defeitos ósseos pode ser feito com a utilização de biomateriais inorgânicos, que ficam sujeitos a vários fatores inerentes ao organismo recetor. Vários estudos apontam para a influência da aplicação da calcitonina e da grelina na reparação de defeitos ósseos.
ObjetivoComparar o efeito da grelina e da calcitonina na regeneração de defeitos ósseos preenchidos com matriz óssea equina em ratos.
Materiais e métodosDez ratos Wistar, fêmeas e adultos, foram distribuídos aleatoriamente por três grupos com 3, 3 e 4 animais, respetivamente. Foram realizados defeitos ósseos biparietais com 4mm de diâmetro, preenchidos com matriz óssea equina (Bio-Gen®). O grupo controlo não recebeu administração de hormonas; o grupo experimental calcitonina recebeu calcitonina (Miacalcin® Sandoz) 0,05mL, via intramuscular, no pós-operatório imediato e semanalmente, até à semana que antecedia o sacrifício; o grupo experimental grelina recebeu grelina (Ghrelin Rat®, Peptide) 0,031mL, via subcutânea, no mesmo esquema posológico. Os animais foram sacrificados à 5a e 7a semanas após a cirurgia e as amostras recolhidas foram analisadas macroscopicamente e histologicamente.
ResultadosVerificou-se a presença de novo tecido ósseo à 5a semana no grupo grelina e apenas a existência de uma matriz óssea colágena organizada no grupo calcitonina. À 7a semana, observou-se uma atividade de neoformação óssea mais acentuada no grupo calcitonina.
ConclusãoA administração de grelina, parece favorecer mais a neoformação óssea em torno dos grânulos de biomaterial à 5a semana, embora se observe um efeito mais significativo com a calcitonina à 7a semana.
From among the existing alternatives, treatment of bone defects can be done with the use of inorganic biomaterials, which shall be subject to a number of factors inherent to the recipient organism. Several studies point to the influence of calcitonin and ghrelin in repair of bone defects.
PurposeTo compare the effect of ghrelin and calcitonin in the repair of bone defects fulfilled with equine bone matrix in rats.
Materials and methodsTen adult female Wistar rats were distributed into three groups with 3, 3 and 4 animals, respectively. Bilateral calvarial bone defects with 4mm of diameter were produced and fulfilled with Bio-Gen® equine bone matrix. The control group didn’t received any hormonal treatment; the calcitonin experimental group received calcitonin (Miacalcin®, Sandoz) 0,05mL intramuscular, in the immediate postoperative period and weekly administrations until the week before the sacrifice; the ghrelin experimental group received ghrelin (Ghrelin Rat® Peptide) 0,031mL subcutaneous, with a similar schedule. The animals were sacrificed at 5th and 7th weeks after the surgery and calvarial bones were submitted to clinical and microscopic evaluation.
ResultsIt was found the presence of new bone tissue in ghrelin group and only the existence of an organized collagen bone matrix in calcitonin group at 5th week. At 7th week, bone neoformation was more pronounced in calcitonin group.
ConclusionThe administration of ghrelin seems to favour bone formation around the biomaterial granules at 5th week, although we had note a more significant effect with calcitonin at 7th week.
A remodelação óssea é o processo através do qual se estabelece o equilíbrio entre os efeitos catabólicos dos osteoclastos (reabsorção) e os efeitos anabólicos dos osteoblastos (formação)1,2.
A regulação do metabolismo ósseo engloba fatores locais e sistémicos. As hormonas sistémicas mais relevantes neste processo são a paratormona, a vitamina D3, a calcitonina, a hormona de crescimento, as hormonas sexuais e os glicocorticóides. As citocinas com produção local exercem influência na aposição e reabsorção e vários fatores de crescimento acabam por ter efeitos locais e sistémicos1,2.
A vascularização assume um papel importante, pois possibilita a troca de nutrientes, oxigénio e metabolitos. A ausência de inervação parece provocar osteopenia e fragilidade óssea em pacientes com distúrbios neurológicos e diminuição da densidade óssea em mandíbulas sem inervação2.
A reparação de defeitos ósseos constitui um desafio para médicos e médicos dentistas. Os métodos tradicionais de tratamento têm por base a utilização de enxertos ósseos autógenos (transplante de um local anatómico (dador) para outro local (recetor) do mesmo paciente). Embora este tipo de enxerto seja imunologicamente seguro, apresenta a necessidade de uma cirurgia extra para a recolha do enxerto da área dadora (cuja quantidade disponível é reduzida)3.
Os enxertos ósseos alógenos (entre indivíduos da mesma espécie), apesar de dispensarem a segunda intervenção cirúrgica e a quantidade de osso disponível ser ilimitada, apresentam o risco de transmissão de doenças e a imunogenicidade3.
Nos enxertos ósseos xenógenos, a espécie do organismo dador é distinta da do organismo recetor. A quantidade de tecido passível de ser obtida é maior3.
Os substitutos ósseos aloplásticos permitem a utilização de um material disponível em grande quantidade, purificado, sem risco de transmissão de doenças e apresentam resistência, flexibilidade e crescimento variáveis3.
A velocidade de regeneração óssea vai depender de vários fatores, de que são exemplo as hormonas4.
A calcitonina é uma hormona de ação direta no metabolismo mineral, sendo fundamental na recuperação e manutenção da homeostasia óssea1,4. É secretada pelas células C/ parafoliculares da tiroide em mamíferos e causa hipofosfatemia e hipocalcemia. Possui uma ação analgésica, anti-inflamatória e anti-osteoclástica4–7. A calcitonina altera as estruturas responsáveis pela reabsorção óssea (zona clara e o bordo em escova). Apresenta um efeito anabólico preponderante, proporcionando o aumento da atividade osteoblástica e da mineralização do tecido osteoide, assim como a redução do número de osteoclastos por bloqueio do processo que lhes dá origem5–8.
Ultimamente foi isolado um ligando endógeno para o recetor da hormona de crescimento a partir do estômago humano e de rato, sendo designado por grelina. A grelina é um peptídeo constituído por 28 aminoácidos, que possui uma única modificação pós-translaccional no terceiro resíduo de serina, onde se localiza o éster n-octanoil, que lhe proporciona a capacidade de estimulação da secreção somatotrópica. Esta hormona difere em apenas dois aminoácidos em relação à do rato9–17.
A grelina é expressa mais abundantemente nas células especializadas das glândulas oxínticas do epitélio gástrico e 60 a 70% da grelina circulante é secretada pelo estômago, sendo a restante originada no intestino delgado. Foi demonstrada a expressão de baixos níveis de grelina nas células ¿ dos ilhéus pancreáticos, hipotálamo, hipófise, pulmão, córtex adrenal, rim, osso, líquido cérebro-espinal, tecido testicular e placenta9,10,14,17.
Os níveis plasmáticos de grelina estão aumentados no jejum, antes das refeições e à noite, assim como com a estimulação colinérgica ou administração conjunta de hormona de libertação da hormona de crescimento e arginina. Produzem efeito diminutivo a glicose, a insulina, a glicagina, a hormona de crescimento e a somatostatina. O efeito supressor exercido pela hormona de crescimento na expressão de grelina no estômago e seus níveis sistémicos sugere a existência de regulação por mecanismo de feedback negativo entre o estômago e a hipófise9–11.
O recetor do secretagogo da hormona de crescimento (GHS) apresenta duas isoformas: a GHS-1a (ativa) e a GHS-1b (inativa, truncada). Pensa-se que existe um recetor ao qual se liga a grelina não acetilada, uma vez que esta não ativa o recetor GHS-1a9–14,17.
A grelina pode ainda influenciar o crescimento dos osteoblastos. O estômago desempenha um papel importante no metabolismo ósseo, uma vez que as células X/A like das glândulas oxínticas do fundo do estômago produzem grelina, que posteriormente se vai ligar a recetores existentes no osso9,13. Estudos realizados mostram que a administração oral de GHS aumenta o turnover ósseo em seres humanos. A grelina estimula a replicação dos osteoblastos e aumenta a produção de fosfatase alcalina e osteocalcina. Também se observou que a proliferação osteoblástica não era dependente da dose de grelina, o que leva a conjeturar que por aumento da dose, os peptídeos reconhecessem diversos subtipos de recetores, inibindo, de certa forma, a atividade proliferativa13.
Fukushima et al. verificaram que os osteoblastos respondiam à sinalização da grelina, uma vez que dispõem dos recetores específicos para esta hormona, estimulando a sua proliferação e diferenciação. Observou-se igualmente a promoção da transcrição de genes que codificam os marcadores de diferenciação dos osteoblastos, embora não alterasse a do Runx2. Pode-se afirmar que a grelina atua diretamente sobre os osteoblastos e pode regular o metabolismo ósseo por via neuronal14,15.
A grelina desempenha um papel importante na regulação da proliferação celular e diferenciação e inibe a proliferação celular em carcinomas da próstata. Sugere-se também que a grelina possa desempenhar um papel na modulação da diferenciação de células mesenquimatosas16.
Num estudo realizado por Deng et al., verificou-se que a grelina estimulava a reparação do osso intramembranoso, uma vez que a administração local desta hormona aumentava a formação de novo osso em defeitos ósseos criados na calvária de ratos, aumentando a densidade mineral óssea e o calo ósseo formado nos que foram tratados com grelina. Verificou-se um aumento da expressão da fosfatase alcalina, osteocalcina e colagénio tipo I (marcadores da osteogénese)16.
A grelina pode ter um efeito indireto sobre o osso por estimulação da libertação da hormona de crescimento. O agonista do recetor GHS-R1a inibe os marcadores da reabsorção óssea no rato, efeito esse que não é observado no tratamento com hormona de crescimento. Isto sugere que os secretagogos devam ter efeitos independentes da hormona de crescimento no osso do rato. Sabe-se que extratos da mucosa oxíntica levam à mobilização de cálcio intracelular para linhas de células osteoblásticas, o que sugere a presença de uma hormona osteotrópica na mucosa gástrica16–18.
Tendo em conta o que foi anteriormente exposto e que a ocorrência de defeitos ósseos craniofaciais é frequente por trauma, anomalias de desenvolvimento, ressecção tumoral, infeção ou outros tipos de patologias, realizou-se o trabalho experimental seguidamente descrito, com vista a realizar o estudo comparativo do efeito da grelina e da calcitonina na regeneração de defeitos ósseos.
Materiais e métodosForam utilizados 10 ratos Wistar fêmeas com 19-21 semanas de vida, que durante o período de ensaio foram alojados em gaiolas isoladas, colocadas em armário devidamente programado em termos de temperatura, humidade, circulação de ar, pressão e ciclos de luz/escuridão. Foi fornecida água e ração apropriada ad libitum. Os animais foram aleatoriamente divididos em 3 grupos: um grupo com 3 animais (grupo controlo, cujos defeitos ósseos foram apenas preenchidos com osso equino desvitalizado, desantigenizado (Bio-Gen®, Bioteck), outro grupo com 3 animais (grupo experimental, cujo preenchimento dos defeitos ósseos foi feito de modo semelhante ao do grupo controlo, mas que recebeu uma injeção de calcitonina de salmão 0,05mL (2UI) (Miocalcin®, Sandoz), via intramuscular, no pós-operatório imediato e administrações semanais até à semana anterior ao sacrifício dos animais) e um grupo de 4 animais (grupo experimental, sujeito ao mesmo procedimento de preenchimento dos defeitos ósseos criados, com o mesmo material e que recebeu grelina de rato (Ghrelin Rat®, Peptide), 0,031mL, via subcutânea, no mesmo regime posológico que a calcitonina).
Os animais foram submetidos a anestesia geral, tendo sido primeiramente introduzidos numa câmara, na qual estiveram sujeitos a anestesia inalatória com isoflurano (IsoFlo®, veterinaria Esteve).
Em seguida, foram anestesiados com uma preparação 1:1 de Ketamina (Imalgene®, Merial) 80-100mg/kg e Xilazina (Rompum®, Bayer) 5-10mg/kg, por via intra-peritoneal.
Após o registo do peso corporal dos animais, realizou-se uma ligeira tricotomia da cabeça dos mesmos e desinfectou-se a zona a intervencionar com solução iodada (Betadine®, solução cutânea 100mg/mL, MEDA Pharma).
Foi feita uma incisão sagital ao nível da sutura mediana, utilizando uma lâmina n°15 montada em cabo de bisturi, estendendo-se desde a parte posterior à sutura coronal até à sutura parieto-occipital.
Procedeu-se à reflexão do plano cutâneo com o auxílio de afastadores, descoladores e pinças de dissecção e fez-se o descolamento do periósteo, de modo a refletir o pericrânio da tábua óssea externa e aceder aos ossos parietais.
Em seguida, realizaram-se defeitos ósseos circulares bilaterais nos ossos parietais, com 4mm de diâmetro e uma distância de 1,8mm entre ambos, não interferindo com nenhuma das suturas referidas, com o auxílio de uma broca tronco-cónica de 4mm montada em micromotor, sempre com abundante irrigação com soro fisiológico estéril (NaCl 0,9%®, 250mL, Braun) e não lesando a dura mater nem atingindo o seio sagital.
Colocou-se o biomaterial anteriormente referido nos defeitos ósseos criados, condensando-o bem, de modo a que estes ficassem totalmente preenchidos. Seguiu-se o encerramento dos tecidos, que foi realizado por planos – o periósteo foi suturado com ponto em cruz com fio reabsorvível de ácido poliglicólico, entrançado, revestido (Safil® 4/0 Braun) e a pele foi suturada com pontos simples e utilizando o mesmo tipo de fio de sutura.
Após a realização do ato operatório, foi administrada a primeira dose de calcitonina aos animais do 2° grupo (0,05mL ou 2 UI, via intramuscular) e a primeira dose de grelina aos do 3° grupo (0,031mL, via subcutânea), tendo as restantes administrações seguido a planificação anteriormente referida.
O sacrifício dos ratos ocorreu à 5a e 7a semanas pós-operatórias, recorrendo à sobredosagem de preparação anestésica. Fez-se uma incisão com as mesmas características e localização que a anteriormente descrita, dissecando cuidadosamente os tecidos moles e promovendo o acesso ao local dos defeitos ósseos.
Para obtenção da peça operatória foi utilizado um disco/serra montado em micromotor, sempre com refrigeração, tendo o cuidado de verificar que as margens da peça obtida ficassem a uma distância razoável da zona a estudar.
As amostras obtidas foram colocadas em frascos de plástico devidamente identificados, contendo solução de formaldeído a 4% em tampão fosfato, pH=7,4, durante 48h (fixação) e foram enviadas para realização de processamento histológico de rotina para o Laboratório de Anatomia Dentária da Faculdade de Medicina Dentária da Universidade do Porto.
Antes de se proceder à preparação histológica, as amostras foram seccionadas, de modo a preservar a zona que se pretendia estudar, mas simultaneamente reduzir o seu tamanho, facilitando todo o processamento histológico.
Após fixação, procedeu-se à desidratação, durante a qual as amostras foram colocadas numa série crescente de diferentes concentrações de álcool, começando pela colocação das amostras em frascos individuais, contendo uma solução de etanol a 70% durante 48 horas. Após esse período de tempo, foram sucessivamente colocadas em frascos contendo cada um soluções de álcool etílico a 70, 80, 90 e 100%, permanecendo em cada frasco cerca de 48 horas (no caso da última solução, esta foi substituída 3 vezes, com períodos de permanência de 48 horas cada).
Seguidamente, procedeu-se à inclusão, na qual cada amostra foi colocada individualmente num frasco de vidro contendo 800mL/L de metilmetacrilato (Methyl Methacrylate BDH®), 200mL/L de Plastoid (Plastoid N®, Rohm Pharma) e 1g/L de Perkadox (Akzo® Chemicals Bv, Holand). Os frascos ainda abertos foram colocados em vácuo durante 15 minutos, para remover bolhas de ar que pudessem ocorrer e foram fechados e colocados em banho-maria a 37°C durante 48 horas, de modo a verificar-se a total polimerização dos blocos.
Após a inclusão, realizou-se o corte dos blocos com o auxílio de um micrótomo para tecidos duros não descalcificados, com abundante lubrificação e refrigeração, a uma rotação de 2500rpm, de modo a obter-se cortes com espessuras médias de 150-200μm.
Para a obtenção de cortes com menor espessura (cerca de 40μm), foi utilizado um equipamento de polimento (DAPS®, Struers, Dinamarca) com vários discos de granulometrias sucessivamente menores, começando com os de granulometrias de #1000, #1200 (P1000 e P1200, 3M 734® e 3M 714®, Reino Unido) e terminando com os de grão superfino (SF737, 3M®, Reino Unido), tendo-se confirmado a espessura com um micrótomo digital (Digimatic Micrometer®, Mytotuyo, Japão).
Antes de se proceder à coloração, as amostras foram colocadas em banho de ultrassons durante alguns minutos, a fim de remover resíduos do polimento.
A coloração utilizada foi a Solocrom. As amostras obtidas foram ainda colocadas em lâminas de vidro coladas com Permacol (Ind Permacol UV®, Adhesive 327/3, Permacol Ind. Holanda), polimerizado por luz ultravioleta. A colocação da lamela sobre a amostra seguiu o mesmo procedimento, tendo sempre o cuidado de evitar a inclusão de bolhas de ar. As lâminas foram devidamente identificadas e observadas no microscópio ótico do laboratório (Leica DMLB®, Wetzlar, Alemanha). As imagens foram captadas por uma câmara de vídeo que se encontrava acoplada ao referido microscópio e emitidas num ecrã de computador (Leica Q 500Iw®, Wetzlar, Alemanha), tendo sido utilizado o software de aquisição e análise de imagem específico para o efeito (Leica Lida, Leica Imaging Systems®, Reino Unido, Cambridge, 1996), através do qual se procedeu a uma avaliação qualitativa da área de preenchimento de cada defeito ósseo realizado.
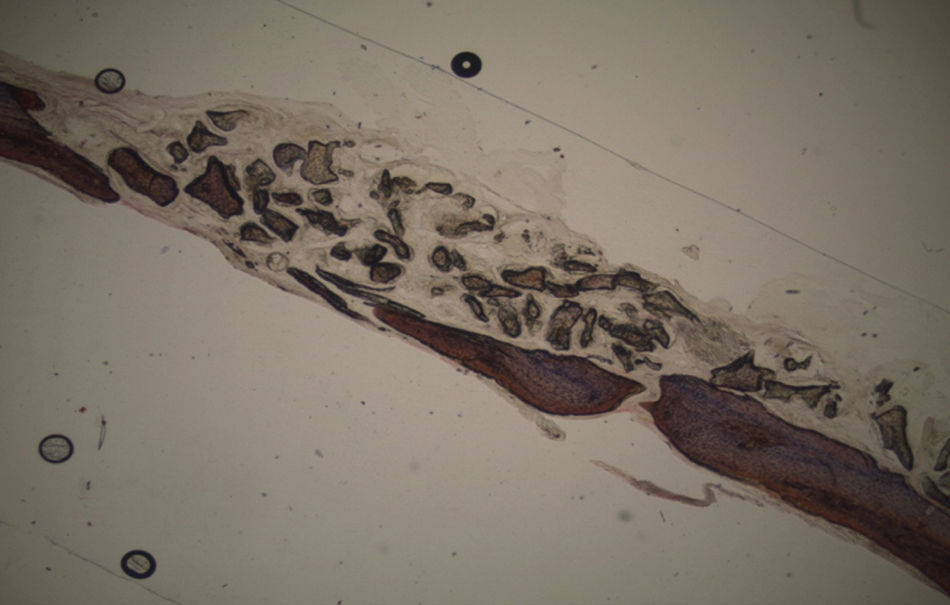
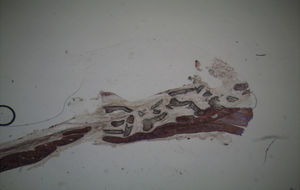
ResultadosTodos os animais ganharam peso, tendo ocorrido o óbito do animal n°3 do grupo controlo durante o recobro. Por análise macroscópica das amostras, não se verificou a ocorrência de quaisquer fraturas das calotes intervencionadas nem calcificações ectópicas. Quer nas amostras referentes aos animais sacrificados à 5a semana pós-operatória, quer nas dos animais sacrificados à 7a semana pós-operatória era visível o contorno dos defeitos ósseos criados.
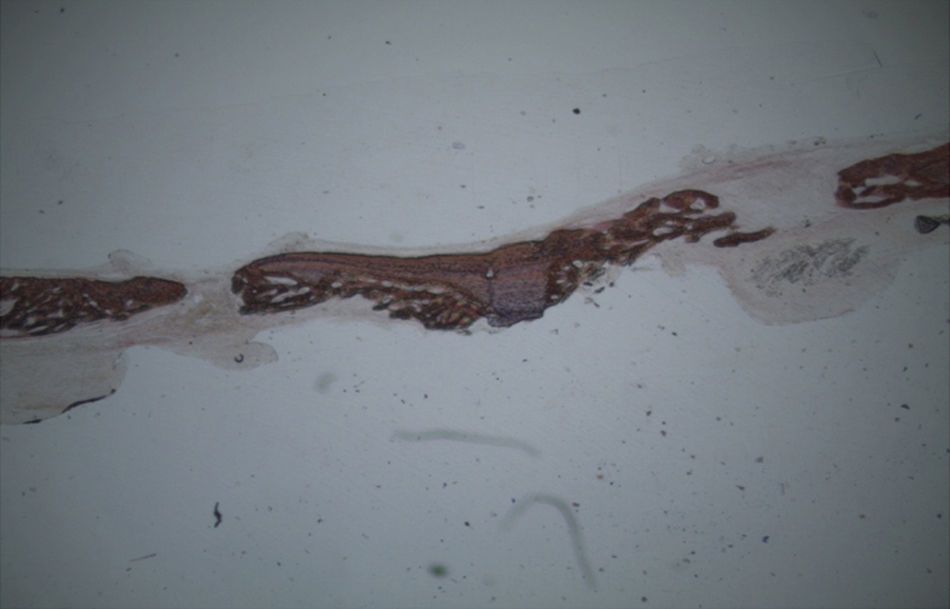
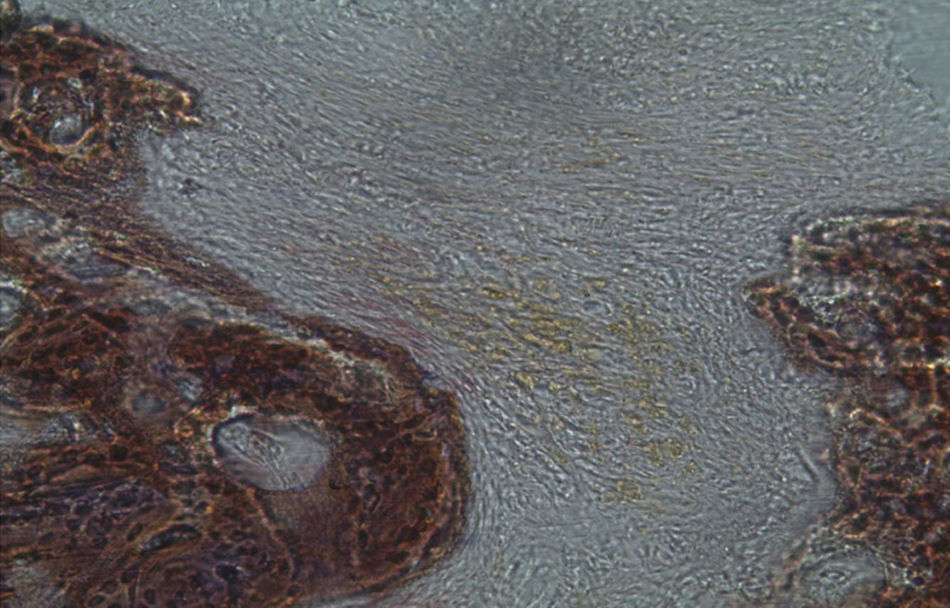
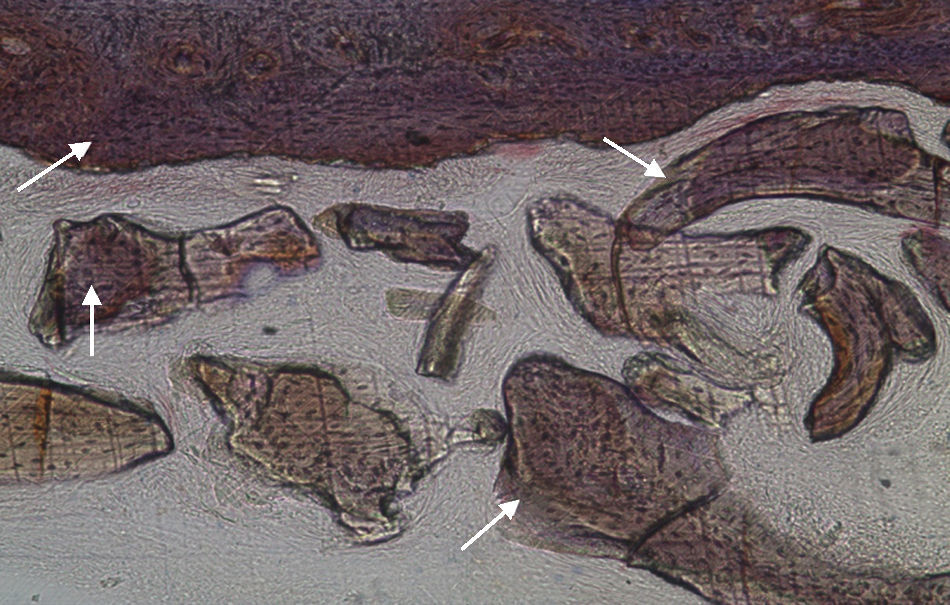
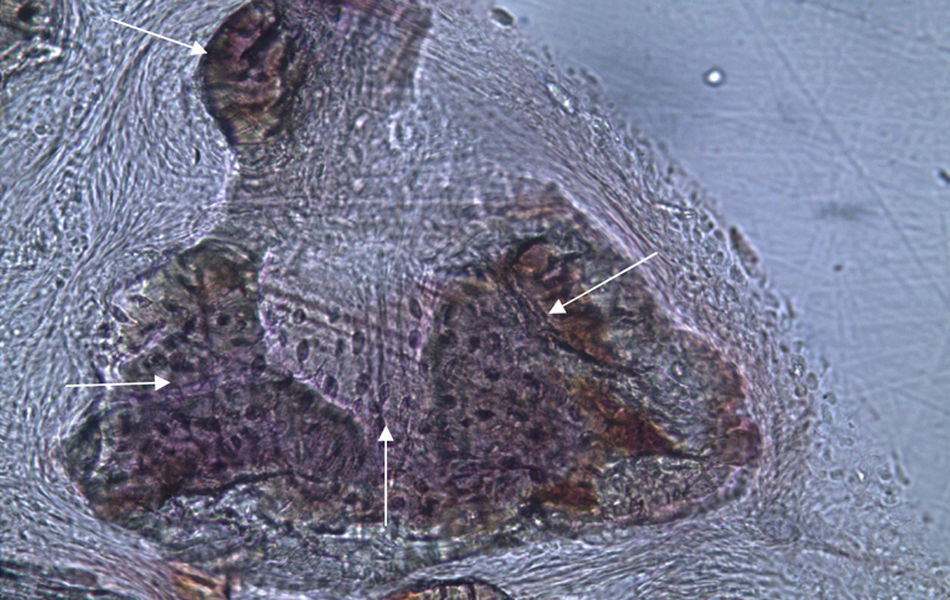
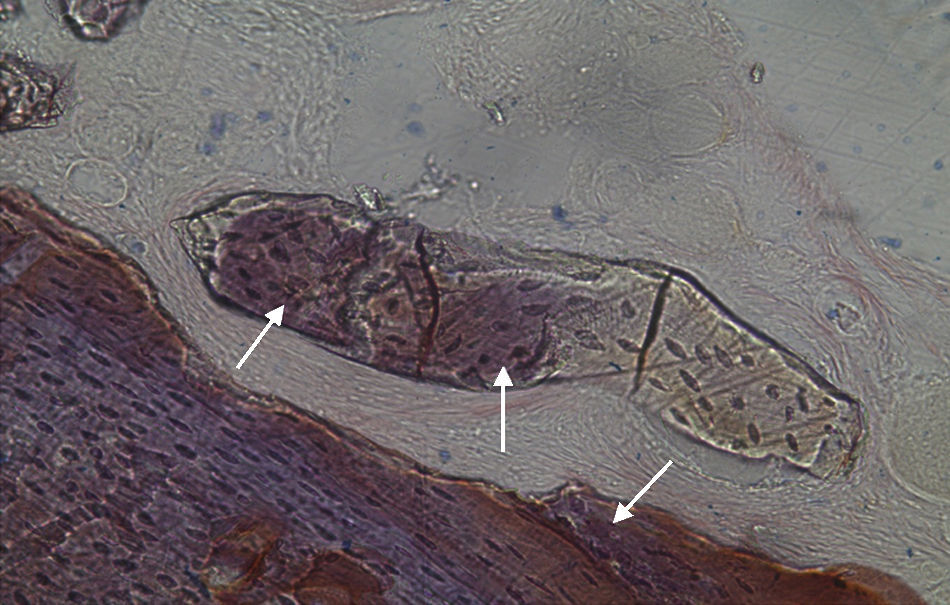
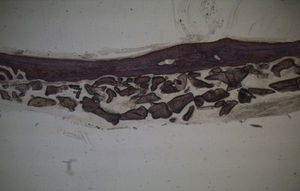
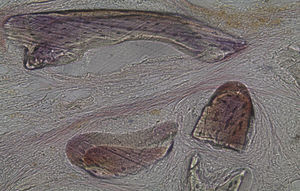
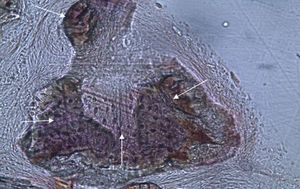
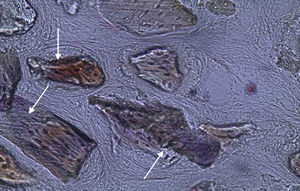
Por observação microscópica, verificou-se a ocorrência de avulsão de alguns dos grânulos de Bio-Gen® durante o processamento histológico da amostra de Controlo n°1, sendo apenas observável a formação de matriz óssea, com uma rede de fibras de colagénio dispostas irregularmente, apresentando-se finas e entremeadas de forma grosseira. Verificou-se também uma discreta presença de células intervenientes na remodelação óssea (osteoblastos e osteoclastos) (figs. 1 e 2).
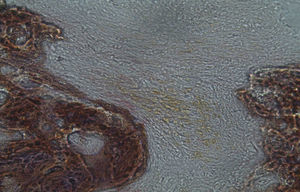
Em relação às preparações histológicas obtidas a partir da amostra Calcitonina n°2, verificou-se a retenção dos grânulos de biomaterial por formação de matriz óssea com esparsas e irregulares fibras de colagénio, adivinhando-se alguma neoformação óssea pontualmente (figs. 3 e 4).
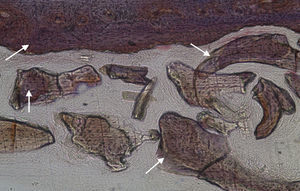
No que respeita às preparações histológicas da amostra obtida a partir de Grelina n°1 e Grelina n°3, podem-se observar sinais de neoformação óssea entre e em torno de grânulos de biomaterial colocado nos defeitos ósseos criados cirurgicamente (figs. 5, 6 e 7).
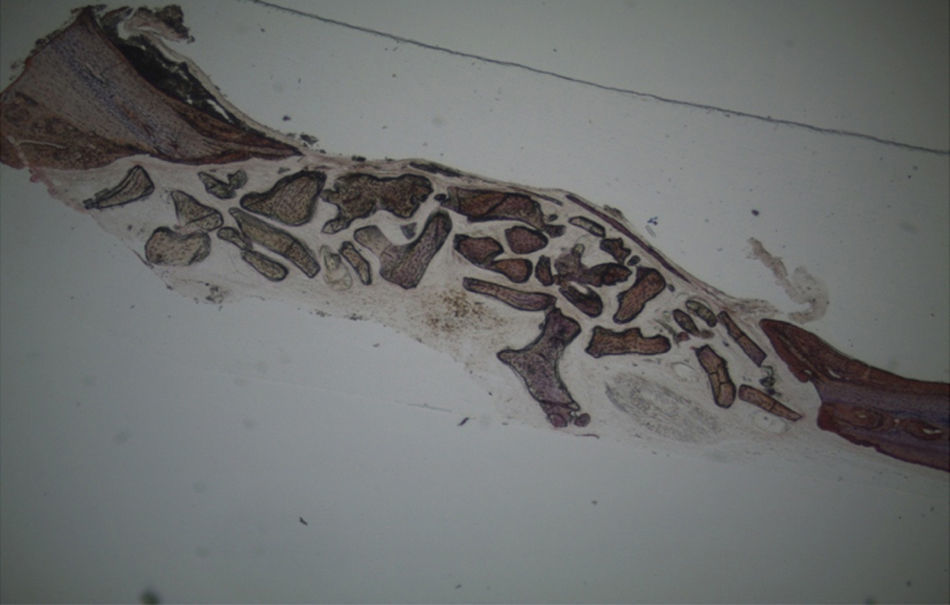
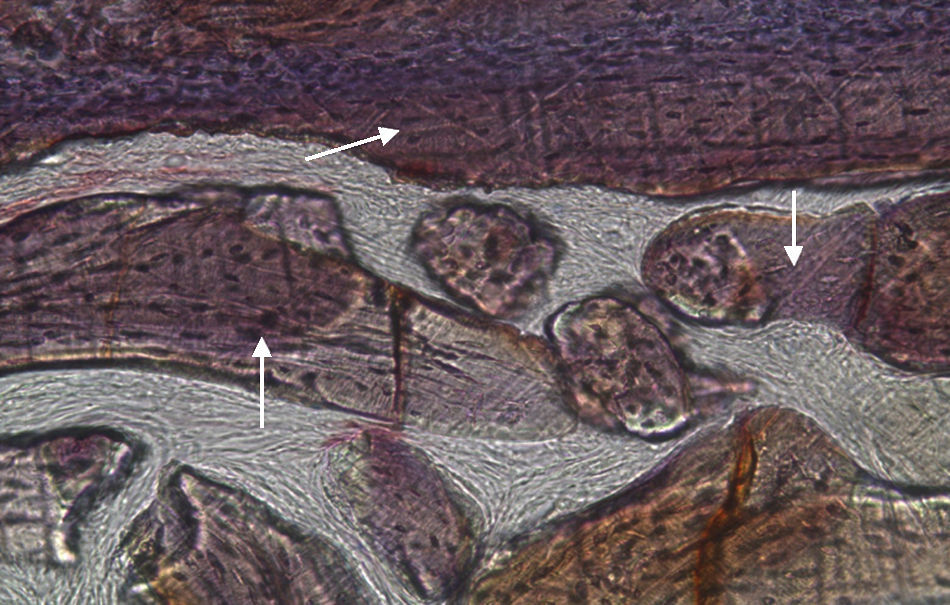
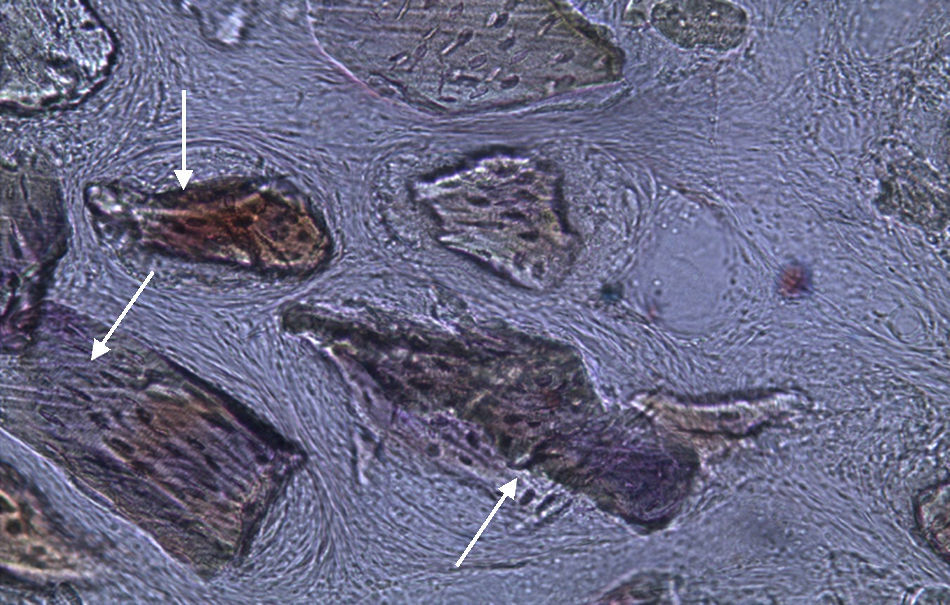
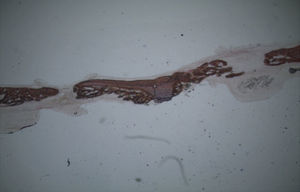
Por observação ao microscópio ótico das preparações histológicas referentes à amostra recolhida do animal Controlo n°2 (7 semanas), verificou-se a retenção dos grânulos do biomaterial empregue no preenchimento dos defeitos ósseos criados, contrariamente ao que se verificou para o Controlo n°1 às 5 semanas, uma vez que ocorreu a formação de uma matriz colagénica mais organizada em termos de disposição fibrilar. No entanto, não se observou a neoformação de tecido ósseo nesta amostra recolhida do Controlo n°2 (figs. 8 e 9).
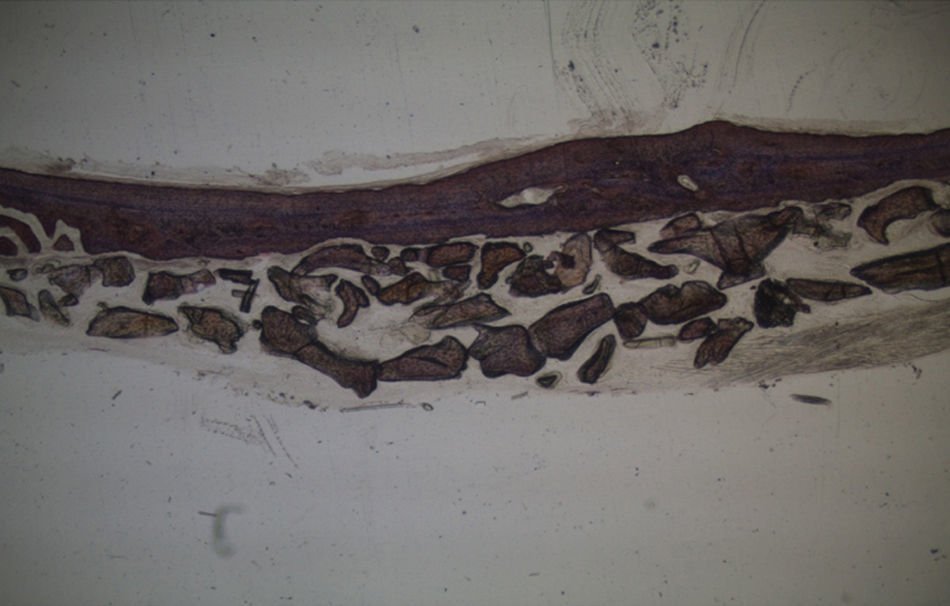
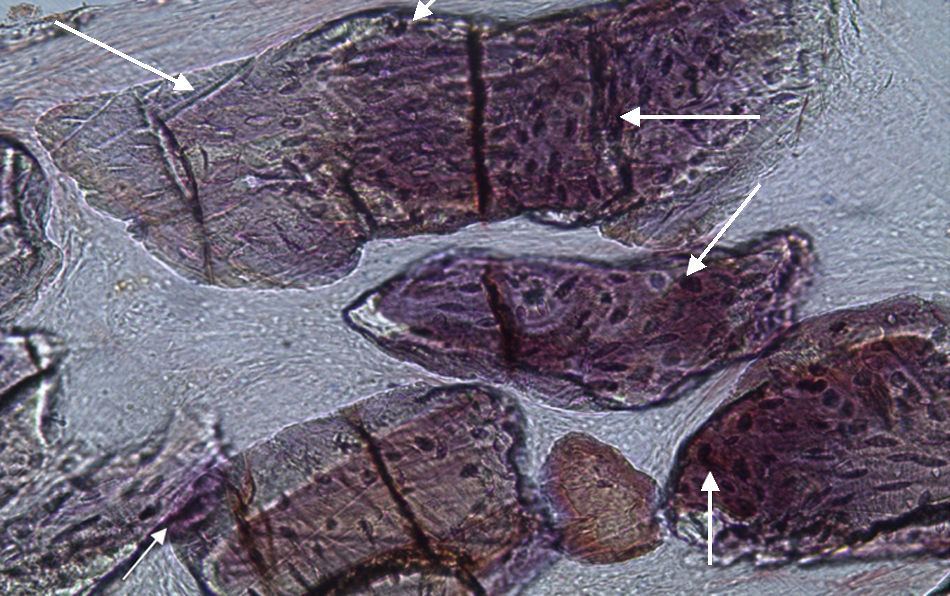
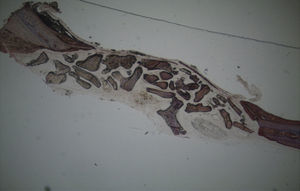
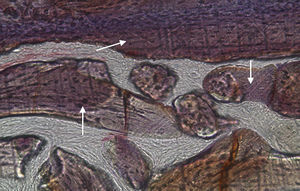
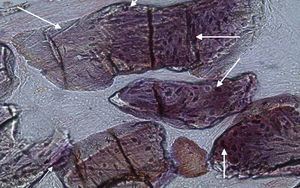
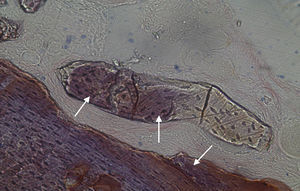
Em relação às preparações histológicas obtidas a partir das amostras dos animais Calcitonina n° 3 e Calcitonina n°1 (7 semanas), é possível observar a formação nítida de tecido ósseo novo, preenchendo o espaço entre os grânulos de matriz óssea equina e em torno dos mesmos. A matriz, essencialmente colagénica, apresenta fibras de maior calibre e com uma disposição mais regular (figs. 10, 11 e 12).
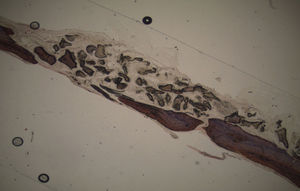
No que respeita às preparações histológicas referentes à amostra recolhida dos animais Grelina n°2 e Grelina n°4, pode-se observar a existência de uma matriz de colagénio com sinais de organização fibrilar, contribuindo para a retentividade dos grânulos de biomaterial e sinais de neoformação óssea algo semelhantes aos observados para as amostras Calcitonina n°3 e Calcitonina n°1, com presença de células intervenientes no metabolismo ósseo (osteoblastos), embora de forma mais discreta (figs. 13, 14 e 15).
Em todas as preparações histológicas coradas pelo método anteriormente referido, a neoformação óssea é observada pela presença de uma tonalidade rósea correspondente. Nas preparações histológicas correspondentes a amostras recolhidas de animais pertencentes aos grupos experimentais calcitonina e grelina é possível observar a formação de tecido ósseo junto ao remanescente que rodeia os locais de defeito ósseo.
DiscussãoA utilização de biomateriais na regeneração óssea tem como principal vantagem a promoção da formação óssea pelo facto de fornecer proteção contra a invasão de tecidos não osteogénicos competidores e também pelo facto de as matrizes inorgânicas serem reabsorvidas lentamente e substituídas por osso neoformado. Neste trabalho experimental optou-se pela utilização de osso equino desprovido de antigéneos para o preenchimento dos defeitos ósseos criados por ser biocompatível, estar disponível em quantidade suficiente, ser barato e de fácil manuseio, não exigir instrumental cirúrgico especializado para a sua colocação e poder ser armazenado à temperatura ambiente5.
O emprego da calcitonina de salmão teve por base alguns aspetos como o facto de este tipo de calcitonina ter uma semi-vida mais longa, ser resistente à degradação plasmática e demonstrar elevada afinidade para os recetores específicos. Além disso, a calcitonina de salmão é a mais ativa das calcitoninas isoladas e está isenta de proteínas animais exógenas. Uma vez que é facilmente degradada pelo suco gástrico, deve ser administrada por via subcutânea, retal, endovenosa, intramuscular ou nasal. Neste caso, optou-se pela via intramuscular por facilidade de aplicação, melhor controlo da dosagem e melhor acesso. A dose de calcitonina utilizada (0,05mL ou 2 UI) corresponde à dose terapêutica utilizada em seres humanos. Foi administrada no pós-operatório imediato, uma vez que esta hormona deve ser fornecida antes do início da osteogénese, de modo a promover o aumento do número dos osteoblastos5,18.
O rato foi o modelo animal selecionado, uma vez que é de fácil obtenção para amostra homogénea e é simples de manusear. O aumento ponderal verificado deve-se ao facto de o biomaterial empregue e a calcitonina administrada não interferirem com o desenvolvimento animal normal. Como o biomaterial utilizado se ajusta perfeitamente ao defeito ósseo criado e foi coberto pelos planos musculares, não necessitou da utilização de outros elementos de fixação5. O número de animais utilizado neste trabalho experimental foi reduzido, uma vez que se trata de um estudo preliminar (respeitando a regra dos 3 R's – Replacement (substituição), Reduction (redução), Refinement (refinamento)), cujos resultados obtidos poderão motivar a realização de mais trabalhos experimentais, de modo a esclarecer os mecanismos subjacentes à remodelação óssea sob o efeito destas hormonas.
Foram realizados defeitos ósseos circulares por serem ideais para o estudo da influência das substâncias empregues em relação à cicatrização óssea – a forma do defeito permite a manutenção do coágulo sanguíneo formado no seu interior, assim como a perfeita adaptação do biomaterial usado.
O tipo de grelina selecionado para a realização deste trabalho experimental teve em conta o facto de a grelina humana e a de rato diferirem apenas em dois aminoácidos, sendo, por isso, consideradas homólogas12.
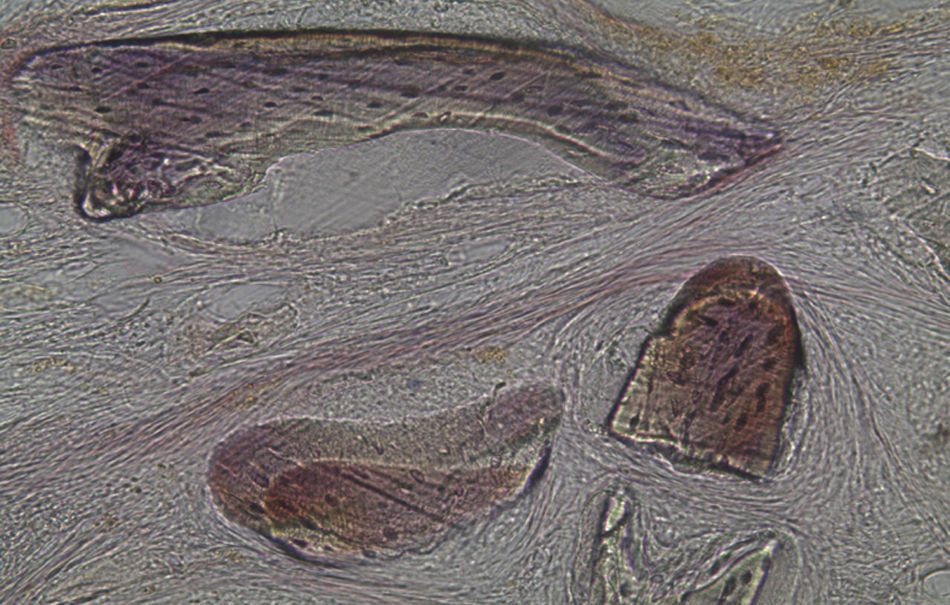
Apesar de se ter verificado a avulsão de alguns grânulos de Bio-Gen® durante o processamento histológico da amostra referente ao animal Controlo n°1, observou-se a formação de matriz óssea, notando-se o preenchimento da área do defeito ósseo por uma rede de fibras de colagénio delgadas e dispostas de forma relativamente aleatória. No caso das preparações obtidas da amostra recolhida do animal Calcitonina n°2, verificou-se a manutenção dos grânulos de biomaterial no local correspondente ao defeito ósseo, parecendo indicar a existência de um efeito retentivo da matriz óssea essencialmente colagénica formada sob influência da calcitonina, embora esta matriz apresente ainda um arranjo primário de fibras colagénicas delgadas. Relativamente às preparações histológicas obtidas a partir da amostra dos animais Grelina n°1 e Grelina n°3, verificou-se a formação de novo tecido ósseo no espaço inter e perigranular - tecido osteoide (coloração rósea envolvendo os grânulos de biomaterial). É necessário ter em conta que estes animais foram sacrificados na 5a semana pós-operatória, podendo ainda não ter ocorrido tempo suficiente para a observação de formação mais evidente de tecido ósseo e que o tamanho dos defeitos ósseos criados (4mm de diâmetro) poderá ser considerado um critical size defect, ou seja, possui um tamanho que não permite a regeneração dos defeitos apenas pelo organismo, ao contrário dos tamanhos reduzidos (inferiores a 4mm) utilizados em estudos que serviram de base bibliográfica a este trabalho, nos quais se verificava uma neoformação óssea acentuada em intervalos de tempo mais prolongados. Nas preparações histológicas referentes à amostra recolhida do animal Controlo n°2 às 7 semanas, verificou-se a retenção dos grânulos pela matriz colagénica, embora em menor grau relativamente à observada nas amostras recolhidas de animais dos grupos Calcitonina e Grelina. No entanto, não são evidentes sinais de neoformação óssea.
No que respeita às preparações obtidas a partir das amostras dos animais Calcitonina n°3 e Calcitonina n°1, foi possível observar a formação de tecido ósseo pela presença de osteoblastos em torno e entre os grânulos de biomaterial, o que remete para o efeito anabólico preponderante exercido por esta hormona, proporcionando o aumento da atividade osteoblástica e da mineralização do tecido osteoide, assim como a redução do número de osteoclastos por bloqueio do processo que lhes dá origem5,6.
Relativamente às preparações histológicas obtidas a partir da amostra dos animais Grelina n°2 e Grelina n°4, verificou-se uma discreta presença de células do metabolismo ósseo, indicadoras da ocorrência do processo de regeneração. Também se observou a formação de matriz colágena organizada e a disposição dos grânulos de biomaterial de forma coesa.
É de referir que a granulometria do biomaterial utilizado neste trabalho experimental pode não ter sido a mais adequada, o que pode ter facilitado a avulsão de grânulos na amostra de Controlo n°1. Além disso, os grânulos de matriz óssea equina exercem um efeito de osteoindução (recrutamento e conversão de células osteoprogenitoras ou indiferenciadas em células ósseas em formação) e não osteocondutor (fornecimento de um substrato que favoreça a migração, junção e crescimento de células osteoprogenitoras e osteoblastos para o enxerto).
ConclusãoTendo em conta o que foi referido, a grelina parece exercer um efeito mais significativo na neoformação óssea à 5a semana pós-operatória do que a calcitonina, embora esta última apresente resultados mais evidentes na 7a semana pós-operatória.
Conflito de interessesOs autores declaram não haver conflito de interesses.