A regeneração tecidular guiada e as proteínas de matriz de esmalte são duas técnicas regenerativas com resultados promissores no que diz respeito à regeneração periodontal.
ObjetivoA presente revisão bibliográfica pretende comparar a eficácia destas duas técnicas quando aplicadas no tratamento de defeitos ósseos, bem como avaliar um possível benefício na sua utilização conjunta.
Material e métodosForam selecionadas as meta-análises e os ensaios clínicos randomizados referentes ao tratamento de defeitos ósseos em humanos, que apenas comparassem as duas modalidades terapêuticas em questão ou associadas uma à outra.
ResultadosForam incluídas 5 meta-análises e 3 ensaios clínicos randomizados.
ConclusãoDentro das limitações impostas pelo tipo de revisão efetuada, podemos concluir que ambas as técnicas são eficazes no tratamento de defeitos ósseos e que a combinação das duas não parece apresentar vantagens significativas na melhoria dos resultados clínicos quando comparada com a utilização destes tratamentos de forma isolada.
Guided tissue regeneration and enamel matrix proteins are two regenerative techniques with promising clinical and histological results with regard to periodontal regeneration.
AimThis literature review aims to compare the effectiveness of these two techniques when applied in the treatment of bone defects and to evaluate a possible benefit in using them together.
Material and methodsMeta-analysis and randomized clinical trials for the treatment of bone defects in humans which compare the two treatment modalities in question or the combination of both.
ResultsThis review includes five meta-analysis and three randomized clinical trials.
ConclusionsWithin the limitations imposed by the type of review undertaken, we can conclude that both are effective in the treatment of bone defects and the combination of the two techniques does not seem to offer significant advantages in improving clinical outcomes when compared with the use of these treatments alone.
A periodontite é caracterizada pela destruição progressiva dos tecidos periodontais responsáveis pelo suporte dos dentes na cavidade oral1. Após o controlo da doença, o principal objetivo do tratamento periodontal consiste em restaurar as estruturas de suporte periodontal perdidas, de forma a que a sua anatomia e função possam ser restabelecidas, ou seja, que haja regeneração periodontal2.
A regeneração periodontal pressupõe a regeneração dos tecidos de suporte perdidos, incluindo novo osso, novo cemento acelular aderido à superfície radicular e novo ligamento periodontal com fibras de colagéneo funcionais, corretamente orientadas e inseridas tanto no novo cemento como no novo osso alveolar1. Deste modo, têm sido várias as técnicas desenvolvidas de forma a promover esta regeneração, tais como a regeneração tecidular guiada (RTG) e as proteínas de matriz de esmalte (PME).
A RTG assenta no pressuposto de que o ligamento periodontal é o tecido que contém as células progenitoras necessárias para a formação de osso alveolar, cemento radicular e ligamento periodontal3. O princípio biológico fundamental que sustenta esta técnica é a seletividade celular, ou seja, é utilizada uma barreira física que impeça a migração apical das células dos tecidos epitelial e conjuntivo gengival, proporcionando um espaço isolado para a proliferação das células provenientes do ligamento periodontal4. Deste modo, o primeiro tratamento com RTG em humanos descrito por Nyman et al em 19825, bem como os restantes diversos estudos clínicos e histológicos realizados, demonstraram a capacidade desta técnica em regenerar os tecidos periodontais perdidos.
A aplicação das PME representa, atualmente, um tratamento alternativo na regeneração periodontal, que tenta reproduzir os fenómenos do desenvolvimento embrionário6. A matriz de esmalte é constituída por um conjunto de proteínas, das quais se destacam as amelogeninas, que constituem a componente mais importante da fração orgânica desta matriz, representando cerca de 90%7. Estas proteínas estão presentes nas fases iniciais da formação do órgão dentário, principalmente na formação do cemento radicular, apresentando, assim, um importante papel no desenvolvimento de cemento acelular, ligamento periodontal e osso alveolar8. Assim sendo, são vários os estudos em que esta técnica é aplicada, com resultados clínicos e histológicos promissores, no que se refere à regeneração periodontal.
Deste modo, perante a segurança e eficácia que tem sido demonstrada com a utilização da regeneração tecidular guiada e das proteínas de matriz de esmalte na regeneração periodontal, a presente revisão bibliográfica tem como principal objetivo comparar a eficácia destas duas modalidades terapêuticas quando aplicadas no tratamento de defeitos ósseos, bem como avaliar um possível benefício na sua utilização conjunta.
Material e métodosUtilizando a base de dados da MEDLINE e com recurso às palavras-chave «guided tissue regeneration», «enamel matrix proteins», «infrabony defects» e «periodontal regeneration», foi efetuada uma primeira pesquisa limitando a busca para meta-análises publicadas entre 1999 e março de 2011. Numa segunda etapa, visto que as meta-análises existentes apenas apresentavam estudos publicados até 2008, foi realizado uma pesquisa suplementar apenas com ensaios clínicos randomizados (ECR) publicados entre 2008 e março de 2011, utilizando as mesmas palavras-chave.
Os critérios de inclusão utilizados nesta revisão da literatura permitiram selecionar as meta-análises e os ECR referentes ao tratamento de defeitos ósseos que incluíssem a comparação de ambas as modalidades terapêuticas em questão (PME e RTG) ou associadas uma à outra (PME+RTG). No que diz respeito aos ensaios clínicos randomizados foram incluídos aqueles publicados entre 2008 e 2011 com, pelo menos, 6 meses de duração, incluindo apenas os pacientes com diagnóstico de periodontite, sem qualquer comprometimento sistémico e que não tivessem recebido qualquer tipo de antibiótico nos últimos 6 meses. A primeira pesquisa identificou 31 estudos. Com base na leitura do título e do resumo dos artigos, foram apenas incluídas cinco meta-análises. A pesquisa realizada para a recolha dos ECR identificou 18 estudos dos quais apenas 3 foram incluídos nesta revisão.
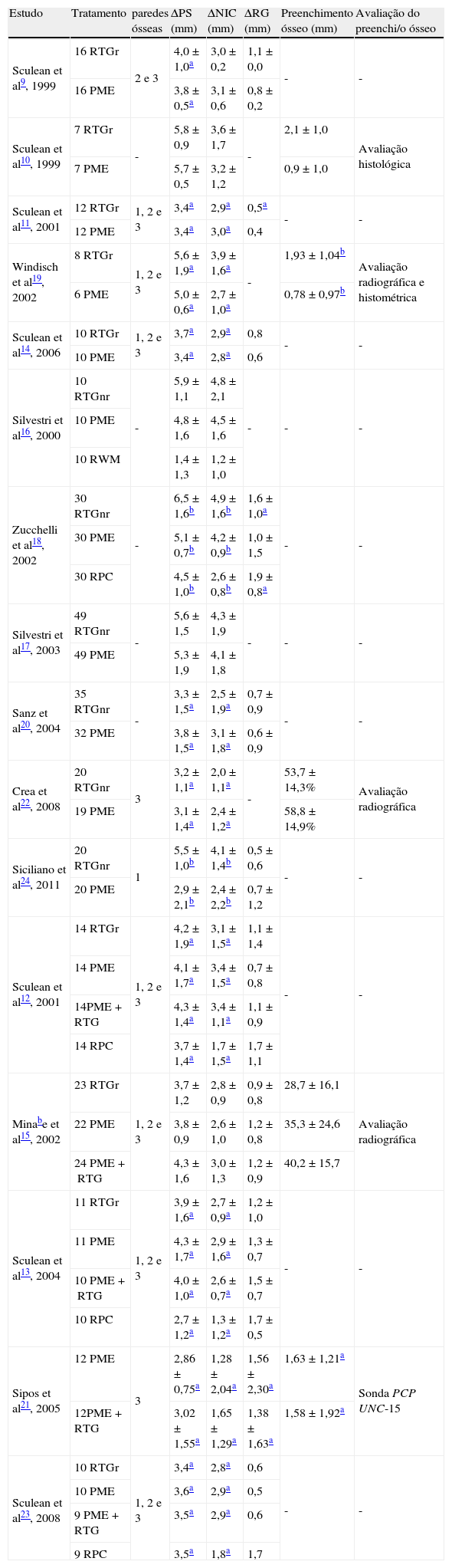
ResultadosA tabela 1 inclui todos os ensaios clínicos randomizados utilizados na realização desta revisão, relativamente ao tratamento dos defeitos ósseos com as modalidades terapêuticas PME, RTG e a combinação das PME com a RTG. A disposição dos estudos obedece a uma ordem cronológica crescente e são acompanhados pelos resultados obtidos pelos autores para as diferentes variáveis – profundidade de sondagem (PS), nível de inserção clínico (NIC), recessão gengival (RG) e preenchimento ósseo com o seu respetivo método de avaliação.
Ensaios clínicos randomizados do tratamento de defeitos ósseos.
| Estudo | Tratamento | paredes ósseas | ΔPS (mm) | ΔNIC (mm) | ΔRG (mm) | Preenchimento ósseo (mm) | Avaliação do preenchi/o ósseo |
| Sculean et al9, 1999 | 16 RTGr | 2 e 3 | 4,0±1,0a | 3,0±0,2 | 1,1±0,0 | - | - |
| 16 PME | 3,8±0,5a | 3,1±0,6 | 0,8±0,2 | ||||
| Sculean et al10, 1999 | 7 RTGr | - | 5,8±0,9 | 3,6±1,7 | - | 2,1±1,0 | Avaliação histológica |
| 7 PME | 5,7±0,5 | 3,2±1,2 | 0,9±1,0 | ||||
| Sculean et al11, 2001 | 12 RTGr | 1, 2 e 3 | 3,4a | 2,9a | 0,5a | - | - |
| 12 PME | 3,4a | 3,0a | 0,4 | ||||
| Windisch et al19, 2002 | 8 RTGr | 1, 2 e 3 | 5,6±1,9a | 3,9±1,6a | - | 1,93±1,04b | Avaliação radiográfica e histométrica |
| 6 PME | 5,0±0,6a | 2,7±1,0a | 0,78±0,97b | ||||
| Sculean et al14, 2006 | 10 RTGr | 1, 2 e 3 | 3,7a | 2,9a | 0,8 | - | - |
| 10 PME | 3,4a | 2,8a | 0,6 | ||||
| Silvestri et al16, 2000 | 10 RTGnr | - | 5,9±1,1 | 4,8±2,1 | - | - | - |
| 10 PME | 4,8±1,6 | 4,5±1,6 | |||||
| 10 RWM | 1,4±1,3 | 1,2±1,0 | |||||
| Zucchelli et al18, 2002 | 30 RTGnr | - | 6,5±1,6b | 4,9±1,6b | 1,6±1,0a | - | - |
| 30 PME | 5,1±0,7b | 4,2±0,9b | 1,0±1,5 | ||||
| 30 RPC | 4,5±1,0b | 2,6±0,8b | 1,9±0,8a | ||||
| Silvestri et al17, 2003 | 49 RTGnr | - | 5,6±1,5 | 4,3±1,9 | - | - | - |
| 49 PME | 5,3±1,9 | 4,1±1,8 | |||||
| Sanz et al20, 2004 | 35 RTGnr | - | 3,3±1,5a | 2,5±1,9a | 0,7±0,9 | - | - |
| 32 PME | 3,8±1,5a | 3,1±1,8a | 0,6±0,9 | ||||
| Crea et al22, 2008 | 20 RTGnr | 3 | 3,2±1,1a | 2,0±1,1a | - | 53,7±14,3% | Avaliação radiográfica |
| 19 PME | 3,1±1,4a | 2,4±1,2a | 58,8±14,9% | ||||
| Siciliano et al24, 2011 | 20 RTGnr | 1 | 5,5±1,0b | 4,1±1,4b | 0,5±0,6 | - | - |
| 20 PME | 2,9±2,1b | 2,4±2,2b | 0,7±1,2 | ||||
| Sculean et al12, 2001 | 14 RTGr | 1, 2 e 3 | 4,2±1,9a | 3,1±1,5a | 1,1±1,4 | - | - |
| 14 PME | 4,1±1,7a | 3,4±1,5a | 0,7±0,8 | ||||
| 14PME+RTG | 4,3±1,4a | 3,4±1,1a | 1,1±0,9 | ||||
| 14 RPC | 3,7±1,4a | 1,7±1,5a | 1,7±1,1 | ||||
| Minabe et al15, 2002 | 23 RTGr | 1, 2 e 3 | 3,7±1,2 | 2,8±0,9 | 0,9±0,8 | 28,7±16,1 | Avaliação radiográfica |
| 22 PME | 3,8±0,9 | 2,6±1,0 | 1,2±0,8 | 35,3±24,6 | |||
| 24 PME+RTG | 4,3±1,6 | 3,0±1,3 | 1,2±0,9 | 40,2±15,7 | |||
| Sculean et al13, 2004 | 11 RTGr | 1, 2 e 3 | 3,9±1,6a | 2,7±0,9a | 1,2±1,0 | - | - |
| 11 PME | 4,3±1,7a | 2,9±1,6a | 1,3±0,7 | ||||
| 10 PME+RTG | 4,0±1,0a | 2,6±0,7a | 1,5±0,7 | ||||
| 10 RPC | 2,7±1,2a | 1,3±1,2a | 1,7±0,5 | ||||
| Sipos et al21, 2005 | 12 PME | 3 | 2,86±0,75a | 1,28±2,04a | 1,56±2,30a | 1,63±1,21a | Sonda PCP UNC-15 |
| 12PME+RTG | 3,02±1,55a | 1,65±1,29a | 1,38±1,63a | 1,58±1,92a | |||
| Sculean et al23, 2008 | 10 RTGr | 1, 2 e 3 | 3,4a | 2,8a | 0,6 | - | - |
| 10 PME | 3,6a | 2,9a | 0,5 | ||||
| 9 PME+RTG | 3,5a | 2,9a | 0,6 | ||||
| 9 RPC | 3,5a | 1,8a | 1,7 |
Sculean et al publicaram diversos estudos comparativos entre as PME e RTG no tratamento de defeitos ósseos9–13. Em 1999a9, compararam o tratamento de 32 defeitos contralateriais, maioritariamente de duas paredes, durante um período de 8 meses, com estas duas técnicas. Ambos os tratamentos resultaram numa diminuição significativa da PS comparativamente com os valores iniciais (p<0,001) e num ganho do NIC, no entanto, não foram detetadas diferenças estatisticamente significativas entre a RTG e as PME nos parâmetros clínicos avaliados. É ainda de salientar que, no grupo RTG, verificou-se a exposição da membrana em 7 dos 16 defeitos tratados.
Nesse ano, os mesmos autores publicaram outro estudo com o objetivo de avaliar histologicamente a cicatrização dos defeitos ósseos em humanos após o tratamento com PME ou RTG10. Foram incluídos 14 pacientes que apresentavam defeitos ósseos ao redor de dentes indicados para extração e foram seguidos durante um período de 6 meses. No fim do tratamento foi possível observar que houve uma melhoria na PS e um ganho no NIC de 3,2±1,2mm para as PME e de 3,6±1,7mm para a RTG. Quanto à avaliação histológica, verificou-se a formação de uma nova inserção de 2,6±1,0mm nas PME e de 2,4±1,0mm na RTG, com as fibras de colagénio inseridas num novo cemento predominantemente celular, assim como a formação de novo osso (0,9±1,0mm nas PME e 2,1±1,0mm na RTG). Neste grupo, a formação de uma nova inserção foi sempre acompanhada por formação de osso, o que não se verificou em alguns casos tratados com PME.
Doze dos dezasseis pacientes do estudo de Sculean et al 1999a9 foram seguidos ao longo de 4 anos11 em que foi observado um aumento significativo em ambos os grupos, tanto na redução da PS (p<0,05) como no ganho do NIC (p<0,001), comparativamente aos valores iniciais. Os valores da recessão gengival diminuíram em ambos os grupos, mas a diferença só foi significativa no grupo da RTG (p<0,05). A semelhança entre os resultados após um ano manteve-se durante mais três anos, com a ausência de diferenças estatisticamente significativas entre os dois tratamentos.
O mesmo grupo de investigadores publicou um outro ensaio clínico em que, para além do tratamento com PME e RTG, também avaliaram a associação das PME com a RTG, comparativamente com o retalho periodontal convencional (RPC)12. Seleccionaram 56 pacientes, distribuídos aleatoriamente por quatro grupos de tratamento, com 14 defeitos cada. Aos 12 meses, todos os grupos apresentaram melhorias significativas quanto à PS e ao NIC. Entre os três grupos de teste (PME, RTG e RTG com PME) não houve diferenças significativas, mas os valores relativos ao controlo foram estatisticamente inferiores. Ocorreu ainda a exposição da membrana em 6 casos tratados com RTG e 5 nos casos tratados com a combinação da RTG com as PME.
Dos 56 pacientes que fizeram parte deste estudo, 42 fizeram parte de um outro estudo do mesmo autor, realizado em 200413, no qual foram aplicadas as mesmas quatro modalidades terapêuticas PME, RTG, PME+RTG e RPC com um follow-up de 5 anos. No fim do estudo, todos os tratamentos apresentaram melhorias em termos de PS e NIC, mas não se observaram diferenças significativas entre eles. Em 2006, os mesmos autores compararam apenas a eficácia dos tratamentos PME e RTG em 10 pacientes, perfazendo um período de 8 anos14. Os resultados finais, quando comparados com os valores iniciais, demonstraram melhorias clínicas satisfatórias, no entanto, não se verificaram diferenças estatisticamente significativas entre as duas modalidades de tratamento.
Tal como estes dois últimos estudos, Minabe et al15 compararam o tratamento combinado (PME com RTG) com as técnicas regenerativas isoladamente (PME e RTG), em 69 defeitos infra-ósseos de 61 doentes. Ao fim de um ano, verificaram que não houve diferenças estatisticamente significativas na diminuição da PS, no ganho do NIC, no aumento da recessão gengival e no preenchimento ósseo dos defeitos entre os três tratamentos. Da associação das duas técnicas regenerativas, tal como no estudo anterior, não resultou numa potenciação da sua capacidade regenerativa.
Outro estudo, realizado por Silvestri et al em 200016, comparou a eficácia de três procedimentos cirúrgicos: RTG, PME e retalho de Widman modificado (RWM). Um ano após o tratamento, as PME e a RTG demonstraram melhores resultados comparativamente ao RWM, cujo procedimento não obteve alterações significativas no ganho do NIC e na redução da PS. Por outro lado, não houve diferenças estatisticamente significativas no ganho de NIC entre as PME e a RTG. No entanto, os resultados da análise demonstraram uma relação significativa entre os resultados clínicos finais e os valores iniciais do NIC. Foi observado que a RTG apresentava melhores resultados do que as PME em termos de percentagem de ganho de NIC em pacientes com um NIC inicial ≥9mm, e que em pacientes com NIC inicial <9mm, as PME apresentavam melhores resultados do que a RTG. Verificou-se ainda a exposição de 70% das membranas utilizadas no grupo RTG.
Os mesmos autores efetuaram um novo estudo, multicêntrico, envolvendo 98 doentes, no qual foi comparada a utilização das PME com RTG, utilizando membranas não-reabsorvíveis (ePTFE)17. Neste estudo, houve uma alteração no procedimento cirúrgico, com a utilização da técnica de preservação da papila. Os resultados deste novo estudo confirmaram a inexistência de uma diferença estatisticamente significativa em termos de ganho de NIC e de redução na PS, entre as PME e a RTG. À semelhança do resultado da análise regressiva do primeiro estudo de Silvestri e colaboradores em 200016, a RTG demonstrou maior ganho de NIC do que as PME, nos casos em que o NIC inicial era superior a 8, embora essa variação fosse muito reduzida (0,3mm) e sem grande importância clínica. Quanto à exposição das membranas, desta vez apenas se verificaram em 48% dos casos no grupo RTG.
O primeiro estudo que demonstrou diferenças estatisticamente significativas entre os dois tratamentos foi realizado por Zuccheli e colaboradores em 200218, em que comparou o tratamento PME com a RTG com a utilização de membranas de ePTFE reforçado com titânio e com o RPC, pela técnica simplificada de preservação da papila. Aos 12 meses verificou-se uma melhoria significativa no NIC e na PS nos pacientes tratados com PME e RTG, comparativamente aos tratados com RPC. A RTG apresentou uma redução da PS estatisticamente superior quando comparado as PME e, clinicamente, a grande maioria dos defeitos tratados por RTG (87%) apresentavam uma PS≤ 3mm e nenhuma das bolsas residuais era mais profunda que 5mm. Por outro lado, só 20% dos defeitos tratados com PME apresentavam bolsas com PS≤ 3mm e 7% apresentavam bolsas residuais maiores do que 5mm. Quanto à recessão gengival, esta encontrava-se mais pronunciada nos casos tratados com RTG que com PME. É ainda de salientar que 33% dos casos tratados com RTG apresentaram exposição da membrana.
No mesmo ano, Windisch e colaboradores19 publicaram um estudo com o objetivo de comparar os parâmetros clínicos e radiográficos com achados histométricos obtidos após a utilização de dois tratamentos regenerativos. Foram selecionados 14 defeitos em dentes com indicação para extração, dos quais 8 foram tratados com RTG (membranas reabsorvíveis) e 6 com PME, durante um período de 6 meses. Após o tratamento, não se verificaram diferenças estatisticamente significativas nas variáveis clínicas e radiográficas entre os dois tratamentos, mas houve uma melhoria significativa na PS e no NIC quando comparados com os valores iniciais. A nível histométrico, observou-se a formação de quantidades significativas de novo cemento com fibras de colagénio inseridas. Apesar disto, a formação óssea foi mais significativa no grupo RTG com 1,93±1,04mm quando comparado com 0,78±0,97mm nas PME.
Em 2004, Sanz e colaboradores20 efetuaram um estudo envolvendo 67 pacientes, dos quais 35 foram tratados com PME e 32 com RTG, utilizando a técnica de preservação da papila. Da análise das variáveis clínicas, os autores verificaram que não existiam diferenças clínicas estatisticamente significativas entre os dois tratamentos. Contudo, foi possível observar uma grande incidência (100%) de complicações pós-operatórias nos casos tratados com RTG quando comparados aos 6% daqueles tratados com PME. No grupo tratado com RTG, as exposições das membranas ocorreram em 35% dos casos na primeira semana, 62% na terceira e 29% na sexta semana. Isto levou a uma perda do NIC em 6% dos defeitos tratados com RTG, enquanto que em nenhum dos casos tratados com PME isto se verificou.
Sipos e colaboradores publicaram um estudo no ano seguinte21, com o objetivo de avaliar os resultados clínicos após o tratamento de defeitos ósseos com PME e a combinação de PME com membranas não reabsorvíveis (ePTFE). Foram incluídos 12 pares de defeitos, nos quais foram aplicadas PME na superfície radicular exposta, no entanto, só em metade é que ainda foi utilizada uma membrana de ePTFE. Após 12 meses, os parâmetros clínicos PS, NIC e preenchimento ósseo apresentaram melhorias significativas nos dois grupos, mas a RG aumentou significativamente quando comparada com os valores iniciais. Apesar das complicações pós-operatórias associadas à exposição de 10 das 12 membranas utilizadas, não se verificaram diferenças estatisticamente significativas entre as duas modalidades de tratamento.
Em 2008, Crea e colaboradores22 realizaram um ensaio clínico randomizado com o objetivo de comparar a utilização da RTG com as PME. Foram avaliados 39 defeitos ósseos de 3 paredes, durante um período de 3 anos, dos quais 20 foram tratados com membranas não-reabsorvíveis (RTG) e 19 com PME. Durante a realização deste estudo foram administrados antibióticos sistémicos a 3 pacientes (RTG:2; PME:1) e foram observados 5 casos (RTG:3; PME:2) onde ocorreram deiscências, nos quais foram repetidas as cirurgias no mesmo dia. No entanto, não se verificaram diferenças nos resultados clínicos destes pacientes com aqueles que não receberam nenhum destes tratamentos. Da análise das variáveis clínicas deste estudo, os autores observaram que tanto a RTG como as PME resultam numa melhoria significativa na PS e no NIC. Apesar de se ter observado um maior ganho no NIC do grupo tratado com PME e num aumento da recessão nos casos tratados com RTG, não foram encontradas diferenças estatisticamente significativas entre os dois tratamentos utilizados.
No mesmo ano, Sculean e colaboradores23 publicaram um novo estudo, o qual pretendia averiguar se os resultados clínicos após tratamentos com PME, RTG, PME+RTG e RPC se podiam manter durante um período de 10 anos. A partir de um grupo inicial de 56 indivíduos12, 38 pacientes participaram neste novo estudo. Destes, 10 foram tratados com PME, 10 com RTG (membrana reabsorvível), 9 com PME+RTG e 9 com RPC. Após 10 anos, todos os tratamentos resultaram numa melhoria significativa, tanto no ganho dos NIC quanto na redução das PS. Porém, apesar do tratamento combinado entre as PME com a RTG ter levado a melhorias clínicas, estes resultados não foram suficientemente significativos quando comparados com os resultados obtidos através da utilização de cada tratamento isoladamente. É ainda de salientar que nos quatros grupos foi possível observar uma ligeira perda do NIC entre o primeiro e o décimo ano, bem como um ligeiro aumento ao nível do índice de placa.
Um ensaio clínico randomizado mais recente, realizado por Siciliano e colaboradores24, teve como objectivo avaliar e comparar a utilização de PME e RTG no tratamento de defeitos ósseos de uma parede. Foram avaliados 40 defeitos em dentes monorradiculares, dos quais 20 foram tratados com PME e os outros 20 com membranas não-reabsorvíveis reforçadas com titânio (RTG). Durante os 12 meses de estudo, o grupo PME não apresentou qualquer complicação pós-operatória, ao contrário da RTG em que ocorreu a exposição da membrana em três dos seus casos. Os resultados obtidos permitiram observar que a regeneração periodontal de defeitos ósseos de uma parede com a utilização de membrana não-reabsorvível proporciona melhores benefícios em termos de ganho no NIC e da redução da PS, quando comparada com a aplicação de PME, após o período de um ano. No entanto, não se verificaram diferenças significativas entre os dois tratamentos quanto à recessão gengival.
DiscussãoUm dos principais objetivos da regeneração periodontal é a reconstrução da morfologia e da função dos tecidos periodontais de suporte perdidos. Deste modo, a «verdadeira regeneração periodontal» é caracterizada pela regeneração destes tecidos, incluindo novo osso, novo cemento acelular aderido à superfície radicular e novo ligamento periodontal com fibras de colagéneo funcionais, corretamente orientadas e inseridas tanto no novo cemento quanto no novo osso alveolar25. A regeneração tecidular guiada, bem como a aplicação dos derivados das proteínas de matriz de esmalte são duas técnicas que têm demonstrado bons resultados clínicos e histológicos no que diz respeito à regeneração periodontal5,26. Deste modo, são vários os estudos que têm sido realizados de forma a comparar a eficácia destas duas técnicas no tratamento de defeitos ósseos.
Apesar de ambas as técnicas terem demonstrado melhorias clínicas relativamente aos valores apresentados inicialmente, nenhum dos estudos, à exceção dos estudos de Zucchelli e col., Siciliano e col. e Windisch et al18,19,24. demonstraram diferenças significativas entre os dois tratamentos em qualquer um dos parâmetros clínicos avaliados, apesar de na maioria dos estudos, os resultados obtidos pela RTG no NIC e na PS serem superiores. No entanto, alguns estudos apontam para a existência de uma interação entre o NIC inicial e os ganhos obtidos no fim dos tratamentos relativamente a este parâmetro16,17.
A regeneração tecidular guiada parece proporcionar melhores resultados clínicos do que as PME em termos de percentagem de ganho de NIC em pacientes com um NIC inicial ≥9mm; e as PME parecem proporcionar melhores resultados em pacientes com um NIC inicial <9mm16. O mesmo se verificou no estudo de Silvestri, em que a RTG apresentou melhores resultados do que as PME em pacientes com um NIC≥8mm17. Assim sendo, os autores sugerem a utilização de PME no tratamento de defeitos ósseos em zonas estéticas e o tratamento com RTG em áreas onde a estética é secundária, especialmente em defeitos muito profundos17.
Zucchelli et al e Siciliano et al foram os únicos estudos que demonstraram diferenças significativas entre os dois tratamentos em termos de ganhos no NIC e reduções na PS superiores nos casos tratados com RTG do que naqueles tratados com PME e no estudo de Windisch e col., verificou-se uma superioridade da RTG relativamente ao preenchimento ósseo. No entanto, também foi o método que apresentou maior recessão gengival18,19,24.
De facto, na grande maioria dos estudos foi possível observar valores superiores de recessão gengival no grupo RTG, assim como a ocorrência de mais de 50% de exposições de membranas9,11,12,14,20,21,26. Os únicos dois estudos que apresentaram uma percentagem inferior utilizaram a técnica de preservação da papila. Silvestri e colaboradores reduziram a taxa de exposições de 70 para 48% com a introdução desta técnica17, e Zucchelli et al obtiveram apenas 33% de membranas expostas18.
A nível histológico, a RTG aparenta obter melhores resultados do que as PME. Nos estudos de Sculean et al10 e Windisch et al19 a maioria dos defeitos tratados com RTG apresentou verdadeira regeneração periodontal, enquanto que nos defeitos tratados com PME foi possível observar a formação de novo cemento e ligamento periodontal, mas nem sempre acompanhados de formação de novo osso. No entanto, apesar destes resultados, em nenhum dos estudos se verificaram diferenças significativas entre os dois tratamentos, com a exceção do preenchimento ósseo.
Na análise da combinação das duas técnicas regenerativas RTG e PME no tratamento de defeitos ósseos, esta não parece trazer melhores resultados clínicos do que a utilização de cada uma destas técnicas de forma isolada, uma vez que em nenhum dos cincos estudos se observaram diferenças significativas entre as três modalidades de tratamento12–14,21,23.
Quanto ao retalho periodontal convencional, este parece ser um tratamento menos eficaz em melhorar os parâmetros clínicos PS e NIC, uma vez que, na maioria dos estudos, apresenta resultados clínicos significativamente inferiores comparativamente com a RTG, as PME ou a combinação de RTG com PME12,13,18,23.
Na grande maioria dos estudos os resultados obtidos foram avaliados através de parâmetros meramente clínicos e em três estudos foi realizada a avaliação radiográfica. Visto que a avaliação histológica é o único método fiável para identificar os tecidos presentes após a cicatrização, apenas Sculean et al e Windisch et al a realizaram10,19, pelo que, em todos os outros estudos apresentados, apenas podemos falar em melhorias clínicas com os tratamentos efetuados e não de uma verdadeira regeneração periodontal.
ConclusõesDa análise dos vários estudos, podemos, dentro das limitações impostas pelo tipo de revisão efetuada, concluir que:
- •
Tanto a aplicação da RTG, quanto das PME são tratamentos eficazes para a melhoria dos parâmetros clínicos PS e NIC;
- •
Apesar de nenhum dos estudos ter poder estatístico suficiente para determinar igualdade ou superioridade entre a RTG e as PME, os seus resultados sugerem uma superioridade da RTG relativamente ao preenchimento ósseo;
- •
A combinação da RTG com as PME não parece apresentar vantagens significativas na melhoria dos resultados clínicos, quando comparada com a utilização destes tratamentos de forma isolada;
- •
As melhorias clínicas obtidas com a RTG e as PME podem ser mantidas ao longo do tempo;
- •
A utilização da técnica de preservação da papila parece diminuir o risco de exposição das membranas;
- •
A aplicação da técnica do retalho periodontal convencional é menos eficaz do que qualquer um dos três tratamentos.
Os autores declaram não haver conflito de interesses.