Os implantes dentários constituem cada vez mais uma solução efectiva e estética em casos de perda dentária. Uma vez que um dos principais objectivos actuais da implantologia é a optimização dos resultados em reabilitações com implantes dentários, tem-se procurado compreender de que forma o recurso à engenharia genética pode contribuir para esse efeito. O presente artigo pretende avaliar a importância de técnicas da área da engenharia genética, nomeadamente sobre o papel do ligante do receptor activador do factor nuclear kappa beta em osteoimunologia.
O artigo de revisão bibliográfica que se apresenta baseou-se nos resultados de pesquisa efectuados em motores de pesquisa de informação médica e genética, tendo especial relevância a informação referente aos últimos dez anos.
Acredita-se que os níveis de ligante do receptor activador do factor nuclear kappa beta e a osteoprotegerina possam contribuir para a optimização de resultados referentes ao sucesso da reabilitação implantar. Mais investigações clínicas urgem ser efectuadas para que se possam esclarecer algumas dúvidas e para que eventualmente se possam rentabilizar as aplicações clínicas da engenharia genética aplicada à implantologia oral.
Dental implants are an increasingly effective and aesthetic solution in cases of tooth loss. Once one of the major goals of current implantology is the optimal outcome in rehabilitation with dental implants, there's an attempt to understand how the use of genetic engineering can contribute to this effect. This article aims to evaluate the importance of the technical area of genetic engineering,
specialy on the role of the receptor activator for nuclear factor kappa beta ligand in osteoimmunology.
The present article is a literature review that was based on the results of research carried out on search engines for medical information and genetics, with particular relevance to information concerning the last ten years.
It is believed that the levels of receptor activator for nuclear factor kappa beta ligand and osteoprotegerin may contribute to the optimization results in implant rehabilitation. Further clinical investigations are urged to be made in order to clarify some issues and to recoup the clinical applications of genetic engineering applied to oral implantology.
O processo de remodelação óssea requer a aposição óssea por osteoblastos e a reabsorção por osteoclastos, sendo que na coordenação da osteoclastogénese e remodelação óssea realça-se a interacção de três membros da superfamília do factor de necrose tumoral (TNF): 1 - ligante do receptor activador do factor nuclear kappa Beta (NF-kB) - RANKL, 2 - receptor activador do NF-kB (RANK) e 3 - osteoprotegerina (OPG)1,2.
RANKLEstá demonstrado que são necessárias duas citocinas para a indução da diferenciação osteoclástica: o factor estimulador de colónias de macrófagos (M-CSF) e o RANKL. O M-CSF participa na proliferação de progenitores osteoclásticos e colabora com o RANKL para induzir a fusão de pré-osteoclastos em osteoclastos que serão secundariamente activados em osteoclastos maduros pelo próprio RANKL1–7.
Embora o RANKL seja expresso como um membro transmembranar em células do estroma da medula óssea (osteoblastos imaturos), o mesmo pode ser libertado da superfície celular por clivagem proteolítica e ligar-se ao RANK ou à OPG. A OPG, por sua vez, é formada pelos osteoblastos quando estes reagem com citocinas, como o estrogénio, o factor de transformação de crescimento beta (TGF-β) e as proteínas morfogenéticas ósseas (BMPs). A OPG pode ainda ser produzida em células do ligamento periodontal, em fibroblastos gengivais e em células epiteliais. Quanto ao RANK, ele é expresso na superfície de células progenitoras mielóides, pré osteoclastos, osteoclastos maduros e em células dendríticas1,2,8–12.
A razão RANKL/OPG, em termos de expressão, é um parâmetro considerado importante para o controle da reabsorção óssea. Esta razão tem ainda um papel importante no controle dos graus de reabsorção ou densidade óssea mineral uma vez que a OPG bloqueia a interacção entre RANK e RANKL. O RANKL é considerado um estimulador poderoso da reabsorção óssea, comportando-se como factor quimiotáctico para células monocíticas através da sua ligação ao RANK. Já a OPG é descrita como um protector ósseo solúvel e a razão RANKL/OPG também tem sido indicada como marcador de prognóstico biológico em patologias não malignas1,2,9,11,13.
As partículas de revestimento de alguns implantes inibem a diferenciação de osteoblastos e alteram a razão de expressão de genes do RANKL e OPG, podendo por isso ter efeitos adversos na remodelação óssea1.
MétodosPara a identificação dos estudos incluídos ou considerados nesta revisão, foi realizada uma pesquisa através da base de dados da Pubmed (Arquivo digital de literatura biomédica e de ciências da vida do Instituto Nacional da Saúde dos Estados Unidos) limitada aos últimos dez anos (2002-2011), complementada perante uma selecção mais direccionada através da base de dados OMIM (Online Mendelian Inheritance in Man - base de dados gerida pelo Instituto de Genética Médica McKusick-Nathans, parte da Universidade de Medicina Johns Hopkins). Foram utilizados como termos de pesquisa na Pubmed: “RANKL dental implants”. Foram utilizadas as palavras - chave na pesquisa direccionada à OMIM “RANKL”.
Como critérios de inclusão foram utilizados artigos clínicos e de revisão referentes à influência do RANKL na osteoimunologia. Foram excluídos os estudos cujo idioma não fosse o inglês, espanhol ou o português. Relativamente aos artigos obtidos a partir da Pubmed, excluíram-se aqueles com mais de dez anos (artigos anteriores a 2002). Esta exclusão não foi válida para os artigos obtidos a partir da base de dados OMIM, não se verificando assim limitação temporal, pela informação de extrema pertinência contida em alguns artigos com mais de dez anos nesta última base de dados.
Após análise segundo os critérios de inclusão e exclusão, foram seleccionados cerca de vinte artigos. Os dados que constavam nos artigos em causa foram analisados e utilizados para a realização do presente artigo de revisão.
RANKLO RANKL é uma proteína transmembranar do tipo II que é expressa em osteoblastos, células do mesênquima, condrócitos hipertróficos e em células T activas, podendo a sua expressão ser potenciada por factores de reabsorção óssea como o factor de necrose tumoral alfa (TNFα) e interleucina 1(IL1)2. Wei e colaboradores concluíram que a IL1 é uma molécula chave na optimização da osteoclastogénese induzida pelo TNF, participando na estimulação de células do estroma da medula óssea para a expressão do RANKL e na estimulação da diferenciação de precursores dos osteoclastos13.
A função principal do RANKL é estimular a diferenciação dos osteoclastos e inibir a apoptose dos mesmos1,3. Assim, verificou-se que na presença de baixos níveis do M-CSF, o RANKL parecia ser necessário e suficiente para a completa diferenciação de células precursoras de osteoclastos em osteoclastos maduros. Para além desta função, verificou-se que o RANKL exercia uma série de efeitos sobre as células imunes, incluindo a activação da cinase c-Jun N-terminal (JNK) nas células T, a inibição da apoptose de células dendríticas, a indução da formação de aglomerados de células dendríticas, bem como efeitos em citocinas que actuam na proliferação de células T activas2.
O RANKL pode ser denominado de diferentes formas na literatura, tais como: citocina relacionada com o TNF, indutora de activação (TRANCE), ligante da osteoprotegerina (OPGL), factor de diferenciação dos osteoclastos (ODF)2.
No que concerne ao mapeamento do gene responsável pela produção do RANKL, o mesmo foi efectuado por Anderson e colaboradores que determinaram mesmo o seu locus preciso no cromossoma 13 (13q14)4. Posteriormente, diversos investigadores, independentemente, clonaram cDNAs do RANKL4–6.
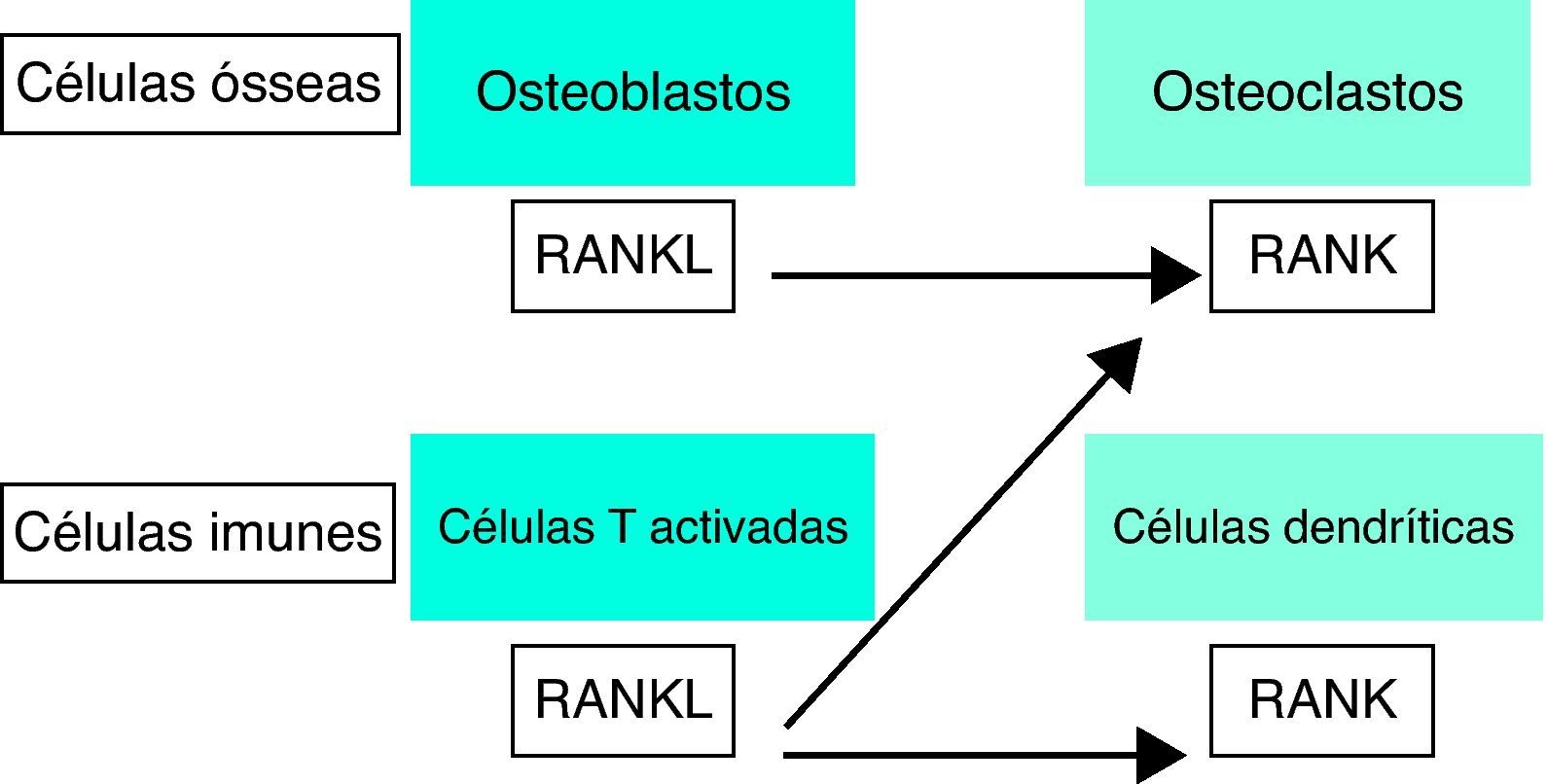
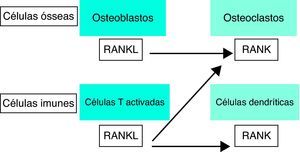
O RANK, também conhecido como receptor do TRANCE, é uma proteína de membrana do tipo I que se expressa na superfície de osteoclastos e em células dendríticas facilitando a sinalização imunológica, como se pode visualizar esquematicamente na Figura 12,8,9,10,11.
Osteoimunologia: a interface entre osso e sistema imune.
RANKL - ligante do receptor activador do factor nuclear kappa Beta, RANK - receptor activador do factor nuclear kappa Beta. (Adaptado de Cohen MMJr 2006)15.
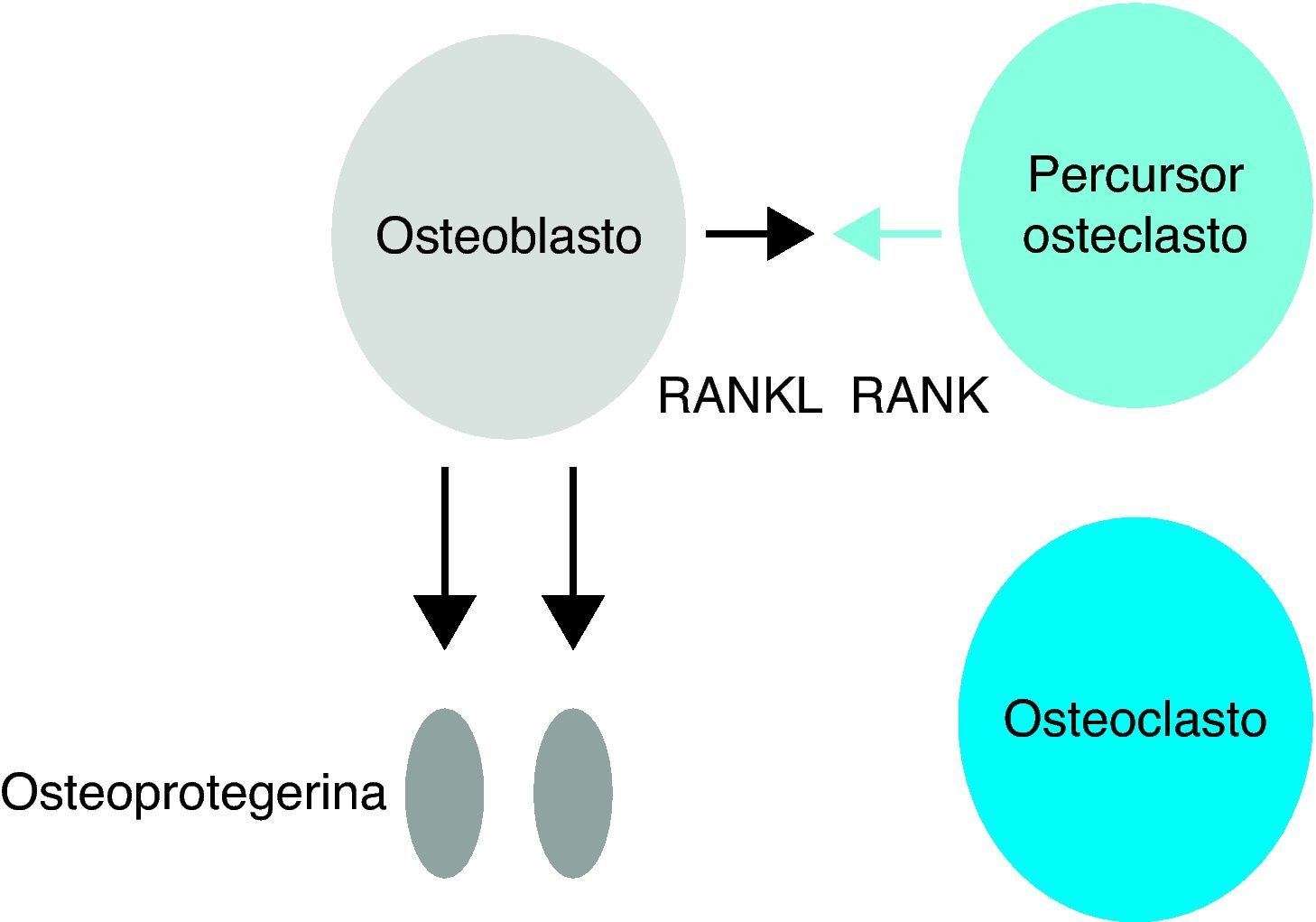
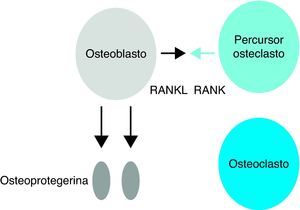
A OPG, conhecida como factor inibidor da osteoclastogénese (OCIF), é uma proteína solúvel produzida por osteoblastos que pode inibir a diferenciação de precursores dos osteoclastos em osteoclastos e pode regular a reabsorção dos osteoclastos in vitro e in vivo, como esquematizado na Figura 22,8,9,10,11. Esta proteína é um receptor que se liga ao RANKL competindo com o RANK. A frequência de OPG produzida regula a massa óssea, pelo que uma alta frequência de OPG faz com que o RANKL esteja menos disponível para ligação com o RANK e favorece assim o aumento da massa óssea, enquanto uma baixa frequência de OPG faz com que o RANKL se torne mais disponível para a ligação com o RANK favorecendo a reabsorção e diminuição da massa óssea2,8–11. Acreditando-se assim que a OPG possa ter efeito ósseo protector.
Acção da osteoprotegerina – inibição da diferenciação dos osteoclastos.
RANKL - ligante do receptor activador do factor nuclear kappa Beta, RANK - receptor activador do factor nuclear kappa Beta. (Adaptado de Cohen MMJr 2006)15.
A tríade molecular constituída por RANKL, RANK e OPG poderá desempenhar um papel determinante na regulação da remodelação óssea e é essencial para a osteoclastogénese e activação de osteoclastos14. Por estes motivos têm sido sugeridas algumas possibilidades terapêuticas na inibição da perda óssea e na promoção da remodelação óssea periodontal por parte desta tríade15.
Actividade do RanklA reabsorção óssea é iniciada quando os osteoblastos produzem o RANKL, que por sua vez activa o RANK nos osteoclastos. No fundo, o RANKL comporta-se como um factor quimiotáctico para monócitos através desta ligação2,8–11. A activação do RANK pelo RANKL é seguida da sua interacção com membros associados à família do receptor TNF (TRAF). O TRAF6 leva à expressão de genes específicos responsáveis pela diferenciação e activação osteoclástica, sendo que os alvos do TRAF6 incluem factores de transcrição como o NF-kB, activador de proteína 1 (AP-1), o factor nuclear de células T activas (NFAT) e as proteínas cinases (MAPKs) como as vias das cinases p38, JNK, cinase regulada por sinal extracelular (ERK) e Fosfatidilinositol-3-cinase/proteína cinase B (PI3K/AKTA)2.
O RANK activado induz o produto de transcrição codificado pelo gene FOS (c-Fos), que por sua vez se liga ao DNA e promove a expressão de vários genes essenciais à maturação osteoclástica e consequentemente à reabsorção óssea. Ao mesmo tempo, o c-Fos activa o interferão β e inibe a diferenciação dos osteoclastos, impedindo que o RANK induza a expressão de c-Fos2. Assim sendo, verifica-se que os osteoclastos podem exercer upregulation ou downregulation sobre si mesmos. Ikeda e colaboradores concluíram que a sinalização c-Jun em cooperação com NFAT é crucial para a diferenciação dos osteoclastos regulados pelo RANKL7.
O desenvolvimento dos osteoclastos deve estar sob o controle de células do estroma da medula óssea/preosteoblasticas, de forma a garantir que o processo de reabsorção e formação óssea seja fortemente associado permitindo manter a integridade do esqueleto2,15. Além disso, a associação entre osteoblastogénese e osteoclastogénese é assegurada pelo facto do factor de diferenciação dos osteoblastos Cbfa1 (principal factor de ligação alfa 1)/Runx2, ser necessário para a expressão adequada do factor de diferenciação dos osteoclastos, RANKL, na superfície de células do estroma/ preosteoblasticas2. A formação de osteoclastos requer a presença de M-CSF, que é produzido por células vizinhas do estroma e osteoblastos, exigindo assim o contacto directo entre essas células e precursores de osteoclastos1–3.
Citocinas como o TNFα e IL1, estimulam a produção de M-CSF (aumentando assim o pool de células preosteoclasticas), aumentando directamente a expressão de RANKL. Além disso, uma série de outras citocinas e hormonas, como o TGF-β (aumenta a produção de OPG), PTH (aumento da produção de RANKL/diminuição da produção de OPG), 1,25 dihidroxivitamina D3 (aumento da produção de RANKL), glicocorticóides (aumento da produção RANKL/diminuição da produção de OPG) e estrogénio (aumento da produção de OPG) exercem seus efeitos sobre a osteoclastogénese através da regulação da produção de células do estroma/osteoblásticas de OPG e RANKL2,11,12. No entanto, nem toda a regulação dos osteoclastos é exclusivamente via osteoblástica. O TGF-β pode também estimular a expressão de RANK em células preosteoclásticas e assim aumentar a sensibilidade osteoclástica ao RANKL2,11.
Quando as células da linhagem osteoclástica RAW264.7 são tratadas simultaneamente com OPG e RANKL, a formação osteoclástica é abolida, pelo que poder-se-á afirmar que a diferenciação dos osteoclastos é inibida pela OPG que se liga ao RANKL, impedindo a interacção com o RANK2. A função da OPG tem também sido demonstrada através do desenvolvimento de ratos transgénicos e knock-out, sendo que os ratos knock-out exibiram diminuição da densidade e volume ósseo e sofriam de osteoporose, a qual foi revertida através da injecção intravenosa de OPG recombinante, revelando que a presença de OPG é necessária à manutenção da massa óssea em situações fisiológicas2.
Verificou-se que a quantidade de osteoprotegerina era superior em tecidos adjacentes a implantes saudáveis16 e a de RANKL inferior, sendo que a razão RANKL/OPG tende a aumentar com a severidade da perimplantite9, sendo que a idade não está associada com a quantidade e concentração de RANKL e não varia com o género, pelo que a OPG poderá ser um possível marcador para avaliar o estado de saúde dos tecidos envolventes dos implantes dentários10,12.
Constatou-se ainda que o sRANKL (forma obtida a partir da clivagem do RANKL associado à membrana pela enzima de conversão TNFα) no fluído crevicular perimplantar não se correlacionou com parâmetros clínicos correspondentes, pelo que o imuno-ensaio com sRANKL não reflecte correctamente o estado da doença, sendo necessário executar estudos longitudinais com amostras grandes12,17.
Novas abordagensVárias abordagens baseadas em moléculas recombinantes (OPG-Fc, RANK-Fc) ou anticorpos específicos contra o RANKL foram reportadas com sucesso2,12. Péptidos do receptor do factor de necrose tumoral (TNFR) têm sido desenvolvidos e eliminam a sinalização induzida pelo RANKL, reabsorção e perda óssea2,12. Tais peptidomiméticos que mimetizam quer receptores de citocina como o TNFR quer receptores como a OPG podem apresentar várias vantagens, sobretudo uma imunogenicidade diminuída, um efeito mais dirigido e múltiplas aplicações em que estas moléculas são implicadas2.
Influência dos iões de titânio na implantologiaO uso de implantes dentários de titânio não é totalmente inócuo para o organismo em que é implementado, tendo-se verificado em estudos realizados por Mine e colaboradores1 que os iões de Ti apresentam efeitos biológicos, tanto na viabilidade de osteoblastos e osteoclastos como na diferenciação destas células, o que pode influenciar o prognóstico dos implantes dentários1. Sendo a resposta biológica a partículas de revestimento na interface osso/implante considerada a principal causa de osteólise periprostética3.
Resultados in vitro sugerem que os iões de Ti podem aumentar significativamente a produção de citocinas inflamatórias por macrófagos o que pode levar a reabsorção óssea, tendo-se também verificado a possível alteração dos padrões de expressão do M-CSF, RANKL e OPG através da interacção entre osteoblastos, células gengivais e linfócitos dos tecidos adjacentes aos implantes1. Ainda neste estudo se verificou que o tamanho das partículas de Ti é um dos factores condicionantes da resposta do organismo, sendo que os iões de Ti no intervalo de concentração de 1-9ppm (parte por milhão) têm pouco efeito sobre a viabilidade de células da linhagem osteoblástica (MC3T3-E1), da linhagem osteoclástica (RAW264.7) e da linhagem de células epiteliais (GE-1), enquanto os iões de Ti de 20ppm diminuíram significativamente a viabilidade de todas as células. Tais conclusões foram possíveis através do recurso a uma reacção da transcriptase reversa, seguida da reacção em cadeia da polimerase (RT-PCR). Os dados RT-PCR quantitativos em tempo real revelaram ainda que os iões de Ti de 9ppm inibiram notavelmente a expressão de Runx2, Osterix e colagénio tipo I na linhagem osteoblástica (MC3T3-E1), em RAW264.7, os iões de Ti não demonstraram nenhum efeito sobre os níveis de mRNAs para a fosfatase ácida tartarato resistente (TRAP) e catepsina K reforçada por RANKL1.
No que ao efeito sobre os níveis de mRNAs para RANKL e OPG em GE-1 diz respeito, verificou-se que os iões de Ti no intervalo de 1-9ppm não apresentaram qualquer influência relevante sobre os mesmos enquanto os iões de Ti de 9ppm aumentaram a expressão destes genes em MC3T3-E11.
Verificou-se ainda em alguns estudos, que o uso de rutilo que é um mineral composto de dióxido de titânio (TiO2) provocou menor bioreactividade comparativamente ao uso de Ti, promovendo assim uma melhor osteointegração in vivo e adesão osteoblástica in vitro, tendo-se verificado actividade de ALP superior em TiO2 comparativamente ao Ti18,19. Tal poderá dever-se a uma maior hidrofilia da fase cristalina oxidada comparada à forma nativa, sendo as superfícies de TiO2 cristalino mais favoráveis à viabilidade, diferenciação e morfologia celular do que o Ti.
A superfície porosa oxidada de Ti aparenta ser a superfície mais efectiva, verificando-se ainda que a adesão de osteoblastos é superior em implantes de titânio que foram previamente sujeitos a anodização18–20.
A modificação das superfícies implantares tem sido o grande desafio da implantologia moderna e a engenharia genética possui ainda uma vastíssima quantidade de informação por desvendar, acreditando-se que esta nobre área da medicina longe estará de ter cessado a sua contribuição para o desenvolvimento da tecnologia implantar.
ConclusõesPerante tudo o que foi consultado e neste trabalho apresentado, atrevemo-nos a concluir que hoje já se torna mais claro e predictível o sucesso da reabilitação oral com implantes dentários, contudo ainda existe uma franja, reduzida certamente, de indivíduos para os quais a previsão não é tão simples. A susceptibilidade do hospedeiro para desenvolver reacções exacerbadas pró-inflamatórias pode, em parte, ser um factor etiológico do insucesso implantar. Nestes casos específicos e talvez na globalidade dos casos, se possível, os níveis de RANKL e OPG poderão eventualmente contribuir para a optimização de resultados referentes ao sucesso da reabilitação implantar.
Acreditamos que estudos clínicos futuros em humanos com recurso a estas moléculas poderão desempenhar um papel fundamental na determinação da influência destas moléculas em procedimentos de regeneração óssea em cirurgia oral, bem como em implantologia.
É nossa convicção ainda que a investigação baseada na determinação dos níveis destas moléculas e a sua associação a susceptibilidade do hospedeiro para a reabsorção radicular externa e para a reabsorção óssea na área da ortodontia fixa não devem ser menos válidas enquanto objecto de estudo.
Conflito de interessesOs autores declaram não haver conflito de interesses.