Determinar a capacidade de estimulação do fluxo salivar, potencial erosivo e quantidade de flúor libertado na saliva durante a exposição a dois estimulantes gustativos de secreção salivar (EGSS) numa população saudável.
MétodosEnsaio clínico aleatório duplamente cego em cross‐over. Sessenta voluntários foram distribuídos aleatoriamente por 2 grupos. Cada grupo foi exposto inicialmente a um EGSS baseado em ácido cítrico ou a um EGSS composto por ácido málico, flúor e xilitol. Foram determinados o fluxo salivar não estimulado, o estimulado mecanicamente e o estimulado com os diferentes EGSS. O pH salivar e o flúor libertado na saliva foram determinados por potenciometria. O potencial erosivo foi calculado com base no número de episódios de pH salivar inferior a 4,5 por mais de um minuto. Os resultados foram apresentados como média e intervalo de confiança±95% e analisados pelo teste t de Student e ANOVA, aceitando‐se apenas valores comparativos para p<0,05.
ResultadosO estimulante baseado em ácido málico obteve uma redução do risco absoluto para fenómenos potencialmente erosivos de 13,91% (1,67%; 26,15%) e um número necessário tratar (NNT) de 8, tendo libertado na saliva 87,75% (81,48%; 94,03%) da quantidade de flúor advogada pelo fabricante.
ConclusãoOs EGSS baseados em ácido málico apresentaram uma eficácia de estimulação da secreção salivar semelhante quando comparados com os EGSS com ácido cítrico. Contudo, os EGSS baseados em ácido málico apresentaram diminuição do potencial erosivo associado a uma libertação de flúor na saliva, a qual é potencialmente protetora da estrutura dentária nos fenómenos de erosão dentária.
To compare salivary flow stimulation capacity, erosive potential and fluoride quantities released in saliva during the exposure to two different gustatory stimulants of salivary secretion (GSSS).
MethodsA double blind randomized controlled trial in cross‐over. Sixty volunteers randomly both recruited and divided into two groups, according to the first GSSS tested. The groups were exposed to GSSS based on citric acid or GSSS containing malic acid, fluoride and xylitol. Unstimulated, mechanical and GSSS stimulated salivary secretions were measured within each group. The pH variations and fluoride release of all samples were measured using potenciometric techniques. Erosive potential was determined regarding salivary pH variations and counts of subjects with pH below 4.5 for over 1min. Results were presented as mean±95% confidence interval and analyzed with Student's t‐test or ANOVA as appropriate and only comparative findings for p<0.05 were accepted.
ResultsThe malic acid, fluoride and xylitol GSSS presented an absolute risk reduction (ARR) for potential erosive phenomena's of 13.91% [1.67%; 26.15%] and a number needed to treat (NNT) of 8 when compared with the citric acid GSSS. The same GSSS released 87.75% [81.48%; 94.03%] of the total fluoride quantity announced by the producer into the saliva.
ConclusionThe malic acid based GSSS presented similar salivary stimulation efficiency when compared to the GSSS containing citric acid. Moreover the malic acid based GSSS presented a decrease of erosion potential and fluorides release to the saliva, which in turn could potentially protect tooth structure from erosion episodes.
A secreção salivar em quantidades fisiológicas é fundamental para a saúde oral1. Doentes com uma diminuição objetiva do fluxo salivar2–4 apresentam um risco aumentado para numerosas situações patológicas, entre as quais a cárie e a erosão dentária1,3. Com o objetivo de minorar as complicações decorrentes da hipossialia1,5 surgiram estimulantes gustativos de secreção salivar (EGSS), como o SST® (Pharm Plc, Godalming, Reino Unido), que, apesar de não apresentarem sacarose na sua constituição, são na maioria compostos por diferentes ácidos (cítrico, acético) podendo originar um potencial erosivo para a estrutura dentária2,6–8.
Recentemente surgiu um novo EGSS – Xeros™ (Dentaid®, Cerdanyola, Espanha), baseado em ácido málico ao qual foi adicionado na sua composição flúor e xilitol9,10, com o objetivo de contrariar o potencial cariogénico e erosivo proporcionado pela diminuição de pH salivar11. Apesar do papel preponderante do flúor na saliva, descrito por limitar os fenómenos de desmineralização dentária, potenciar a remineralização12,13 e apresentar propriedades antibacterianas14–17, a aplicação do flúor deve ser ponderada14, sendo o grande paradigma a maximização dos seus benefícios com minimização dos efeitos colaterais18.
A ausência de estudos comparativos dos efeitos e consequências da utilização dos EGSS associada à sua libertação de flúor propiciou a realização deste trabalho experimental, onde o objetivo foi obter resultados preliminares, numa população sistemicamente saudável, relativos à real eficácia secretória, potencial erosivo e possíveis efeitos benéficos ou deletérios da libertação de flúor obtida por 2 produtos: Xeros™, constituído por ácido málico, flúor e xilitol, e SST®, baseado em ácido cítrico.
Foram definidas as seguintes hipóteses para este estudo. H0: a capacidade de estimulação secretória não é influenciada pelo EGSS utilizado. H0: o pH salivar não é influenciado pelo EGSS utilizado. H0: a quantidade de flúor libertado na saliva não é influenciada pelo EGSS utilizado.
Materiais e métodosFoi realizado um ensaio clínico aleatório duplamente cego em «cross‐over» com 60 voluntários da população de estudantes da Faculdade de Medicina Dentária da Universidade de Lisboa. Como critérios de inclusão foram selecionados voluntários saudáveis, maiores de 18 anos, sem alterações do fluxo salivar e sem nenhuma doença sistémica ou a realizar qualquer medicação que induzisse a hipossalivação. Na 1.a visita, após a assinatura do consentimento informado, os voluntários foram distribuídos aleatoriamente, com recurso a um «software» (GraphPad QuickCalcs Website: http://www.graphpad.com/quickcalcs/randomize1.cfm) em 2 grupos A e B, correspondentes a qual dos EGSS realizariam em primeiro lugar. Tratando‐se de um estudo em «cross‐over», os voluntários testaram os 2 EGSS. Os participantes foram instruídos dos métodos de colheita da saliva e dos tempos pré‐definidos.
Na 2.a visita foi realizada a colheita de saliva não estimulada e estimulada mecanicamente com o auxílio de uma pastilha de parafina (CRT Buffer, Ivoclar‐Vivadent®, Liechtenstein). Na 3.a e 4.a visitas, de acordo com a distribuição aleatória do grupo, foi realizada a colheita de saliva não estimulada e estimulada quimicamente com os respetivos EGSS. Nas amostras recolhidas por métodos pré‐estabelecidos foram determinados os fluxos salivares9,10. Para determinação do pH salivar e da libertação de flúor para a saliva foi realizada uma técnica potenciométrica, com o auxílio de um potenciómetro GLP 22+ (Crison®, Barcelona, Espanha) associado ao microelétrodo INLAB 423 (Metler Toledo®, OH, EUA) e acoplado a um elétrodo de ião seletivo de flúor DC219‐F (Mettler Toledo®, OH, EUA), respetivamente, tendo sido realizada antes de cada grupo de medições a calibração da respetivas curvas. Os resultados foram analisados estatisticamente por um operador cego ao estudo, sendo os produtos referidos apenas como A e B no programa SPSS (SPSS V. 16, Inc, Chicago, IL, EUA). O potencial erosivo dos EGSS foi calculado pela quantidade de tempo, em minutos, em que o pH salivar foi inferior a 4,5. Foi ainda realizada a tabela de contigência e determinada a redução do risco absoluto de fenómenos potencialmente erosivos e o número necessário tratar (NNT). Todos os resultados foram indicados como média e intervalo de confiança (IC) de±95%, e analisados estatisticamente com o teste t de Student, qui‐quadrado ou ANOVA consoante o apropriado.
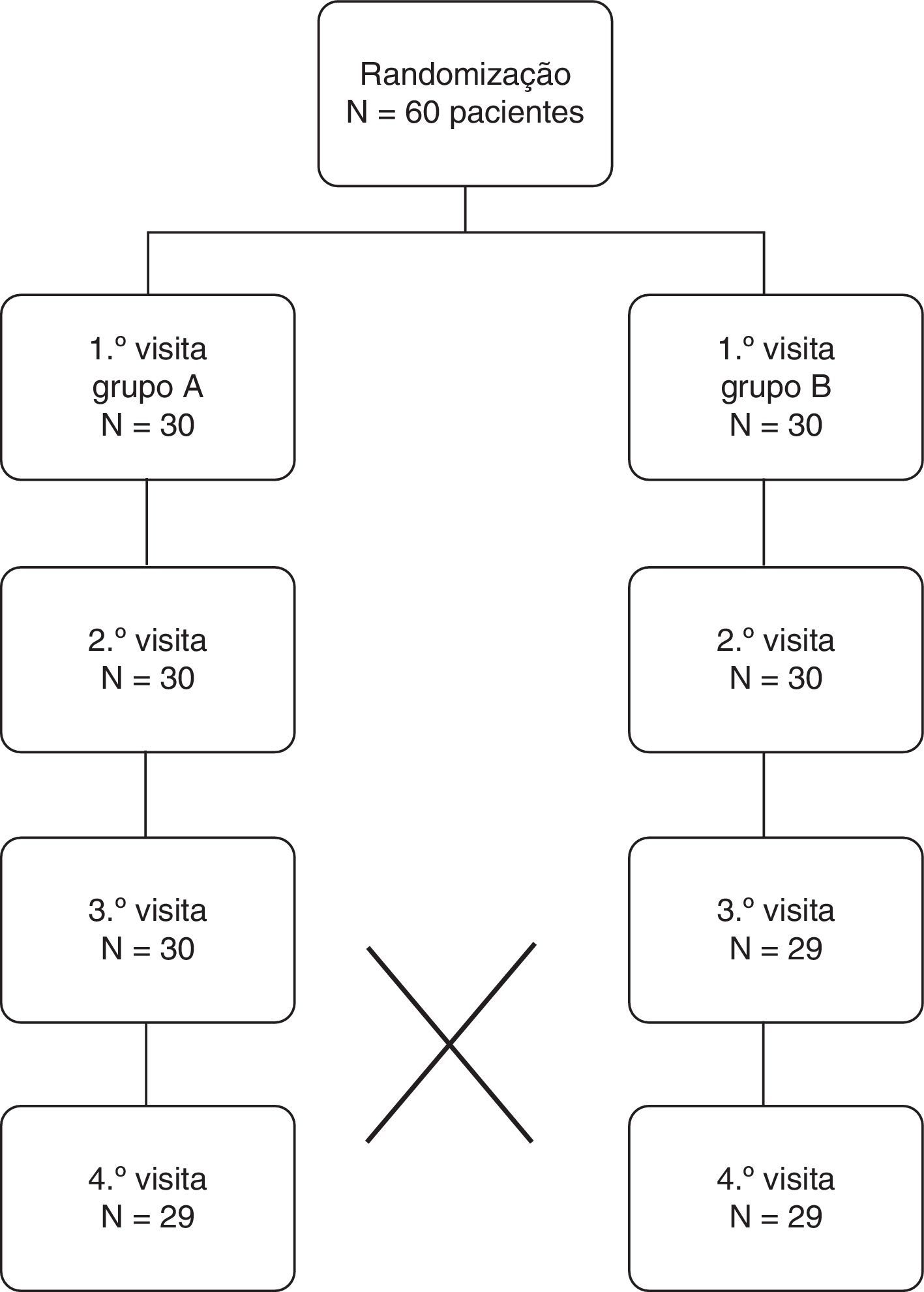
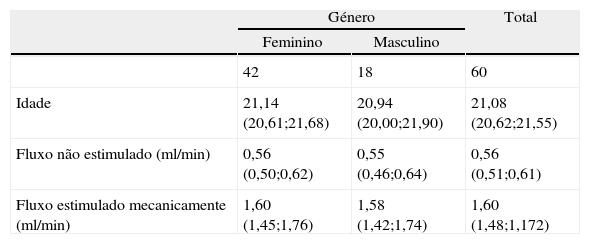
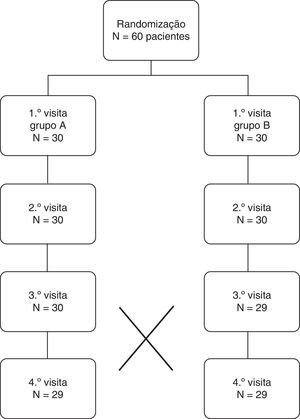
ResultadosUm total de 60 voluntários foram distribuídos aleatoriamente por um dos 2 grupos, de acordo com a figura 1. Tratando‐se de um estudo em “cross‐over” todos os voluntários experimentaram os 2 EGSS. As características dos 60 voluntários foram indicadas como média e IC±95% (tabela 1), tendo ocorrido apenas 2 desistências ao longo do estudo. Foi realizado o teste t de Student não se observando diferenças estatísticas significativas (p>0,05) quanto às características basais dos voluntários independentemente do seu género.
Caracterização da amostra. Tabela de caracterização da amostra com resultados indicados sobre a forma de média e intervalo de confiança (IC) de±95%
| Género | Total | ||
| Feminino | Masculino | ||
| 42 | 18 | 60 | |
| Idade | 21,14 (20,61;21,68) | 20,94 (20,00;21,90) | 21,08 (20,62;21,55) |
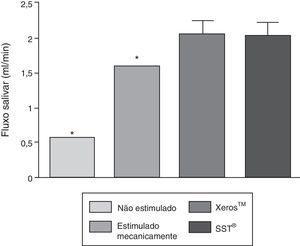
| Fluxo não estimulado (ml/min) | 0,56 (0,50;0,62) | 0,55 (0,46;0,64) | 0,56 (0,51;0,61) |
| Fluxo estimulado mecanicamente (ml/min) | 1,60 (1,45;1,76) | 1,58 (1,42;1,74) | 1,60 (1,48;1,172) |
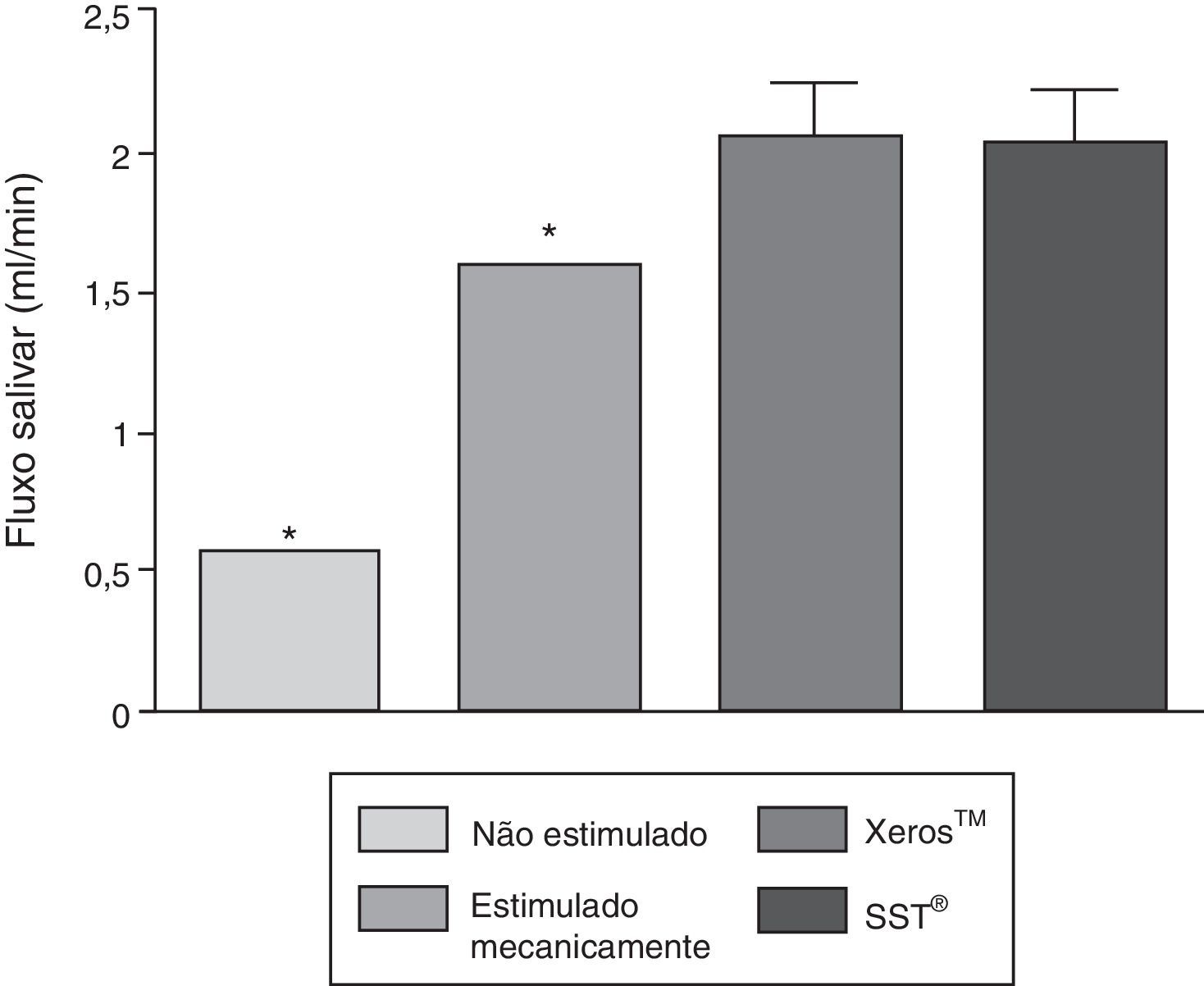
Na figura 2 é possível verificar com um IC±95% que a estimulação mecânica e química tiveram a capacidade de aumentar significativamente a secreção salivar (p<0,05), quando comparadas com o fluxo salivar não estimulado. Os 2 EGSS não apresentaram diferenças estatisticamente significativas relativamente à sua capacidade de estimulação secretória (p>0,05), porém ambos apresentaram uma capacidade significativamente superior (p<0,05) quando comparados com a estimulação mecânica.
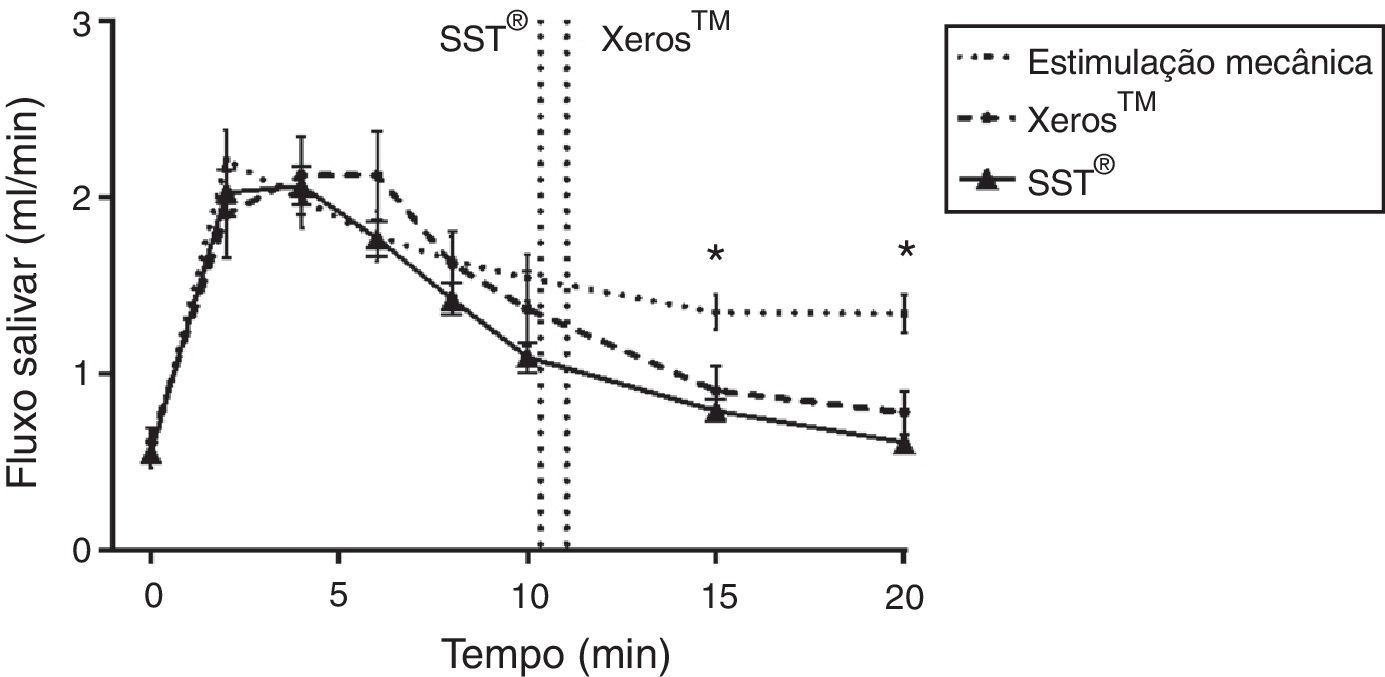
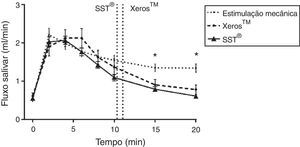
De acordo com a figura 3, ao longo do tempo o fluxo salivar estimulado mecanicamente e o estimulado quimicamente apresentaram um padrão de resposta semelhante com IC de±95%. Contudo, após a dissolução dos comprimidos, aos 15 e 20 minutos, verificou‐se uma diminuição significativa (p<0,05) dos fluxos estimulados quimicamente, comparativamente ao fluxo salivar estimulado mecanicamente. Quando comparados os fluxos salivares dos 2 EGSS ao longo do tempo bem como o tempo médio de dissolução dos comprimidos não foram observadas diferenças estatisticamente significativas (p>0,05).
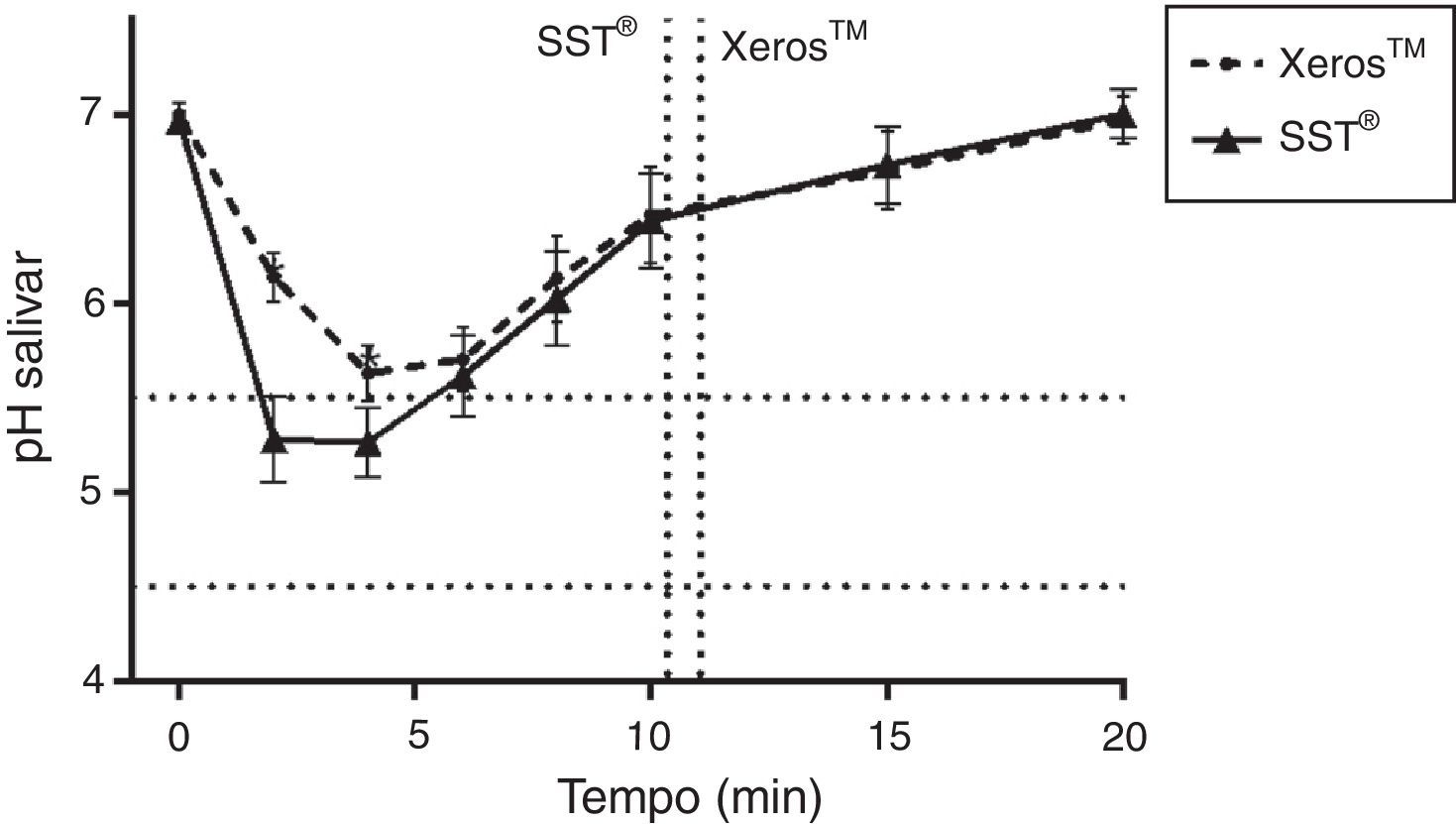
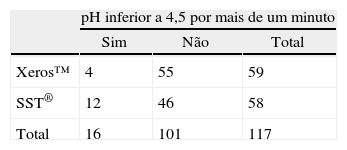
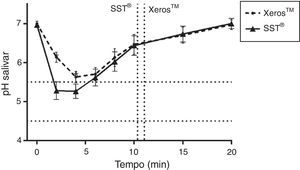
Na figura 4, quando comparados os 2 EGSS durante a sua utilização e de acordo com estudos anteriores9,10, foram observados valores inferiores de pH salivar ao longo do tempo para o SST® porém apenas aos 2 e 4 minutos estes valores foram estatisticamente significativos (p<0,05). A tabela de contingência (tabela 2) revela ainda que o Xeros™ apresentou uma redução do risco absoluto para fenómenos erosivos, para um pH salivar inferior a 4,5, de 13,91% (1,67%; 26,15%), representando um NNT de 8, sugerindo que um em cada 8 voluntários apresenta a redução de um episódio de potencial erosivo com a utilização do Xeros™ face ao SST®.
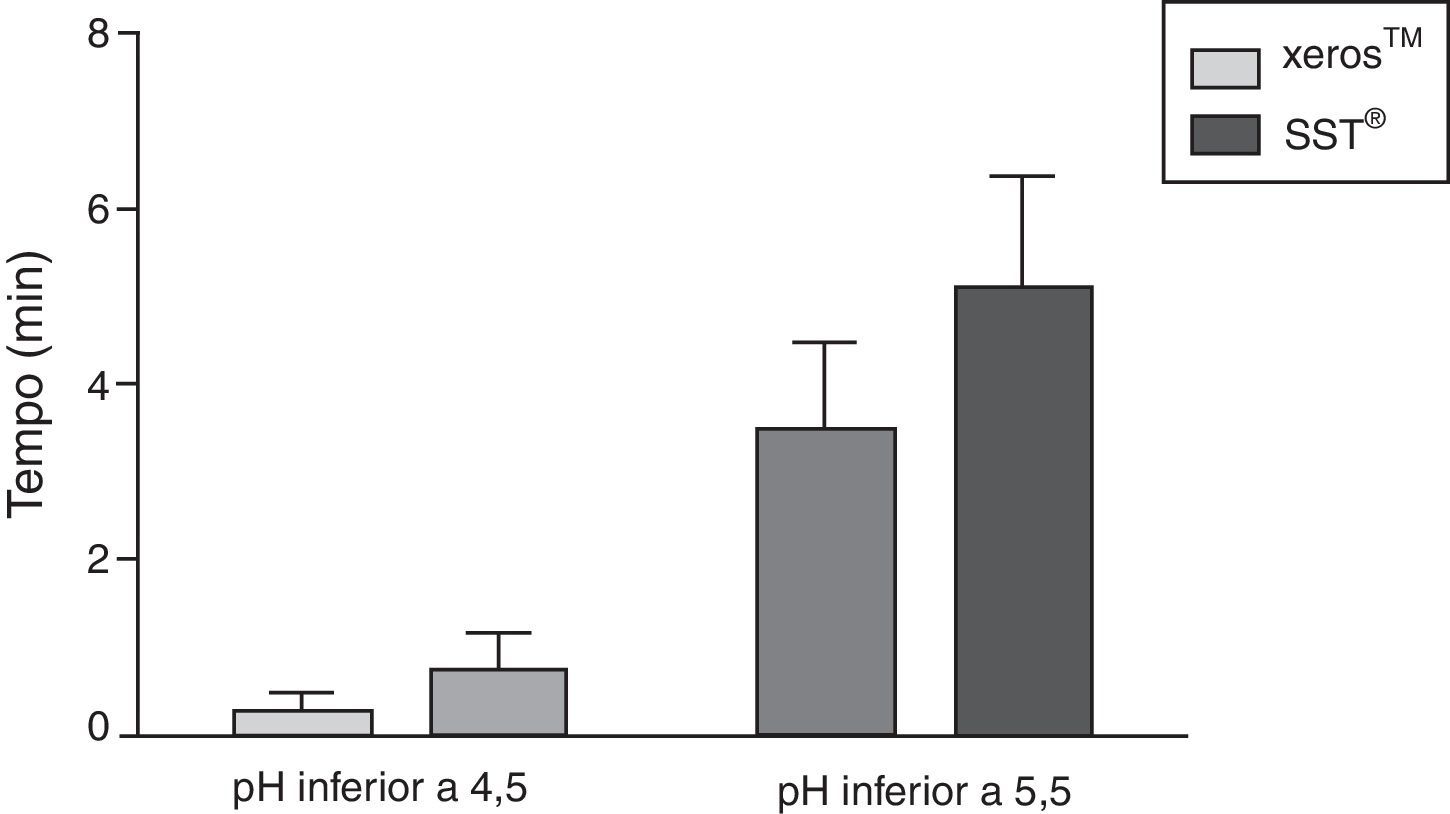
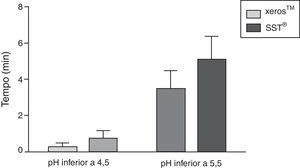
Na figura 5 é apresentado o tempo médio, em minutos com IC de±95%, em que o pH salivar foi inferior a 5,5 e a 4,5 durante a colheita com os EGSS, tendo sido a média de tempo abaixo de valores potencialmente erosivos sempre superior para o SST®, porém apenas com diferenças estatisticamente significativas (p<0,05) para um pH inferior a 5,5.
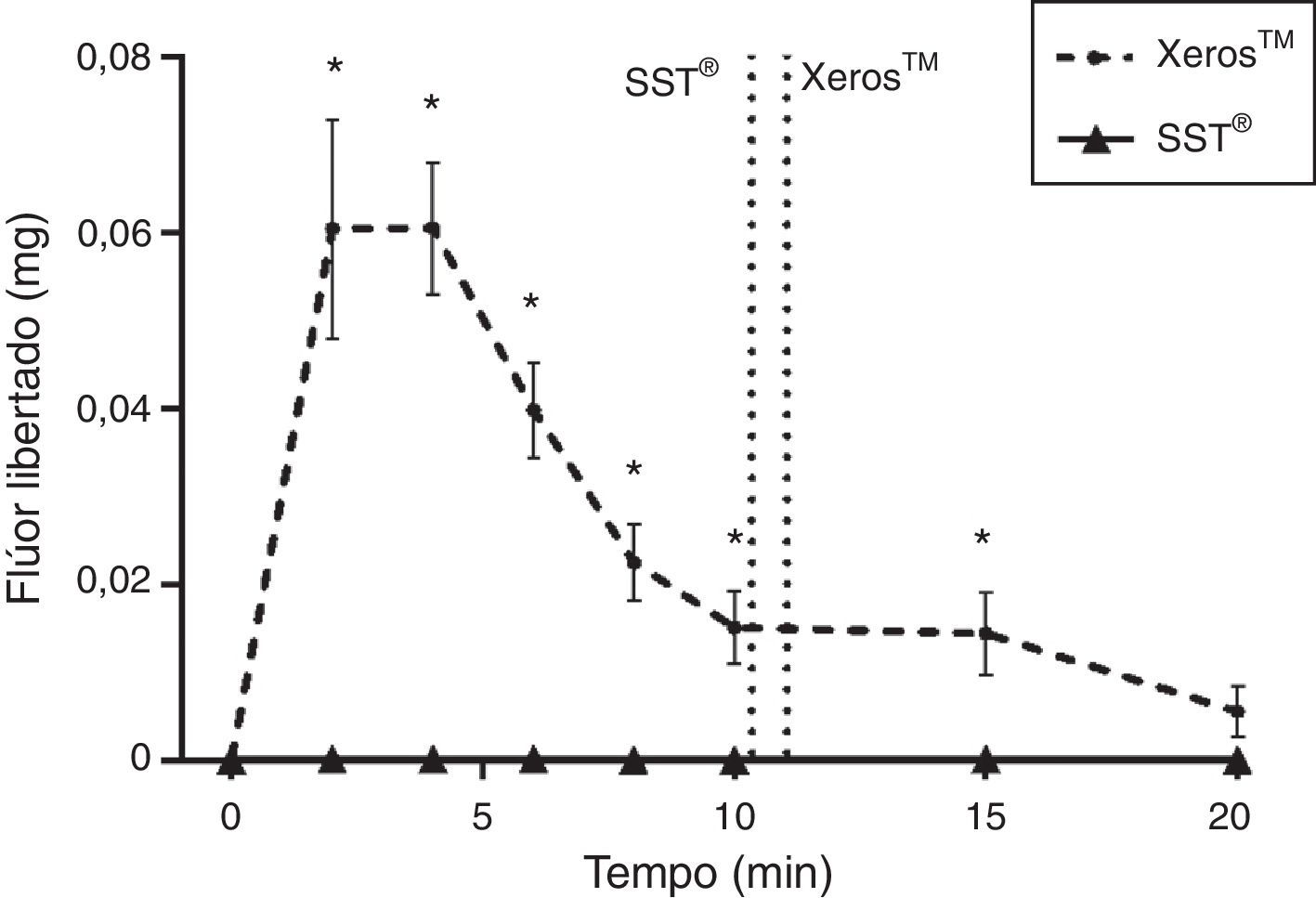
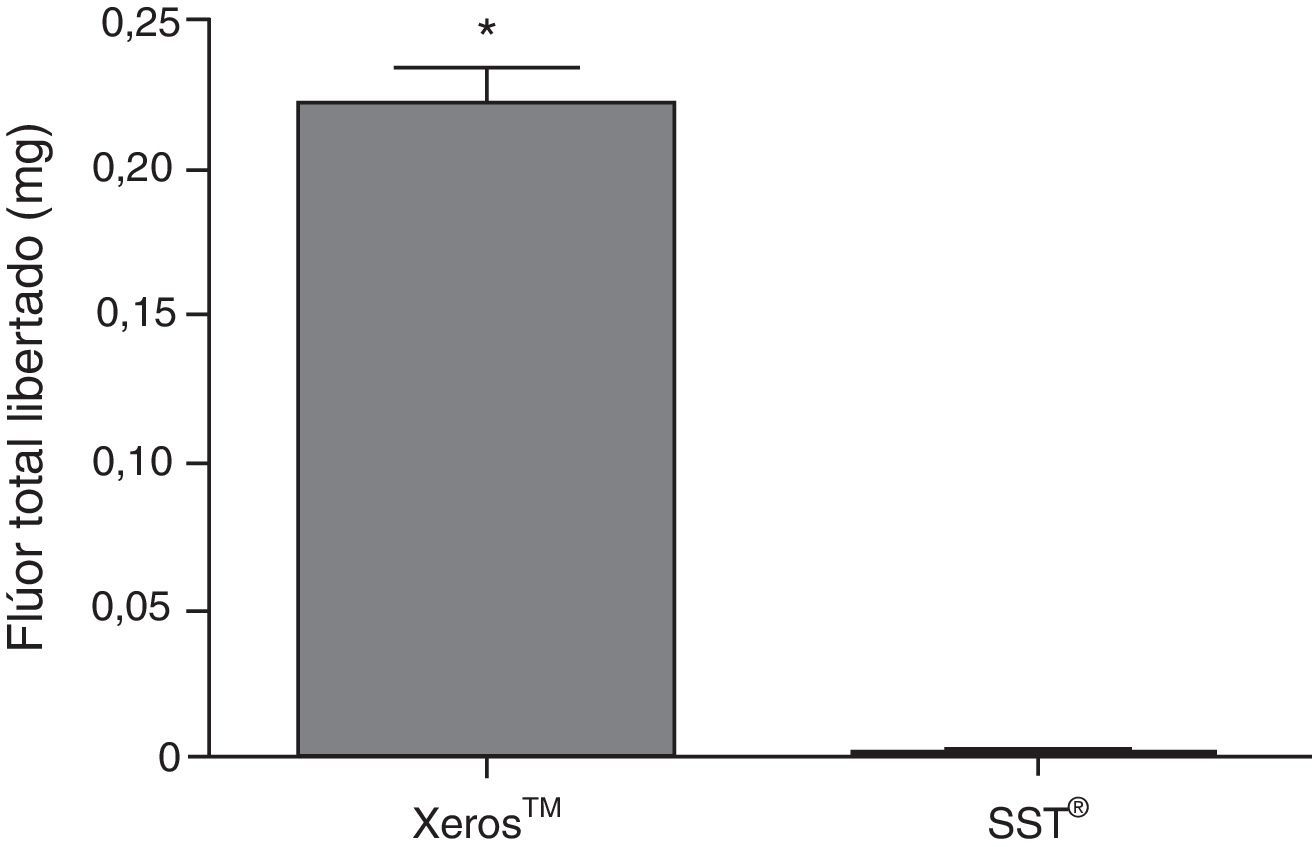
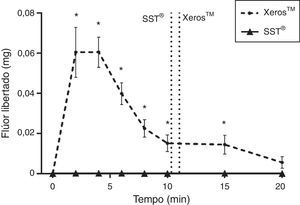
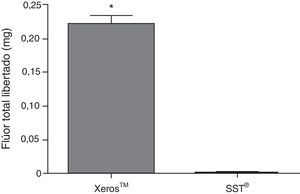
Na figura 6 pode ser observado para o Xeros™ um pico na quantidade de flúor libertada para a saliva nos 4 minutos iniciais de colheita diminuindo progressivamente até aos 20 minutos. Porém, durante toda a colheita, foi significativamente superior (p<0,05) quando comparado com o SST®, com exceção dos 20 minutos. A figura 7 representa o flúor total libertado em miligramas (mg) pelos 2 EGSS, tendo apresentado o Xeros™ valores significativamente superiores (p<0,05) quando comparado com o SST®, uma vez que este último não possui flúor na sua constituição. De acordo com o advogado pelo fabricante, o comprimido Xeros™ possui 0,25mg de flúor na sua constituição, no entanto, durante todo o tempo de colheita foi recolhido 87,75% (81,48%; 94,03%) do flúor total existente no comprimido (±95% CI) o que corresponde a 0,22 (0,20; 0,23) mg de flúor.
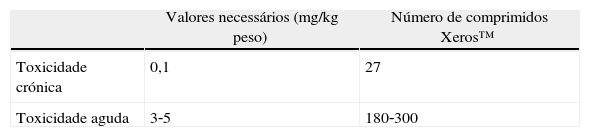
Em 2002, a World Health Organization19–21 definiu valores de toxicidade crónica e aguda para o flúor. De acordo com os valores pré‐estabelecidos na tabela 3, foi determinado a quantidade de comprimidos necessários ingerir para a ocorrência destes fenómenos de toxicidade, de acordo com a quantidade de flúor encontrado na saliva pela utilização do EGSS Xeros™ (em média 0,22mg). Para a ocorrência de toxicidade crónica seria necessário ingerir aproximadamente 27 comprimidos de Xeros™ por dia.
Tabela de toxicidade. Tabela relativa à ocorrência de fenómenos potencialmente tóxicos19–21 num indivíduo de 60kg de acordo com a quantidade total de flúor encontrado na saliva (0,22mg)
| Valores necessários (mg/kg peso) | Número de comprimidos Xeros™ | |
| Toxicidade crónica | 0,1 | 27 |
| Toxicidade aguda | 3‐5 | 180‐300 |
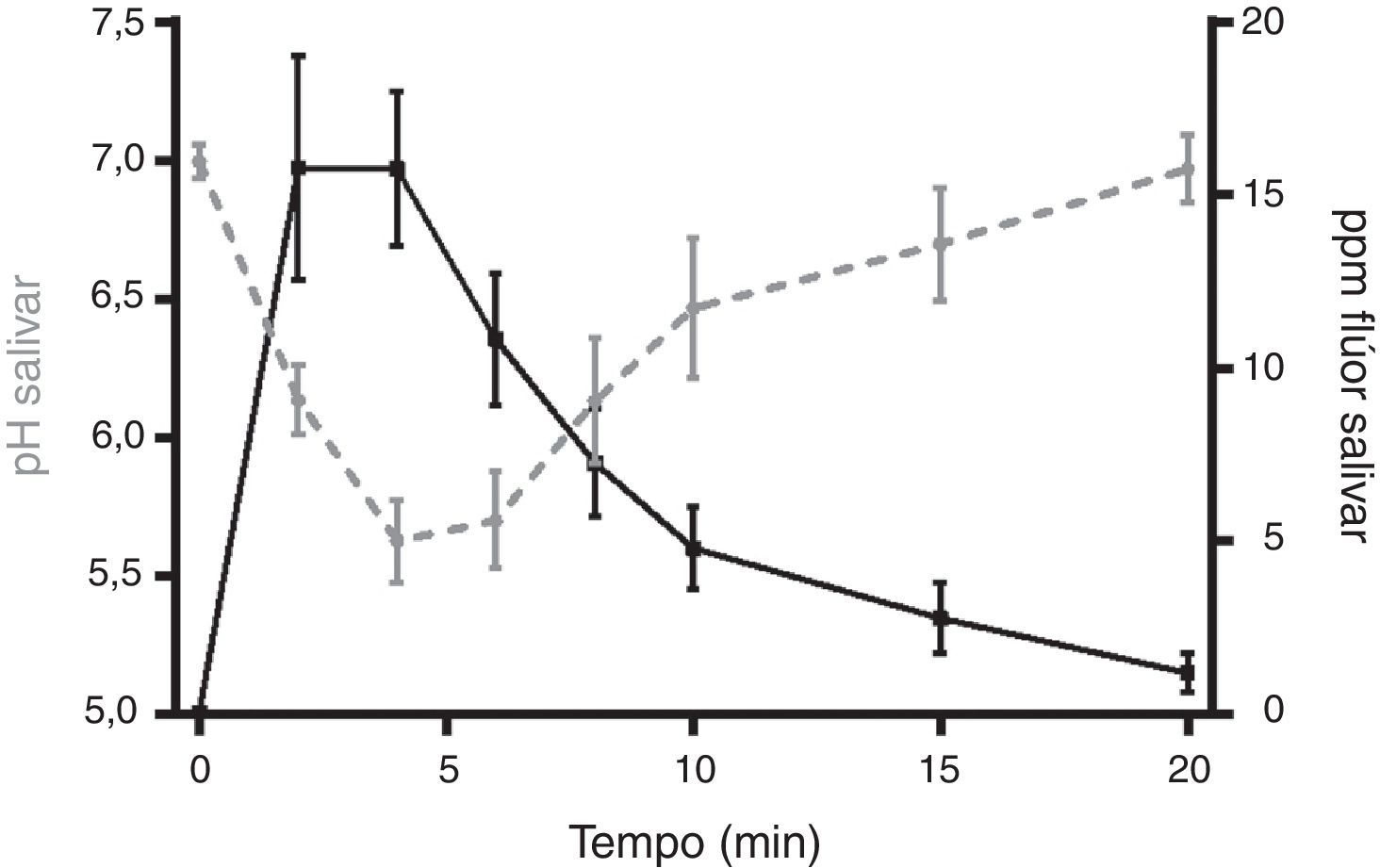
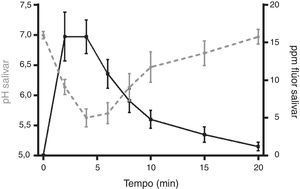
A figura 8, pela associação da variação de pH salivar e a concentração de flúor média (ppm) ao longo do tempo, com o comprimido Xeros™, determinada com IC±95%, foi possível constatar concentrações salivares de flúor superiores no momento em que ocorrem os valores inferiores de pH salivar.
DiscussãoOs resultados obtidos neste ensaio clínico sugerem que os EGSS baseados em ácido málico e flúor, como o Xeros™, revelam igual capacidade de estimulação da secreção salivar, associada a uma menor diminuição do pH e uma libertação de flúor para a saliva potencialmente remineralizadora da estrutura dentária, constatado numa redução do risco absoluto em 13,91% (1,67%; 26,15%) face ao SST® e um NNT de 8.
O fluxo salivar estimulado mecanicamente apresenta‐se estatisticamente inferior (p<0,05) ao estimulado quimicamente durante a dissolução do comprimido. Estes resultados apresentam‐se contraditórios em alguns estudos9, uma vez que a determinação do fluxo salivar estimulado quimicamente foi realizada na totalidade da colheita salivar (20 minutos), o que considerava fluxos após a dissolução do comprimido e que diminuía a média dos valores obtidos. A estimulação mecânica apresenta efeitos mais prolongados na capacidade secretória, porém, é de salientar as implicações diretas e prejudiciais na articulação temporomandibular, músculos mastigatórios23 e na mucosa gástrica24–26.
O componente ácido dos EGSS tem como função a estimulação da secreção salivar, porém, a substituição do ácido cítrico por ácido málico, segundo os resultados observados, apresenta igual capacidade estimulatória e ainda induz uma menor diminuição do pH salivar. O ácido cítrico, componente principal do SST®, para além de um pKa superior ao ácido constituinte do Xeros™, apresenta um potencial erosivo resultante da aptidão para quelação do cálcio. Estes 2 processos potenciam uma maior capacidade destrutiva do esmalte/dentina6 e consequentemente um potencial erosivo superior do SST®. Comprovado neste estudo, pela redução do risco absoluto de 13,91% do EGSS baseado em ácido málico (1,67%;26,15%).
Durante a dissolução do comprimido Xeros™, para além do menor número de amostras salivares com valores de pH salivar potencialmente erosivos6, estas encontravam‐se abrangidas pelo pico de libertação de flúor para a saliva. Com base em estudos anteriores, valores de concentração salivar de flúor superiores a 2ppm permitem a completa inibição da desmineralização dentária27 e valores superiores a 10ppm poderão permitir a inibição do metabolismo bacteriano28. Assim, de acordo com os resultados do estudo realizado, a cinética de libertação do flúor do comprimido para a saliva do comprimido Xeros™ coaduna‐se com o objetivo protetor do produto e a ausência de flúor no SST® aumenta o risco da perda de estrutura dentária.
O flúor total libertado na saliva por cada comprimido Xeros™ é aproximadamente 0,22mg, ligeiramente inferior ao advogado pelo fabricante, podendo o remanescente ficar retido nos reservatórios orais ou ser deglutido. Os fenómenos de toxicidade aguda ficam à partida excluídos pela dose necessária de comprimidos ingeridos, no entanto, tratando‐se de um tratamento paliativo, seria passível a ocorrência de toxicidade crónica como a fluorose óssea15,20,29. Apesar do Xeros™ ser um produto de venda livre, a ingestão de 27 comprimidos por dia torna pouco provavél estes processos de toxicidade.
Os resultados obtidos neste estudo permitiram reforçar a ideia dos estudos anteriores9,10 que os EGSS apresentam uma estimulação salivar efetiva, sendo que os que apresentam um maior potencial erosivo intrínseco, como o SST®, levam a uma maior diminuição do pH salivar e eventual desmineralização dentária9,10.
O desenho deste estudo apresenta‐se como um ensaio clínico aleatório duplamente cego em que os grupos existentes experimentaram os 2 EGSS em «cross‐over» permitindo duplicar a amostra. Tratando‐se de um estudo relativo a uma terapêutica específica, em estudos futuros seria importante verificar os resultados num público‐alvo, como pacientes hipossiálicos.
É de salientar que apesar da diminuição de pH ter sido descrita como um fator de risco preditivo da erosão dentária7,30,31, alguns autores referiram que poderia não ocorrer dissolução da hidroxiapatite quando o pH salivar caísse para 5,5, num curto período de tempo32. Assim, e de modo a colmatar a limitação deste estudo baseando‐se na determinação do potencial erosivo com base num pH salivar, optou‐se por considerar um pH salivar inferior a 4,5 o qual, de acordo com a literatura, deveria produzir efeitos desmineralizantes, no entanto, e uma vez que não foram realizadas técnicas profilométricas, os resultados obtidos poderão não refletir a verdadeira ocorrência de processos erosivos na estrutura dentária.
Nos últimos anos foram publicados diversos artigos em que demonstravam um aumento do risco de episódios potencialmente erosivos aquando da utilização dos EGSS3,9,10,22,32. Recentemente surgiram no mercado estimulantes aos quais foi adicionado flúor à sua constituição, contudo, a evidência científica disponível sobre a cinética da libertação do flúor para a saliva destes produtos é inexistente tendo justificado a realização deste estudo.
É fundamental referir quanto às implicações clínicas deste estudo, e com base na semelhança do custo monetário dos 2 EGSS, Xeros™ e SST®, que de acordo com os resultados deste estudo quanto ao potencial erosivo e à cinética de libertação de flúor dos EGSS, que a terapia paliativa com Xeros™ pode‐se apresentar com um risco‐beneficio superior face aos EGSS mais antigos.
De futuro, é fulcral testar os efeitos destes EGSS na estrutura da superfície dentária.
ConclusãoUm estimulante químico recente (Xeros™ – constituído por ácido málico, flúor e xilitol) permite a mesma estimulação da secreção salivar, associada a menor diminuição do pH salivar e uma libertação de flúor para a saliva potencialmente protetora da estrutura dentária quando comparado com o EGSS baseado em ácido cítrico. Neste contexto e tendo em conta o pH salivar como valor preditivo, observou‐se uma diminuição dos fenómenos potencialmente erosivos quando comparados com os EGSS baseados em ácido cítrico.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem a todos os voluntários que participaram no estudo, bem como à Faculdade de Medicina Dentária da Universidade de Lisboa, ao Grupo de Investigação em Bioquímica e Biologia Oral da Unidade de Investigação em Ciências Orais e Biomédicas (GIBBO‐UICOB) pelo apoio e suporte. À Dentaid pelo apoio logistico através do fornecimento de comprimidos Xeros. Trabalho desenvolvido no UICOB, unidade I&D n.° 4.062da FCT.