Avaliar, in vitro, o comportamento biológico de células osteoblásticas na presença de diferentes superfícies implantares.
MétodosForam utilizados 6 grupos de implantes. Os 2 primeiros formados por implantes maquinados, o terceiro, quarto e quinto por implantes jateados e submetidos a ataque ácido, segundo diferentes protocolos, e o sexto por implantes revestidos a spray de plasma de titânio. Os implantes foram semeados com células de medula óssea humana e cultivados por um período de 33 dias, tendo sido avaliados os seguintes parâmetros: adesão e padrão de crescimento celular por microscopia eletrónica de varrimento, morfologia celular através de microscopia confocal de varrimento laser, atividade da fosfátase alcalina, expressão génica de marcadores osteoblásticos e consumo de cálcio ionizado do meio de cultura. Os dados foram analisados com o teste estatístico MANOVA (alfa=0,05).
ResultadosNão se verificaram diferenças entre os 6 grupos no que se refere à adesão e proliferação celular e à expressão génica de marcadores osteoblásticos. O padrão de crescimento apresentou diferenças com maior grau de complexidade nos implantes dos grupos 3 e 5. A atividade da fosfátase alcalina apresentou, aos 21 dias, diferenças estatisticamente significativas entre os grupos 3, 5 e 6 e o grupo controlo 1. Em relação aos níveis de cálcio ionizado no meio cultura os maiores consumos verificaram‐se nos grupos 3, 5 e 6.
ConclusõesA superfície dos implantes parece influenciar o comportamento biológico in vitro para o conjunto dos parâmetros analisados, mesmo quando considerados implantes com a mesma designação de superfície, embora preparada segundo protocolos distintos
Evaluate the in vitro biological behavior of odontoblastic cells in the presence of different implant surfaces.
Methods264 pure titanium implants were divided into six groups. The two first ones were formed by machined implants, the third, fourth and fifth by blast‐etched implants, according to different protocols, and the sixth one by plasma spraying coated titanium implants. The six group implants were cultured with human bone marrow cells for a 33‐day period to evaluate cell adhesion and proliferation by scanning electron microscopy, cytoskeleton organization by confocal laser scanning microscopy, alkaline phosphatase activity, osteoblast markers gene expression and ionized calcium consumption. Groups of data were evaluated using MANOVA (alfa=0.05).
ResultsNo differences were observed in cell adhesion and proliferation and in gene expression of osteoblastic markers. The pattern of growth showed differences with more complexity observed in groups 3 and 5. Alkaline phosphatase activity at 21 days in groups 3, 5 and 6 showed statistically significant differences compared with control group 1. Consumption of ionized calcium from the culture media was higher in groups 3, 5 and 6.
ConclusionImplant surface seems to influence in vitro biological behavior of osteoblasts even considering implants designate by the same surface treatment although prepared according to different protocols.
O titânio é, presentemente, o material mais utilizado na confeção de implantes dentários pelas suas excelentes propriedades, nomeadamente biocompatibilidade e segurança biológica1–3.
As características da superfície dos implantes revelam‐se importantes uma vez que é nessa zona que ocorrem as reações biológicas que conduzem, quando as condições são favoráveis, à osteointegração4–6. A microtopografia, nomeadamente a rugosidade, e a composição química superficial são importantes pois podem condicionar a osteogénese, desde as fases moleculares até às fases celulares, devendo ser analisadas sempre que se interpretam resultados referentes ao fenómeno da osteointegração e ao desempenho de implantes7,8. Microtopografia, rugosidade e composição química da superfície estão intimamente interligadas, uma vez que, modificando uma modificam‐se as outras. Em certa medida, todas elas são influenciadas pelo tipo de tratamento de superfície.
São várias as técnicas de tratamento de superfície a que podem ser sujeitos os implantes9–11, podendo ser agrupados em 2 grandes grupos: os que apresentam superfície modificada por métodos de adição e os preparados por métodos de subtração9,12. Para além da melhoria das características, algumas técnicas procuram tornar a superfície do titânio bioativa9,13,14. Uma das formas de o conseguir é recorrendo ao seu revestimento com substâncias do tipo fosfato de cálcio que, devido às suas características e semelhanças com o tecido ósseo, apresentam a vantagem de proporcionar uma melhor e mais rápida ancoragem ao osso14–16. No presente trabalho analisou‐se o comportamento biológico in vitro de células osteoblásticas quando em contacto com superfícies implantares com diferentes microtopografias.H0= o tratamento de superfície dos implantes não influencia a resposta biológica in vitro dos osteoblastos. o tratamento de superfície dos implantes influencia a resposta biológica in vitro dos osteoblastos.
Foram utilizados 264 implantes em titânio comercialmente puro (All Spiral, Eckerman, Alicante, Espanha; Stark‐D, Sweden Matina, Padua, Itália), de graus III e IV, divididos em 6 grupos: grupos 1 e 2 – implantes maquinados com macrotopografias diferentes, grupos 3, 4 e 5 – implantes submetidos a duplo tratamento, por método de subtração, consistindo primeiramente no jateamento da superfície, com diferentes partículas, seguido de um ataque ácido. A diferença entre estes 3 grupos reside no tipo de partículas e no tipo de ácido utilizado, bem como nas condições de temperatura, pressão e duração de tempo a que foram submetidos os implantes, não tendo essas condições sido reveladas pelos fabricantes. Por fim o grupo 6 formado por implantes revestidos a spray de plasma de titânio (TPS). Os implantes do grupo 5 eram, segundo o fabricante, uma evolução relativamente aos implantes do grupo 4, apresentando o mesmo tipo de tratamento de superfície embora realizado segundo um protocolo distinto, não revelado pelo fabricante. Os implantes dos grupos 1 e 3 apresentavam a mesma macrotopografia, sendo os do grupo 1 maquinados e os do grupo 3 jateados. Quanto aos grupos 2 e 6, os implantes apresentavam as mesmas características macrotopográficas, sendo os do grupo 2 maquinados e os do grupo 6 revestidos a TPS.
Os implantes foram cortados longitudinalmente, no sentido do longo eixo, e transversalmente, tendo os cortes sido realizados com recurso a um disco diamantado montado num micrótomo para tecidos duros não descalcificados (Acuttom, Struers, Dinamarca). As amostras obtidas foram submetidas a um processo de limpeza metalográfica, em banho ultrassónico, secas numa estufa (Heraeus Electronic, Gaprüfte Sicherheit, Alemanha), à temperatura de 37°C, durante 24 horas, e esterilizadas, em mangas individuais, em autoclave (OMRON ESCS, Kyoto, Japão), a uma temperatura de 121°C e uma pressão de 124KPa, durante 45 minutos. Os implantes dos 6 grupos foram semeados com células de medula óssea humana e cultivados por um período de 33 dias. As culturas de células osteoblásticas foram estabelecidas a partir de medula óssea humana obtida em procedimentos cirúrgicos ortopédicos programados, em pacientes saudáveis. O comportamento celular foi avaliado, ao longo do tempo de cultura, quanto à adesão celular à superfície dos implantes, à organização do citoesqueleto de F‐actina, à morfologia celular e ao padrão de crescimento celular. Foi também avaliada a atividade da fosfátase alcalina, a expressão génica de proteínas da matriz e o consumo de cálcio ionizado (Cai) a partir do meio de cultura.
A atividade da fosfátase alcalina foi avaliada numa solução de Triton a 1% pela hidrólise do p‐nitrofenilfosfato em tampão alcalino (30 minutos, 37°C) e determinação espectrofotométrica do p‐nitrofenol formado a 405nm, num leitor ELISA (Denley Wellscan) e comparada com os valores obtidos para uma série de padrões de p‐nitrofenol. Os resultados foram expressos em nanomoles de p‐nitrofenol produzido por minuto e por micrograma de proteína (nmol/min.μg proteína). Para a avaliação deste parâmetro foram utilizadas 3 amostras dos implantes, pertencentes a cada um dos grupos, por tempo de cultura analisado: 7, 14, 21, 25 e 28 dias, perfazendo um número total de 8 implantes, por experiência, considerando os 5 tempos analisados. Assim, no total, foram utilizados 24 implantes por grupo.
Na avaliação da expressão génica dos marcadores osteoblásticos procedeu‐se à extração do ácido ribonucleíco (RNA) da camada celular recorrendo ao Mini Kit RNeasy® (QIAGEN, Valência, CA, EUA), de acordo com as instruções do fornecedor. O RNA foi quantificado através da medição da absorvância das amostras, a 260nm. Meio micrograma do RNA celular total, de cada amostra, foi transcripto inversamente e amplificado (25 ciclos) com o sistema Titan One Tube RT‐PCR System (Roche), com uma temperatura de annealing, de 55°C. Os produtos Reverse transcriptasepolymerase chain reaction (RT‐PCR) foram analisados, num gel de agarose, a 1%. Nesta análise foram utilizados 5 implantes (10 metades), aos 21 dias, por experiência, pertencentes a cada um dos 6 grupos analisados. Foram, assim, utilizados, no total, 15 implantes por grupo.
Os resultados apresentados relativos à atividade da fosfátase alcalina/proteína total e à análise da expressão génica por RT‐PCR são a média de 3 experiências separadas.
O consumo de Cai do meio de cultura foi determinado utilizando um kit de diagnóstico da Sigma («Sigma Diagnostics Kit, procedure number 587»). Os resultados foram expressos em milimoles de cálcio ionizado por litro de meio de cultura (mmol Cai/l).
Para a observação das culturas celulares em microscopia electrónica de varrimento (MEV) foram utilizados, no total, 3 implantes de cada grupo. Foram utilizadas 2 metades de implante para cada um dos tempos analisados: 3 horas, 24 horas e 28 dias. Para a observação em microscopia confocal de varrimento laser foram utilizados 2 implantes de cada grupo, tendo sido utilizada uma metade para cada um dos tempos de cultura analisados: 7, 21 e 28 dias.
Na análise do comportamento biológico dos implantes foram utilizados um total de 44 implantes pertencentes a cada um dos grupos analisados.
As variáveis atividade da fosfátase alcalina e consumo de Cai do meio de cultura foram sujeitas a análise estatística para comparação de resultados entre grupos.
Os resultados quantitativos são apresentados como média±desvio padrão. A comparação entre grupos de implantes foi avaliada pelo método estatístico MANOVA. Foi fixado um nível de significância estatística de 5%. Na análise estatística foi utilizado o programa informático SPSS (versão 13.0) (SPSS Inc., Chicago, Illinois, EUA).
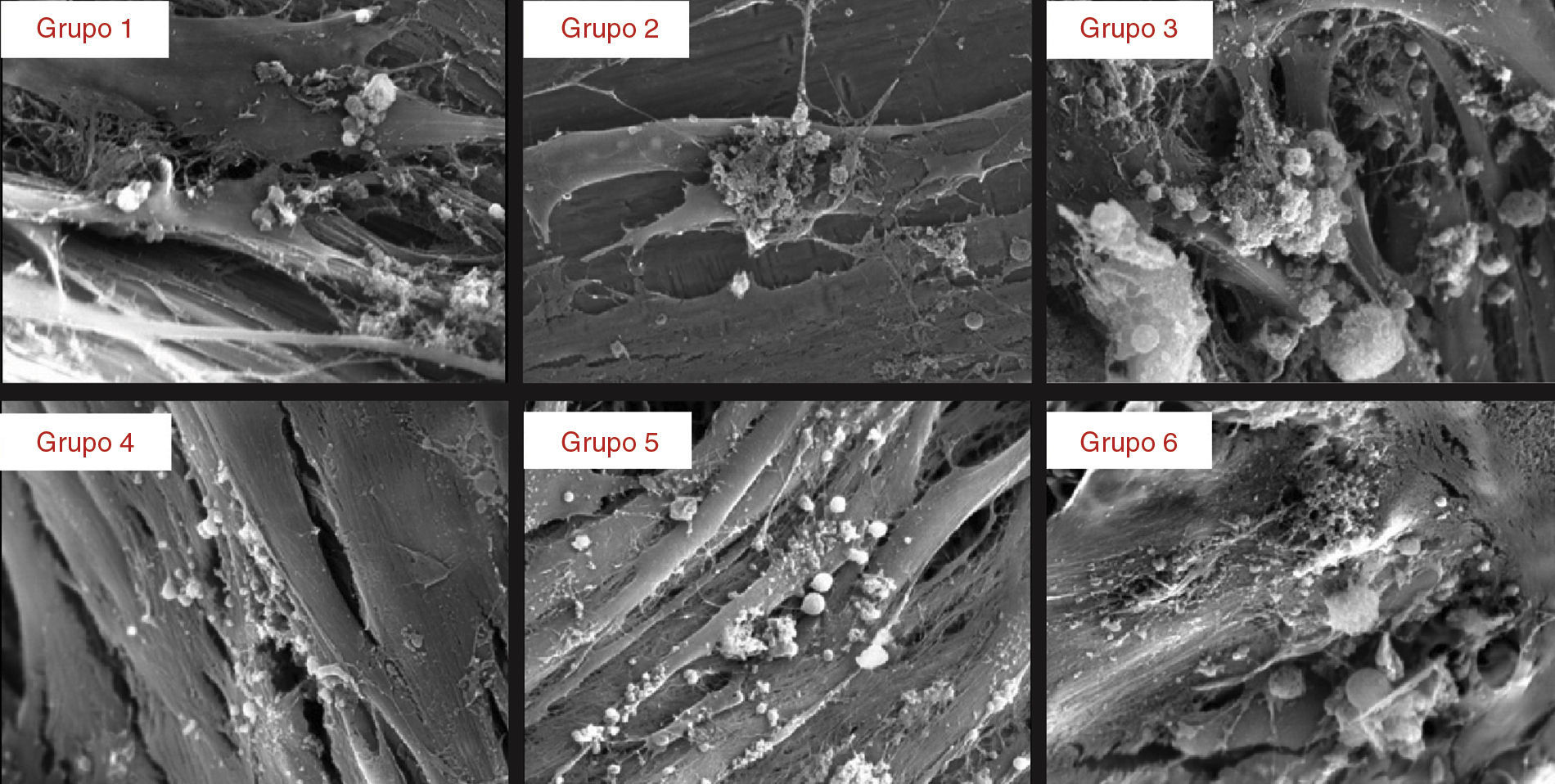
ResultadosO processo de adesão celular foi avaliado nas primeiras 24 horas de cultura através de MEV (fig. 1). As células osteobláticas demonstraram capacidade para aderir a todas as superfícies analisadas, não se observando, para este tempo, diferenças entre os grupos.
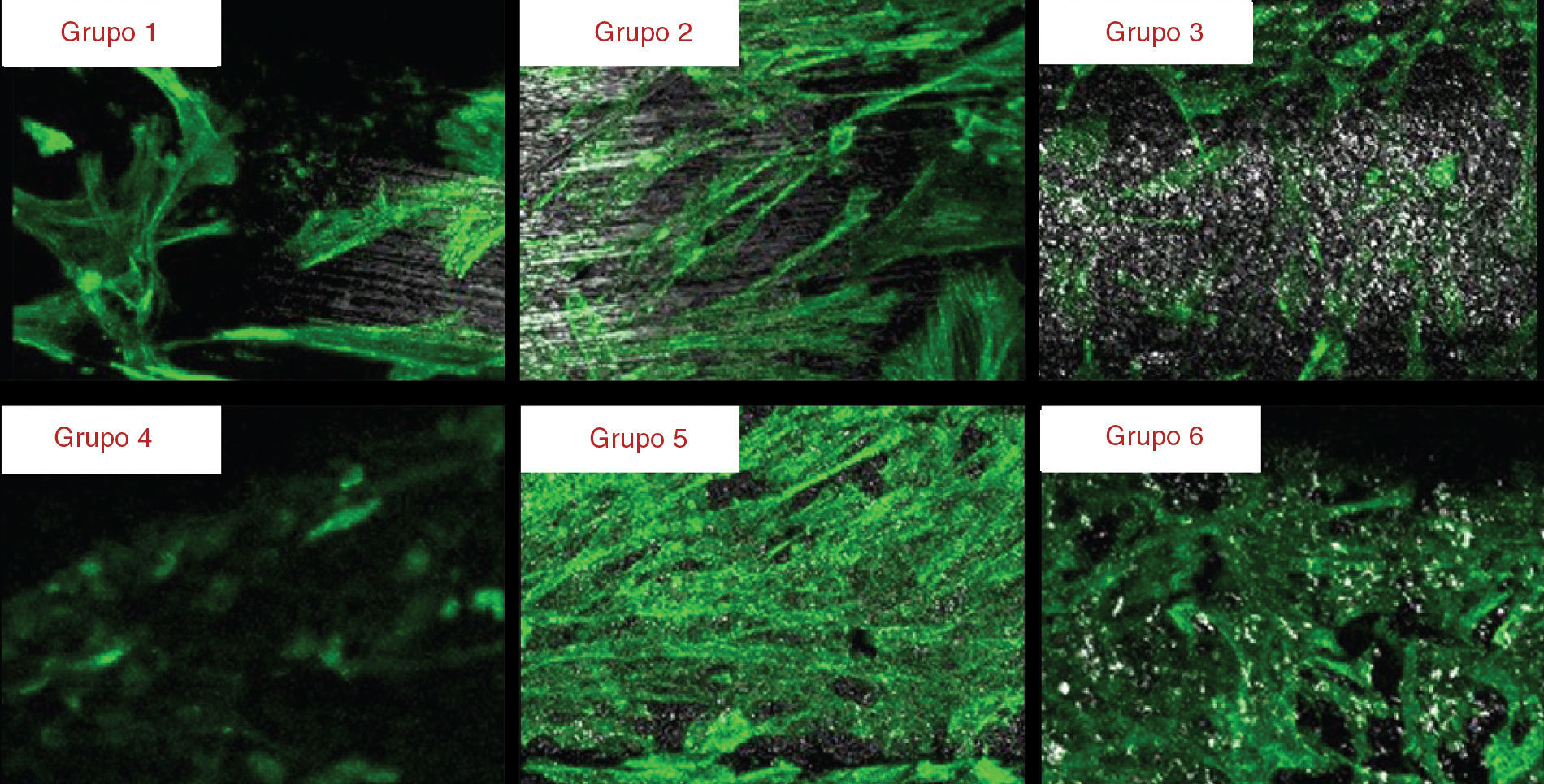
A morfologia celular e a organização do citoesqueleto foram observadas com recurso à microscopia confocal de varrimento laser após coloração imunocitoquímica para o citoesqueleto de F‐actina e núcleo. Aos 7 dias já era evidente o início da diferenciação celular, sendo que aos 21 dias essa organização tornou‐se mais evidente com todos os grupos a mostrarem fenótipos típicos de células diferenciadas (fig. 2). Nesta fase as células apresentam numerosos prolongamentos citoplasmáticos e extenso contacto celular.
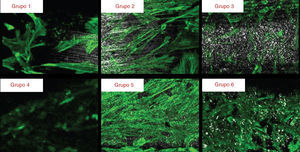
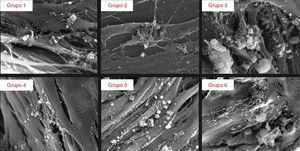
Aos 28 dias de cultura a superfície dos implantes apresentou‐se recoberta por uma camada celular (fig. 3). As imagens obtidas através de MEV mostram diferenças no padrão de crescimento celular. Os implantes dos grupos 1 e 2 apresentam uma camada celular distribuída em forma de paliçada e um padrão de crescimento diferente nas 2 vertentes. Os implantes dos grupos 3 e 5 apresentam uma camada celular com um grau de complexidade mais elevado, com as células a emitirem prolongamentos citoplasmáticos e sendo visíveis numerosas estruturas fibrilares. Os implantes do grupo 4 mostram uma camada de células dispostas em paliçada apresentando a mesma disposição nas 2 vertentes. Os implantes do grupo 6 apresentam uma camada de células dispostas aleatoriamente que se adaptam às irregularidades da superfície, estabelecendo numerosos contactos intercelulares.
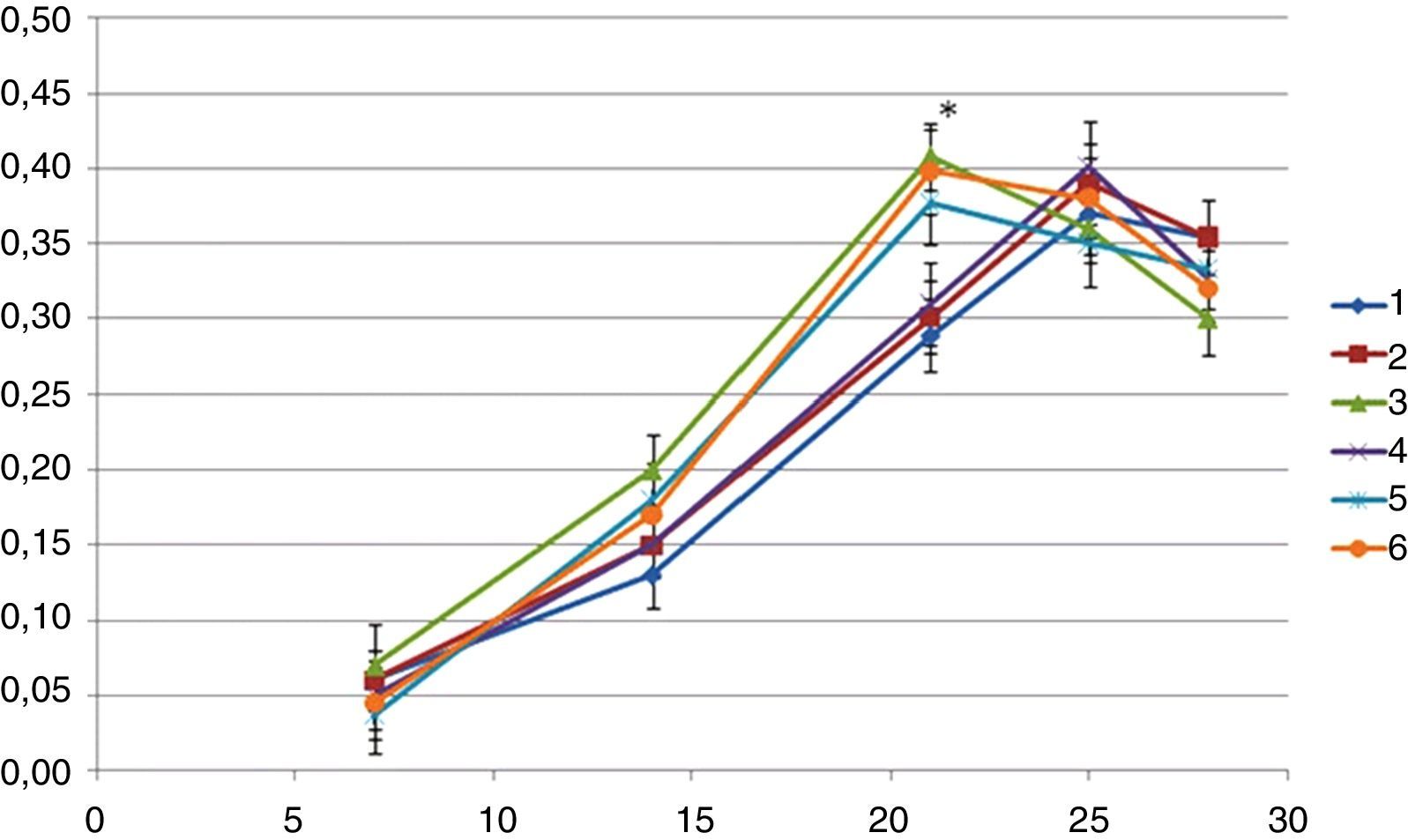
A atividade da fosfátase alcalina foi avaliada ao longo do tempo de cultura e os resultados são apresentados na figura 4.
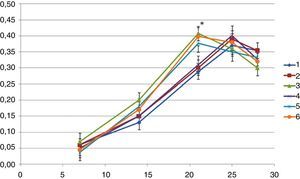
Durante a primeira semana a atividade da fosfátase alcalina revelou‐se pouco expressiva para os 6 grupos observando‐se um aumento significativo da sua atividade a partir da segunda semana. O pico máximo da atividade foi alcançado aos 21 dias para os implantes dos grupos 3, 5 e 6 e 4 dias depois para os implantes dos grupos 1, 2 e 4. As diferenças observadas, para este tempo, entre os implantes dos grupos 3, 5 e 6 e os implantes do grupo controlo 1, foram estatisticamente significativas (MANOVA [p<0,05]). Para cada um dos grupos os valores começaram a diminuir após este pico (fig. 4).
Observaram‐se diferenças com significado estatístico (p<0,05) entre os grupos 4‐5 aos 21 dias de cultura e entre o grupo 6 e os grupos 1 e 2 aos 14 e 21 dias de cultura.
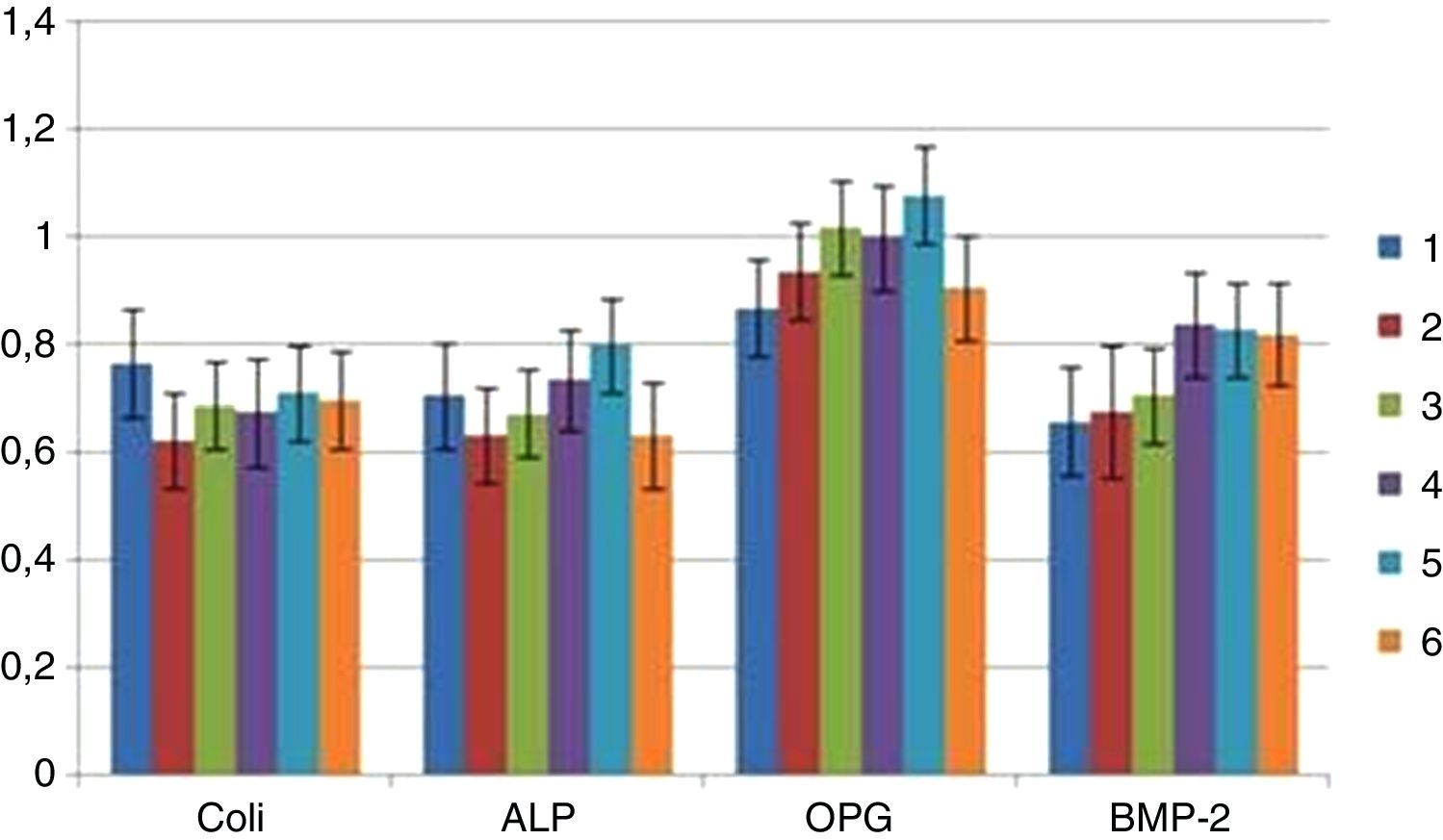
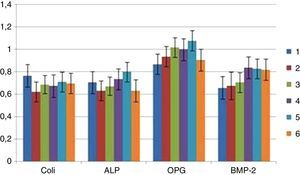
Aos 21 dias não se observaram diferenças significativas na expressão génica dos marcadores osteoblásticos analisados (colagénio tipo I, fosfátase alcalina, osteoprotegerina e BMP‐2) (fig. 5).
A análise dos implantes colonizados aos 28 dias, através de MEV, revelou a presença de uma camada praticamente contínua de células osteoblásticas contendo depósitos minerais de aspeto globular em associação com a matriz extracelular. Os implantes do grupo 3 parecem revelar uma organização celular mais complexa e maior abundância de depósitos minerais. Em contrapartida, os implantes do grupo 4 mostram a presença de uma camada celular praticamente contínua que parece conter menor número de estruturas globulares (fig. 6).
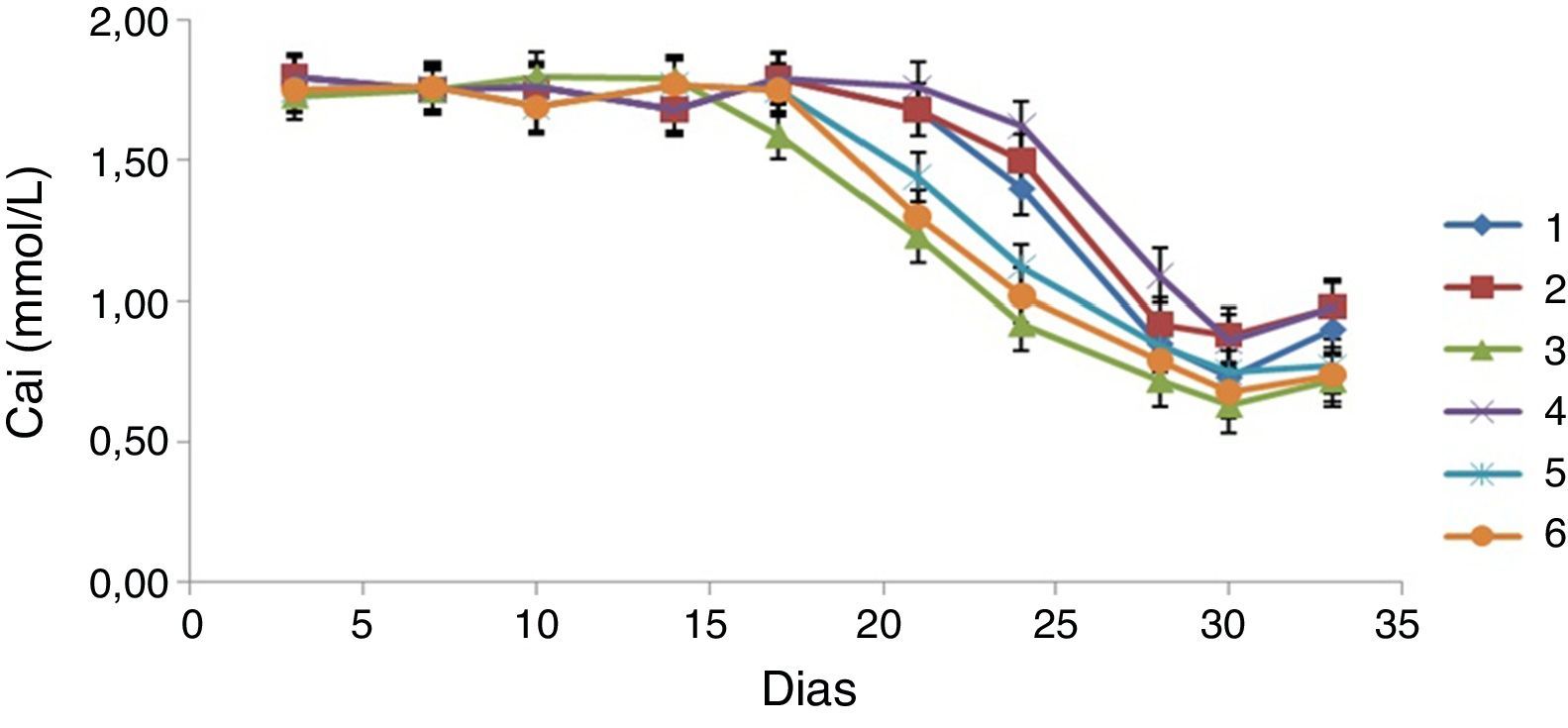
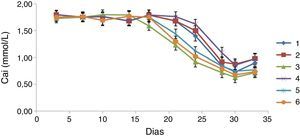
A avaliação quantitativa do processo de mineralização da matriz foi efetuada através da determinação dos níveis de Cai no meio de cultura, ao longo do tempo de cultura (fig. 7). Os valores de Cai apresentaram‐se elevados e constantes até aproximadamente ao dia 14 para os implantes do grupo 3, até ao dia 16 para os implantes dos grupos 5 e 6 e até ao dia 21 para os implantes dos grupos 1, 2 e 4. A partir destes dias os valores de Cai começaram a diminuir até atingirem os valores mínimos que foram alcançados por volta do dia 30 de cultura. Observaram‐se diferenças estatisticamente significativas (p<0,05), para este parâmetro, entre os grupos 1‐3 aos 16, 21 e 25 dias, entre os grupos 4‐5 relativamente ao grupo 1 aos 25 dias, entre o grupo 4 e os grupos 1‐5 aos 29 dias, e entre o grupo 6 e os grupos 1‐2 aos 21 e 24 dias de cultura.
Estes resultados mostram um consumo maior e mais rápido de Cai para os implantes do grupo 5 comparativamente com o observado para os implantes dos grupos 1 e 4.
DiscussãoOs implantes dentários endo‐ósseos têm sido utilizados, com notório sucesso, há mais de 25 anos, com uma grande variedade de materiais e desenhos17,18. A investigação atual centra‐se, maioritariamente, na otimização das superfícies implantares com vista a potenciar e acelerar a resposta osteoblástica19–22 e, deste modo, encurtar o tempo de osteointegração. Um dos maiores e mais recentes avanços foi o condicionamento das superfícies, segundo diferentes técnicas, modificando a sua microestrutura11,13,21–23. Sabe‐se que a criação de microrugosidades, bem como a incorporação de substâncias bioativas, como por exemplo o fosfato de cálcio, iões cálcio e magnésio ou proteínas ósseas morfogénicas, pode acelerar e intensificar a formação óssea ao redor dos implantes14,16,24–28.
Há vários trabalhos, in vitro e in vivo, que atestam um crescimento mais favorável de células osteoblásticas e a correspondente formação de osso, quando em contacto com superfícies que apresentam rugosidade moderada comparativamente com superfícies lisas ou extremamente rugosas25,29–39.
Neste estudo todos os implantes proporcionaram uma adesão celular semelhante observando‐se crescimento celular em todas as superfícies analisadas. Em relação a esta etapa da experimentação in vitro não é evidente a influência que as diferentes microtopografias, rugosidades e composição química possam desenvolver, contrariamente ao que sucede in vivo, em que essa influência parece ser certa40,41. Aos 21 dias de estudo já foi evidente, mediante técnicas de coloração específicas, a organização do citoesqueleto, começando‐se a perceber a influência do tipo de superfície, nomeadamente da rugosidade, sobre o fenótipo celular.
Com este trabalho foi possível verificar que as diferentes superfícies implantares proporcionam condições favoráveis para o crescimento celular, embora com grau e complexidade distintos. Os implantes do grupo 3 apresentaram o padrão de crescimento mais complexo e os implantes do grupo 4 um padrão de crescimento semelhante ao dos implantes maquinados, isto apesar de se tratar de um implante com tratamento de superfície tal como os dos grupos 3 e 5. Nestes 2 últimos grupos foi visível uma grande densidade de contactos focais com a superfície e com outras células mostrando uma melhor organização do citoesqueleto com fibras de actina mais evidentes. Outra observação importante foi a de que implantes com a mesma macroestrutura, mas com tratamentos de superfície distintos (grupos 1 e 3 e grupos 2 e 6), apresentaram diferenças entre si, o que está de acordo com o relatado por Schneider et al.42, que verificaram diferença na orientação dos osteoblastos sobre superfícies maquinadas e jateadas refletindo, provavelmente, que a expressão fenotípica destas células é dependente da microtopografia de superfície.
Relativamente à expressão de genes reguladores da osteogénese não foram observadas diferenças significativas, nem evidência de maior expressão para superfícies tratadas relativamente às superfícies maquinadas, ao 21.° dia de cultura, fase em que as células já se encontravam bastante diferenciadas em todas as superfícies. Estes resultados estão de acordo com o obtido por outros autores que verificaram haver um aumento na expressão de diferentes genes associados à osteogénese, não tendo, igualmente, encontrado diferenças significativas entre superfícies maquinadas e superfícies tratadas43,44. A explicação pode ficar a dever‐se, por um lado, ao facto de todas as superfícies terem demonstrado proporcionar, desde que mantidas boas condições, a osteointegração e, por outro, porque os níveis de mRNA foram medidos aos 21 dias, fase em que as células já se apresentavam suficientemente diferenciadas.
O facto de não se terem observado diferenças indicia que todas as superfícies são suscetíveis de induzir a formação óssea e a consequente osteointegração, in vivo.
As diferenças mais evidentes, entre as superfícies analisadas, verificaram‐se ao nível da quantificação da atividade da fosfátase alcalina e da quantidade de Cai consumido a partir do meio, 2 importantes indicadores da osteogénese. As diferenças observadas na quantificação da atividade da fosfátase alcalina são sugestivas da influência da microtopografia da superfície no processo de osteointegração. As superfícies maquinadas mostraram tendência para iniciarem a mineralização da matriz um pouco mais tarde do que as superfícies tratadas, com exceção dos implantes do grupo 4, que revelaram um comportamento muito semelhante ao observado para os implantes maquinados. O pico da atividade da fosfátase alcalina foi atingido mais cedo para os implantes do grupo 5 comparativamente com os implantes do grupo 4 que têm o mesmo tratamento de superfície, embora preparados segundo protocolos diferentes, o que parece confirmar tratar‐se de uma evolução relativamente aos implantes do grupo 4. A influência da microtopografia parece ser igualmente confirmada pelo facto de os implantes pertencentes aos grupos 1 e 3 apresentarem diferenças evidentes nos tempos associados ao processo de mineralização, com aparente vantagem para o grupo 3. Também os implantes do grupo 6 demonstraram melhor desempenho comparativamente aos do grupo 2.
A observação do consumo do Cai permite reforçar algumas das tendências observadas pela análise da atividade da fosfátase alcalina. O consumo do Cai começou ligeiramente antes para os implantes do grupo 3 e um pouco mais tarde para os implantes do grupo 4. Observaram‐se diferenças evidentes, com um aparente melhor comportamento biológico dos implantes pertencentes ao grupo 5, em relação aos implantes do grupo 4, o que parece confirmar tratar‐se de uma evolução da superfície. Em relação a este parâmetro foi também evidente o melhor desempenho dos implantes do grupo 3 comparativamente aos do grupo 1.
Este estudo apresenta, à semelhança dos outros estudos in vitro, a limitação de os resultados obtidos não serem totalmente extrapoláveis para o que acontece in vivo na prática clínica e por esta razão devem ser interpretados com algum cuidado.
ConclusõesNeste trabalho confirmou‐se que as superfícies com rugosidade média correspondentes a implantes jateados e submetidos a ataque ácido (grupos 3, 4 e 5) foram aqueles que apresentaram os melhores comportamentos biológicos, in vitro, para o conjunto dos parâmetros analisados. Outra conclusão que advém deste trabalho é a de que agrupar implantes sob o mesmo tipo de tratamento, sem caracterizar convenientemente as superfícies, sob o ponto de vista topográfico e de composição química, pode ser redutor já que se podem observar diferenças evidentes e significativas na resposta biológica desencadeada.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.