Os tumores neuroendócrinos pancreáticos (TNEPs) apresentam um espetro diversificado quanto à apresentação clínica, comportamento biológico, histopatologia e prognóstico. Distinguem-se os tumores funcionantes dos não funcionantes dependendo da capacidade de secreção hormonal. O objetivo deste trabalho foi analisar retrospetivamente os TNEPs acompanhados no Instituto Português de Oncologia de Lisboa, Francisco Gentil (IPOLFG) entre 2000-2011.
MétodosRevisão de processos clínicos dos TNEPs com diagnóstico anatomo-patológico. A seleção foi feita a partir de bases de dados do Registo Oncológico Regional do Sul e dos Serviços de Anatomia Patológica e Endocrinologia do IPOLFG.
ResultadosIdentificaram-se 44 TNEPs, 68,2% não funcionantes e 31,8% funcionantes (11 insulinomas e 3 gastrinomas). A maioria dos doentes era do sexo masculino (52,3%). A idade média na altura do diagnóstico foi de 55 anos (intervalo 31-83). A maioria dos TNEPs apresentou-se sintomática (79,5%), unifocal (70,5%) e bem diferenciada (63,6%). Doença locorregional e metastização estavam presentes em 61,4 e 56,8% respetivamente. Os exames de diagnóstico mais sensíveis foram a ressonância magnética (RM) e a ecoendoscopia. A principal terapêutica foi a cirúrgica. O tempo médio de seguimento foi de 32 meses (±35; intervalo: 1 a 130 meses). A sobrevida média foi de 85 meses (±11).
Comparando os TNEPs não funcionantes e funcionantes, os primeiros apresentaram-se menos sintomáticos (73,3 vs 92,9%), e mais vezes com doença locorregional (73,3 vs 35,7%), metastização (70,0 vs 28,6%), índices proliferativos mais elevados e maior diâmetro tumoral (5,4 vs 2,9cm). A sobrevida média foi mais elevada nos funcionantes (106 vs 72 meses). Dos fatores com impacto positivo no prognóstico destacam-se: funcionalidade, boa diferenciação histológica, ausência de angioinvasão, ausência de doença locorregional e metastização, índices proliferativos baixos.
ConclusãoComo já observado noutras séries, a maioria dos TNEPs revelou-se não funcionante sendo o seu prognóstico pior do que os tumores funcionantes.
Pancreatic neuroendocrine tumors (PNETs) have a broad spectrum of clinical behavior, histopathological characteristics and prognosis. Hormonal production distinguishes functional from nonfunctional tumours. The aim was to review the cases of PNETs diagnosed and/or followed, between 2000 and 2011, at Instituto Português de Oncologia de Lisboa, Francisco Gentil (IPOLFG).
MethodsData of clinical files of PNETs of the IPOLFG was analysed. Patients were identified through South Regional Cancer Registry and databases of IPOLFG's Pathology and Endocrinology Departments.
Results44 PNETs were identified, 68.2% nonfunctioning and 31.8% functioning (11 insulinomas and 3 gastrinomas). 52.3% of the cases were male. The median age at diagnosis was 55 years (range 31-83). The majority of all PNETs was symptomatic (79.5%), unifocal (70.5%) and well-differentiated (63.6%). Loco-regional disease and metastases were present in 61.4% and 56.8% of the cases, respectively. Magnetic resonance and endoscopic ultrasonography were the most sensitive exams. Surgery was the main treatment offered. Median follow-up time was 32 months (±35; range 1 to 130 months) and median survival was 85 months (±11).
Comparison between nonfunctioning and functioning PNETs, revealed that patients in the former group were less symptomatic (73.3 vs 92.9%), presented more often loco-regional disease (73.3 vs 35.7%), metastases (70.0 vs 28.6%), higher proliferative indexes and tumoural diameter (5.4 vs 2.9cm). Median survival was higher in functioning tumors (106 vs 72 months). Factors associated with a more favorable prognosis were: hormonal secretion; histological differentiation; absence of angioinvasion; absence of locorregional disease or metastization; low proliferative indexes.
ConclusionAs observed in other series, the majority of PNETs were nonfunctional and the prognosis of these cases was worse than the prognosis of functional tumours.
Os tumores neuroendócrinos (TNEs) constituem um grupo heterogéneo de neoplasias, com origem nas células do sistema neuroendócrino. Podem afetar os mais diversos sistemas, sendo que a maioria se localiza a nível gastroenteropancreático e pulmonar1.
Os tumores neuroendócrinos pancreáticos (TNEPs) são entidades raras, com uma incidência anual estimada de <1/100.000 em estudos populacionais e compreendem menos de 2% dos tumores pancreáticos2,3. São frequentemente divididos em funcionantes e não funcionantes, na dependência da secreção hormonal e da sintomatologia daí decorrente. As manifestações clínicas nos não funcionantes estão sobretudo associadas a «efeitos de massa» e/ou sintomas constitucionais, como astenia, anorexia e emagrecimento. A maioria dos TNEPs são não funcionantes4.
A diversidade das manifestações clínicas e variabilidade da história natural destes tumores, a par do facto de serem raros, colocam problemas de diagnóstico e tratamento. Diferentes sociedades científicas têm procurado definir normas de orientação das quais se destacam as propostas pela European Neuroendocrine Tumor Society (ENETS)5. A própria classificação não é consensual. A Organização Mundial de Saúde (OMS) propõe um sistema que classifica os TNEPs de acordo com a histologia e índices proliferativos6.
O interesse e a investigação têm sido crescentes nesta área, o que tem contribuído para a sua melhor compreensão2,3,5,6,8. No entanto, Halfdanarson diz ser limitado o conhecimento destas patologias, sobretudo a nível epidemiológico e de fatores de risco4, sendo necessários mais estudos para incrementar o conhecimento nestas patologias.
Com o intuito de contribuir para a definição da realidade nacional, procedeu-se à análise retrospetiva de TNEPs acompanhados no IPOLFG entre 2000- 2011, com os seguintes objetivos: 1) caracterização demográfica, clínica, anatomopatológica e funcional dos TNEPs; 2) análise comparativa dos TNEPs funcionantes e não funcionantes; 3) análise de fatores de prognóstico nos TNEPs.
MétodosForam revistos todos os registos clínicos dos casos de TNEPs acompanhados no IPOLFG com diagnóstico anatomopatológico estabelecido entre 2000-2011.
A amostra foi selecionada a partir das bases de dados do Registo Oncológico Regional Sul (ROR Sul) e dos Serviços de Anatomia-Patológica e Endocrinologia do IPOLFG, tendo-se identificado 44 casos. Foram consideradas as seguintes variáveis: sexo, idade na altura do diagnóstico, manifestações clínicas, tempo entre o início da sintomatologia e o diagnóstico, modo de diagnóstico, funcionalidade, história familiar, características anatomopatológicas, índices proliferativos, disseminação locorregional ou à distância, tratamento e estado atual do doente. O estadiamento de cada caso foi definido de acordo com o sistema TNM proposto pela ENETS6.
Os dados foram colhidos, inseridos em base de dados e tratados estatisticamente no programa aplicativo IBM SPSS 19.0.®. Foram aplicados testes estatísticos ajustados ao tipo de variáveis em análise. Curvas de Kaplan-Meier foram obtidas para estimar sobrevidas e analisar fatores prognósticos. Valores de p<0,05 foram considerados estatisticamente significativos.
ResultadosIdentificaram-se 44 casos de TNEPs, 23 do sexo masculino (52,3%) e 21 do feminino (47,7%). A média de idades na altura do diagnóstico foi de 55±11 anos (idades mínima de 31 e máxima de 83 anos). A maioria da amostra era composta por TNEPs não funcionantes com 30 casos, existindo 14 funcionantes. Dos funcionantes, 11 eram insulinomas e 3 gastrinomas. Na amostra foram identificadas apenas 3 formas familiares de TNEPs: 2 gastrinomas e um não funcionante em contexto de síndrome de Neoplasias Endócrinas Múltiplas tipo 1 (MEN-1).
Os TNEPs não funcionantes afetaram maioritariamente o sexo masculino (56,7%), enquanto os funcionantes foram mais prevalentes no sexo feminino (57,1%); as diferenças encontradas não têm significado estatístico (p=0,763). A diferença da média de idades entre não funcionantes e funcionantes (56 vs 53 anos) também não tem significado estatístico (p=0,372).
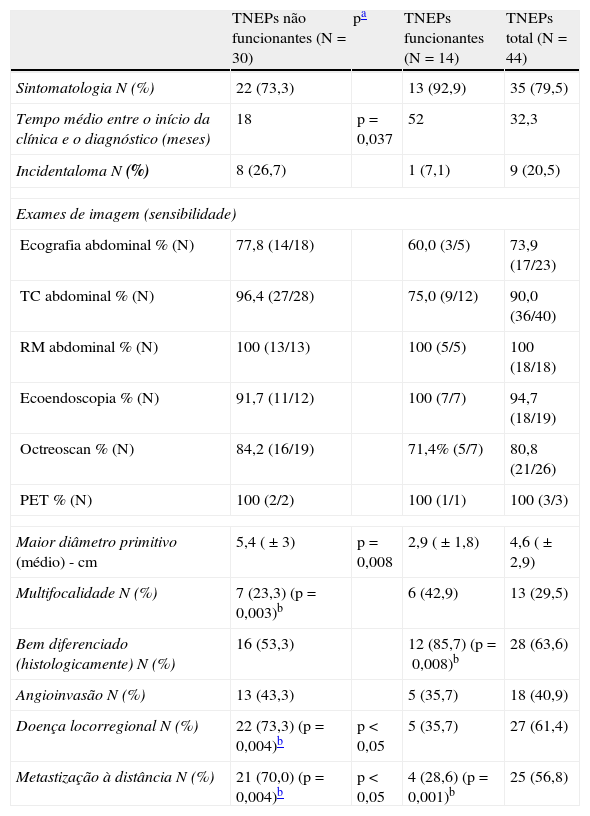
Quanto à apresentação clínica dos TNEPs (tabela 1) verificou-se que 79,5% apresentaram sintomas e o diagnóstico decorreu de uma investigação dirigida, enquanto os restantes corresponderam a incidentalomas. Comparando funcionantes e não funcionantes, verificou-se uma proporção maior de casos sintomáticos nos primeiros. O tempo médio entre o início dos sintomas e o diagnóstico foi superior nos funcionantes (52 vs 18 meses; p=0,037). Os sintomas mais frequentes nos TNEPs não funcionantes foram dor abdominal (50%), emagrecimento (50%), anorexia (41%) e vómitos (36%), enquanto nos funcionantes destacam-se sintomas relacionados com excesso hormonal, e como a maioria eram insulinomas, verificaram-se com maior preponderância sintomas associados a hipoglicemias (lipotímia - 54%; confusão mental - 54%; tonturas - 31%).
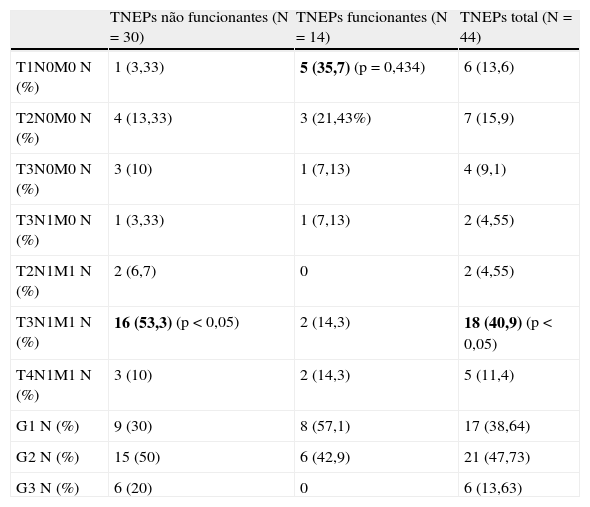
Características clínicas, sensibilidade dos exames de imagem e parâmetros histopatológicos dos TNEPs
| TNEPs não funcionantes (N=30) | pa | TNEPs funcionantes (N=14) | TNEPs total (N=44) | |
| Sintomatologia N (%) | 22 (73,3) | 13 (92,9) | 35 (79,5) | |
| Tempo médio entre o início da clínica e o diagnóstico (meses) | 18 | p=0,037 | 52 | 32,3 |
| Incidentaloma N (%) | 8 (26,7) | 1 (7,1) | 9 (20,5) | |
| Exames de imagem (sensibilidade) | ||||
| Ecografia abdominal % (N) | 77,8 (14/18) | 60,0 (3/5) | 73,9 (17/23) | |
| TC abdominal % (N) | 96,4 (27/28) | 75,0 (9/12) | 90,0 (36/40) | |
| RM abdominal % (N) | 100 (13/13) | 100 (5/5) | 100 (18/18) | |
| Ecoendoscopia % (N) | 91,7 (11/12) | 100 (7/7) | 94,7 (18/19) | |
| Octreoscan % (N) | 84,2 (16/19) | 71,4% (5/7) | 80,8 (21/26) | |
| PET % (N) | 100 (2/2) | 100 (1/1) | 100 (3/3) | |
| Maior diâmetro primitivo (médio) - cm | 5,4 (±3) | p=0,008 | 2,9 (±1,8) | 4,6 (±2,9) |
| Multifocalidade N (%) | 7 (23,3) (p=0,003)b | 6 (42,9) | 13 (29,5) | |
| Bem diferenciado (histologicamente) N (%) | 16 (53,3) | 12 (85,7) (p=0,008)b | 28 (63,6) | |
| Angioinvasão N (%) | 13 (43,3) | 5 (35,7) | 18 (40,9) | |
| Doença locorregional N (%) | 22 (73,3) (p=0,004)b | p<0,05 | 5 (35,7) | 27 (61,4) |
| Metastização à distância N (%) | 21 (70,0) (p=0,004)b | p<0,05 | 4 (28,6) (p=0,001)b | 25 (56,8) |
Dos exames imagiológicos realizados, a sensibilidade diagnóstica foi mais elevada para a ressonância magnética e ecoendoscopia (tabela 1).
Quanto às características histopatológicas (tabela 1), a maioria era unifocal, bem diferenciada, sem angioinvasão, com doença locorregional e metastização; o diâmetro tumoral médio foi de 4,6cm. Quando se comparam parâmetros segundo a funcionalidade surgem diferenças importantes: os não funcionantes eram significativamente maiores (p=0,008), com menos casos de multifocalidade e de histologia bem diferenciada; por outro lado, apresentaram mais vezes angioinvasão, doença locorregional e metastização (tabela 1). Nos casos metastizados, o fígado foi o órgão predominantemente afetado (80%), seguindo-se o osso (20%).
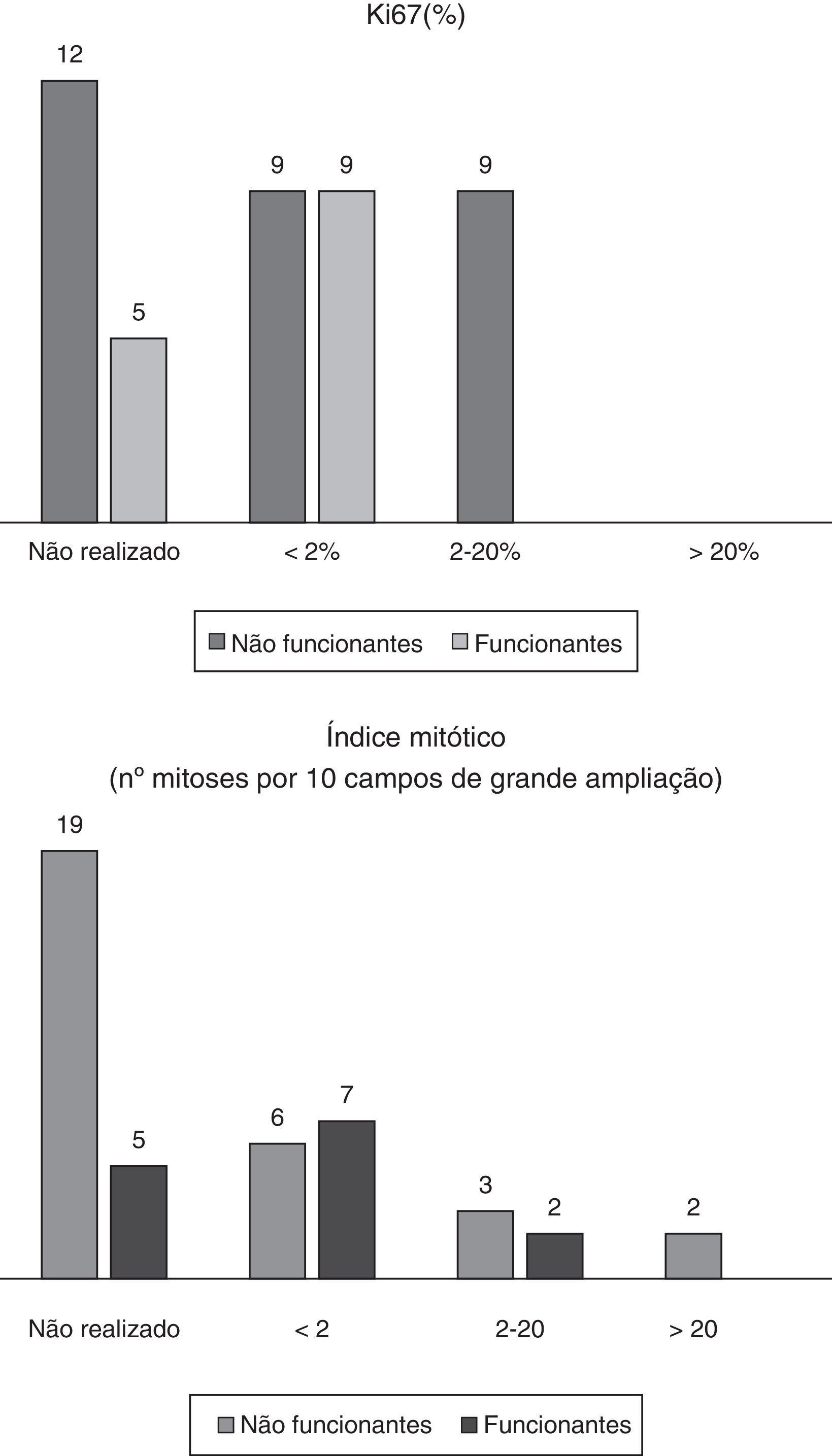
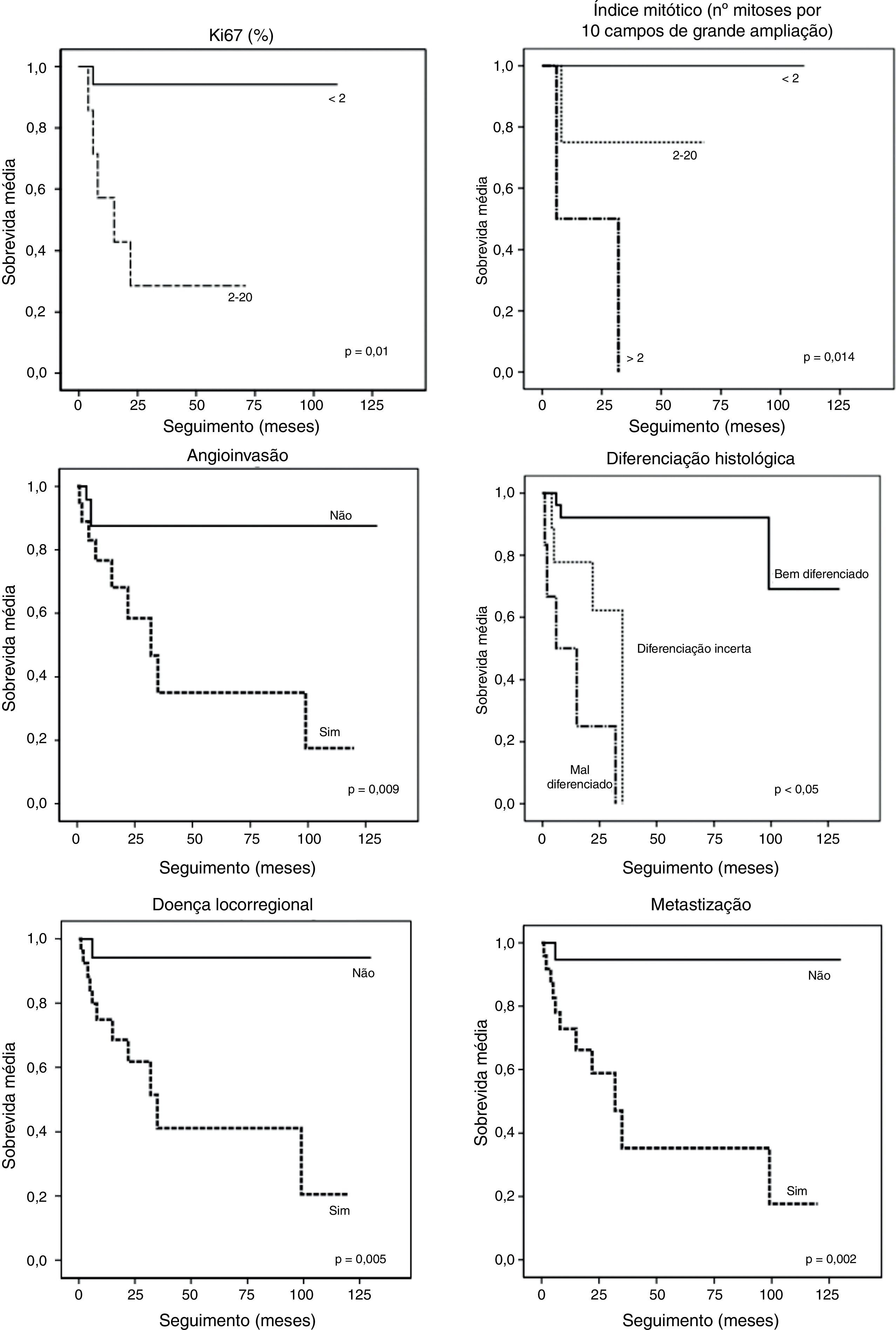
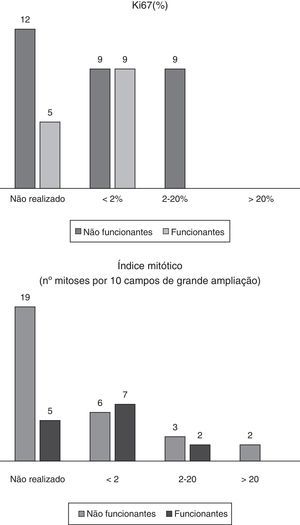
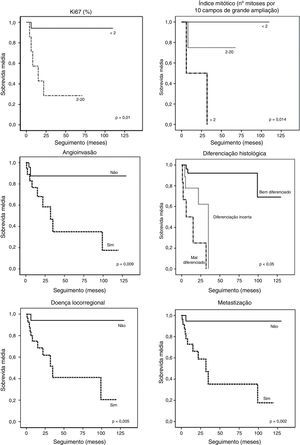
Na figura 1 apresentam-se dados relativos aos índices proliferativos. Nos casos em que o Ki67 e índice mitótico foram pesquisados, verificam-se valores mais elevados nos não funcionantes. Na figura 2 correlacionam-se os valores dos índices com a sobrevida, com representação de curvas de sobrevida sendo o impacto prognóstico percetível (quanto maior for o valor do índice em questão, pior é o prognóstico).
Na tabela 2 os TNEPs estão organizados de acordo com o sistema de estadiamento TNM7. Da sua análise, verifica-se que a maioria dos não funcionantes era T3N1M1, enquanto os funcionantes se distribuíram em níveis menos avançados de estadiamento. O grau de estádio mais frequente nos não funcionantes foi o IV (TxNxM1) e nos funcionantes o I (T1N0M0). Nesta tabela, os TNEPs apresentam-se ainda distribuídos segundo a classificação da OMS6.
Distribuição dos TNEPs de acordo com os Sistemas TNM e da OMS
| TNEPs não funcionantes (N=30) | TNEPs funcionantes (N=14) | TNEPs total (N=44) | |
| T1N0M0 N (%) | 1 (3,33) | 5 (35,7) (p=0,434) | 6 (13,6) |
| T2N0M0 N (%) | 4 (13,33) | 3 (21,43%) | 7 (15,9) |
| T3N0M0 N (%) | 3 (10) | 1 (7,13) | 4 (9,1) |
| T3N1M0 N (%) | 1 (3,33) | 1 (7,13) | 2 (4,55) |
| T2N1M1 N (%) | 2 (6,7) | 0 | 2 (4,55) |
| T3N1M1 N (%) | 16 (53,3) (p<0,05) | 2 (14,3) | 18 (40,9) (p<0,05) |
| T4N1M1 N (%) | 3 (10) | 2 (14,3) | 5 (11,4) |
| G1 N (%) | 9 (30) | 8 (57,1) | 17 (38,64) |
| G2 N (%) | 15 (50) | 6 (42,9) | 21 (47,73) |
| G3 N (%) | 6 (20) | 0 | 6 (13,63) |
O significado do negrito-permite realçar os estágios TNM mais frequentes por grupo.
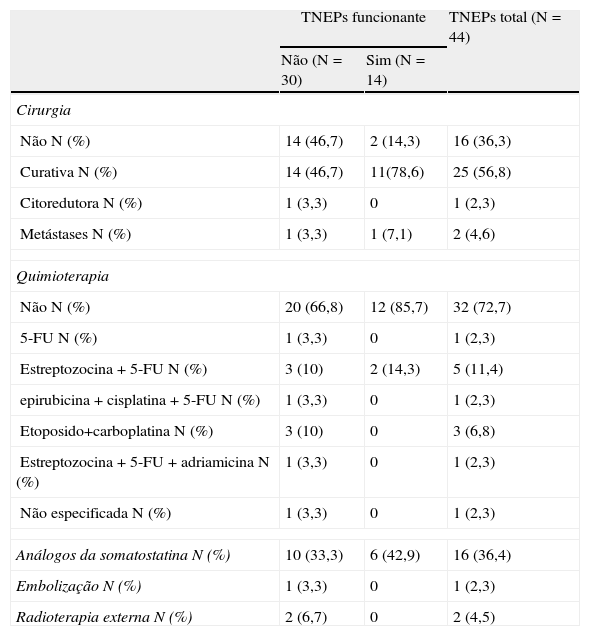
Relativamente ao tratamento (tabela 3), salienta-se que a maioria dos TNEPs (63,7%) foi submetida a cirurgia. Quimioterapia foi usada em 12 casos (10 não funcionantes), sendo o esquema mais usado a estreptozocina com 5-FU. Outras terapêuticas foram usadas em menor número (tabela 3).
Terapêuticas realizadas nos TNEPs
| TNEPs funcionante | TNEPs total (N=44) | ||
| Não (N=30) | Sim (N=14) | ||
| Cirurgia | |||
| Não N (%) | 14 (46,7) | 2 (14,3) | 16 (36,3) |
| Curativa N (%) | 14 (46,7) | 11(78,6) | 25 (56,8) |
| Citoredutora N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Metástases N (%) | 1 (3,3) | 1 (7,1) | 2 (4,6) |
| Quimioterapia | |||
| Não N (%) | 20 (66,8) | 12 (85,7) | 32 (72,7) |
| 5-FU N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Estreptozocina + 5-FU N (%) | 3 (10) | 2 (14,3) | 5 (11,4) |
| epirubicina + cisplatina + 5-FU N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Etoposido+carboplatina N (%) | 3 (10) | 0 | 3 (6,8) |
| Estreptozocina + 5-FU + adriamicina N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Não especificada N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Análogos da somatostatina N (%) | 10 (33,3) | 6 (42,9) | 16 (36,4) |
| Embolização N (%) | 1 (3,3) | 0 | 1 (2,3) |
| Radioterapia externa N (%) | 2 (6,7) | 0 | 2 (4,5) |
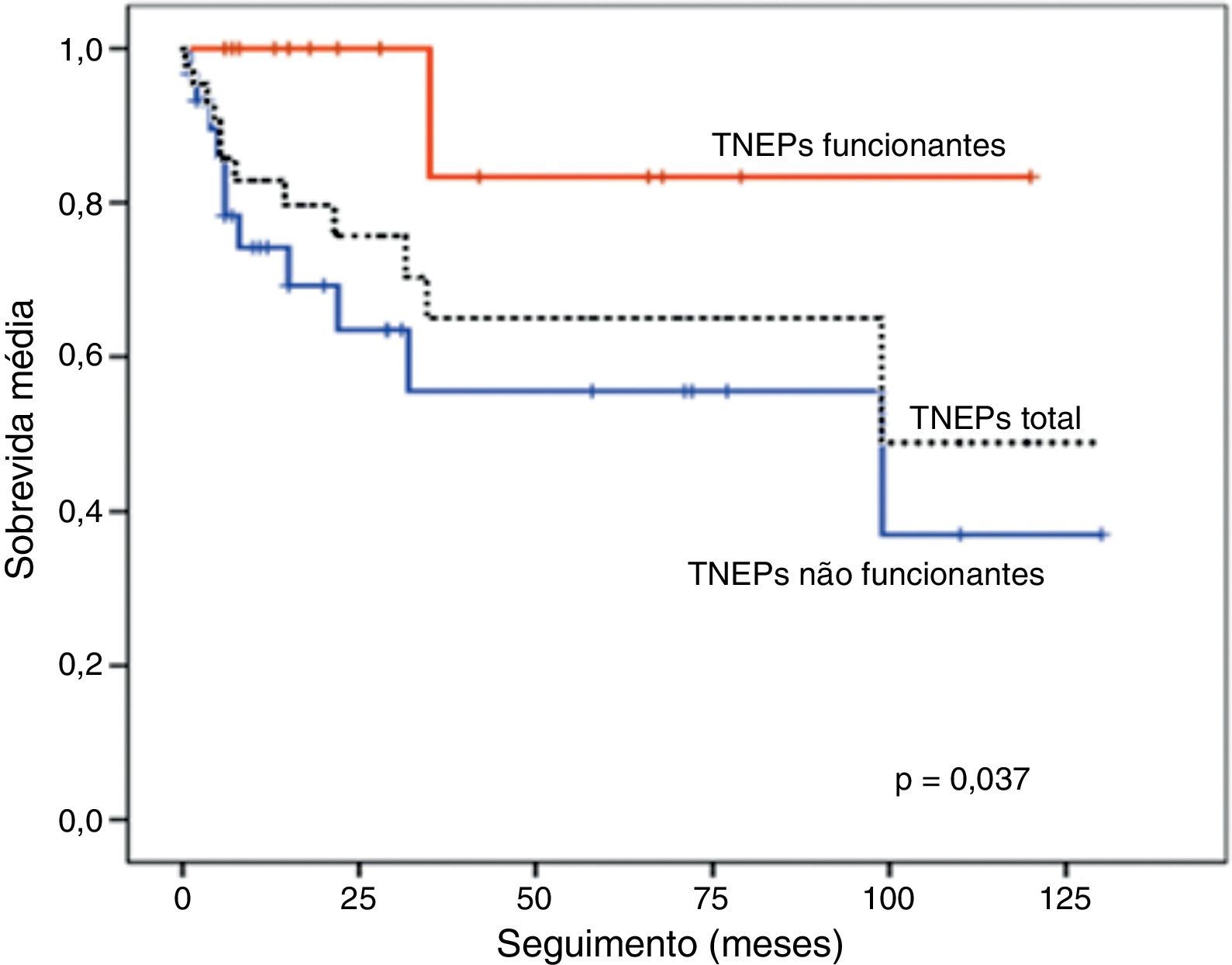
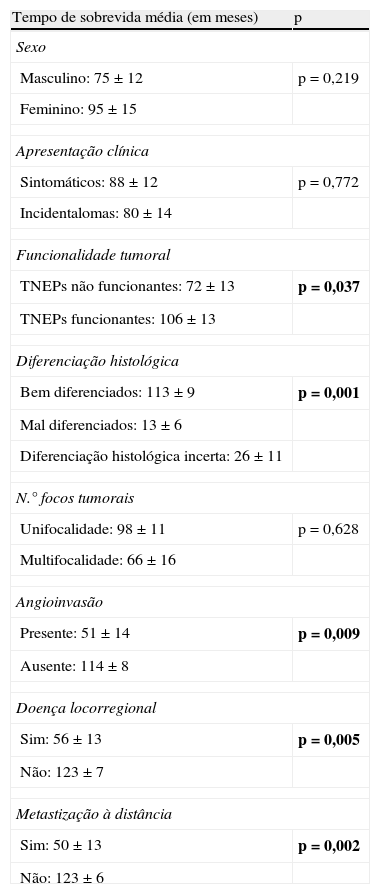
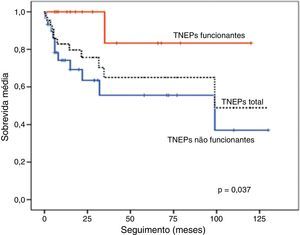
Quando se analisou o estado atual dos doentes, contabilizaram-se 12 doentes falecidos por doença oncológica (27,3%), 8 encontravam-se vivos com doença (18,2%) e 9 vivos sem doença (20,5%). Em 13 casos houve perda de seguimento (alta da consulta ou por motivo desconhecido) e 2 doentes faleceram de causa não oncológica. O tempo médio de seguimento foi estimado em 32 meses (± 35), variando entre 1 e 130 meses. A sobrevida média do grupo de TNEPs foi estimada em 85 meses (± 11), sendo superior nos funcionantes (tabela 4).
Tempo de sobrevida média dos TNEPs de acordo com diferentes parâmetros
| Tempo de sobrevida média (em meses) | p |
| Sexo | |
| Masculino: 75±12 | p=0,219 |
| Feminino: 95±15 | |
| Apresentação clínica | |
| Sintomáticos: 88±12 | p=0,772 |
| Incidentalomas: 80±14 | |
| Funcionalidade tumoral | |
| TNEPs não funcionantes: 72±13 | p=0,037 |
| TNEPs funcionantes: 106±13 | |
| Diferenciação histológica | |
| Bem diferenciados: 113±9 | p=0,001 |
| Mal diferenciados: 13±6 | |
| Diferenciação histológica incerta: 26±11 | |
| N.° focos tumorais | |
| Unifocalidade: 98±11 | p=0,628 |
| Multifocalidade: 66±16 | |
| Angioinvasão | |
| Presente: 51±14 | p=0,009 |
| Ausente: 114±8 | |
| Doença locorregional | |
| Sim: 56±13 | p=0,005 |
| Não: 123±7 | |
| Metastização à distância | |
| Sim: 50±13 | p=0,002 |
| Não: 123±6 | |
O significado do negrito - para destacar os p estatisticamente significativos (p<0,05).
Por fim, correlacionaram-se alguns fatores com a sobrevida dos doentes. Estes dados estão nas figuras 2 e 3, sob a forma de curvas de sobrevida para cada fator. Na tabela 4 apresentam-se os valores de sobrevida média para cada fator, bem como o seu significado estatístico. Destaca-se a importância prognóstica dos índices proliferativos, funcionalidade, diferenciação histológica, angioinvasão, presença de doença locorregional e metastização.
DiscussãoEste estudo evidencia algumas particularidades já conhecidas dos TNEPs. São tumores heterogéneos, de apresentação habitualmente inespecífica, sendo o diagnóstico tardio e difícil, com o tempo médio entre o início das manifestações clínicas e o diagnóstico estimado em 32 meses neste trabalho.
O tempo entre o início da sintomatologia e o diagnóstico dos TNEPs funcionantes foi superior ao dos não funcionantes. Uma explicação possível, é o facto dos sintomas associados à produção hormonal poderem ser inespecíficos, frustres ou indolentes, e portanto não imediatamente valorizados. Por outro lado, houve um caso de gastrinoma em contexto MEN-1 que demorou cerca de 20 anos até ser diagnosticado (doente com queixas dispépticas com resposta à terapêutica com inibidor da bomba de protões durante 20 anos, em que o diagnóstico de MEN-1 só se colocou na sequência do diagnóstico de hiperparatiroidismo primário). Este caso poderá justificar o elevado tempo médio de diagnóstico nos tumores funcionantes. Por sua vez, os não funcionantes são diagnosticados mais precocemente pelas maiores dimensões e extensão da doença locorregional, que condicionam queixas expressivas e facilitam a sua deteção pelos métodos de imagem e por vezes mesmo através do exame objetivo.
Dos 9 incidentalomas, 5 foram detetados no seguimento de patologias oncológicas: 2 carcinomas retais, um prostático, um renal e um vesical. Um dos casos neste subgrupo revelar-se-ia um insulinoma, não obstante não terem sido valorizadas antes queixas já sugestivas de hipoglicemia. A associação dos TNEPs com as neoplasias supramencionadas parece fortuita. Não só não foram descritas na literatura como não se enquadram nas associações clássicas correspondentes ao MEN-1, síndrome de Von Hippel Lindau, Neurofibromatose tipo 1 ou esclerose tuberosa.
A percentagem de incidentalomas neste estudo (20,5%), de uma forma geral, é inferior a números internacionais10,11. Admitem-se 2 explicações para este achado: por um lado tratar-se de uma casuística de um centro oncológico, e por outro, a subjetividade inerente ao conceito de incidentaloma (dependente da valorização das queixas).
Os exames que demonstraram maior sensibilidade diagnóstica foram a RM abdominal e a ecoendoscopia. A PET-FDG teve uma sensibilidade de 100%, mas importa referir que foi utilizada em apenas 3 casos, todos eles pouco diferenciados, não se podendo concluir que a sua sensibilidade seja sobreponível para as formas diferenciadas. A TC abdominal apresentou uma boa sensibilidade diagnóstica (90%), enquanto o octreoscan e a ecografia abdominal foram inferiores. Em termos de custo-benefício e acessibilidade dos exames, a TC abdominal apresenta-se como um excelente exame para investigar casos suspeitos de TNEPs, sobretudo não funcionantes. Já se a suspeita for de insulinoma, recomenda-se a ecoendoscopia que nesta série identificou 100% dos casos. De uma forma geral os dados da literatura revelam sensibilidades inferiores destes exames (na ordem dos 73-79% para a TC e RM)12,13.
A maioria dos TNEPs foram não funcionantes, surgiram no sexo masculino e em adultos na 5a década de vida. Quanto às características histopatológicas, a maioria revelou-se bem diferenciada, unifocal, com uma proporção significativa de casos com angioinvasão, doença locorregional e metastização. Estes dados são concordantes com estudos internacionais, apesar dos números serem bastante variáveis3,4,14–19.
À luz da literatura atual, os índices proliferativos são úteis à caracterização, estadiamento e prognóstico dos TNEs, constituindo a base indispensável para a definição da estratégia terapêutica6. Por isso, são parâmetros que devem constar nos relatórios de anatomia patológica dos TNEs20. Nesta amostra foi evidente a correlação entre a agressividade dos TNEPs e os índices proliferativos, de acordo com dados já publicados3,4,21. De referir que existe um número significativo de casos cujos índices não foram pesquisados, especialmente nos mais antigos. Recentemente, sobretudo a partir de 2008, praticamente todos os relatórios incluíram estes parâmetros.
Quanto aos tratamentos oferecidos, contabilizou-se o cirúrgico com intenção curativa como o mais frequente. Em cerca de 36% dos casos não houve qualquer abordagem cirúrgica. Da análise de sobrevida verificou-se que os submetidos a cirurgia curativa apresentaram uma sobrevida superior (p<0,05). A cirurgia «curativa» é o tratamento com maior impacto prognóstico, oferecendo possibilidade de cura quando é possível a exérese tumoral completa. Por outro lado, os doentes com critérios de ressecabilidade e portanto submetidos a cirurgia curativa são habitualmente diagnosticados em fases mais precoces, nomeadamente, sem metastização sistémica, e que por si só favorece imediatamente o prognóstico.
A análise comparativa entre não funcionantes e funcionantes, revelou os primeiros com menor número de casos bem diferenciados, maior diâmetro (5,4 vs 2,9cm), maior frequência de angioinvasão, doença locorregional e metastização à distância (70% dos TNEPs não funcionantes tinham metastização à distância à apresentação) índices proliferativos mais elevados e diagnóstico em estádios mais avançados (os TNEPs não funcionantes apresentaram-se maioritariamente como T3N1M1). Consequentemente, a sua sobrevida foi inferior quando comparada com a dos funcionantes (72 vs 106 meses; p=0,037). Salienta-se que a presença de metástases à distância, nomeadamente a nível hepático, é considerada por alguns autores o fator de prognóstico mais importante, e o tamanho tumoral particularmente importante para o seu desenvolvimento9.
Nesta amostra, os TNEPs não funcionantes comportaram-se com maior agressividade e consequentemente pior prognóstico, como alguns estudos sugerem3,14,15, embora não confirmado por outros22. Tal pode dever-se ao diagnóstico tardio, em fases mais avançadas de doença, dado não se associarem a excesso de produção hormonal e/ou às manifestações clínicas serem inespecíficas. Em alternativa, a própria biologia tumoral poderá ser mais agressiva, atendendo aos valores mais elevados dos índices proliferativos e há maior frequência de critérios histológicos de risco (diferenciação histológica; angioinvasão; disseminação locorregional) no grupo dos TNEPs não funcionantes.
De referir ainda que o grupo dos TNEPs funcionantes é muito heterogéneo, sob os mais diversos aspetos inclusive quanto à agressividade biológica, e que habitualmente os insulinomas apresentam um prognóstico mais favorável do que outros TNEPs funcionantes, como por exemplo os gastrinomas. Neste estudo, como a população de TNEPs funcionantes era maioritariamente composta por insulinomas (apenas 3 gastrinomas), este aspeto pode limitar as comparações entre estes grupos e conferir melhor prognóstico aos TNEPs funcionantes. Mais uma vez, de uma forma geral, estes dados estão em consonância com alguma literatura3,4,14,15.
Por último analisaram-se alguns parâmetros como fatores de prognóstico (figs. 2 e 3; tabela 4), salientando-se com significado estatístico: índices proliferativos, diferenciação histológica, presença de angioinvasão, doença locorregional e metastização. Os TNEPs não funcionantes, por si só implicam pior prognóstico, dado reunirem mais frequentemente características que implicam curso de doença mais desfavorável, como discutido anteriormente.
Mais estudos nesta área são necessários para melhor conhecer as características deste grupo de patologias e evoluir no sentido do diagnóstico e tratamento mais precoces2,3,8,23.
Conflito de interessesOs autores declaram não haver conflito de interesses.