O aumento da sobrevida das crianças e adultos jovens com cancro faz com que haja cada vez mais sobreviventes em idade reprodutiva, o que implica que a preservação da fertilidade seja uma questão cada vez mais valorizada tanto pelos doentes como pela comunidade científica. Apesar da reconhecida importância da discussão atempada com os doentes do risco de infertilidade associado ao cancro e ao tratamento antineoplásico, várias são as barreiras que fazem com que mais de metade dos oncologistas não aborde ainda por rotina estas questões. A criopreservação de embriões é o método mais bem estabelecido para preservar a fertilidade de doentes oncológicas, mas tem limitações bem reconhecidas, como a necessidade de estimulação prévia com gonadotrofinas e a de utilização de gâmetas masculinos. A criopreservação de ovócitos garante a liberdade reprodutiva da mulher, uma vez que não implica que haja um parceiro nem o recurso a um banco de esperma. Importantes desenvolvimentos técnicos nesta área, como protocolos de desidratação para diminuição do stress osmótico e crioferramentas para preservação de ovócitos, bem como o recurso a injeção intracitoplasmática (ICSI), com melhoria das taxas de fertilização, contribuíram para os avanços na sua implementação. A criopreservação de tecido ovárico tem como vantagem não necessitar de estimulação hormonal prévia, não impondo atrasos no início do tratamento antineoplásico. Poderá ser proposta a mulheres selecionadas, idealmente inseridas em protocolos de investigação clínica. Os agonistas da GnRH são utilizados em vários centros durante a quimioterapia, mas a sua eficácia na preservação da função ovárica e da fertilidade é muito controversa. Os dados até agora disponíveis não mostram aumento da incidência de malformações congénitas na descendência dos sobreviventes de cancro. Particular atenção deverá ser dada a mulheres submetidas a irradiação pélvica, por risco aumentado de abortamento, parto pré-termo e baixo peso ao nascimento, e a mulheres submetidas a irradiação torácica ou a tratamento com antraciclinas, pelo risco de miocardiopatia. A existência de uma equipa multidisciplinar, constituída por oncologistas e outros clínicos envolvidos no tratamento de doentes com cancro, especialistas em Medicina da Reprodução (como ginecologistas, geneticistas, endocrinologistas), psicólogos, entre outros, permitirá ajudar a mulher a preservar a sua fertilidade de forma tão eficaz e atempada quanto possível, sem colocar em risco o sucesso do tratamento antineoplásico.
The increased survival rates in childhood and young adulthood cancer have resulted in a parallel rise in survivors of reproductive age. Accordingly, fertility preservation is an increasingly valued issue by patients and the scientific community. Despite the recognized importance of timely discussion with the patient about the infertility risk associated with cancer and anticancer treatment, there are several barriers that may explain why more than half the oncologists do not routinely address these issues further. Embryo cryopreservation is a well established method to preserve fertility in cancer patients, but the need for prior stimulation with gonadotrophins and the use of male gametes are recognized limitations. Oocyte cryopreservation guarantees women's reproductive autonomy, since it does not imply a partner or a sperm donor. Important technical developments in this area, along with improvement in fertilization rates with intracytoplasmic injection (ICSI), contributed to the progress in its implementation. Ovarian tissue cryopreservation has the advantage of not requiring prior hormonal stimulation, without imposing delays to the beginning of anticancer treatment. It may be offered to selected women, ideally integrated in clinical research protocols. GnRH agonists are used in various centers during chemotherapy, but their effectiveness in the preservation of ovarian function and fertility is controversial. Data so far available show no increased incidence of congenital malformations in the offspring of cancer survivors. Particular attention should be given to women undergoing pelvic irradiation, as there is an increased risk of miscarriage, preterm delivery and low birth weight, as well as to women undergoing thoracic irradiation or anthracycline treatment, for the risk of cardiomyopathy. A multidisciplinary team consisting of oncologists and other clinicians involved in cancer treatment, reproductive medicine specialists (as gynecologists, geneticists, endocrinologists), psychologists, among others, will help women to preserve their fertility as efficiently and timely as possible, without jeopardizing the success of anticancer treatment.
Introdução
Nas duas últimas décadas tem-se assistido a um aumento significativo das taxas de sobrevida dos doentes com cancro, particularmente no que diz respeito a neoplasias que afetam crianças e jovens adultos. Consequentemente, questões de qualidade de vida como a preservação da fertilidade são cada vez mais valorizadas.
Um em cada 570 indivíduos com idades entre os 20 e os 34 anos sobreviveu a um cancro diagnosticado na infância ou adolescência1, e vários estudos têm vindo a demonstrar a importância dada pelos sobreviventes à possibilidade de maternidade e paternidade biológicas2-4.
Inquéritos efetuados a sobreviventes de cancro identificaram um aumento de stress emocional naqueles que ficaram inférteis pelo tratamento antineoplásico3-8.
A American Society of Clinical Oncology (ASCO) e a American Society for Reproductive Medicine (ASRM) recomendam que o doente seja informado do risco de infertilidade associado ao tratamento antineoplásico, bem como das opções disponíveis para preservação da fertilidade. Este assunto deve ser discutido o mais precocemente possível após o diagnóstico, e sempre antes do início de terapêutica gonadotóxica9,10. A preservação da fertilidade deve ser individualizada. A melhor abordagem depende do tipo de tratamento gonadotóxico, tempo disponível, idade da doente, tipo de doença neoplásica, e da existência ou não de parceiro9. É de realçar a inexistência de ensaios clínicos aleatorizados com grande número de doentes ou de estudos com longas catamneses para avaliar os possíveis impactos dos tratamentos da fertilidade nos sobreviventes de cancro.
Barreiras na abordagem da preservação da fertilidade com o doente oncológico
Apesar destas recomendações, mais de 50% dos oncologistas reconhecem não abordar por rotina o tema da fertilidade com os seus doentes em idade reprodutiva. Várias são as barreiras identif icadas, nomeadamente: a atualização insuf iciente, por parte dos oncologistas e restantes clínicos envolvidos no tratamento destes doentes, em relação aos métodos disponíveis para preservação da fertilidade, em parte pela falta de ligação às equipas de Medicina da Reprodução; pelas características do doente (prognóstico, sexo, idade, status parental, estado civil, capacidade financeira, orientação sexual, infeção VIH); pelo impacto negativo da doença; pela perceção da fertilidade como questão «menor»; pelo receio de agravamento do prognóstico devido ao atraso no início do tratamento a que alguns métodos de preservação de fertilidade se poderão associar; assim como por questões éticas e legais, como a utilização póstuma de gâmetas ou embriões e a preservação de fertilidade em doentes menores.
Risco de infertilidade no doente oncológico
Apesar do papel causal amplamente reconhecido do tratamento antineoplásico - quimioterapia, radioterapia e cirurgia - na infertilidade futura dos doentes oncológicos, o cancro per se tem sido apontado também como tendo um potencial efeito negativo sobre a fertilidade11-16. É ainda de referir que o adiamento generalizado da maternidade / paternidade a que hoje se assiste, associado ao atraso imposto pela doença oncológica, faz com que a idade seja também um fator etiológico importante nestes doentes, tal como na restante população.
Cancro per se e infertilidade
No homem com cancro do testículo ou neoplasias hematológicas foram demonstradas taxas significativamente mais elevadas de azoospermia prévia ao tratamento antineoplásico do que em controlos, pelo que parece haver um efeito negativo daqueles tipos de cancro per se sobre a fertilidade11-15. O efeito da doença sobre a fertilidade está menos bem comprovado em mulheres. Recentemente, em gâmetas de mulheres com linfoma de Hodgkin foram demonstradas pela primeira vez lesões significativas antes do tratamento.
O córtex do ovário destas mulheres foi comparado com o córtex de ovário de mulheres controlo (não tratadas, sem linfoma de Hodgkin). O exame histológico do córtex ovárico fresco mostrou que, nas doentes com linfoma de Hodgkin, os folículos apresentavam uma presença incomum de vacúolos claros quando comparados com grupo controlo (73,7% versus 5,7%). Ficou ainda demonstrado que os pequenos vacúolos se fundiam em grandes vacúolos autofágicos. A percentagem de folículos vacuolizados foi maior em doentes em estádio mais avançado e maior volume tumoral16.
Infertilidade associada ao tratamento antineoplásico na mulher
As lesões resultantes da quimioterapia no ovário são dependentes do fármaco e da dose utilizada, bem como da idade no tratamento. Doses progressivamente menores produzem falência ovárica à medida que avança a idade da mulher. A irradiação corporal total, abdominal ou pélvica pode causar lesão ovárica e uterina dependendo da dose de radiação, fracionamento e idade no tratamento. A elevação da FSH é atualmente o indicador bioquímico mais bem validado de insuficiência ovárica10. Duas determinações de FSH em níveis menopausicos, com pelo menos um mês de intervalo, associadas a oligomenorreia ou amenorreia e a níveis baixos de estrogénios são fortemente sugestivos de falência ovárica. Contudo, nos últimos anos, a hormona antimulleriana tem sido considerada um indicador mais preciso da reserva ovárica do que a FSH17, tendo sido demonstrada a sua utilidade em mulheres submetidas a quimioterapia e radioterapia18-20.
A maioria dos fármacos antineoplásicos atua sobre as células em divisão, pelo que afeta de forma preferencial as células da granulosa e da teca do ovário relativamente aos ovócitos. Os ovários de mulheres submetidas a tratamentos de quimioterapia têm um número normal ou ligeiramente diminuído de folículos primordiais, mas apresentam uma redução mais significativa de folículos maiores em maturação21,22, o que indica um maior efeito da quimioterapia sobre o desenvolvimento folicular do que sobre os ovócitos. Em conformidade com estes achados histológicos, muitas mulheres desenvolvem amenorreia durante a quimioterapia, frequentemente associada a elevação das gonadotrofinas, mas em alguns casos, sobretudo se a idade for inferior a 40 anos, pode haver recuperação dos ciclos menstruais e mesmo da fertilidade meses a anos após o final da terapêutica23-25.
Tanto no homem como na mulher, as classes de fármacos mais ameaçadoras para a fertilidade são os agentes alquilantes, particularmente a ciclofosfamida, ifosfamida, nitrosureias, clorambucil, melfalan, bussulfan e procarbazina. Os agentes alquilantes originam morte celular por alteração na síntese do ADN e na transcrição de ARN.
As células em proliferação, como as da medula óssea, tubo digestivo e folículos ováricos em crescimento, são mais vulneráveis aos efeitos tóxicos dos agentes alquilantes. Estes podem ser, contudo, igualmente citotóxicos para células em repouso, uma vez que não são específicos de ciclo celular. Os agentes alquilantes causam, assim, destruição direta dos ovócitos e deplecção folicular, e podem originar fibrose cortical bem como lesão da vasculatura ovárica26.
Relativamente à radioterapia, a probabilidade de falência ovárica prematura em doentes com idade igual ou superior a 20 anos é quase de 100% para doses de 15 Gy27 (Tabela 1).
Preservação da fertilidade na mulher
Criopreservação de embriões
A criopreservação de embriões é um método bem estabelecido para preservação da fertilidade, disponível em todos os centros de reprodução medicamente assistida, e o único oficialmente reconhecido pela American Society of Reproductive Medicine e pela American Society of Clinical Oncology9,10.
Implica um período de aproximadamente duas semanas de estimulação ovárica com injeções diárias de gonadotrofinas e monitorização ecográfica do crescimento dos folículos. A maturação ovocitária final é obtida habitualmente com uma injeção de hCG. Os folículos maduros são posteriormente aspirados por via transvaginal sob controlo ecográfico, os ovócitos são fecundados e os embriões resultantes criopreservados.
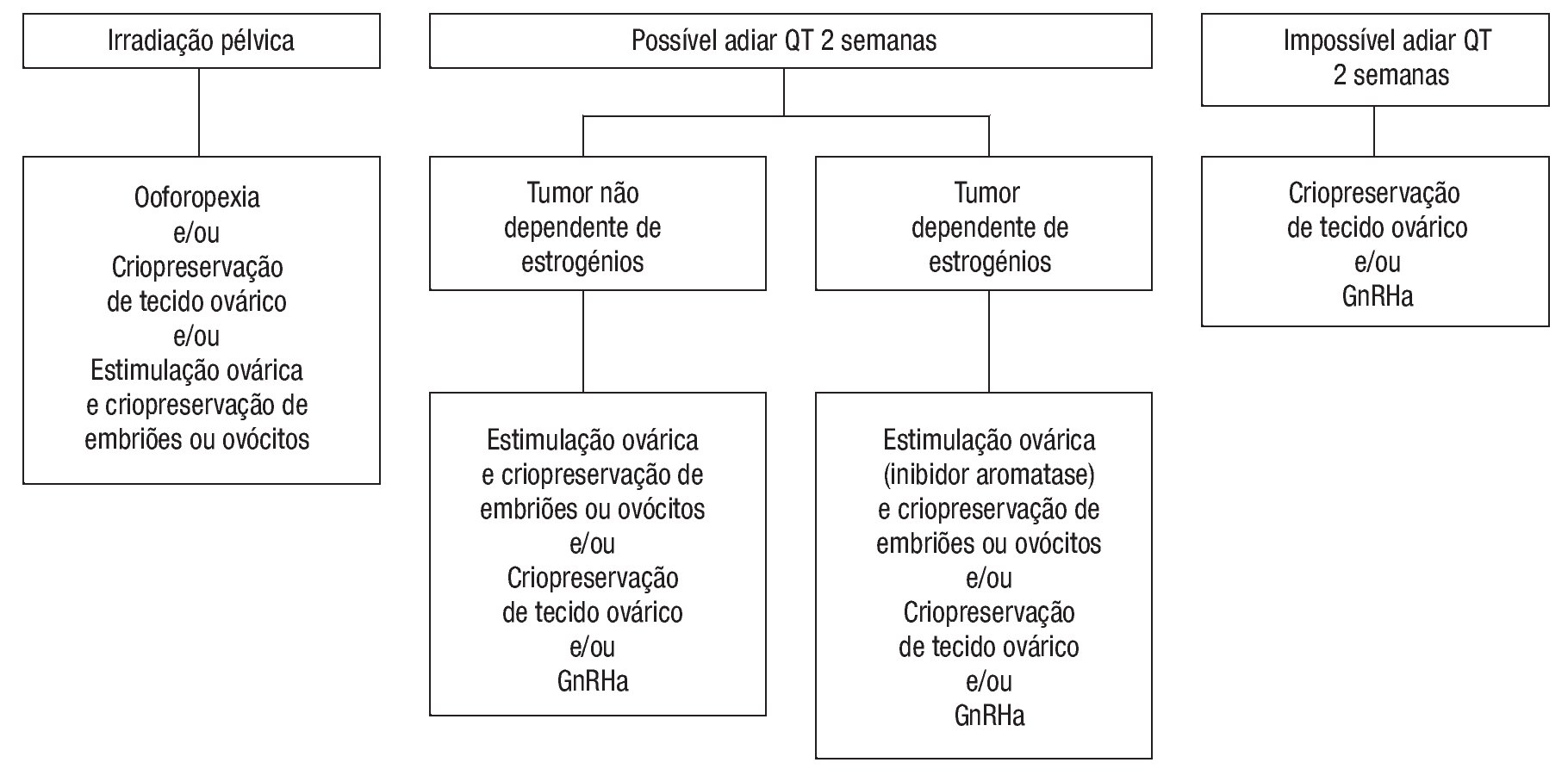
A necessidade de estimulação ovárica implica um atraso de pelo menos 2 semanas no início do tratamento antineoplásico e a exposição a níveis elevados de estrogénios, podendo esta última ser prejudicial no caso de tumores hormono-sensíveis. Para as mulheres com estes tumores existem protocolos de estimulação que associam doses mais baixas de gonadotrofinas a um inibidor da aromatase (em geral o letrozole), ou ao tamoxifeno, permitindo uma elevação menos acentuada de estrogénios durante o ciclo de fertilização (Figura 1). A administração de um agonista da hormona libertadora de gonadotrofinas (GnRH) (ex: acetato de leuprolide 2 mg dose única; triptorelina 0,2 mg) para desencadear a ovulação, em lugar da tradicional hCG, limita a incidência da síndrome de hiperestimulação ovárica em doentes com uma resposta exagerada às gonadotrofinas28.
Figura 1. Preservação da fertilidade em mulheres pós-pubertária . GnRHa: agonista da GnRH.
A doente que está sob contraceção oral ou na fase lútea ou fase folicular precoce, pode iniciar rapidamente a estimulação ovárica. Em geral, os oncologistas deverão manter os contracetivos orais na altura do diagnóstico uma vez que a estimulação poderá ser iniciada 1 a 2 dias após suspensão da pílula contracetiva28.
No caso de ser possível iniciar a estimulação durante o cataménio, é habitualmente aplicado um protocolo clássico com antagonistas da GnRH, uma vez que se associa a um risco mais baixo de síndrome de hiperestimulação ovárica. Se for necessário iniciar de imediato a estimulação, noutra fase do ciclo menstrual, para evitar mais atrasos no início do tratamento antineoplásico, poder-se-á seguir um dos seguintes protocolos:
1. Administrar um antagonista da GnRH (3 mg dose única ou 250 mg durante 2-3 dias consecutivos); iniciar a estimulação com gonadotrofinas 5-7 dias depois; se nessa altura os níveis de estradiol forem elevados, adicionar antagonista da GnRH diário durante os primeiros 2 dias da estimulação com gonadotrofinas;
2. Administrar um contracetivo oral 4-6 dias; associar um antago--nista da GnRH 250 mg/dia nos últimos 2-3 dias de contracetivo oral; iniciar estimulação ovárica 2 dias depois;
3. Na fase luteínica: iniciar antagonista da GnRH 250 mg/dia em simultâneo com as gonadotrofinas.
Além da necessidade de estimulação ovárica, a criopreservação de embriões implica também que haja uma fonte de gâmetas masculinos, o que exclui as mulheres sem parceiro fixo que não desejem recorrer a um banco de esperma. A lei portuguesa não permite, contudo, que uma mulher que não tenha parceiro recorra à criopreservação de embriões. Há algumas questões éticas relacionadas com a criopreservação de embriões de doentes oncológicas a considerar, nomeadamente no caso de morte da mãe ou da separação do casal antes da transferência. No primeiro caso, de acordo com a legislação portuguesa, os embriões poderão ser doados a casais inférteis ou para investigação médica, se previamente autorizado pelo casal, caso contrário serão destruídos. Em caso de separação do casal antes da transferência dos embriões, estes só poderão ser utilizados com a autorização de ambos os elementos do casal (Lei no 32/2006 de 26 de julho).
Criopreservação de ovócitos
A criopreservação de ovócitos permite preservar a autonomia reprodutiva da mulher, uma vez que não implica a necessidade de gâmetas masculinos.
A criopreservação de ovócitos maduros requer estimulação ovárica, tal como anteriormente descrito para a criopreservação de embriões. O primeiro nascimento obtido a partir de ovócitos criopreservados foi publicado em 198629, mas os resultados obtidos nessa altura eram insatisfatórios, com taxas de sobrevivência e de fertilização dos ovócitos e de gravidez muito baixas. O elevado conteúdo em água do ovócito e a sensibilidade das estruturas internas à temperatura limitavam o sucesso da criopreservação de ovócitos. Importantes desenvolvimentos técnicos nesta área, como protocolos de desidratação para diminuição do stress osmótico e crioferramentas para preservação de ovócitos, bem como o recurso à injeção intracitoplasmática (ICSI), com melhoria das taxas de fertilização, contribuíram para os avanços nesta área28,30,31. A ICSI deve ser por princípio utilizada, independentemente do espermograma, para reduzir o risco de insucesso na fertilização dos ovócitos criopreservados32.
Até ao final de 2004 tinham nascido aproximadamente 100 crianças a partir de ovócitos criopreservados, mas a percentagem de nascimentos por ovócito congelado era de 1 a 5%. Contudo, a partir de 2005, com as técnicas de vitrificação, mais eficazes do que o congelamento lento dos ovócitos não fecundados, assistiu-se a um aumento daquelas taxas33: mais de 1000 nascimentos foram já reportados com esta técnica e, de acordo com alguns centros, com taxas de gravidez semelhantes àquelas que se obtêm com ovócitos a fresco34,35. Apesar de ser ainda considerada uma técnica experimental pela ASRM, a criopreservação de ovócitos é utilizada em mais de 50% das clínicas de infertilidade dos EUA em doentes oncológicos30.
Maturação de ovócitos in vitro
A colheita de ovócitos imaturos, in situ ou de tecido ovárico excisado36, é ainda uma técnica em fase experimental. Os ovócitos são amadurecidos in vitro em meio próprio antes do seu congelamento ou após descongelamento37.
A colheita de ovócitos imaturos não implica estimulação prévia com gonadotrofinas, obviando preocupações em relação aos cancros hormono-sensíveis38,39 e permitindo ainda evitar os atrasos no início da quimioterapia associados à estimulação hormonal. A colheita de ovócitos in situ é efetuada 38 horas após o priming com hCG, de forma ideal quando o maior folículo atingiu 10 a 12 mm40,41. Nos casos em que não haja tempo suficiente, antes do início da quimioterapia, para a colheita não estimulada de ovócitos em fase folicular, pode ser considerada a colheita em fase luteínica42,43. As grandes desvantagens desta técnica são a baixa taxa de sobrevida e de fertilização dos ovócitos vitrificados após maturação in vitro, comparativamente à dos ovócitos maduros colhidos após estimulação ovárica41,44, e a baixa taxa de gravidez quando comparada com a de ciclos convencionais de fertilização in vitro, pela menor taxa de implantação45. Foram já descritas, no entanto, algumas gestações obtidas com ovócitos humanos imaturos congelados/descongelados e, embora os estudos de catamnese destas crianças sejam escassos, os resultados são promissores44,46,47.
A técnica de maturação in vitro é promissora, mas o seu papel na preservação da fertilidade em doentes com cancro permanece ainda por avaliar28.
Criopreservação de tecido ovárico
A criopreservação de tecido ovárico é um método considerado ainda experimental, devendo ser disponibilizado apenas no contexto de protocolos de investigação. Foram reportados menos de 20 nascimentos na última década a partir de tecido ovárico criopreservado48. São candidatas a este método mulheres com idade inferior a 35-37 anos, com reserva ovárica adequada à idade, que tenham programada quimioterapia ou outro tratamento associado a risco significativo de falência ovárica prematura. A criopreservação de tecido ovárico envolve a remoção da totalidade ou parte de um ovário e, assim, de uma parte substancial do capital folicular da doente, pelo que se justifica apenas em situações em que seja quase certa a perda de função ovárica no final do tratamento: quimioterapia com doses elevadas de agentes alquilantes (como a ciclofosfamida ou o bussulfan); irradiação corporal total ou abdominal: ooforectomia bilateral ou ooforectomia unilateral de ovário único restante49. Deve ser excluída previamente metastização ovárica, pelo que é considerado habitualmente critério de exclusão a presença de neoplasias com risco elevado de metástases anexiais (leucemias, cancro da mama metastizado, cancro do ovário, etc.). O linfoma de Hodgkin é considerado uma neoplasia de baixo risco50,51.
Após a colheita de tecido ovárico, é feita uma avaliação histológica para diagnóstico de micrometástases28,52,53. Tem as vantagens de não atrasar de forma significativa o início do tratamento antineoplásico e de poder ser utilizada em mulheres pré-menarca.
A transplantação pode ser ortotópica (na fossa ovárica) ou heterotópica (ex. na parede abdominal peritoneal, na serosa uterina ou na parede abdominal ou antebraço por transplantação subcutânea).
O desenvolvimento folicular ocorre geralmente 4 a 5 meses após o transplante, mas observou-se uma variação entre 8 a 26 semanas. A funcionalidade do enxerto é muito variável, de 3 a 4 meses até aos 5 anos51.
As taxas de sucesso da criopreservação de tecido ovárico dependem da densidade folicular original do tecido ovárico, da quantidade de tecido transplantado, da idade da doente na altura da criopreservação, do método de congelamento / descongelamento, da lesão isquémica do enxerto, do ambiente hormonal e da técnica de transplantação54.
A eficácia deste procedimento é difícil de avaliar, uma vez que o número de doentes submetidas a autotransplante de tecido ovárico comparativamente ao número de mulheres que o criopreservaram é muito limitado, mas estima-se uma taxa de gravidez por trans--plantação de 20 a 30%, embora a taxa de nascimentos possa ser menor48,55,56.
Supressão ovárica com agonistas da hormona libertadora de gonadotrofinas
Os agonistas da GnRH causam uma libertação inicial de gonadotrofinas hipofisárias, designado por efeito de explosivo (flare-up), que dura cerca de uma semana, seguido de hipogonadismo hipogonadotrófico por sub-regulação do recetor da GnRH. Este efeito inibitório poderá proteger o ovário durante a quimioterapia por manutenção dos folículos no estádio primordial/primário, diminuindo a sensibilidade ao tratamento gonadotóxico. Por outro lado, poderá diminuir a irrigação sanguínea ovárica51. Pela hiperestimulação ovárica inicial, os agonistas da GnRH devem ser iniciados pelo menos 1 semana antes do início da quimioterapia, e o seu efeito deverá durar até pelo menos 1 a 2 semanas após o final do tratamento. Caso a quimioterapia tenha que ser iniciada de imediato, deve ser utilizado simultaneamente um antagonista da GnRH durante 7 dias. A fármaco-proteção do ovário com agonistas da GnRH é um método mesmo em teoria controverso, tendo em conta que o crescimento inicial dos folículos é independente das gonadotrofinas.
Como efeitos secundários destacam-se os sintomas de hipoestrogenismo ou menopáusicos, como fogachos ou secura vaginal, bem como a perda de massa óssea se o tratamento se prolongar por um período superior a 6 meses. Há ainda o risco teórico de diminuição da eficácia da quimioterapia no cancro da mama hormono-sensível, embora não haja evidência que comprove ou refute esta teoria. Na ausência de dados conclusivos, os análogos da GnRH não devem ser usados em mulheres com este tipo de neoplasias sem que seja feita uma cuidadosa análise do seu risco/benefício32.
Estudos não aleatorizados sugeriram uma redução nas taxas de falência ovárica prematura com a utilização de agonistas da GnRH concomitantemenete com a quimioterapia57,58, mas a metodologia destes estudos foi criticada59,60. Três meta-análises publicadas em 2009 e 2010 mostraram um efeito favorável da utilização concomitante dos análogos durante a quimioterapia na preservação da função ovárica61-63.
Dois estudos aleatorizados mostraram uma melhoria das provas de reserva ovárica no grupo tratado com análogos, mas a taxa de gravidez espontânea foi semelhante entre os dois grupos57,64. Dois outros estudos aleatorizados em doentes com linfoma de Hodgkin, o mais recente conduzido pelo German Hodgkin Study Group, não demonstraram qualquer eficácia nos análogos da GnRH no que diz respeito à preservação da reserva ovárica65-67.
O estudo ZORO também não mostrou diferenças significativas na restauração de ciclos menstruais espontâneos ou no perfil hormonal em mulheres com cancro da mama tratadas com análogos68.
Apesar da discordância dos resultados entre diferentes estudos e da ausência de eficácia comprovada dos análogos da GnRH neste contexto, há muitos centros que os têm vindo a utilizar durante a quimioterapia. Estas doentes deverão, contudo, ser inseridas em ensaios clínicos, após discussão das demais opções disponíveis para preservação da fertilidade51.
Ooforopexia
A ooforopexia consiste na transposição habitualmente craniolateral do ovário, fixação e marcação com clips, de modo a conseguir a maior distância possível da principal área irradiada32,69,70.
Está indicada para manter a função menstrual e fertilidade em mulheres que vão ser submetidas a radioterapia pélvica. Pode ainda proceder-se a uma abordagem combinada consistindo na criopreservação de um dos ovários com transposição do ovário contralateral71,72. As taxas de sucesso publicadas para a ooforopexia são muito inconsistentes, variando entre 16 e 90%. A transposição ovárica tem como possíveis complicações, a formação de cistos ováricos, aderências peritoneais, enfarte tubar e dor crónica73-75.
Num grupo de 51 doentes submetidas a transposição ovárica foi necessária revisão cirúrgica em 9 para alívio da dor69. Poderá ser necessário o posterior reposicionamento dos ovários no local anatómico original se, apesar da preservação da função ovárica, não ocorrer gravidez espontânea. Se for necessária fertilização in vitro, poderá ter que ser efetuada colheita de ovócitos do ovário transposto por via transabdominal (vs transvaginal)76.
Gravidez em sobreviventes de cancro - complicações materno-fetais
Pais submetidos a tratamentos de quimioterapia, radioterapia ou ambos para cancro na infância não têm risco aumentado de malformações congénitas, doenças monogénicas ou alterações cromossómicas na descendência, de acordo com a quase totalidade dos estudos publicados77-85.
Resultados diferentes foram encontrados em 2 estudos. No primeiro, que incluiu 427 gravidezes de mulheres previamente submetidas a tratamento por tumor de Wilms, observou-se uma tendência para aumento do risco de malformações na descendência das previamente irradiadas (p = 0,054), independentemente da dose de radiação recebida82. Apesar de esta ser a maior série de seguimento de doentes com tumor de Wilms, o tamanho desta amostra é pequeno quando comparado com a de outras séries que mostraram ausência de risco aumentado de malformações congénitas na descendência de indivíduos submetidos a radioterapia. Um outro estudo, que analisou dados de registos nacionais da Suécia e Dinamarca, encontrou um aumento ligeiro mas estatisticamente significativo do risco absoluto de malformações congénitas major na descendência de homens com cancro (taxa absoluta de 3,7% vs 3,2% no grupo controlo; RR 1,7, 95% CI 1,05-1,31)86. Uma explicação para estes achados, que contrariam a esmagadora maioria dos estudos prévios, é a de que a descendência dos sobreviventes de cancro é observada de forma mais apertada87.
Os dados disponíveis não mostram efeitos adversos da quimioterapia prévia no risco de abortamento ou morte fetal78,83,88-90.
A gravidez em mulheres previamente submetidas a irradiação pélvica associa-se a aumento de complicações como abortamento, parto pré-termo, baixo peso ao nascimento, placenta acreta e nados-mortos78,83,84,88,91-99. O risco depende da dose total de radiação, do local irradiado e da idade da mulher na altura da irradiação, sendo o útero pré-pubertário particulamente sensível27,100,101.
A toxicidade cardíaca a longo prazo do tratamento antineoplásico poderá complicar uma gravidez futura, por exemplo em mulheres com história de irradiação torácica prévia ou de terapêutica com antraciclinas (daunorrubicina, doxorrubicina, idarrubicina, epirrubicina e mitoxantrona). Estas mulheres deverão ser avaliadas do ponto de vista cardíaco previamente à conceção102-106.
A descendência dos sobreviventes não tem risco aumentado de cancro, a menos que o cancro do progenitor se integre numa síndrome hereditária (ex: retinoblastoma). De acordo com o Comité de Ética da American Society for Reproductive Medicine, é eticamente aceitável o recurso ao diagnóstico genético pré--implantatório para evitar o nascimento de descendência com elevado risco de cancro hereditário10. Por outro lado, a gravidez não altera o risco de recidiva de nenhum tipo de cancro, com a possível exceção da doença trofoblástica gestacional. Em particular, o risco de recidiva de melanoma107,108 ou cancro da mama79,109,110 não parece aumentar por uma gravidez futura.
Conclusões
O risco de infertilidade associado ao tratamento antineoplásico e as diferentes opções disponíveis para preservar a fertilidade devem ser discutidos com as doentes antes do início do tratamento. A criopreservação de embriões é o melhor método para preservação da fertilidade da doente com cancro, devendo as restantes técnicas, nomeadamente a criopreservação de ovócitos e a criopreservação de tecido ovárico, ser oferecidas a doentes selecionadas, de preferência inseridas em protocolos de investigação clínica. O papel da proteção farmacológica do ovário com agonistas da GnRH durante a quimioterapia é ainda controverso, sendo necessários mais dados que comprovem a sua eficácia neste contexto. A referenciação destas mulheres, tão precocemente quanto possível após o diagnóstico, a especialistas em Medicina da Reprodução é crucial para que seja possível disponibilizar o procedimento com maior possibilidade de sucesso, sem comprometer o início atempado do tratamento antineoplásico. Para tal é fundamental uma boa cooperação entre as equipas responsáveis pelo tratamento destas doentes e as equipas de Medicina da Reprodução.
* Autor para correspondência.
Correio electrónico:matos.mjd@gmail.com (M.J. Matos).
INFORMAÇÃO DO ARTIGO
História do artigo:
Recebido a 30 de julho de 2012
Aceite a 20 de outubro de 2012