Nos doentes com pubarca precoce, o gold‐standard para o diagnóstico diferencial entre pubarca precoce idiopática (PPI) e a forma não clássica da hiperplasia congénita da suprarrenal (HCSR‐NC) é a prova de Synacthen. Esta permite também estimar a reserva adrenal de cortisol nos doentes com HCSR‐NC.
ObjetivosComparar as características clínicas e perfil hormonal basal dos doentes com pubarca precoce; avaliar a importância da prova de Synacthen no diagnóstico diferencial entre PPI e HCSR‐NC e na determinação da reserva adrenal de cortisol.
Material e métodosEstudo transversal de doentes com pubarca precoce que realizaram prova de Synacthen.
ResultadosForam incluídos 43 doentes, com idade mediana de 7,5 anos (3,5‐9,4), sendo 37 (86,0%) do sexo feminino. Na prova de Synacthen, 37 (86,0%) foram classificados como PPI e 6 (14,0%) como HCSR‐NC. Não houve diferenças significativas entre os 2 grupos quanto às características clínicas e doseamentos basais de ACTH, cortisol e androgénios da suprarrenal. A 17‐OHP basal e estimulada foi mais elevada nos doentes com HCSR‐NC (p=0,001 e p<0,001, respetivamente) (basal: 4,62±3,70ng/ml [0,80‐10,50]; estimulada: 35,41±24,87ng/ml [12,0‐80,2]) do que nos doentes com PPI (basal: 1,04±0,77ng/ml [0,22‐3,80]; estimulada: 4,18±1,71ng/ml [1,0‐8,96]). O cut‐off basal habitualmente proposto (<2,0ng/ml) para a distinção entre estes grupos não o permitiu em 2 doentes, que apenas foram diagnosticados após realização da prova de Synacthen. Dois doentes com HCSR‐NC (33,3%) tiveram cortisol após estimulação <18μg/dl, revelando necessidade de tratamento com glucocorticoide em stress. Os doentes com HCSR‐NC com valores mais elevados de 17‐OHP basal tiveram valores de cortisol mais baixos após estimulação (p=0,004; r=‐0,43).
ConclusãoA realização desta prova foi útil para distinguir os doentes com HCSR‐NC e PPI, pois nenhum valor de 17‐OHP basal permitia fazer o diagnóstico diferencial definitivo. Em alguns doentes com HCSR‐NC a prova revelou secreção inapropriada de cortisol em stress, contribuindo para a decisão terapêutica.
In patients with precocious pubarche (PP), the gold standard for the differential diagnosis between idiopathic PP (IPP) and nonclassical congenital adrenal hyperplasia (NCCAH) is the ACTH stimulation test (ST); this test also estimates the adrenal cortisol reserve in NCCAH patients.
ObjectivesTo compare the clinical characteristics and baseline hormonal profile of patients with PP; to determine the importance of ST in the differential diagnosis between IPP and NCCAH and in the evaluation of the adrenal production of cortisol.
MethodsCross‐sectonal study of patients with PP who underwent ST.
Results43 patients were included; median age at diagnosis was 7.5 years [range: 3.5‐9.4], 37 (86.0%) were female. After ST, 37 (86.0%) were classified as IPP and 6 (14.0%) as NCCAH. No significant differences could be found in the clinical characteristics and baseline determination of ACTH, cortisol and adrenal androgens between the groups. Both basal and stimulated 17‐OHP levels were significantly higher (p=0.001 and p<0.001, respectively) in NCCAH patients (basal: 4.62±3.70ng/ml [0.80‐10.50]; stimulated: 35.41±24.87ng/ml [12.0–80.2]) than IPP patients (basal: 1.04±0.77ng/ml [0.22–3.80]; stimulated: 4.18±1.71ng/ml [1.0–8.96]). Nevertheless, the proposed basal cut‐off level (<2.0ng/ml) for the distinction between the groups, did not allow for this in 2 NCCAH patients that were only diagnosed after ST. Two NCCAH patients (33.3%) had stimulated cortisol levels <18μg/dl, showing the need for glucocorticoid stress therapy. NCCAH patients with higher initial 17‐OHP value had lower cortisol after stimulation (p=0.004; r=‐0.43).
ConclusionThe ST was useful to distinguish between patients with NCCAH and IPP, for no basal 17‐OHP level could allow for a definitive differential diagnosis in the individual patient. In some NCCAH cases, it also showed inappropriate cortisol secretion under stress, contributing to the therapeutic decision.
A hiperplasia congénita da suprarrenal (HCSR) é uma doença de transmissão autossómica recessiva que resulta, em mais de 95% dos casos, de uma mutação no gene CYP21A2, que codifica a enzima 21‐hydroxilase (CYP21)1,2. Esta enzima é responsável pela conversão de 17‐hidroxiprogesterona (17‐OHP) em 11‐desoxicortisol, sendo este depois convertido em cortisol pela 11‐beta‐hidroxilase1,3. Existem várias formas clínicas de HCSR por défice de 21‐hidroxilase, com gravidade diferente, dependendo da atividade enzimática existente4. Na HCSR forma não clássica (HCSR‐NC), descrita pela primeira vez em 1979, estima‐se que a atividade enzimática da 21‐hidroxilase seja de cerca de 20‐50%5,6. Apesar de reduzida, é suficiente para manter produção normal de glucocorticoides e mineralocorticoides, à custa da produção excessiva de androgénios4. A sua prevalência estimada nos caucasianos não judeus é de 0,1‐0,2% (incidência 1:1.000), mas poderá ser mais elevada em determinadas populações, como os povos do Mediterrâneo, Médio Oriente, judeus da Europa de Leste e indianos3,4,6–8. Manifesta‐se após a infância por sinais de hiperandrogenismo, sem insuficiência adrenal, pelo que o seu diagnóstico não é tão evidente como na forma clássica2,6. Pensa‐se que esteja subdiagnosticada nos indivíduos com hiperandrogenismo.5. Por outro lado, muitos doentes são assintomáticos e têm normal crescimento, puberdade e fertilidade, sendo apenas detetados através de familiares afetados3,6. Nas crianças, a HCSR‐NC é a causa mais frequente de hiperandrogenismo e a pubarca precoce (PP) é a sua forma de apresentação mais frequente, nomeadamente antes dos 10 anos3,5,6,9. No entanto, em crianças com PP, a estimativa da prevalência de HCSR‐NC é muito discrepante entre os estudos, variando entre 4 e até 30% em populações de alto risco (mediana 8%)3–6,10. A HCSR‐NC também pode cursar com clitoromegalia, alopecia, acne de difícil tratamento, hirsutismo e oligoamenorreia2,4,9.
Diagnóstico diferencial de pubarca precoce: pubarca precoce idiopática e hiperplasia congénita da suprarrenal forma não clássicaDe acordo com a maioria dos estudos publicados, nenhuma característica clínica parece predizer a existência de HCSR‐NC nos doentes com PP, sendo o diagnóstico definitivo feito laboratorialmente10.
Os doentes com HCSR‐NC apresentam aumento do valor basal de 17‐OHP8. No entanto, devido ao ritmo circadiano de síntese de hormonas do córtex da SR, as determinações aleatórias de 17‐OHP podem estar dentro dos parâmetros normais na HCSR‐NC e o diagnóstico passar despercebido, a menos que o doseamento seja feito de manhã cedo, preferencialmente entre as 7h30‐8h00 da manhã3,6,7. A prova de Synacthen (tetracosactido), que consiste na administração endovenosa de 250μg de um análogo sintético dos primeiros 24 aminoácidos do segmento N‐terminal da adrenocorticotrofina (ACTH), é o gold‐standard para confirmar a existência de défice de 21‐hidroxilase2,3,5,7. É o método mais específico para detetar os casos mais ligeiros de doença e é seguro, custo‐efetivo e rápido9. Nos doentes com HCSR‐NC existirá uma resposta de 17‐OHP exagerada 60 minutos após a estimulação com ACTH (17‐OHP após estimulação entre 10‐100ng/ml)2. Existe grande variabilidade nas indicações para a realização de prova de Synacthen nos indivíduos com PP. Muitos autores defendem que a prova de Synacthen deve ser feita em todas as crianças com PP, garantindo uma sensibilidade de 100% no diagnóstico da HCSR‐NC10. No entanto, esta estratégia leva à realização de provas de Synacthen desnecessárias em mais de 80% dos doentes com PP. Outros autores defendem que essa abordagem não é exequível e que se deve optar pela realização da prova apenas nos doentes com valor basal de 17‐OHP mais elevado, valor basal elevado de androstenediona ou com razão dehidroepiandrosterona (DHEA)/androstenediona >16,7,10. Foram propostos diferentes cut‐offs para o valor da 17‐OHP basal a utilizar, situando‐se na maioria dos estudos entre 1,5‐3,0ng/dl6–9,11,12. No entanto, o valor preditivo destes limiares não está validado em crianças com PP10.
Importância do diagnóstico diferencial na pubarca precoceNecessidade de tratamento com glucocorticoides em stressA prova de Synacthen é também útil para avaliar a reserva adrenal de glucocorticoide6,8. Apesar de haver autores que defendem que a síntese de cortisol em situações de stress não está afetada de forma clinicamente relevante na HCSR‐NC e que não há registo de mortes por insuficiência adrenal3, alguns estudos mostraram que, na HCSR‐NC, pelo menos 30% dos doentes adultos têm uma resposta diminuída do cortisol à ACTH e podem estar em risco de insuficiência adrenal induzida pelo stress de doença aguda ou cirurgia8. Deste modo, a pesquisa da reserva de corticoide adrenal está indicada por rotina nos doentes com HCSR‐NC8. Os doentes com HCSR‐NC têm indicação para tratamento com hidrocortisona em situações de stress se a sua função adrenal for subótima na prova de Synacthen (cortisol após estimulação <18‐20μg/dl) ou estiver iatrogenicamente suprimida6,7,13.
Aconselhamento genéticoO diagnóstico da HCSR‐NC assume também importância relativamente ao aconselhamento genético, uma vez que muitos doentes com HCSR‐NC são heterozigotos compostos de 2 ou mais alelos mutados. Apesar do seu fenótipo traduzir a mutação menos grave, 2/3 dos doentes com HCSR‐NC são portadores de mutações que podem condicionar a forma clássica da doença13,14. Estima‐se que o risco de um doente com HCSR‐NC ter um filho com HCSR forma clássica é de cerca de 1:2406,13; um estudo francês estimou que esse risco será de 2,5% e que o risco de ter um filho com forma não clássica é de 15%1, provavelmente devido a consanguinidade em determinadas populações6.
Os objetivos deste trabalho são: 1) determinar se é possível distinguir os doentes com pubaca precoce idiopática (PPI) e HCSR‐NC com base em características clínicas e perfil hormonal basal; 2) determinar se existe algum valor basal de 17‐OHP que permita o diagnóstico, evitando a realização de provas de Synacthen desnecessárias; 3) avaliar a importância da realização da prova de Synacthen na avaliação da reserva adrenal e necessidade de tratamento de stress com glucocorticoide nos doentes com HCSR‐NC.
Material e métodosEstudo transversal, em que foram analisados os processos clínicos de doentes enviados à consulta de endocrinologia pediátrica entre novembro de 1998 e março de 2013 por PP (definida como aparecimento de pilosidade púbica antes dos 8 anos no sexo feminino e dos 9 anos no sexo masculino) após os 2 anos de vida, tendo realizado prova de Synacthen com diagnóstico final de HCSR forma não clássica ou pubarca/adrenarca precoce idiopática. Foram excluídos os doentes com PP associada a outras etiologias, os doentes com evidência de puberdade precoce (existência de botão mamário ou volume testicular >4ml) e os doentes que estivessem medicados com qualquer terapêutica que interferisse com os resultados da prova.
Obtiveram‐se dados relativos às seguintes variáveis: apresentação clínica (sexo; idade da pubarca; presença de outros sintomas/sinais sugestivos de virilização – acne, clitoromegalia [raparigas], hirsutismo [raparigas]); dados relativos à primeira consulta (idade, peso [desvio padrão – SD], altura [SD], índice de massa corporal [IMC] [SD], estádio Tanner [pelo axilar e pelo púbico], diferença entre idade óssea [IO] e idade cronológica [IC] [IO‐IC] em anos); perfil hormonal basal (ACTH [pg/ml], cortisol [μg/dl], Δ4‐androstenediona [ng/ml], 11‐desoxicortisol [ng/ml], sulfato de dehidroepiandrosterona [DHEAS] [μg/dl], 17‐OHP [ng/ml], testosterona total [ng/dl]); determinações laboratoriais após estimulação na prova de Synacthen (aos 60 minutos) (17‐OHP [ng/ml] e cortisol [μg/dl]).
Os doentes foram classificados como tendo HCSR‐NC ou PPI de acordo com um valor de 17‐OHP após estimulação ≥10ng/ml ou <10ng/ml, respetivamente.
Na análise e tratamento estatístico dos dados utilizaram‐se os programas informáticos Microsoft Office Excel® e Statistical Package for the Social Sciences (SPSS®) versão 21.0. Na análise descritiva, para as variáveis quantitativas, foram calculadas medidas de tendência central e medidas de dispersão. Para as variáveis qualitativas, apresentam‐se números absolutos e percentagens. No estudo de associações entre variáveis qualitativas utilizou‐se o teste de correlação de Spearman e na comparação da distribuição das variáveis quantitativas entre diferentes categorias de uma variável qualitativa usou‐se o teste Mann‐Whitney. Foi considerado um nível de significância de 0,05.
ResultadosCaracterização da amostraNo período analisado, foram observados 43 doentes por PP de aparecimento após os 2 anos e que realizaram prova de Synacthen para diagnóstico diferencial. A idade mediana dos doentes na primeira consulta foi de 7,5 anos (amplitude interquartis [AIQ]: 2,0; mínimo 3,5; máximo 9,4). A maioria dos doentes (37; 86,0%) era do sexo feminino e apenas 6 (14,0%) eram do sexo masculino. Após realização da prova de Synacthen, 37 doentes (86,0%) foram classificados como tendo PPI e 6 (14,0%) como tendo HCSR‐NC.
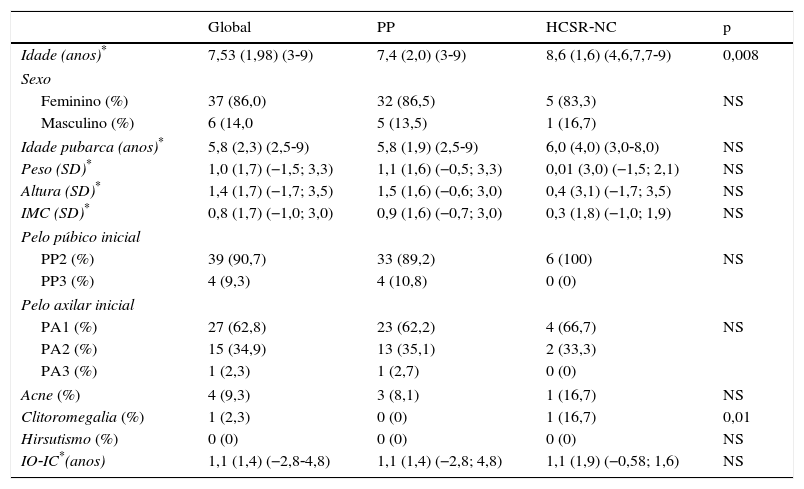
Características clínicas e perfil hormonal basalA tabela 1 mostra a distribuição das características clínicas dos doentes globalmente e por subgrupos. Não se encontraram diferenças estatisticamente significativas entre os doentes com PPI e HCSR‐NC quanto às características clínicas iniciais, à exceção da presença de clitoromegalia presente em apenas um doente com HCSR‐NC (p=0,03) e da idade na primeira consulta (mais elevada nos doentes com HCSR‐NC) (p=0,008).
Características clínicas dos doentes
| Global | PP | HCSR‐NC | p | |
|---|---|---|---|---|
| Idade (anos)* | 7,53 (1,98) (3‐9) | 7,4 (2,0) (3‐9) | 8,6 (1,6) (4,6,7,7‐9) | 0,008 |
| Sexo | ||||
| Feminino (%) | 37 (86,0) | 32 (86,5) | 5 (83,3) | NS |
| Masculino (%) | 6 (14,0 | 5 (13,5) | 1 (16,7) | |
| Idade pubarca (anos)* | 5,8 (2,3) (2,5‐9) | 5,8 (1,9) (2,5‐9) | 6,0 (4,0) (3,0‐8,0) | NS |
| Peso (SD)* | 1,0 (1,7) (−1,5; 3,3) | 1,1 (1,6) (−0,5; 3,3) | 0,01 (3,0) (−1,5; 2,1) | NS |
| Altura (SD)* | 1,4 (1,7) (−1,7; 3,5) | 1,5 (1,6) (−0,6; 3,0) | 0,4 (3,1) (−1,7; 3,5) | NS |
| IMC (SD)* | 0,8 (1,7) (−1,0; 3,0) | 0,9 (1,6) (−0,7; 3,0) | 0,3 (1,8) (−1,0; 1,9) | NS |
| Pelo púbico inicial | ||||
| PP2 (%) | 39 (90,7) | 33 (89,2) | 6 (100) | NS |
| PP3 (%) | 4 (9,3) | 4 (10,8) | 0 (0) | |
| Pelo axilar inicial | ||||
| PA1 (%) | 27 (62,8) | 23 (62,2) | 4 (66,7) | NS |
| PA2 (%) | 15 (34,9) | 13 (35,1) | 2 (33,3) | |
| PA3 (%) | 1 (2,3) | 1 (2,7) | 0 (0) | |
| Acne (%) | 4 (9,3) | 3 (8,1) | 1 (16,7) | NS |
| Clitoromegalia (%) | 1 (2,3) | 0 (0) | 1 (16,7) | 0,01 |
| Hirsutismo (%) | 0 (0) | 0 (0) | 0 (0) | NS |
| IO‐IC*(anos) | 1,1 (1,4) (−2,8‐4,8) | 1,1 (1,4) (−2,8; 4,8) | 1,1 (1,9) (−0,58; 1,6) | NS |
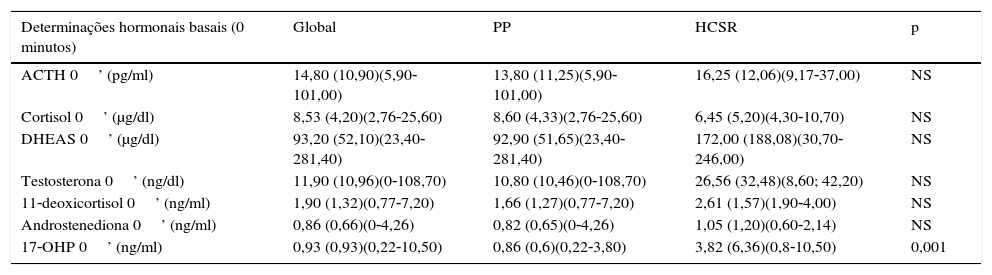
Não se encontraram diferenças estatisticamente significativas entre os doentes com HCSR‐NC e PPI quanto aos doseamentos basais de ACTH, cortisol e androgénios da suprarrenal. No entanto, os valores basais de DHEAS, testosterona e androstenediona foram mais elevados no grupo da HCSR‐NC (tabela 2).
Doseamentos basais de ACTH, cortisol e androgénios da suprarrenal
| Determinações hormonais basais (0 minutos) | Global | PP | HCSR | p |
|---|---|---|---|---|
| ACTH 0’ (pg/ml) | 14,80 (10,90)(5,90‐101,00) | 13,80 (11,25)(5,90‐101,00) | 16,25 (12,06)(9,17‐37,00) | NS |
| Cortisol 0’ (μg/dl) | 8,53 (4,20)(2,76‐25,60) | 8,60 (4,33)(2,76‐25,60) | 6,45 (5,20)(4,30‐10,70) | NS |
| DHEAS 0’ (μg/dl) | 93,20 (52,10)(23,40‐281,40) | 92,90 (51,65)(23,40‐281,40) | 172,00 (188,08)(30,70‐246,00) | NS |
| Testosterona 0’ (ng/dl) | 11,90 (10,96)(0‐108,70) | 10,80 (10,46)(0‐108,70) | 26,56 (32,48)(8,60; 42,20) | NS |
| 11‐deoxicortisol 0’ (ng/ml) | 1,90 (1,32)(0,77‐7,20) | 1,66 (1,27)(0,77‐7,20) | 2,61 (1,57)(1,90‐4,00) | NS |
| Androstenediona 0’ (ng/ml) | 0,86 (0,66)(0‐4,26) | 0,82 (0,65)(0‐4,26) | 1,05 (1,20)(0,60‐2,14) | NS |
| 17‐OHP 0’ (ng/ml) | 0,93 (0,93)(0,22‐10,50) | 0,86 (0,6)(0,22‐3,80) | 3,82 (6,36)(0,8‐10,50) | 0,001 |
*Mediana (amplitude interquartis) (mínimo‐máximo); NS: não significativo.
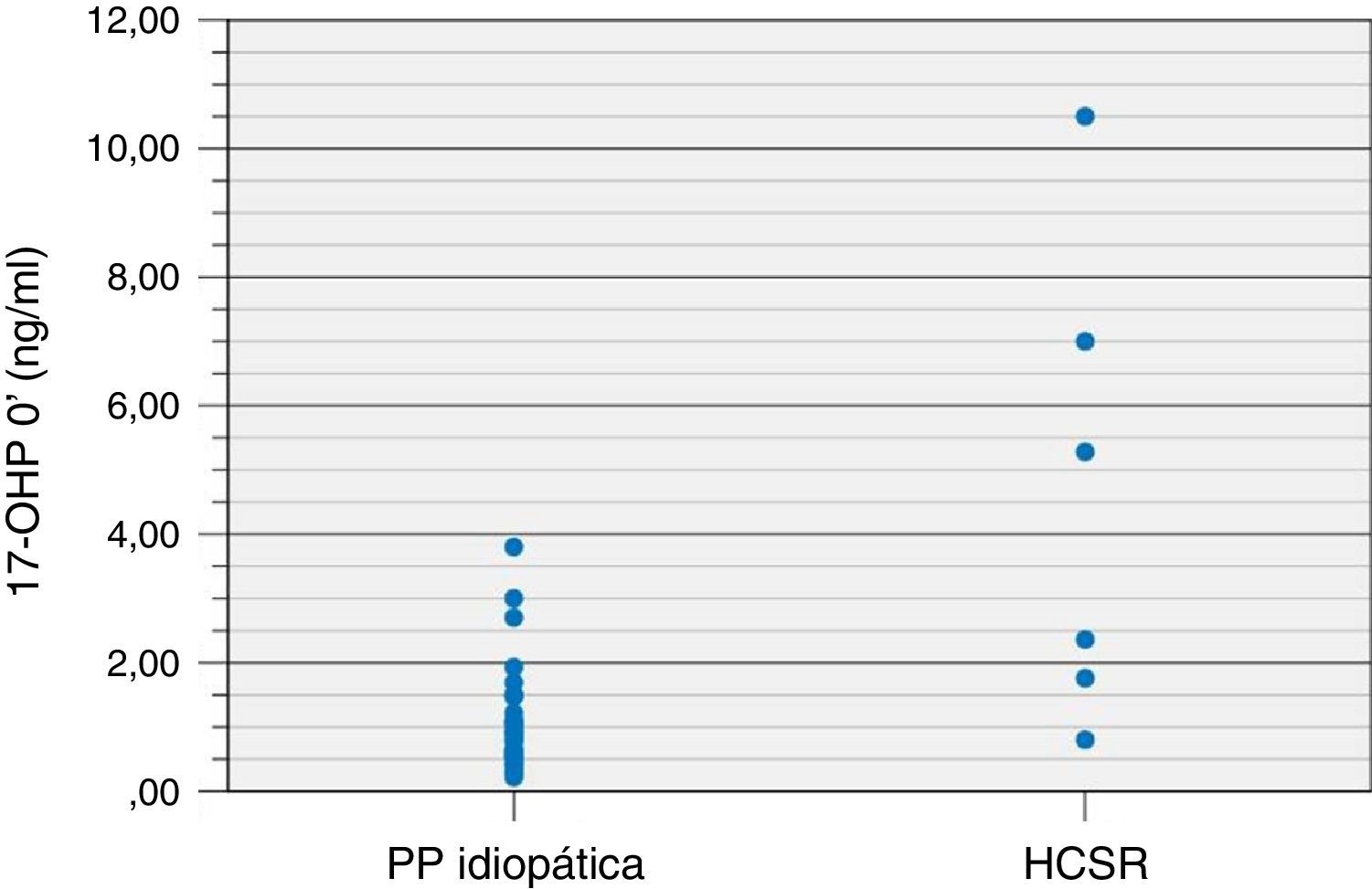
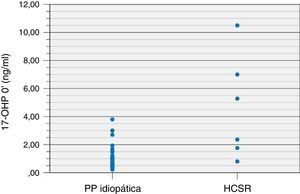
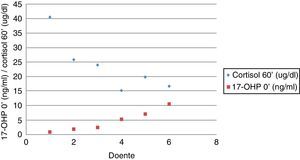
Nos doentes com PPI, o valor basal de 17‐OHP variou entre 0,22‐3,80ng/ml e nos doentes com HCSR‐NC entre 0,80‐10,50ng/ml. Neste subgrupo de doentes, 2 (33,3%) apresentaram valor de 17‐OHP basal inferior a 2,0ng/ml. Apesar de o valor basal de 17‐OHP do grupo da HCSR‐NC ter sido significativamente superior ao do grupo com PPI (p=0,001), não se encontrou um valor de 17‐OHP que distinguisse, com certeza, os 2 grupos.
A figura 1 mostra a distribuição do valor de 17‐OHP basal nos doentes com PPI e HCSR‐NC (fig. 1).
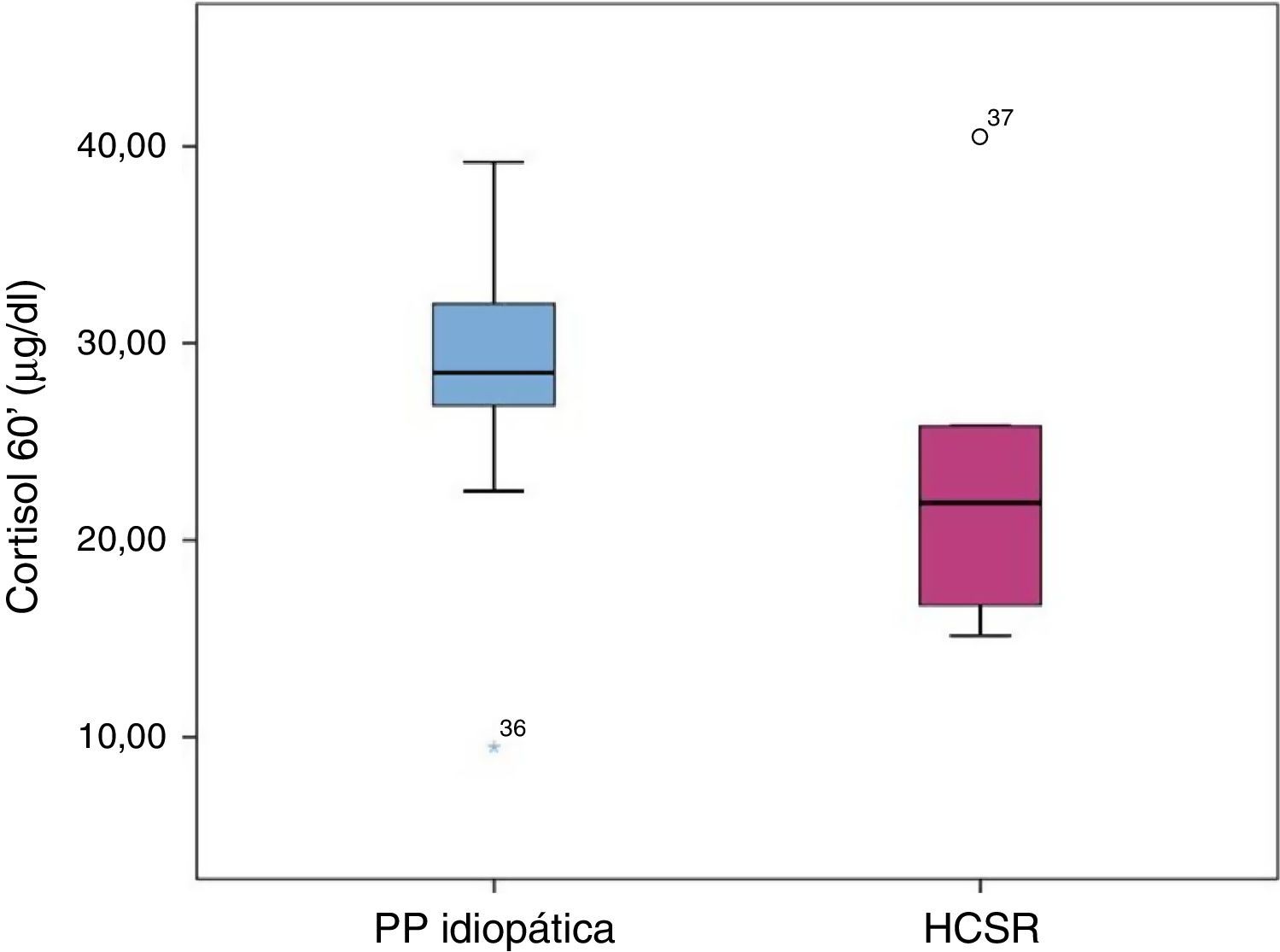
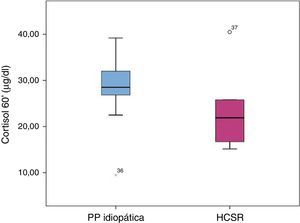
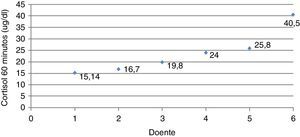
Avaliação da reserva adrenal nos doentes com hiperplasia congénita da suprarrenal forma não clássicaSessenta minutos após estimulação com ACTH verificou‐se que os doentes com HCSRC apresentaram valores de cortisol significativamente inferiores aos dos doentes com PPI (HCSR‐NC: 23,66±9,21μg/d [15,14‐40,50] vs. PPI: 29,28±5,37μg/dl [9,49‐39,2]) (p=0,028) (fig. 2).
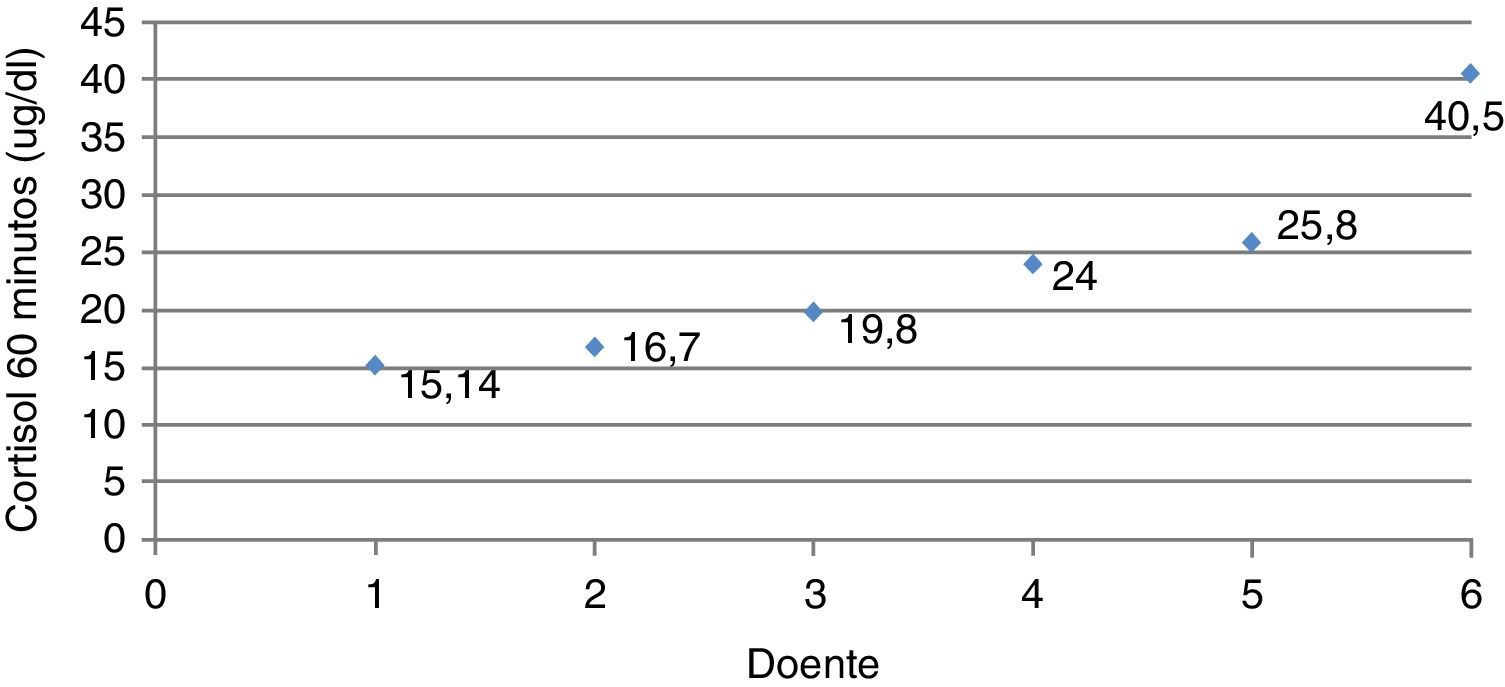
Analisando os doentes com HCSR‐NC individualmente, verificou‐se que 4 (66,7%) tiveram valores de cortisol aos 60 minutos superiores a 18μg/dl, mas os restantes 2 (33,3%) tiveram uma resposta subótima da secreção de cortisol em situação de stress induzido. A figura 3 mostra os valores de cortisol após estimulação dos doentes com HCSR‐NC.
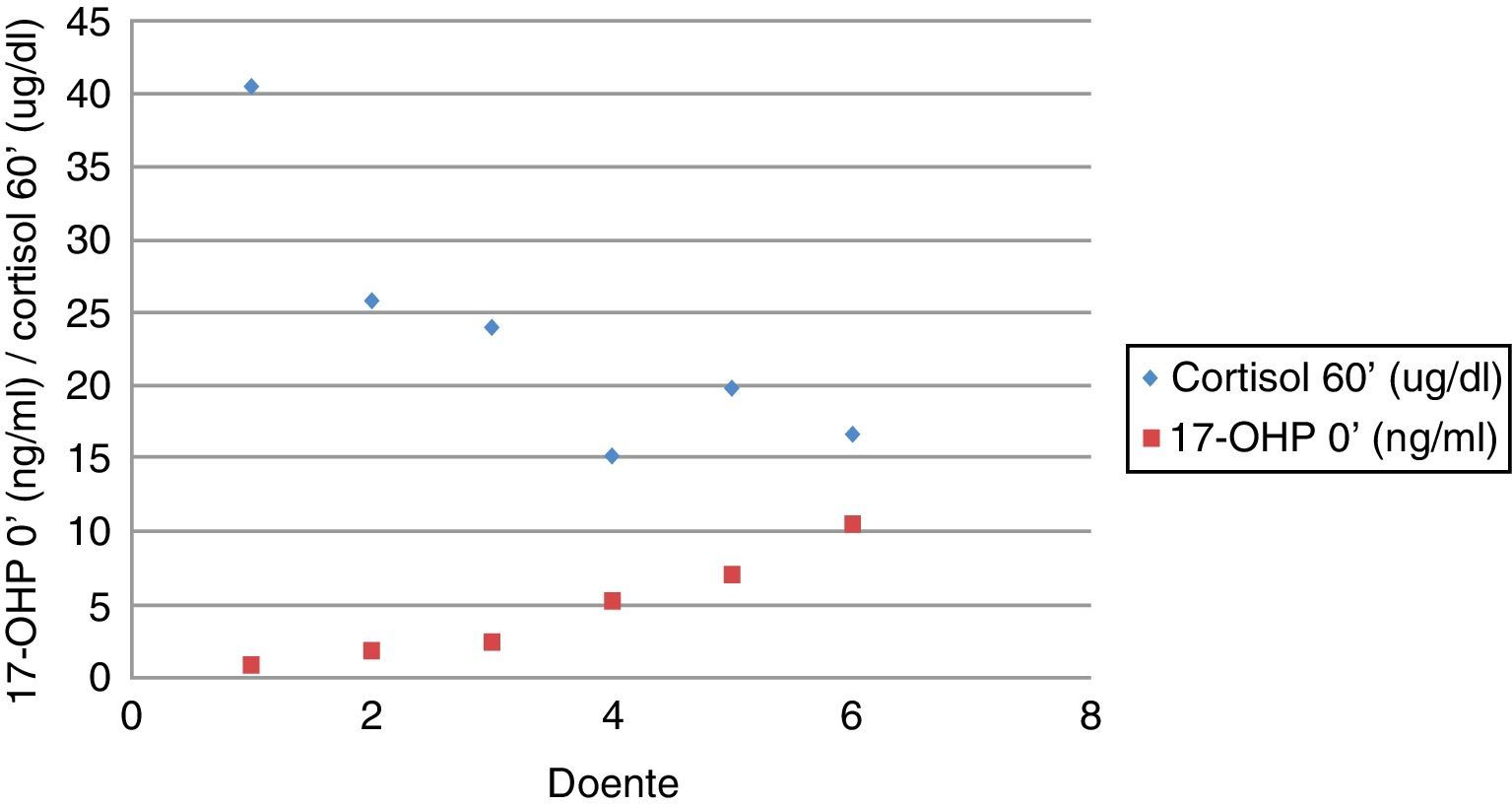
Se se analisar o valor basal de 17‐OHP e de cortisol aos 60 minutos nos doentes com HCSR, verifica‐se que os doentes com valor mais elevado de 17‐OHP basal foram os que tiveram um valor mais baixo de cortisol aos 60 minutos da prova de Synacthen, traduzindo uma menor atividade enzimática (correlação de Pearson: r=‐0,431; p=0,004) (fig. 4), o que não se verificou nos doentes com PPI (correlação de Pearson: r=0,091; p=0,591).
DiscussãoNesta série, dos 43 doentes com PP estudados com prova de Synacthen, 6 (14%) tinham HCSR‐NC. Pensamos que esta é a primeira série publicada em Portugal analisando os resultados da prova de Synacthen em crianças com PP. A maior série de doentes com PP e com prova de Synacthen foi publicada em 2009 e incluiu 238 crianças, das quais 10 (4%) tinham critérios de HCSR‐NC na prova de Synacthen10. A nossa amostra não representa todo o universo de doentes observados por PP, mas apenas os que fizeram prova de Synacthen.
Não foi possível distinguir os doentes com e sem HCSR‐NC com base nas suas características clínicas iniciais, nomeadamente idade de aparecimento da pubarca, distribuição por sexos, IMC, estádio pubertário inicial relativo a pelo púbico e axilar, presença de sinais de hiperandrogenismo como acne e hirsutismo e avanço da IO. Apenas a clitoromegalia foi diferente, com um único caso nos doentes com HCSR‐NC. Estes achados estão de acordo com a maioria dos estudos descritos. No referido estudo francês10 retrospetivo com 238 crianças com PP, das quais 10 (4%) tinham HCSR‐NC, também não foram encontradas diferenças estatisticamente significativas entre os 2 grupos quanto a idade da pubarca, altura, peso, estádio PP e não foi encontrada associação significativa entre diagnóstico de HCSR‐NC e sexo masculino, idade pubarca ≤6 anos, peso >2SD, altura >2SD e PP >2 na primeira consulta. Nesse estudo, apenas o IMC>P97 mostrou tendência para significância estatística na associação com HCSR‐NC10. Torok9, num trabalho retrospetivo de 287 crianças com virilização peripubertal, que realizaram prova de Synacthen, não encontrou nenhuma característica clínica específica dos doentes com HCSR‐NC9. Escobar‐Morreale12, num estudo com 270 mulheres com hiperandrogenismo, das quais 6 (2,2%) tinham HCSR‐NC, também não encontrou diferenças clínicas significativas entre as mulheres com e sem HCSR‐NC12.
Apesar de estar descrito que as crianças com PP e HCSR têm, geralmente, avanço IO >2,0SD relativamente às crianças com adrenarca precoce idiopática e de terem sido descritos aumento da velocidade de crescimento (VC) e avanço da IO nas crianças com HCSR‐NC, com risco de puberdade precoce central, encerramento das epífises e baixa estatura final, a evidência existente quanto ao compromisso da estatura final na HCSR‐NC não é consensual2–4.
Um achado inexplicado é a diferença encontrada na idade na primeira consulta pois, ao contrário do esperado, esta foi significativamente maior no grupo da HCSR‐NC.
Neste trabalho, verificou‐se que os doentes com HCSR‐NC apresentavam valores basais de 17‐OHP, androstenediona, DHEAS e testosterona mais elevados, mas apenas encontrámos significância estatística no valor de 17‐OHP, provavelmente pelo número reduzido de doentes. Estes dados estão de acordo com a literatura, nomeadamente no que se refere à testosterona e androstenediona, que parecem ser os androgénios mais frequentemente elevados na HCSR, depois da 17‐OHP3,8,10. No já citado estudo francês10 com 238 doentes com PP, dos quais 10 (4%) tinham HCSR‐NC, também foram encontrados valores basais significativamente mais elevados de 17‐OHP, androstenediona, testosterona no grupo de doentes com HCSR‐NC. Foi ainda determinado o valor preditivo do valor absoluto de testosterona e androstenediona no diagnóstico de HCSR‐NC e concluiu‐se que androstenediona basal superior a 0,95ng/ml e testosterona basal superior a 0,15ng/ml estavam significativamente associadas ao diagnóstico de HCSR‐NC, mas que o seu valor preditivo era inferior ao da 17‐OHP basal10. Num outro estudo com 287 crianças com virilização peripubertal9, a DHEA basal mostrou‐se significativamente mais elevada nos doentes com HCSR‐NC do que nos doentes sem HCSR‐NC. A testosterona foi significativamente superior nos doentes com HCSR‐NC, mas também estava elevada em alguns doentes sem HCSR‐NC. Dez em 21 doentes com HCSR‐NC tinham testosterona normal, o que também já foi descrito noutros artigos9. Um terceiro trabalho15 com 24 mulheres adultas com HCSR‐NC e 37 sem HCSR‐NC mostrou diferenças significativas entre os 2 grupos quanto aos níveis basais e após estimulação de androgénios, nomeadamente DHEA, Δ4‐androstenediona e testosterona basal (total e livre)15. Vários outros estudos mostraram que os valores de 17‐OHP estão significativamente aumentados na HCSR‐NC5,12.
Nestes doentes, a realização da prova de Synacthen foi importante para o diagnóstico de HCSR‐NC, nomeadamente por ter havido sobreposição entre os valores basais de 17‐OHP nos 2 grupos. Dois doentes com HCSR‐NC apresentavam valor basal de 17‐OHP <2ng/ml, sendo mesmo num caso inferior a 1ng/ml.
De acordo com as guidelines da Endocrine Society de 201013, na população em geral, um valor basal de 17‐OHP matinal entre 2,0‐100,0ng/ml traduz provavelmente a presença de HCSR‐NC e um valor inferior a 2,0ng/ml traduz provavelmente a ausência de HCSR. No entanto, é admitido que a sensibilidade deste limiar é de cerca de 90%, podendo um valor inferior a 2ng/ml pertencer a um doente com HCSR‐NC13. Num estudo de Armengaud et al.10, um valor basal de 17‐OHP 0′ >2ng/ml em crianças com PP teve sensibilidade de 100 e 99% de especificidade para prever existência de HCSR‐NC10. Torok et al.9, num estudo retrospetivo de 287 crianças com virilização peripubertal, encontraram 4 doentes com PP e HCSR‐NC. Neste subgrupo, a 17‐OHP basal média foi de 10,7ng/ml, variando entre 3,5‐18,3ng/ml. Em 4 doentes com PPI, a 17‐OHP basal média foi de 3,5ng/ml e variou entre 1,9‐5,7ng/ml. Abaixo de 3,5ng/ml, nenhum doente tinha HCSR‐NC, acima de 20ng/ml, todos os doentes tinham HCSR. Estes autores propuseram o cut‐off de 3,5ng/ml para diagnóstico de HCSR‐NC, apesar de se ter verificado sobreposição entre doentes com e sem HCSR‐NC entre 3,5‐20ng/ml. Os autores deixaram, contudo, a ressalva de que, em alguns casos, investigação adicional (como a prova de Synacthen) é necessária9. Num outro estudo multicêntrico internacional11 com 220 doentes do sexo feminino com HCSR‐NC, apenas 21 (10%) tiveram valor de 17‐OHP basal <2ng/ml, não tendo sido encontradas diferenças na proporção de doentes entre os diferentes grupos etários. Este estudo incluiu 25 crianças com HCSR‐NC, nas quais a 17‐OHP basal mediana foi de 18,8ng/ml, mas variou entre 0,2‐108,3ng/ml, sendo que 2 das 25 crianças (8,0%) tinham valor inferior a 2,0ng/ml. Este estudo incluiu também adolescentes do sexo feminino, nas quais a 17‐OHP basal mediana foi de 30,3ng/ml, tendo variado entre 3,3‐445,7ng/ml. Nas adolescentes o valor encontrado foi mais elevado, assim como os níveis dos restantes androgénios, provavelmente devido à puberdade11. Na população pediátrica há outros autores que defendem um nível basal de 17‐OHP basal superior a 0,82ng/ml como fortemente sugestivo do diagnóstico de HCSR‐NC2. Ghizzoni et al.16 realizaram um estudo italiano que incluiu 152 crianças com PP, das quais 55 tinham HCSR‐NC. Quatro crianças (7,3%) com PP e HCSR‐NC apresentaram valor de 17‐OHP basal <2,0ng/ml. Nesta população de crianças com PP o valor de 2,0ng/ml teve uma sensibilidade de 92,7% e especificidade de 82,1% para detetar HCSR‐NC em doentes com PP. O cut‐off de 17‐OHP basal mais sensível e específico para diagnosticar HCSR‐NC foi 2,82ng/ml. O cut‐off de 0,89ng/ml conseguiu identificar 100% das crianças com HCSR‐NC, mas com perda significativa de especificidade16. Estes autores defendem que o valor basal de 17‐OHP não é útil no diagnóstico de HCSR‐NC em crianças com PP e que a exclusão deste diagnóstico só é feita através da realização da prova de Synacthen16. Conclui‐se, portanto, que não há consenso quanto ao limiar de 17‐OHP basal a usar em doentes em idade pediátrica e se a prova de Synacthen deve ou não ser realizada em todos os doentes com suspeita de PP. A Endocrine Society defende que deve ser feito um perfil hormonal completo com prova de Synachten para diagnóstico em casos borderline13.
Por fim, a avaliação da reserva adrenal de cortisol aos 60 minutos revelou secreção significativamente menor nos doentes com HCSR‐NC, tendo 2 destes doentes (1/3) resposta de cortisol subótima após estimulação. No estudo de Torok et al.9 a secreção de cortisol aos 60 minutos foi significativamente inferior nos doentes com HCSR‐NC (média 12,8μg/dl [6–22]) relativamente aos doentes sem HCSR‐NC (média 20,5μg/dl [6–73]) (p<0,0001). Dois terços dos doentes com HCSR‐NC tiveram valores >12μg/dl e 3 doentes entre 6‐9,6μg/dl, o que demonstra que doentes com HCSR‐NC podem não ter secreção apropriada de cortisol em situações de stress.9 Também Ghizzoni et al.16 demonstram uma secreção de cortisol significativamente inferior nos doentes com HCSR‐NC comparativamente a doentes heterozigóticos ou com PPI. Neste estudo o valor médio de cortisol após estimulação nos doentes com HCSR‐NC foi de 22,03±7,63μg/dl e 28% dos doentes com HCSR‐NC tiveram valores de cortisol após estimulação <18,12μg/dl16. Estes autores defendem que nos doentes com HCSR‐NC e resposta subótima de secreção de cortisol após estimulação deve ser considerado o tratamento com glucocorticoides em situações de stress16.
Verma et al.17, num estudo com 8 doentes com HCSR‐NC que fizeram prova de Synacthen, encontraram 5 doentes com resposta subótima após estimulação (cortisol aos 60 minutos <18‐20μg/dl). Destes 8 doentes, 2 tinham tido PP e em ambos a resposta de cortisol aos 60 minutos foi subótima. A maioria dos doentes com HCSR‐NC deste estudo mostrou diminuição ligeira na secreção de cortisol, corroborando a possibilidade de alguns doentes com HCSR‐NC não terem resposta normal de cortisol ao exercício ou outros fatores de stress. Estes autores ressalvam que o défice de cortisol ligeiro poderá ou não ser clinicamente relevante, mas que alguns estudos recentes apontam para que estes distúrbios hormonais ligeiros possam ter implicações clínicas subtis17.
Huerta et al.15, num estudo de 24 doentes com HCSR‐NC e doentes sem HCSR‐NC (mulheres saudáveis, sem hirsutismo), não encontraram diferenças estatisticamente significativas entre os 2 grupos quanto à secreção basal e estimulada de cortisol, mas a secreção mediana de cortisol estimulada foi menor nas doentes com HCSR‐NC. Esta ausência de diferenças significativas poder‐se‐á dever ao facto de os doentes ainda terem atividade da enzima 21‐hidroxilase, mas admite que é pouco provável que esta justificação seja a única para a secreção normal de cortisol nestes doentes15. Num outro estudo12 com mulheres com hiperandrogenismo que incluiu 6 com HCSR‐NC, o cortisol basal e após estimulação não foi significativamente diferente entre as doentes com HCSR‐NC e o grupo controlo12.
ConclusãoA PP é um motivo frequente de consulta na endocrinologia pediátrica. O diagnóstico precoce e definitivo de HCSR‐NC através da realização da prova de Synacthen permite identificar as crianças em que a PP é o primeiro sinal de um processo patológico de virilização e programar um seguimento mais intensivo, na tentativa de antecipar o aparecimento das consequências da HCSR‐NC no desenvolvimento pubertário e crescimento. Nas crianças com PPI, a realização da prova de Synacthen permite tranquilizar o clínico e os pais e programar um seguimento menos intensivo, uma vez que não são esperadas consequências clínicas importantes. Este trabalho contribui, assim, para reafirmar que a prova de Synacthen é o método de diagnóstico diferencial preferencial, pois o valor basal de 17‐OHP basal não permite, por vezes, essa distinção clara. Demonstra‐se, ainda, a importância da prova na determinação da reserva adrenal e a sua utilidade na estratificação dos doentes e antecipação das suas necessidades de tratamento em situações de stress.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.