A disfunção tiroideia provocada pelos inibidores de tirosina-cinase (ITC) é um importante efeito adverso desta classe farmacológica. Com o objetivo de avaliar a prevalência de hipotiroidismo nos doentes tratados com ITC entre 2003-2012 na nossa instituição, foi efetuada uma revisão dos processos clínicos destes doentes. Foram avaliados 107 doentes, 56% do sexo masculino. Em 27 doentes foi utilizado erlotinib, em 30 imatinib, em 17 sunitinib, em 15 lapatinib, em 7 sorafenib, em um gefitinib e em 10 doentes mais de um ITC (8 imatinib + sunitinib, um sunitinib + sorafenib, um imatinib + dasatinib). Dos 107 doentes, 59 (55%) efetuaram estudo da função tiroideia, nos quais foi documentado hipotiroidismo em 35,6% (21 doentes). O hipotiroidismo foi observado após um tempo médio (±DP) de tratamento de 9,3±5,8 meses. Foi iniciada terapêutica com levotiroxina em 11 doentes. Foi detetado hipotiroidismo em 57, 46 e 17% dos doentes tratados com sunitinib, lapatinib e sorafenib, respetivamente. Dos doentes tratados com mais de um ITC, 75% apresentaram hipotiroidismo, sendo que em todos estes casos de hipotiroidismo um dos ITC era o sunitinib. Dos doentes sob erlotinib, imatinib ou gefitinib, em monoterapia que fizeram doseamento de hormonas tiroideias, nenhum apresentou hipotiroidismo. Este estudo apresenta como limitação um baixo número de doentes em cada subgrupo, no entanto, o hipotiroidismo parece ser mais frequente em doentes sob sunitinib e lapatinib. Atendendo à elevada prevalência de hipotiroidismo em doentes medicados com ITC será aconselhável efetuar o doseamento de hormonas tiroideias antes e durante o tratamento de forma periódica.
Thyroid dysfunction is an important adverse effect of tyrosine kinase inhibitors (TKI). To assess the prevalence of hypothyroidism in patients treated with TKI at our institution between 2003 and 2012, we reviewed their clinical records. One hundred and seven patients were evaluated, 56% male. Erlotinib was used in 27 patients, imatinib in 30, sunitinib in 17, lapatinib in 15, sorafenib in 7, gefitinib in 1 and more than one TKI in 10 patient (8 imatinib+sunitinib, 1 sunitinib+sorafenib, 1 imatinib+dasatinib). Of 107 patients, 59 (55%) performed thyroid function evaluation, in which hypothyroidism was documented in 35.6% (21 patients). Hypothyroidism was detected after a mean (±SD) time of 9.3±5.8 months of therapy. Levothyroxine was initiated in 11 patients. Hypothyroidism occurred in 57%, 46% e 17% of the patients treated with sunitinib, lapatinib and sorafenib, respectively. Seventy five percent of the patients treated with more than one TKI presented hypothyroidism and in all cases one of TKI was sunitinib. Of the patients receiving erlotinib, imatinib or gefitinib monotherapy that underwent thyroid function evaluation, none had hypothyroidism. The main limitation of the study is the low number of patients in each subgroup, however hypothyroidism seems to be more prevalent in patients on sunitinib or lapatinib. With the high prevalence of hypothyroidism in patients under TKI it is recommended to perform thyroid function assessment before and periodically during the treatment.
Os inibidores da tirosina-cinase (ITC) têm apresentado uma franca expansão nos últimos anos, uma vez que demonstraram eficácia em vários tipos de cancros. O primeiro caso de hipotiroidismo induzido por ITC foi descrito em 20051. Hoje sabe-se que a disfunção tiroideia é um importante efeito adverso desta classe farmacológica, sendo mais evidente com o sunitinib, mas está também documentada, ainda que em menor grau, com outros ITC como sorafenib, imatinib e vandetinib2,3. Existe um caso clínico de exacerbação do hipotiroidismo num doente sob erlotinib4. Não existem casos de hipotiroidismo induzido pelo lapatinib descritos na literatura.
Está descrito que o sunitinib pode induzir hipotiroidismo em 53-85% dos casos em estudos retrospetivos e em 36-71% em estudos prospetivos2,3,5,6. O sorafenib foi considerado indutor de hipotiroidismo em 18% dos doentes sob este fármaco por carcinoma de células renais metastizado7. Está também descrito agravamento do hipotiroidismo em doentes previamente tratados com levotiroxina que iniciaram imatinib1,3. Alguns estudos associaram o hipotiroidismo subclínico induzido pelo sunitinib ou sorafenib como um marcador de boa resposta ao tratamento no carcinoma de células renais metastizado, o que poderá sugerir que o desenvolvimento de hipotiroidismo reflete maior suscetibilidade farmacocinética ao ITC por parte do doente2,8,9.
Os sintomas de hipotiroidismo como astenia, anorexia, intolerância ao frio podem reduzir a qualidade de vida dos doentes, sendo a fadiga o mais frequentemente descrito. Este tipo de sintomatologia é inespecífica, podendo ser consequência do hipotiroidismo, do próprio tratamento com este tipo de quimioterapia ou da doença oncológica em si.
Os mecanismos através dos quais os ITC induzem hipotiroidismo não estão totalmente esclarecidos e são controversos, sendo necessários mais estudos2,10. A maioria dos estudos incide sobre o sunitinib. Foi especulado que o hipotiroidismo induzido pelo sunitinib poderá ser provocado por: atrofia das células tiroideias induzida pelo fármaco por inibição da vascularização (bloqueio do VEGFR)11,12; tiroidite induzida pelo fármaco10,12,13 com atrofia tiroideia documentada ecograficamente em alguns estudos14; diminuição da síntese de hormonas tiroideias por interferência com a atividade da tiroperoxidade (TPO) tendo sido demonstrado in vitro que o sunitinib tem 25% da atividade anti-TPO do propiltiouracilo2,15; diminuição da reserva funcional da tiroide por inibição da captação de iodo por interferência no simportador sódio-iodo16; alteração do gene RET2. Em vários estudos foi observada uma supressão transitória da TSH (Thyroid Stimulating Hormone) antes do hipotiroidismo em doentes sob sunitinib, sugerindo um processo de tiroidite na génese do hipotiroidismo10,13,17. Uma revisão recente propôs que o mecanismo de indução de hipotiroidismo do sunitinib é a redução da angiogénese através da inibição da via de sinalização VEGFR (que também poderá explicar a atrofia tiroideia e a tireotoxicose transitória prévia ao hipotiroidismo) e coloca como principal hipótese para explicar o facto de o sunitinib provocar hipotiroidismo com maior frequência que outros ITC anti-VEGFR o facto de apresentar maior afinidade para o VEGFR1 e PDGFR3. O sorafenib, tal como o sunitinib, inibe as vias de sinalização do VEGFR e PDGFR, causando também inibição da vascularização a nível do tecido tiroideu, provocando hipotiroidismo. Os mecanismos pelos quais o imatinib provoca hipotiroidismo não estão definidos2.
O objetivo do presente estudo foi avaliar a prevalência de hipotiroidismo num grupo de doentes submetidos a terapêutica com ITC.
MétodosForam revistos os processos clínicos dos doentes tratados com inibidores da tirosina-cinase entre 2003-2012 no Instituto Português de Oncologia de Coimbra. Foi solicitado o doseamento de hormonas tiroideias aos doentes que atualmente ainda se encontravam a efetuar terapêutica com ITC. Foram avaliados os seguintes parâmetros: sexo, patologia oncológica, ITC utilizado, valores de TSH e de T4 livre, dose de levotiroxina. O doseamento de TSH foi efetuado por imunoquimioluminescência (Immulite 2000, Siemens Healthcare Diagnostics®) com valores de referência entre 0,4-4,0μUI/mL e a T4 livre foi doseada por electroquimioluminescência (Cobas e411, Roche Diagnostics®) com valores de referência entre 0,8-1,8ng/dL. Foi efetuada uma análise descritiva dos dados e foi utilizado o teste exato de Fisher (GraphPad Prism 6®).
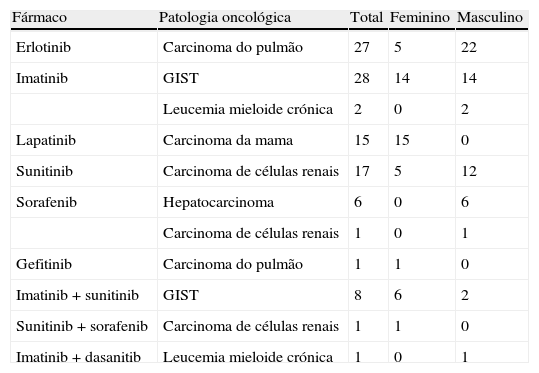
ResultadosForam avaliados 107 doentes, 47 do sexo feminino (44%) e 60 do sexo masculino (56%). Em 27 doentes foi utilizado erlotinib, em 30 imatinib, em 17 sunitinib, em 15 lapatinib, em 7 sorafenib, em um gefitinib e em 10 doentes mais de um ITC de forma não simultânea (8 imatinib e sunitinib, um sunitinib e sorafenib, um imatinib e dasatinib). Dezoito porcento dos doentes apresentavam carcinoma de células renais, 14% carcinoma da mama, 26% carcinoma do pulmão, 27% GIST (Gastrointestinal stromal tumors), 9% leucemia mieloide crónica e 6% hepatocarcinoma (tabela 1).
Patologia oncológica e inibidor da tirosina-cinase utilizado nos 107 doentes
| Fármaco | Patologia oncológica | Total | Feminino | Masculino |
| Erlotinib | Carcinoma do pulmão | 27 | 5 | 22 |
| Imatinib | GIST | 28 | 14 | 14 |
| Leucemia mieloide crónica | 2 | 0 | 2 | |
| Lapatinib | Carcinoma da mama | 15 | 15 | 0 |
| Sunitinib | Carcinoma de células renais | 17 | 5 | 12 |
| Sorafenib | Hepatocarcinoma | 6 | 0 | 6 |
| Carcinoma de células renais | 1 | 0 | 1 | |
| Gefitinib | Carcinoma do pulmão | 1 | 1 | 0 |
| Imatinib + sunitinib | GIST | 8 | 6 | 2 |
| Sunitinib + sorafenib | Carcinoma de células renais | 1 | 1 | 0 |
| Imatinib + dasanitib | Leucemia mieloide crónica | 1 | 0 | 1 |
GIST: gastrointestinal stromal tumor.
A maioria dos doentes (76%) não efetuou estudo da função tiroideia antes de iniciar terapêutica com ITC, 23% apresentavam eutiroidismo e 1% hipotiroidismo.
Dos 107 doentes, 59 (55%) efetuaram estudo da função tiroideia após iniciar tratamento com ITC, nos quais foi documentado hipotiroidismo em 35,6% (21 doentes), hipertiroidismo em 1,7% (um doente) e eutiroidia em 62,7% (37 doentes). Relativamente ao caso de hipertiroidismo, tratava-se de uma situação subclínica detetada 4 meses após a doente ter iniciado lapatinib, tendo-se verificado resolução espontânea para eutiroidia cerca de 3 meses depois. Dos doentes com hipotiroidismo, 52% (11 doentes) apresentavam hipotiroidismo clínico, 24% (5 doentes) hipotiroidismo subclínico com TSH superior a 10μUI/mL e 24% (5 doentes) hipotiroidismo subclínico com TSH inferior a 10μUI/mL. O hipotiroidismo foi observado após um tempo médio (±DP) de tratamento de 9,3±5,8 meses, com mínimo de 2 e máximo de 23 meses. No momento do diagnóstico de hipotiroidismo, a TSH mediana era de 15,4μUI/mL, sendo o mínimo 4,7 e o máximo 304μUI/mL.
Foi iniciada terapêutica com levotiroxina em 11 doentes, dos quais 2 estavam sob lapatinib, 4 sob sunitinib e 5 sob mais de um ITC, sendo o sunitinib um dos fármacos em todos eles.
A percentagem de hipotiroidismos foi de 26,7% (8/30) e de 44,8% (13/29) nos doentes do sexo masculino e feminino, respetivamente. Esta diferença não se revelou estatisticamente significativa (p=0,180, teste exato de Fisher).
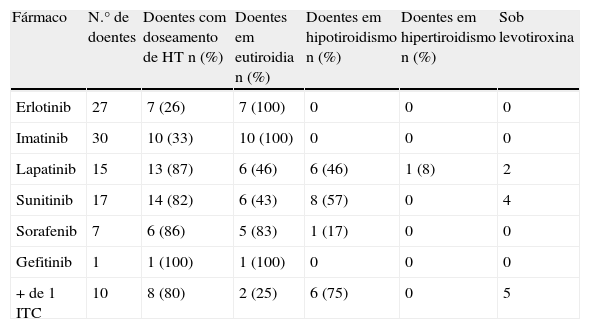
Na tabela 2 estão em evidência os principais resultados do presente estudo. Em todos os doentes sob erlotinib, imatinib ou gefitinib em que foi efetuado o doseamento de hormonas tiroideias foi observado eutiroidismo. Dos 15 doentes sob lapatinib, foi estudada a função tiroideia em 13, dos quais 6 doentes (46%) apresentavam eutiroidia, 6 doentes (46%) hipotiroidismo e um doente (8%) hipertiroidismo. Dos 17 doentes sob sunitinib, 14 efetuaram doseamento de hormonas tiroideias, tendo sido observado eutiroidia em 6 doentes (43%) e hipotiroidismo em 8 (57%). Dos 7 doentes sob sorafenib, em 6 foi avaliada a função tiroideia, tendo sido documentado eutiroidismo em 5 doentes (83%) e hipotiroidismo num doente (17%). Dos 10 casos que efetuaram mais de um ITC, em 8 foi efetuado o doseamento de TSH e T4 livre, tendo-se constatado que 2 doentes apresentavam eutiroidia (25%) e os restantes hipotiroidismo (75%), sendo de salientar que em todos estes o sunitinib era um dos ITC.
Avaliação da função tiroideia dos doentes sob inibidores da tirosina-cinase
| Fármaco | N.° de doentes | Doentes com doseamento de HT n (%) | Doentes em eutiroidia n (%) | Doentes em hipotiroidismo n (%) | Doentes em hipertiroidismo n (%) | Sob levotiroxina |
| Erlotinib | 27 | 7 (26) | 7 (100) | 0 | 0 | 0 |
| Imatinib | 30 | 10 (33) | 10 (100) | 0 | 0 | 0 |
| Lapatinib | 15 | 13 (87) | 6 (46) | 6 (46) | 1 (8) | 2 |
| Sunitinib | 17 | 14 (82) | 6 (43) | 8 (57) | 0 | 4 |
| Sorafenib | 7 | 6 (86) | 5 (83) | 1 (17) | 0 | 0 |
| Gefitinib | 1 | 1 (100) | 1 (100) | 0 | 0 | 0 |
| + de 1 ITC | 10 | 8 (80) | 2 (25) | 6 (75) | 0 | 5 |
HT: hormonas tiroideias; n: número de indivíduos.
A prevalência de hipotiroidismo nos doentes em que foi estudada a função tiroideia foi de 35,6% (21 doentes), dos quais 11 casos eram de hipotiroidismo clínico. É de salientar que um grande número de doentes não efetuou estudo da função tiroideia (45%), o que constitui uma limitação do estudo uma vez que não se conhece a situação em termos de função tiroideia destes indivíduos. Foi detetado hipotiroidismo em 57, 46 e 17% dos doentes tratados com sunitinib, lapatinib e sorafenib, respetivamente. Dos doentes tratados com mais de um ITC, 75% apresentavam hipotiroidismo, sendo que em todos estes casos de hipotiroidismo um dos ITC era o sunitinib. Estes resultados estão de acordo com a literatura18, exceto no que diz respeito ao lapatinib em que existe pouca bibliografia. Dos doentes sob erlotinib, imatinib ou gefitinib, em monoterapia, que fizeram doseamento de hormonas tiroideias, nenhum apresentou hipotiroidismo.
Nove dos 11 doentes que tiveram necessidade de efetuar terapêutica com levotiroxina faziam ciclos de sunitinib, tendo sido mais difícil ajustar a dose substitutiva de hormona tiroideia. A posologia habitual do sunitinib consiste em 50mg por via oral durante 28 dias (fase On), seguidos de 14 dias de descanso (fase Off). Está descrito que a probabilidade de elevação da TSH aumenta ao longo dos dias de tratamento e a cada novo ciclo, conduzindo por vezes a um hipotiroidismo intermitente13. A prolongada semivida plasmática da levotiroxina não permite ajustamentos rápidos do tratamento substitutivo, daí a dificuldade do tratamento do hipotiroidismo induzido pelo sunitinib.
O tratamento do hipotiroidismo induzido pelos ITC é a levotiroxina e este efeito lateral não justifica a redução da dose ou a suspensão do ITC18. No que diz respeito aos hipotiroidismos subclínicos (TSH entre 4-10μUI/mL), a abordagem e a decisão de efetuar eventual tratamento com levotiroxina devem ser individualizadas2,18. Apesar de alguns autores descreverem que o hipotiroidismo seria um fator de bom prognóstico nos doentes com carcinoma das células renais metastizado, o tratamento com levotiroxina não influencia a sobrevida destes doentes2.
Este estudo apresenta como limitação um baixo número de doentes em cada subgrupo, no entanto, o hipotiroidismo parece ser mais frequente em doentes sob sunitinib e lapatinib.
ConclusãoAtendendo à elevada prevalência de hipotiroidismo em doentes medicados com ITC, será aconselhável efetuar o doseamento de hormonas tiroideias antes e durante o tratamento de forma periódica. Serão necessários mais estudos para melhor caracterizar e compreender os mecanismos deste tipo de hipotiroidismo primário e para avaliar qual a melhor estratégia no tratamento substitutivo com levotiroxina, especialmente no caso do sunitinib. Uma colaboração estreita entre oncologistas e endocrinologistas poderá ajudar a melhorar a qualidade de vida destes doentes.
Conflito de interessesOs autores declaram não haver conflito de interesses.