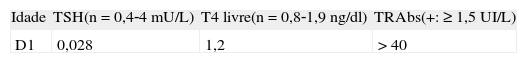A doença de Graves é a causa mais comum de hipertiroidismo na mulher em idade fértil e carateriza‐se pela presença de imunoglobulinas séricas que estimulam os recetores da tirotropina (TRAb) e que podem atravessar a placenta. Quando mal controlada tem consequências graves, causando quer hipertiroidismo fetal e/ou neonatal quer hipotiroidismo. Os autores apresentam o caso de um recém‐nascido de mãe com doença de Graves mal controlada durante a gravidez cujo período neonatal precoce decorreu sem incidentes e que na segunda semana de vida desenvolveu um quadro de hipertiroidismo. Foi medicado 2 dias com propranolol para controlo da taquicardia e metimazol que manteve durante 4 meses, com boa evolução clínica e laboratorial.
Na mulher com doença de Graves é fundamental o controlo rigoroso da função tiroideia e dos TRAbs durante a gravidez. Todos os recém‐nascidos devem ter a função tiroideia avaliada ao nascer e um adequado seguimento que permita o diagnóstico de hipertiroidismo ou hipotiroidismo transitório. Com esta atitude será possível instituir um tratamento atempado, evitando as complicações a curto e longo prazo.
A propósito deste caso, baseado numa revisão bibliográfica, os autores apresentam uma proposta de atuação em recém‐nascidos filhos de mãe com doença de Graves.
Graves’ disease is the main cause of hyperthyroidism in women of childbearing age. It occurs by the presence of serum immunoglobulins which stimulate the thyrotropin receptor (TRAbs) and may cross the placenta. It has serious consequences when uncontrolled, leading to fetal and/or neonatal hyperthyroidism or hypothyroidism. The authors describe the case of a newborn from a mother with poorly controlled Graves’ disease during pregnancy. He had an uneventful early neonatal period but developed hyperthyroidism in the second week of life. He was treated for two days with propranolol to manage tachycardia and metimazol during 4 months, with favourable clinical and laboratory outcome.
During pregnancy, it is essential to control thyroid function and TRAbs in women with Graves’ disease. Newborns should be screened for thyroid function at birth and must have a regular follow up as it allows the diagnosis of transient hyperthyroidism or hypothyroidism and its early treatment, avoiding short and long term complications.
Based on this case and literature review, the authors present a proposal of protocol in infants born to mothers with Graves’ disease.
A doença de Graves é uma patologia autoimune caraterizada pela presença de imunoglobulinas séricas (TRAbs) que mimetizam a ação da tirotropina (TSH), estimulando os seus recetores tiroideus e levando à síntese e libertação aumentadas de hormonas tiroideias com consequente quadro de hipertiroidismo1–3. A sua etiologia é desconhecida, mas parece resultar de uma complexa interação entre fatores genéticos e ambientais que induzem uma perda de tolerância aos antigénios tiroideus, desencadeando uma resposta imune dirigida à glândula tiroide. Parece existir uma suscetibilidade genética, poligénica, tendo já sido identificados alguns genes associados a esta patologia2–4. A glândula tiroide apresenta‐se tipicamente com infiltração linfocítica. Os linfócitos T ativam uma resposta inflamatória local através da produção de citoquinas, levando à desregulação dos linfócitos B com o aumento da produção de imunoglobulinas. Um desequilíbrio entre os linfócitos T reguladores e patogénicos parece estar envolvido na patogénese e severidade da doença2,4.
A doença de Graves ocorre em aproximadamente 0,2% das mulheres e pode causar um quadro autolimitado de hipertiroidismo em 1‐5% dos recém‐nascidos1,5,6. Durante a gravidez, os TRAbs maternos atravessam a placenta e estimulam os recetores de TSH da glândula tiroide fetal, podendo originar, assim, o hipertiroidismo fetal/neonatal. Os recém‐nascidos de mãe com doença de Graves podem apresentar não só hipertiroidismo, mas também hipotiroidismo ou eutiroidismo, dependendo do balanço entre os TRAbs maternos que atingem a circulação fetal e os níveis de fármacos antitiroideus, caso a mãe esteja medicada1,4,5. O hipertiroidismo neonatal pode também surgir em filhos de mulheres com doença de Graves tratada anos antes por tiroidectomia total ou iodo radioativo, uma vez que estas podem ter, ainda, TRAbs em circulação1,4,6. O hipertiroidismo na gravidez é caraterizado por sintomas como taquicardia, intolerância ao calor, ansiedade, tremor, perda ponderal e pode trazer graves consequências tais como insuficiência cardíaca congestiva, pré‐eclâmpsia, aborto espontâneo e parto pré‐termo6,7. Os sinais de hipertiroidismo fetal incluem restrição de crescimento intrauterino, taquicardia, arritmias, hidrópsia, hipercinesia, idade óssea avançada, bócio, podendo condicionar parto pré‐termo e até morte fetal. No período neonatal podem surgir sinais como irritabilidade, sono agitado, edema periorbitário, exoftalmia, insuficiência cardíaca, hipertensão sistémica e pulmonar, apetite voraz, diarreia, má progressão ponderal, pele quente e sudorética, hepatoesplenomegália, microcefalia e craniossinostose1,4.
O diagnóstico do hipertirodismo neonatal baseia‐se, para além da clínica, na avaliação da função tiroideia e TRAbs ao nascimento e da sua evolução nos primeiros dias de vida. A avaliação da função tiroideia materna e TRAbs ao longo da gravidez, sobretudo no último trimestre, é fundamental para prever quais serão as crianças com maior probabilidade de vir a apresentar hipertiroidismo neonatal transitório4–6. O tratamento da mãe durante a gravidez inclui habitualmente fármacos antitiroideus (propiltiouracilo e metimazol) com o objetivo de atingir o eutiroidismo materno e consequentemente fetal6,8. O tratamento do recém‐nascido inclui os mesmos fármacos utilizados durante a gravidez. Em alguns casos pode ser utilizado um bloqueador beta adrenérgico como o propranolol para controlo da taquicardia1,4. Com terapêutica adequada, a maioria dos recém‐nascidos melhora rapidamente, permitindo uma suspensão progressiva dos fármacos4.
Os autores descrevem o caso de um recém‐nascido de mãe com doença de Graves mal controlada durante a gravidez, assintomático ao nascimento, que desenvolveu posteriormente um quadro de hipertiroidismo com necessidade de terapêutica. A propósito deste caso é realizada uma breve revisão teórica, abrangendo os aspetos práticos mais relevantes desta patologia e elaborada uma proposta de atuação, baseada numa revisão bibliográfica.
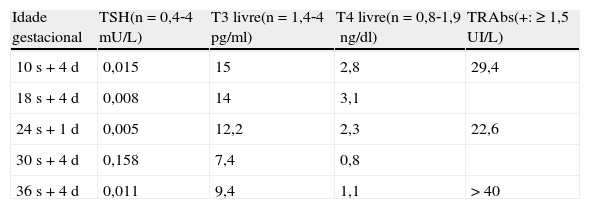
Descrição do casoRecém‐nascido do sexo masculino, segunda gestação vigiada, de risco por doença de Graves materna diagnosticada um ano antes e medicada até à gravidez com propiltiouracilo e propranolol. A medicação antitiroideia foi suspensa no início da gravidez por iniciativa da grávida e reiniciada às 14 semanas de gestação, com propiltiouracilo até ao máximo de 150mg 3id. Às 26 semanas de gestação foi substituído por metimazol 10mg 3id. Na tabela 1 é possível apreciar a evolução dos valores de TSH, tri‐iodotironina livre (T3L), tiroxina livre (T4L) e TRAbs maternos durante a gravidez.
As ecografias pré‐natais foram sempre normais, sem alterações da frequência cardíaca fetal ou bócio, exceto a última que mostrou restrição de crescimento intrauterino (RCIU) e oligoâmnios, sendo por isso motivo programado o parto para as 37 semanas. Nasceu por cesariana devido a sofrimento fetal agudo, com boa adaptação à vida extrauterina (Índice de Apgar de 91/105).
Ao nascer pesava 2.310g (–1,45SDS), tinha um comprimento de 43,9cm (–1,9SDS) e um perímetro cefálico de 32cm (–0,9SDS). No período neonatal precoce não apresentou qualquer intercorrência, nomeadamente irritabilidade, alterações no apetite ou sono, tendo‐se verificado uma perda ponderal inferior a 10% do peso de nascimento. Ao exame físico não apresentava outros sinais de doença tiroideia, nomeadamente alterações das fontanelas, exoftalmia, taquicardia, bócio (palpável) ou alterações cutâneas. O estudo laboratorial realizado no primeiro dia de vida em sangue do cordão umbilical encontra‐se representado na tabela 2.
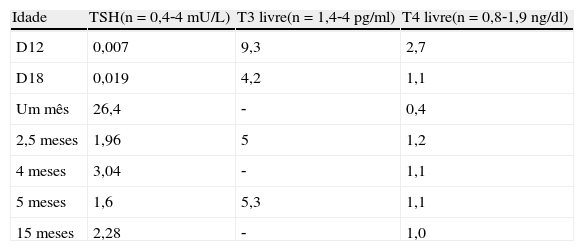
Teve alta da maternidade ao 4.° dia de vida sob aleitamento materno exclusivo e foi observado em consulta de endocrinologia pediátrica ao 12.° dia de vida. Nesta altura havia noção de irritabilidade e sono agitado com 4 dias de evolução. Não apresentava dificuldades alimentares e as dejeções eram normais. Ao exame físico apresentava um aspeto emagrecido, com peso de 2.335g e uma taquicardia de 215 batimentos por minuto. A avaliação laboratorial mostrou alterações compatíveis com hipertiroidismo, com diminuição da TSH (0,007mU/L) e elevação da T3L (9,3pg/ml), T4L (2,7ng/dl) e TRAbs fortemente positivos (24,2UI/L). A ecografia cervical mostrou uma tiroide de morfologia globosa com ecoestrutura normal. Foi internado na unidade de cuidados intermédios pediátricos do 12.° ao 18.° dias de vida, medicado com propranolol (2mg/kg/dia) durante 2 dias e metimazol (1mg/kg/dia). Verificou‐se uma boa evolução clínica, com normalização dos valores de frequência cardíaca, melhoria da irritabilidade e do padrão de sono. Manteve aleitamento materno exclusivo, com boa evolução ponderal.
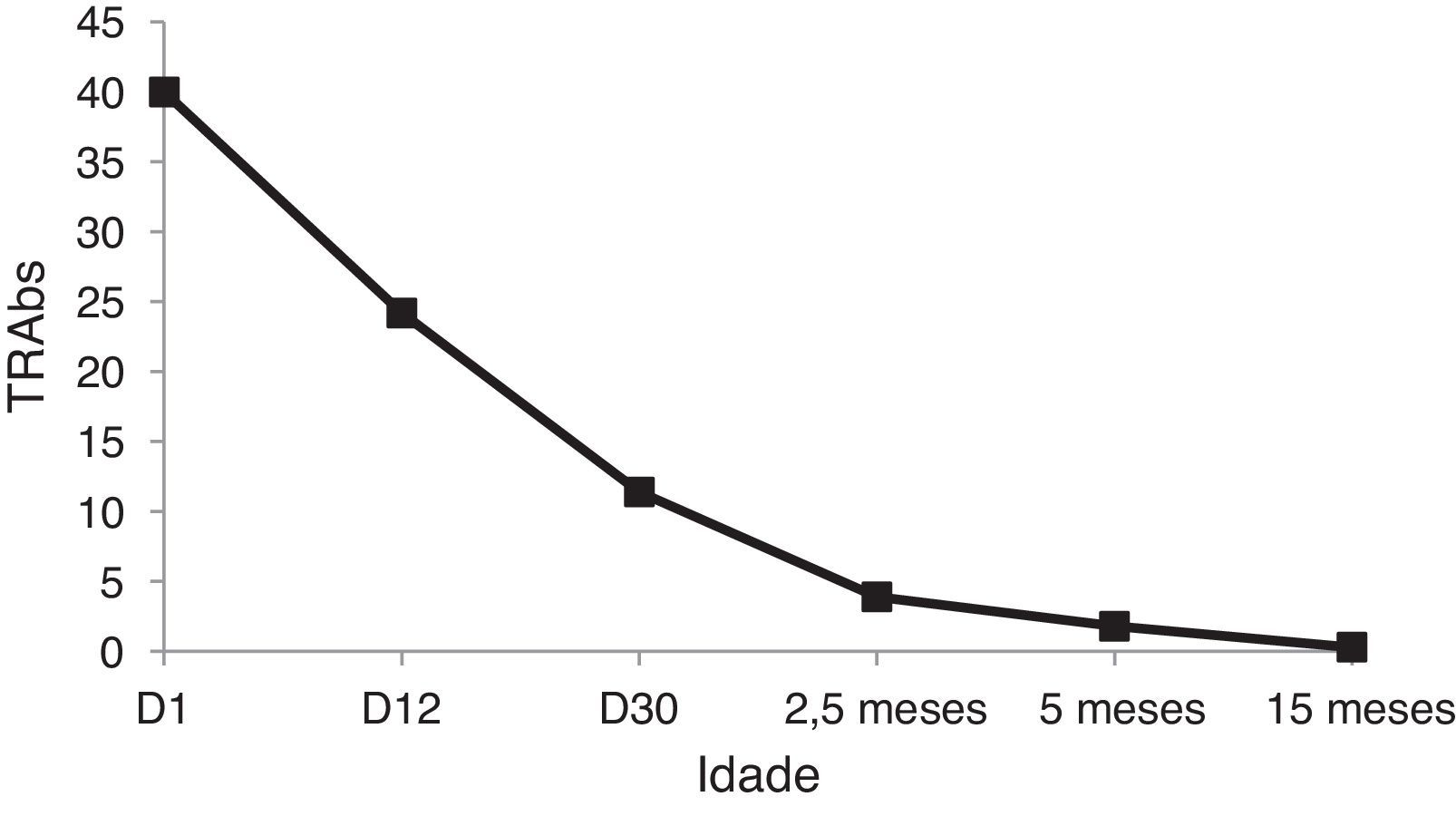
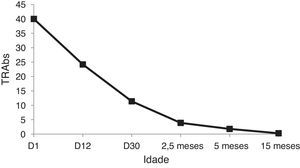
Cumpriu terapêutica com metimazol durante 4 meses, com redução progressiva da dose diária até um mínimo de 0,25mg/kg/dia. Durante este período verificou‐se a normalização progressiva dos valores das hormonas tiroideias, TSH e TRAbs (eutiroidismo). Na tabela 3 está representada a evolução da função tiroideia e na figura 1 a evolução dos TRAbs.
A velocidade de crescimento ponderal foi sempre adequada e apresenta atualmente um crescimento estatural no p50‐75 e perímetro cefálico no p50. Manteve seguimento em consulta de endocrinologia pediátrica até aos 19 meses, não voltando a apresentar clínica de hipertiroidismo.
ComentáriosA glândula tiroide fetal está presente às 7 semanas de gestação, tornando‐se funcionante a partir das 10‐12 semanas com a produção de hormonas tiroideias (tri‐iodotironina ‐ T3 e tiroxina ‐ T4), fundamentais para o crescimento fetal, metabolismo, termogénese e neurodesenvolvimento5. Assim, após o primeiro trimestre, a tiroide fetal é sensível à ação desencadeada pelos TRAbs maternos que atravessam a placenta e estimulam os recetores de TSH originando um quadro de hipertiroidismo. Após o nascimento, estes anticorpos continuam a estimular os recetores da TSH, podendo desencadear hipertiroidismo neonatal, até serem gradualmente eliminados da circulação do recém‐nascido, o que acontece cerca das 8‐20 semanas de vida pós‐natal4–6,9. É de salientar, no entanto, que, não só pelo efeito da eventual terapêutica antitiroideia materna (que atravessa a placenta), mas também pela possibilidade de supressão do eixo hipotálamo‐hipófise fetal (hipotiroidismo central ou hipotalâmico) por exposição a níveis excessivos de T4, pode também surgir um quadro de hipotiroidismo neonatal.
Na grávida com doença de Graves é fundamental o controlo ao longo da gravidez, evitando os efeitos potencialmente graves para o feto. Assim, é essencial o seguimento da função tiroideia e TRAbs. Um valor de TRAbs 5 vezes superior ao limite da normalidade cursa com maior risco de tirotoxicose neonatal, embora também possa ocorrer com níveis bastante inferiores6. A realização de ecografias mensais a partir das 20 semanas de gestação, altura em que a tiroide fetal é funcionante, é fundamental na identificação precoce de sinais de hipertiroidismo, tais como taquicardia fetal ou bócio4.
O tratamento de escolha durante a gravidez é médico, nomeadamente os fármacos antitiroideus propiltiouracilo e metimazol5,6,8,10,11. Estes fármacos diminuem a síntese de hormonas tiroideias inibindo a peroxidase tiroideia que participa na incorporação e oxidação do iodo nos resíduos tirosil da tireoglobulina5,10. O propiltiouracilo inibe ainda a conversão periférica da T4 em T310.
Apesar de ambos os fármacos terem eficácia semelhante no controlo do hipertiroidismo, o risco de efeitos secundários é diferente12. Os efeitos secundários mais frequentes para a grávida são eritemas cutâneos e sintomas gastrointestinais (náuseas e vómitos)12. Embora raros, os efeitos mais temidos associados ao propiltiouracilo são a agranulocitose e a hepatite com potencial falência hepática aguda10,12. Quando ocorre qualquer uma destas reações, está indicada suspensão terapêutica10,12. Tanto o propiltiouracilo como o metimazol atravessam a placenta, podendo levar também a efeitos no feto e recém‐nascido12. Malformações congénitas associadas aos antitiroideus na gravidez ocorrem em 2‐3% dos recém‐nascidos, sendo o risco superior com o tratamento entre as 6‐10 semanas de idade gestacional11. A teratogenicidade é mais frequente com o metimazol, levando a maior risco de aplasia cutis, atrésia das coanas e do esófago, fistula traqueoesofágica e onfalocelo ou outros defeitos do canal onfalomesentérico5,12. Desta forma, a abordagem terapêutica mais recomendada na grávida é a utilização do propiltiouracilo no primeiro trimestre e, a partir daí, o metimazol5,13.
Se ocorrer um mau controlo da doença, nomeadamente por incumprimento da terapêutica, como se verificou neste caso, maior é o risco do recém‐nascido apresentar um quadro de hipertiroidismo neonatal, sobretudo na presença de valores elevados de TRAbs maternos à data do parto1,6. Por outro lado, mesmo que tenha sido realizada uma terapêutica adequada que permita um estado de eutiroidismo ou até hipotiroidismo fetal, após o nascimento os fármacos serão gradualmente excretados pelo que pode ocorrer um quadro de hipertiroidismo na primeira semana de vida, uma vez que os TRAbs irão demorar mais tempo a desaparecer da circulação do recém‐nascido. Há ainda a salientar que mesmo que a mãe tenha sido submetida a terapêutica ablativa (cirurgia ou iodo radioativo), previamente à gravidez, pode também surgir um hipertiroidismo fetal e/ou neonatal transitório devido à persistência dos TRAbs. Assim, mesmo que a função tiroideia seja normal ao nascimento, a avaliação laboratorial deve ser sempre repetida no final da primeira semana de vida4.
No caso descrito, o recém‐nascido apresentava um alto risco de vir a desenvolver hipertiroidismo, uma vez que existia noção de mau controlo da doença materna durante a gravidez comprovado pela presença de elevação dos TRAbs no último trimestre e por um valor francamente diminuído de TSH no primeiro dia de vida. Assim, neste caso provavelmente teria sido benéfico realizar uma avaliação da função tiroideia mais precoce (entre o 3.°‐7.° dia de vida) de forma a evitar o hipertiroidismo com clínica associada que se diagnosticou apenas ao 12.° dia de vida.
Na presença de sintomas associados a evidência laboratorial de hipertiroidismo (diminuição de TSH, elevação de T3 e T4 e aumento dos TRAbs) deve ser iniciada terapêutica com metimazol (0,25‐1mg/kg/dia), que demonstrou ser mais eficaz a curto prazo e ter maior semivida que o propiltiouracilo. Este último fármaco também pode ser utilizado, mas o seu uso está associado a mais efeitos secundários, nomeadamente hepatotoxicidade e agranulocitose4. Para controlo dos sintomas beta‐adrenérgicos, como a taquicardia, pode justificar‐se a associação de um beta‐bloqueante como o propranolol. A terapêutica com antitiroideus deve ser mantida durante 4‐8 semanas com redução progressiva em função da clínica e evolução laboratorial4. Em caso de insucesso da terapêutica de primeira linha pode ser necessário utilizar iodo (Soluto de Lugol [KI 5%, 8mg 8/8h] ou corticoides (prednisolona 2mg/kg/dia 12/12h).
O aleitamento materno deve ser mantido mesmo que a mãe esteja sob terapêutica com antitiroideus, tendo em conta os benefícios conhecidos do leite materno e ausência de risco dos fármacos5,7,12,14. Apesar da passagem para o leite materno ser superior em relação ao propiltiouracilo, o metimazol é preferido devido aos efeitos hepatotóxicos do outro fármaco. Estudos comprovam que o metimazol não altera de modo significativo a função tiroideia no recém‐nascido nem o crescimento ou neurodesenvolvimento da criança12,14.
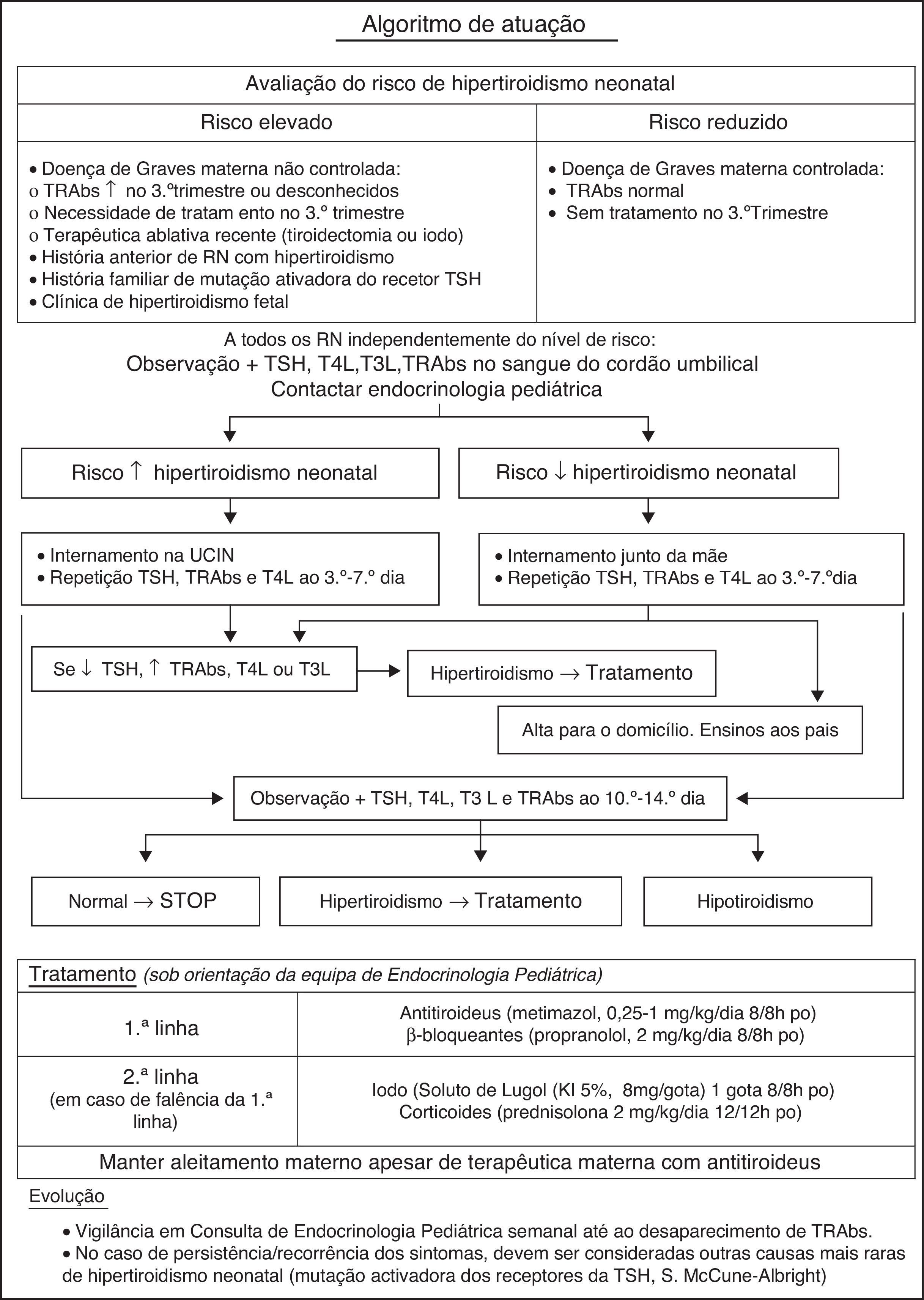
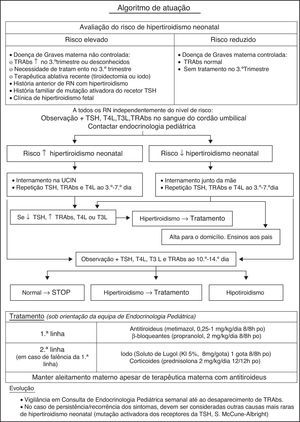
Na figura 2 encontra‐se representada uma proposta de protocolo de atuação para o recém‐nascido de mãe com doença de Graves.
Apesar da maioria dos casos de hipertiroidismo neonatal secundário a doença de Graves materna resolver espontaneamente entre as 3‐12 semanas de vida, altura em que os TRAbs maternos desaparecem da circulação do lactente; em alguns lactentes pode, no entanto, persistir 6 ou mais meses. Em face do exposto é fundamental manter estas crianças referenciadas a uma consulta de endocrinologia para monitorização clínica e analítica, o que permitirá uma terapêutica adequada e a sua suspensão de acordo com a evolução (fig. 2).
O prognóstico destas crianças, desde que a terapêutica seja adequada e precoce, é habitualmente favorável, tal como se verificou no caso descrito. Os efeitos a longo prazo ainda não são bem conhecidos, mas estão descritos casos de atraso de crescimento, hiperatividade, atraso de desenvolvimento psicomotor e alterações de comportamento1,4,15.
Embora raro, o hipertiroidismo neonatal transitório está associado a uma importante taxa de mortalidade, descrita entre 12‐20%, tendo como causa mais frequente a insuficiência cardíaca. A mortalidade e significativa morbilidade que esta patologia condiciona podem ser prevenidas através da precoce suspeição do diagnóstico em recém‐nascidos de risco com atempada instituição da terapêutica2,4,6.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.