A diabetes mellitus tipo 2 (DMT2) é uma doença progressiva que habitualmente requer intensificação da terapêutica ao longo do tempo. As recomendações para a intensificação terapêutica baseiam‐se geralmente em ensaios aleatorizados e controlados rigorosos, existindo uma necessidade de estudos em ambiente real, que melhor traduzam o comportamento dos fármacos na prática clínica.
MétodosO Effectiveness of Diabetes control with vildaGliptin and vildagliptin/ mEtformin (EDGE) foi um estudo observacional prospetivo que comparou a efetividade e segurança da associação de vildagliptina e de outros antidiabéticos orais (ADO) em 45.868 doentes a nível mundial com DMT2 inadequadamente controlada em monoterapia.
ResultadosEm Portugal foram incluídos 6.546 doentes, com uma idade média de 63,5±11,0 anos, sendo 51,8% do sexo masculino. A HbA1c inicial era de 7,9%±1,3 e 7,6%±1,2 nos grupos de vildagliptina (n=4.382) e comparador (n=2.164), respetivamente. No grupo de vildagliptina, uma maior proporção de doentes atingiu o critério de avaliação primário de redução de HbA1c>0,3% sem edema periférico, evento hipoglicémico comprovado, descontinuação por evento gastrointestinal (GI) ou aumento de peso ≥5% (66,1 versus 54,4%, p<0,001). A redução da HbA1c ajustada foi de −1,1 e −0,9% nos grupos de vildagliptina e comparador, respetivamente (p<0,001 para a diferença entre tratamentos). Foram notificados 44 (1,0%) eventos adversos no grupo de vildagliptina e 23 (1,1%) no grupo comparador.
ConclusõesO estudo EDGE demonstrou, num ambiente clínico real, que a associação de vildagliptina permite que uma maior proporção de doentes consiga reduções significativas da HbA1c sem hipoglicemia e aumento de peso, comparativamente com outras associações de ADO.
Type 2 diabetes mellitus (T2DM) is a progressive disease that usually requires intensification of therapy over time. Guidelines for treatment intensification are generally based on rigorous randomized controlled trials, and there is a need for real‐life studies, that better translate drugs’ behaviour in clinical practice.
MethodsEDGE (Effectiveness of Diabetes control with vildaGliptin and vildagliptin/mEtformin) was an observational prospective study that compared the effectiveness and safety of add‐on vildagliptin and other oral antidiabetics (OAD) in 45,868 patients worldwide with T2DM inadequately controlled with monotherapy.
ResultsSix thousand five hundred forty‐six patients, with a mean age of 63.5±11.0 years and 51.8% of males were included in Portugal. Baseline HbA1c was 7.9%±1.3 and 7.6%±1.2 in the vildagliptin (n=4,382) and comparator (n=2,164) groups, respectively. In the vildagliptin group, a greater proportion of patients achieved the primary endpoint of HbA1c reduction>0.3% without peripheral oedema, proven hypoglycaemic event, discontinuation due to a gastrointestinal event, or weight gain ≥5% (66.1% versus 54.4%, p<0.001). The adjusted HbA1c reduction was −1.1% and −0.9% in the vildaglitpin and comparator groups, respectively (p<0.001 for treatment difference). Adverse events were reported in 44 (1.0%) patients in the vildagliptin group and 23 (1.1%) patients in the comparator group.
ConclusionsThe EDGE study showed that in real‐life clinical practice more patients treated with add‐on vildagliptin achieve significant HbA1c reductions without hypoglycaemia and weight gain, compared to other OAD associations.
A diabetes mellitus tipo 2 (DMT2) é uma doença crónica com uma prevalência estimada em Portugal de 12,9%1. Dada a sua evolução progressiva, frequentemente são necessárias terapêuticas combinadas para se conseguir um adequado controlo glicémico e prevenir as suas complicações a longo prazo2. As orientações terapêuticas recentemente publicadas pela Sociedade Portuguesa de Diabetologia (SPD), tendo por base a posição conjunta da American Diabetes Association (ADA) e da European Association for the Study of Diabetes (EASD), sugerem que a eficácia, tolerabilidade, segurança, custo e preferências do doente deverão ser consideradas aquando da escolha dos fármacos antidiabéticos3.
A maior parte dos dados de eficácia e tolerabilidade que sustentam as recomendações terapêuticas provêm de ensaios clínicos aleatorizados e controlados, frequentemente criticados por fornecerem informação de utilidade limitada acerca do comportamento de um fármaco em contextos clínicos reais. Assim, existe uma necessidade crescente de estudos mais adaptados à prática clínica, conduzidos em ambiente real, sem critérios de inclusão e exclusão tão estritos e que melhor reflitam as características da população alvo4–6.
O Effectiveness of Diabetes control with vildaGliptin and vildagliptin/mEtformin (EDGE) foi um estudo observacional, prospetivo, com a duração de um ano, realizado em ambiente real a nível mundial7, que procurou avaliar a efetividade e tolerabilidade de vildagliptina, um inibidor da dipeptidil peptidase‐IV (DPP‐4), associada a outro antidiabético oral (ADO), comparativamente ao conjunto de quaisquer outras associações de 2 ADO excluindo a vildagliptina ou outros inibidores da DPP‐4, durante 12 meses de seguimento. Nesta publicação relatamos os resultados de uma subanálise que avaliou a efetividade e tolerabilidade das associações duplas, incluindo vildagliptina, comparativamente a todas as outras associações de 2 ADO, nos doentes incluídos em Portugal.
MétodosDesenho do estudo. O EDGE foi um estudo de coorte observacional de um ano, prospetivo, no qual foram incluídos 45.868 doentes em 2.957 centros de 27 países da Europa, América Central e Latina, Ásia e Médio Oriente7. Eram elegíveis para o estudo doentes adultos (com 18 ou mais anos de idade) com DMT2 inadequadamente controlada em monoterapia com sulfonilureia (SU), metformina, tiazolidinediona (TZD), glinida ou inibidor da α‐glicosidase (IAG), para os quais houve a decisão clínica de associar um segundo ADO. Foram excluídos os doentes para os quais se planeava a introdução de um inibidor da DPP‐4 que não a vildagliptina ou um análogo da incretina, ou que necessitavam de 3 ou mais ADO no início do estudo, bem como os doentes que mudaram de ADO ou classe de ADO na altura do início do estudo, antes da associação de um novo ADO. Os doentes medicados com insulina na altura do início do estudo ou que tinham história de hipersensibilidade a qualquer um dos medicamentos em estudo (ou medicamentos de classes químicas semelhantes) não eram elegíveis para o estudo EDGE.
Foi obtido o consentimento informado de todos os participantes no estudo. Tendo em consideração as características observacionais do estudo, a inclusão dos doentes ocorreu apenas depois de ser tomada a decisão terapêutica, de acordo com o critério do investigador. Para qualquer das associações terapêuticas era permitida a utilização de uma associação fixa, se disponível.
Recolha de dados. Numa consulta de rotina, definida como a visita inicial, foram recolhidos os dados relativos às características demográficas, peso corporal, altura, data do diagnóstico de DMT2, medicação antidiabética antes da entrada no estudo, ADO recém‐iniciado (segundo componente da medicação de indexação) e resultado do teste de HbA1c mais recente. Após 12 meses, foram reavaliados os dados finais relativos ao peso corporal, alterações da medicação antidiabética, valor de HbA1c, acontecimentos adversos (AA) e acontecimentos adversos graves (AAG). Em qualquer período entre a avaliação inicial e final de dados poderiam realizar‐se avaliações intermédias. As avaliações laboratoriais foram realizadas em linha com a prática clínica habitual e/ou conforme o requerido pelas informações de prescrição dos medicamentos utilizados e/ou nas alturas julgadas apropriadas pelos investigadores. Face à natureza de «ambiente real» do estudo, não foram utilizados laboratórios centrais.
A monitorização foi realizada para uma amostra dos centros com recrutamento mais elevado (∼5% dos centros). No entanto, requereu‐se a todos os investigadores que mantivessem os documentos‐fonte de cada participante, incluindo os consentimentos informados assinados.
Critérios de avaliação de efetividade e tolerabilidade. O critério de avaliação primário (CAP) foi definido como a proporção de doentes que responderam ao tratamento (redução de HbA1c desde o início até ao mês 12>0,3%) sem ocorrência de acontecimentos relacionados com a tolerabilidade (edema periférico, evento hipoglicémico comprovado, descontinuação devido a evento GI ou aumento de peso ≥5%). Os doentes que não podiam ser classificados como sucesso ou insucesso (por exemplo, devido à ausência de dados de HbA1c ou peso corporal na avaliação dos 12 meses) foram considerados como não‐avaliáveis. Os dados de doentes não‐avaliáveis foram considerados insucessos para o cálculo do odds ratio (OR). A análise principal do CAP utilizou a população por protocolo (PP); doentes que alteraram a terapêutica de indexação foram excluídos do estudo. A hipoglicemia foi definida como a presença de sintomas adrenérgicos sugestivos de hipoglicemia; os doentes poderiam também autorregistar e documentar valores de glicemia baixos na mesma altura. Considerou‐se a ocorrência de um evento de hipoglicemia após confirmação por opinião do investigador.
O critério de avaliação secundário (CAS) foi definido como a proporção de doentes que atingiu um valor de HbA1c<7% sem hipoglicemia comprovada e aumento de peso (≥3%), em doentes com HbA1c inicial ≥7%.
Análise dos critérios de avaliação de efetividade e tolerabilidade primários e secundários. Esta análise post‐hoc fornece sobretudo estatísticas descritivas. A análise inferencial foi realizada para o CAP e CAS. Para estes, a probabilidade de sucesso foi analisada utilizando um modelo de regressão logística binária para calcular os OR com intervalos de confiança (IC) a 95%. O OR expressa a hipótese de sucesso com vildagliptina ou vildagliptina/metformina relativamente à hipótese de sucesso com os ADO do grupo de comparação. Nesta análise post‐hoc apenas é apresentado o OR não ajustado. A redução da HbA1c foi ajustada à HbA1c inicial através da utilização de um modelo ANCOVA.
Informação adicional da metodologia do estudo, nomeadamente no que concerne ao cálculo do tamanho da amostra global e análises estatísticas adicionais, encontra‐se disponível em Mathieu et al.7.
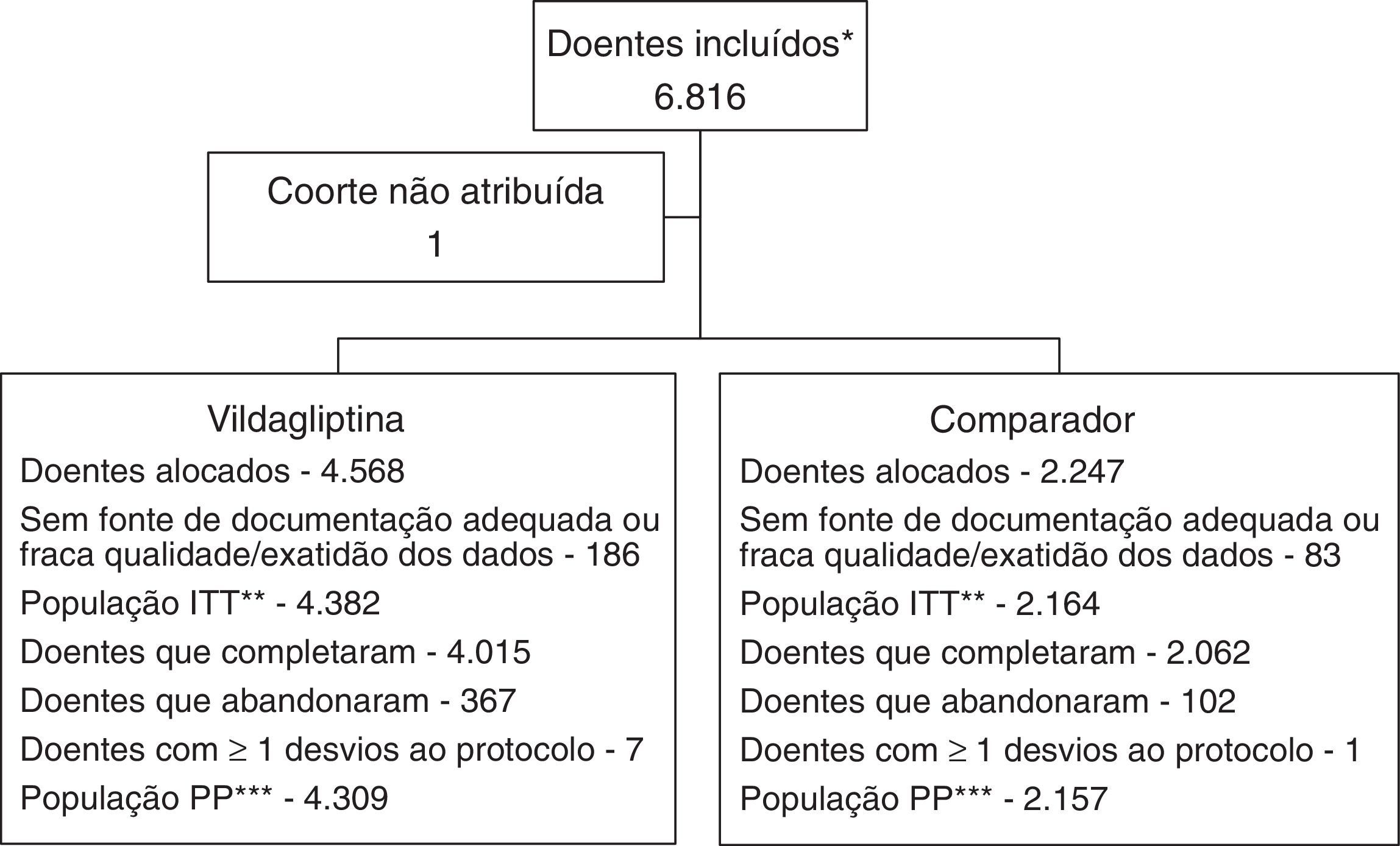
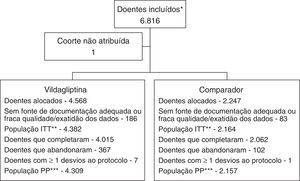
ResultadosPopulação de doentes e características iniciais. Dos 45.868 doentes incluídos a nível global no estudo EDGE, 6.816 foram incluídos por 351 investigadores (na sua maioria especialistas em medicina geral e familiar) em Portugal. Destes, 269 doentes (186 no grupo vildagliptina e 83 no grupo comparador) foram excluídos por ausência de dados adequados ou questões relacionadas com a qualidade dos dados. A população de intenção de tratar (ITT), utilizada para a caracterização demográfica inicial e análises de segurança, incluiu 4.382 e 2.164 doentes tratados com terapêutica dupla incluindo a vildagliptina recém‐prescrita ou com a associação de um ADO que não a vildagliptina e a monoterapia prévia, respetivamente. A população PP, um subgrupo da população ITT, foi utilizada para as análises dos critérios de avaliação de efetividade (fig. 1).
Fluxograma de inclusão dos doentes
* A população de doentes incluídos inclui todos os participantes que forneceram o consentimento informado.
** A população de intenção de tratar (ITT) é um subgrupo da população incluída, que engloba todos os doentes a quem foi atribuído um novo tratamento imediatamente antes da data de entrada no estudo. Os centros e/ou doentes nos quais se identificaram questões relacionadas com a qualidade dos dados ou dados irregulares, foram excluídos da análise da população ITT.
***A população por protocolo (PP) é um subgrupo da população ITT. A população PP foi utilizada para as análises dos critérios de avaliação de efetividade. Os doentes com os seguintes desvios ao protocolo na avaliação inicial foram excluídos da população PP.
Doentes medicados com inibidores da DPP‐4 no início ou no mês anterior ao início do estudo.
Doentes medicados com análogos do GLP‐1 no início ou no mês anterior ao início do estudo.
Doentes medicados com insulina no início do estudo.
Doentes medicados apenas com monoterapia recém‐iniciada ou mais de 2 antidiabéticos orais no início do estudo.
Doentes não previamente tratados no início do estudo (doentes que não tomavam qualquer antidiabético antes do início do estudo).
Doentes que trocaram de um antidiabético oral (ou classe) para outro no início do estudo
Doentes medicados com o fármaco em estudo no início do estudo ou nos 30 dias anteriores ao início ou 5 semividas antes do início.
Doentes medicados com mais de um antidiabético oral antes do início do estudo.
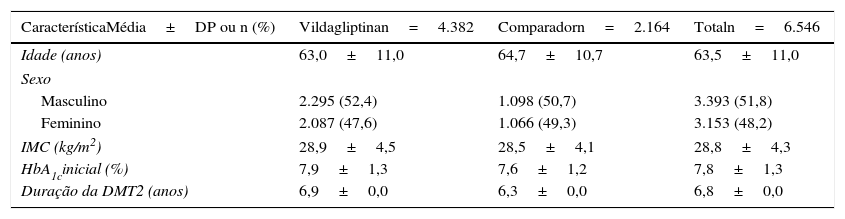
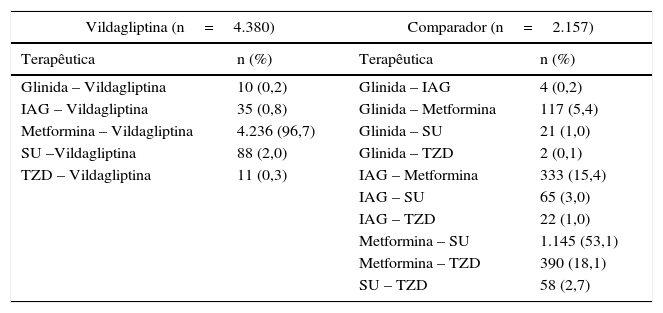
A tabela 1 resume as características iniciais da população ITT, não se tendo observado diferenças significativas entre os 2 grupos de tratamento. A tabela 2 mostra as terapêuticas de indexação da população ITT por coorte. A associação mais frequente no grupo vildagliptina foi com metformina (96,7%), enquanto no grupo comparador as associações mais frequentes foram entre metformina e SU (53,1%), metformina e TZD (18,1%) e metformina e IAG (15,4%).
Características demográficas e caracterização inicial dos doentes (população ITT)
| CaracterísticaMédia±DP ou n (%) | Vildagliptinan=4.382 | Comparadorn=2.164 | Totaln=6.546 |
|---|---|---|---|
| Idade (anos) | 63,0±11,0 | 64,7±10,7 | 63,5±11,0 |
| Sexo | |||
| Masculino | 2.295 (52,4) | 1.098 (50,7) | 3.393 (51,8) |
| Feminino | 2.087 (47,6) | 1.066 (49,3) | 3.153 (48,2) |
| IMC (kg/m2) | 28,9±4,5 | 28,5±4,1 | 28,8±4,3 |
| HbA1cinicial (%) | 7,9±1,3 | 7,6±1,2 | 7,8±1,3 |
| Duração da DMT2 (anos) | 6,9±0,0 | 6,3±0,0 | 6,8±0,0 |
DP: desvio‐padrão; IMC: índice de massa corporal.
Terapêuticas de indexação (população ITT)
| Vildagliptina (n=4.380) | Comparador (n=2.157) | ||
|---|---|---|---|
| Terapêutica | n (%) | Terapêutica | n (%) |
| Glinida – Vildagliptina | 10 (0,2) | Glinida – IAG | 4 (0,2) |
| IAG – Vildagliptina | 35 (0,8) | Glinida – Metformina | 117 (5,4) |
| Metformina – Vildagliptina | 4.236 (96,7) | Glinida – SU | 21 (1,0) |
| SU –Vildagliptina | 88 (2,0) | Glinida – TZD | 2 (0,1) |
| TZD – Vildagliptina | 11 (0,3) | IAG – Metformina | 333 (15,4) |
| IAG – SU | 65 (3,0) | ||
| IAG – TZD | 22 (1,0) | ||
| Metformina – SU | 1.145 (53,1) | ||
| Metformina – TZD | 390 (18,1) | ||
| SU – TZD | 58 (2,7) | ||
Em 2 doentes do grupo vildagliptina e 7 doentes do grupo comparador não foi possível identificar a terapêutica de indexação.
IAG: inibidor da alfa‐glicosidase; SU: sulfonilureia; TZD: tiazolidinediona.
Critérios de avaliação primários e secundários. Nos doentes tratados com vildagliptina, 66,1% atingiram o CAP de redução da HbA1c>0,3%, sem edema periférico, hipoglicemia comprovada, descontinuação por efeitos secundários GI ou aumento de peso ≥5%. O CAP foi atingido por 54,4% dos doentes no grupo comparador, resultando num OR de 1,64 (IC a 95%: 1,47‐1,82, p<0,001). Observou‐se uma vantagem similar com o tratamento com vildagliptina no que diz respeito ao CAS (HbA1c<7% sem hipoglicemia comprovada e aumento de peso (≥3%), em doentes com HbA1c inicial ≥7%), com 48,5% dos doentes tratados com vildagliptina e 40,3% dos doentes do grupo comparador a atingirem o CAS, resultando num OR de 1,40 (IC a 95%: 1,23‐1,59, p<0,001).
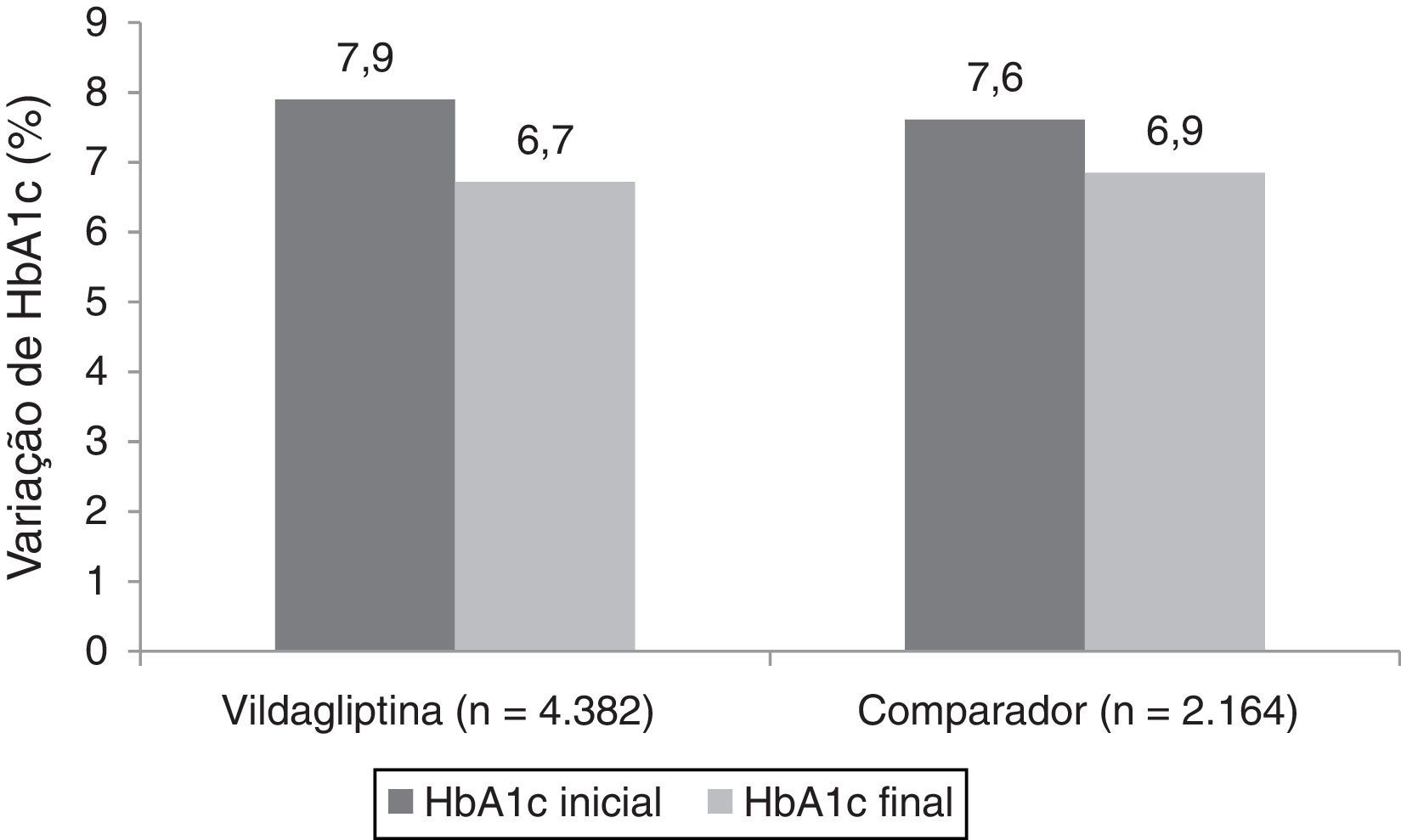
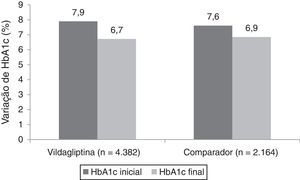
A figura 2 ilustra a variação da HbA1c entre a avaliação inicial e final do estudo, para ambas as coortes. As variações finais ajustadas para o valor de HbA1c inicial aos 12 meses foram de −1,1% (IC a 95%: −1,14 a −1,10) em doentes tratados com vildagliptina e −0,9% (IC a 95%: −0,92 a −0,86) em doentes do grupo comparador (diferença entre tratamentos de 0,2%, p<0,001; análise não pré‐especificada no protocolo).
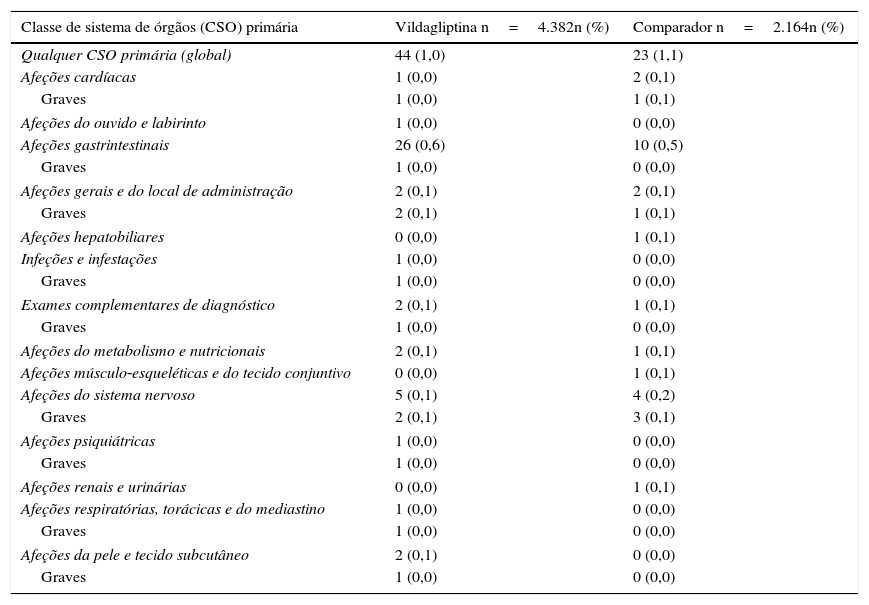
Análise de segurança. A percentagem de doentes com pelo menos um AA notificado de qualquer classe de sistema de órgãos (CSO) primário foi semelhante na coorte de vildagliptina (0,8%) e na do grupo comparador (0,8%). A percentagem de doentes com ≥1 AAG notificados foi idêntica em ambos os grupos (0,2%, correspondente a 8 doentes no grupo vildagliptina e 4 doentes no grupo comparador). A tabela 3 resume os AA observados durante o estudo, listados por CSO. Nenhum doente na coorte de vildagliptina relatou episódios de hipoglicemia, tendo sido notificado um episódio num doente tratado com metformina e SU.
Acontecimentos adversos por classe de sistema de órgãos e coorte (população ITT)
| Classe de sistema de órgãos (CSO) primária | Vildagliptina n=4.382n (%) | Comparador n=2.164n (%) |
|---|---|---|
| Qualquer CSO primária (global) | 44 (1,0) | 23 (1,1) |
| Afeções cardíacas | 1 (0,0) | 2 (0,1) |
| Graves | 1 (0,0) | 1 (0,1) |
| Afeções do ouvido e labirinto | 1 (0,0) | 0 (0,0) |
| Afeções gastrintestinais | 26 (0,6) | 10 (0,5) |
| Graves | 1 (0,0) | 0 (0,0) |
| Afeções gerais e do local de administração | 2 (0,1) | 2 (0,1) |
| Graves | 2 (0,1) | 1 (0,1) |
| Afeções hepatobiliares | 0 (0,0) | 1 (0,1) |
| Infeções e infestações | 1 (0,0) | 0 (0,0) |
| Graves | 1 (0,0) | 0 (0,0) |
| Exames complementares de diagnóstico | 2 (0,1) | 1 (0,1) |
| Graves | 1 (0,0) | 0 (0,0) |
| Afeções do metabolismo e nutricionais | 2 (0,1) | 1 (0,1) |
| Afeções músculo‐esqueléticas e do tecido conjuntivo | 0 (0,0) | 1 (0,1) |
| Afeções do sistema nervoso | 5 (0,1) | 4 (0,2) |
| Graves | 2 (0,1) | 3 (0,1) |
| Afeções psiquiátricas | 1 (0,0) | 0 (0,0) |
| Graves | 1 (0,0) | 0 (0,0) |
| Afeções renais e urinárias | 0 (0,0) | 1 (0,1) |
| Afeções respiratórias, torácicas e do mediastino | 1 (0,0) | 0 (0,0) |
| Graves | 1 (0,0) | 0 (0,0) |
| Afeções da pele e tecido subcutâneo | 2 (0,1) | 0 (0,0) |
| Graves | 1 (0,0) | 0 (0,0) |
Os acontecimentos adversos foram codificados de acordo com o MedDRA versão 14.0.
As CSO primárias são apresentadas por ordem decrescente de incidência de eventos.
Um doente de uma coorte com múltiplas ocorrências de um AA foi contado apenas uma vez na respetiva categoria de AA.
As mudanças de vildagliptina/metformina em associação fixa para vildagliptina em associação livre com metformina e vice‐versa não foram consideradas alterações do tratamento.
Neste estudo, o tratamento com vildagliptina, quando introduzida em doentes não controlados em monoterapia, permitiu que cerca de 2 terços dos doentes atingissem o CAP de diminuição da HbA1c>0,3% sem edema periférico, hipoglicemia, descontinuação devido a eventos adversos GI ou aumento de peso clinicamente relevante (≥5%, de acordo com a definição de Stevens et al.8). A escolha deste critério de avaliação teve por base os aspetos de eficácia e tolerabilidade que habitualmente são considerados na escolha de um ADO, tendo em conta os efeitos indesejáveis associados a cada classe terapêutica3: 1) biguanidas (eventos adversos GI); 2) SU (hipoglicemia e aumento de peso); 3) glinidas (hipoglicemia e aumento de peso); 4) TZD (edema periférico, aumento de peso); e 5) IAG (eventos adversos GI). No entanto, mesmo quando cingimos a avaliação do sucesso terapêutico a critérios globalmente aceites de eficácia (HbA1c<7%)3, sem aumento de peso ≥3% (cut‐off para considerar que não há manutenção do peso corporal8) ou hipoglicemia comprovada, observamos que quase metade dos doentes (com HbA1c inicial ≥7%) tratados com vildagliptina conseguiu atingir este objetivo. Significativamente mais doentes tratados com vildagliptina em associação a outro ADO conseguiram cumprir os CAP e CAS, comparativamente aos doentes tratados com quaisquer outras associações de 2 ADO. Esta diferença poderá ser explicada pela relativa facilidade de introdução da terapêutica com vildagliptina, que não carece de titulação e tem um perfil de tolerabilidade globalmente favorável, facilitando a utilização de doses ótimas e a manutenção da adesão terapêutica9. Inversamente, é pouco provável que tenham sido sempre utilizadas doses máximas dos ADO comparadores, devido em parte à preocupação existente acerca dos seus efeitos secundários potenciais. Este último aspeto demonstra a utilidade dos estudos realizados em ambiente real, como é o caso do estudo EDGE. Os estudos em ambiente real fornecem informação que poderá complementar os dados produzidos por ensaios clínicos aleatorizados e controlados e melhor traduzir as atitudes e resultados obtidos na prática clínica diária6. Esta observação é reforçada pelo facto dos resultados do estudo EDGE serem consistentes com os obtidos em ensaios aleatorizados e controlados. Numa análise post‐hoc de um ensaio aleatorizado, em dupla ocultação, de 2 anos de duração em doentes não controlados em monoterapia com metformina, a proporção de doentes que atingiu o critério de avaliação composto de HbA1c<7% sem hipoglicemia ou aumento de peso foi maior naqueles a quem foi associada vildagliptina do que naqueles que iniciaram glimepirida (29,8 versus 19,4% respetivamente, correspondente a uma taxa de sucesso relativa de 1,54 [IC a 95% 1,31‐1,80])10. A redução da HbA1c de −1,1% verificada no grupo de vildagliptina em ambiente real em Portugal é similar à observada na população global do estudo EDGE (−1,19%)7. Estes dados são consistentes com os resultados obtidos com vildagliptina em estudos aleatorizados e controlados globais com a mesma duração (12 meses) em doentes com DMT211–13. No que diz respeito aos aspetos de segurança das diferentes terapêuticas avaliadas neste estudo, é expectável que tenha ocorrido uma subnotificação de AA, tendo por base de comparação as taxas habitualmente notificadas em ensaios clínicos controlados11–13 e mesmo em estudos observacionais14,15. A deteção e notificação de AA basearam‐se num modelo de notificação voluntário por parte do médico, que é o método mais amplamente utilizado para identificar AA observados durante a utilização de fármacos na prática clínica, mas que poderá subestimar a verdadeira incidência de AA16,17. O número de eventos notificados no estudo EDGE reforça a necessidade de melhorar os procedimentos dos estudos observacionais nos aspetos relativos à colheita de dados de segurança, nomeadamente através da utilização de métodos de notificação combinados, que considerem, por exemplo, a notificação direta de AA por parte dos doentes participantes no estudo17.
Uma limitação deste estudo relaciona‐se com o facto dos seus resultados globais terem sido condicionados pela necessidade de uniformização e garantia da qualidade dos dados recolhidos. Necessariamente, esta situação obrigou a uma redução da amostra PP, utilizada para as análises de efetividade. Importa, no entanto, salientar que, após a exclusão dos registos em que a fonte de documentação não era adequada ou a qualidade/exatidão dos dados não podia ser garantida, foram identificados desvios ao protocolo em apenas 8 doentes, o que sugere uma qualidade global favorável dos dados recolhidos e analisados. Por outro lado, esta é uma análise post‐hoc e, como tal, partilha todas as limitações das análises secundárias. Por fim, o desenho aberto do estudo permitiu aos médicos selecionar qualquer fármaco tendo por base a sua decisão clínica. Esta situação resultou num desequilíbrio no número de doentes incluídos em cada braço de tratamento (4.568 doentes alocados para vildagliptina e 2.247 doentes alocados para o grupo comparador). No entanto, as características iniciais de ambas as coortes eram semelhantes, permitindo a comparação entre tratamentos.
Os resultados do estudo EDGE em Portugal demonstraram que, comparativamente aos dados obtidos a nível global7, a decisão de introdução de um segundo ADO ocorreu para valores médios inferiores de HbA1c (7,8%±1,3 versus 8,2±1,3). Este facto sugere que em Portugal há atualmente uma menor inércia na decisão de intensificação da terapêutica da diabetes, comparativamente a outros países, o que está de acordo com os esforços que têm sido desenvolvidos no sentido de demonstrar a importância do controlo glicémico rigoroso e precoce na prevenção das complicações da diabetes18, tendo por base as evidências obtidas a partir dos dados a longo prazo do estudo UKPDS19. De forma concordante com esta observação, importa destacar o nível médio de HbA1c de 6,6% apurado pelo Observatório Nacional da Diabetes1 entre os doentes do Serviço Nacional de Saúde, que traduz os resultados do investimento no controlo da doença.
O estudo EDGE demonstrou, num ambiente clínico real, que nos doentes com DMT2 nos quais é necessário introduzir um segundo ADO por falência da monoterapia, a vildagliptina poderá conseguir uma redução da HbA1c para valores<7%, sem aumento de peso, hipoglicemia ou edema periférico numa proporção maior do que com outras associações duplas de ADO.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
FinanciamentoO estudo EDGE foi inteiramente financiado e monitorizado pela Novartis Pharma AG.
Conflito de interessesO autor João Miguel Fernandes é funcionário da Novartis Farma SA. O autor Giovanni Bader é funcionário da Novartis Pharma AG.
Os autores gostariam de agradecer a todos os investigadores que participaram no recrutamento de doentes e recolha de dados para o estudo EDGE em Portugal, que se listam de seguida: Abílio Soares Vales, Acácio Fernandes, Acácio Pinto, Adelino Correia, Adriano Jorge, Adriano Oliveira, Águeda Chantre, Alberta Gomes Cruz, Alberta Ramalhão, Alberto Luís Loureiro, Alberto Tavares da Costa, Alberto Palla Beirão, Alcides Carvalho Grade, Alex Kaluza Francis, Alexandra Marujo, Alexandra Rabaçal, Alice Sampaio, Almiro Óscar Mateus, Álvaro Abreu Herdade, Álvaro Mendonça, Américo Fernandes, Ana Faustino, Ana Felício, Ana Figueiredo, Ana Gonçalves, Ana Evangelista, Saque, Ana Maria Fernandes, Ana Maria Santos, Ana Paula Costa, André Azevedo, António Miguelote Castro, António Bernardo, António Campos, António Castro Fonseca, António Espírito Santo, António Fonseca, António Ferreira Reis, António Gomes, António Horta Marques, António Lopes, António Moura Leal, António Paixão Salvado, António Oliveira Pedro, António Leal, António Monteiro, António Moreira, António Magalhães, António Torres, António Santos Silva, António Bastos, António Gomes da Silva, António Sameiro Correia, António Manuel Serrano, António Marques Heitor, António Paixão, António Prestes Ribeiro, António Vinhas, António Silva e Sousa, António Simões Santos, António Xavier Sá, Armando Monteiro, Armando Neto Nogueira, Arminda Moutinho, Augusta Coelho, Augusta Rodrigues, Augusto Montalvão, Aurora Silva, Avelino Amorim, Aventino Dias Hora, Benedita Cavaleiro, Carla Pimentel, Carlos Parente Afonso, Carlos Abreu Pereira, Carlos Marques, Carlos Oliveira, Carlos Costa Moura, Carlos Borges Godinho, Carlos Fonseca, Carlos Gaspar Duarte, Carlos Luís Mendes Gonçalves, Carlos Macedo, Carlos Costa Gonçalves, Carlos Morais, Carlos Azevedo, Carlos Pinto Maymone, Carlos Pires Rodrigues, Carlos Ceia, Carlos Santos Neves, Carlos Silva Guardado, Carlos Vasconcelos, Carlos Ventura, Cecília Gaspar Pereira, Celso Almeida Silva, César Manuel Rodrigues, Clarisse Santana, Cláudia Bernardo, Cristina Maia Costa, Cristina Pinto, Cristino Agostinho, Custódio Silva e Castro, Daniel Dias, Dilermando Sobral, Domingos Carneiro Freitas, Duarte Aguiar, Edite Morais Duarte, Edith Proença, Eduardo Banito, Eduardo Miranda, Eduardo Vicente, Lucas Pedro, Elaine Morais Lins, Elsa Nunes, Elvira Nunes Santos, Emília Júlia Reis, Esmeraldo Almeida, Estevão Pape, Fátima Mira Fonseca, Fausto João Viegas, Fernando Augusto Sousa, Fernando Cruz Gomes, Fernando Fraga, Fernando Alves, Fernando José Santos, Fernando Marques, Fernando Neves Correia, Fernando Pereira, Fernando Silva, Fernando Sobral, Fernando Zagalo, Fernando Zenha, Filipa Mafra, Francisca Banha, Francisco Correia Júnior, Francisco Ferrer, Francisco Matos Silva, Francisco Rodrigues, Gentil Martins Dias Ferreira, Germano Cardoso, Gilberto Coutinho, Guido Pires, Helena Gonçalves, Helena Duarte, Henrique Machado, Henrique Santana, Henrique Gil da Costa, Henrique Carreira, Henrique Ribeiro, Hermenegildo Morgado, Hernâni Simões Pinho, Heroíno Silva Cabral, Hilário Campos, Hugo Barbedo, Humberto Ângelo, Ilda Lagoa, Isabel Rebelo, Isabel Aureliano, Isabel Betina, Isabel Brandão Canudo, Isabel Pedro, Isabel Pedrosa, Isabel Silva Palha, Joan Batcle Cortina, João António Cocharra de Almeida, João António Ferreira Silva, João Carvalho, João Cunha, João Gouveia, João Grilate, João Lobato Nunes, João Luís Silva Gomes, João Manuel Robalo, João Martim Rego, João Belbut, João Novais, João Pignatelli Soares, João Ponte, João Roque Reis, João Severino Rodrigues, João Silva, João Vieira Buisel, João Vilela Gonçalves, Joaquim Antunes Santos, Joaquim Martins Carvalho, Joaquim Neves Oliveira, Jorge Augusto Nunes, Jorge Caldeira, Jorge Gouveia, Jorge Manuel Magalhães, Jorge Santana, Jorge Marques Campos, Jorge Santos Silva, Jorge Silva, Jorge Toste, José Andrade Ferreira, José António Ferreira, José Alves, José Arnout Monroy, José Barriga, José Bernardes Correia, José Braz de Almeida Pires, José Carlos Singéis, José Cortez, José Dias Santos Costa, José Eduardo Silva Santos, José Faria, José Farinha Conceição, José Gabriel Martins, José Gabriel Silva, José Henriques Viegas, José Jacques Pena, José Jorge Brás, José Júlio Matos, José Rodriguez, José Lima Martins, José Luís Figueiredo, José Luís Matos Cunha, José Maia, José Pires, José Manuel de Oliveira Santos, José Manuel Dionísio, José Manuel Lourenço, José Manuel Valbom, José Marques Gonçalves, José Matos Silva, José Morais Morgado, José Batista, José Ogando, José Pereira Fernandes, José Ramos, José Rego, José Ribas Fernandes, José Sampaio, José Silva, José Silva Ferreira, José Timóteo Rendeiro, José Tomé Ramos, Julieta Maria Octávio, Júlio Oliveira, Leopoldo Miguel Cruz, Lígia Cardoso Silva, Luís Borges Alves, Luís Capela, Luís Correia, Luís Lamas, Luís Lourenço, Luís Madeira Pereira, Luís Martins, Luís Oliveira Soares, Luís Quinhones Levy, Luís Sequeira, Luís Sousa, Luísa Gonçalves, Luísa Pepe, Maria Conceição Mendes, Manuel a Pinto, Manuel Costa, Manuel Batista, Manuel a Ramos, Manuel Castro Macedo, Manuel Cruz Ferreira, Manuel Fernandes da Silva, Manuel Florindo Maia, Manuel Godinho, Manuel Gomes, Manuel Inácio Monteiro, Manuel Monteiro Silva, Manuel Ribeiro de Freitas, Manuel Sá Nogueira, Manuel Vicente Silva, Manuela Muralha, Mara Beatriz Souza, Marco Anez Anderson, Margarida Oliveira, Maria Adelaide Fernandes, Maria Alcina Bastos Machado, Maria Alexandra Duarte, Maria Amélia Sinfrónio, Maria Assunção Real, Maria Augusta Borges, Maria Carballo, Maria Clara Mascarenhas, Maria Cristina Preto, Maria de Fátima Cardoso, Maria de Fátima Faria, Maria do Céu Martins, Maria Fernanda Duarte, Maria Gertrudes Magalhães, Maria Goreti Ferreira Alves, Maria Graça Gonçalves, Maria Helena Martins, Maria Isabel Braisinha, Maria João Marinho, Maria José Branco, Maria José do Carmo, Maria Lurdes Moreira, Maria Luz Semedo, Maria Madalena Jerónimo, Maria Otília Colleo, Maria Teresa McGuire, Mário Esteves, Mário Joaquim Pereira Pinto, Mário José Mendonça, Mário Nélson Cordoeiro, Mário Vianna Pereira, Miguel Santos Leite, Miguel Forjaz, Mireia Serrano Sarlé, Napoleon Sanchez, Narciso José Monteiro, Nazaré Guimarães, Nélson Melo, Nuno Campos, Nuno Rodrigues Santiago, Óscar Loureiro, Paula Freitas, Paula Maria Moura, Paulo Abrantes Fonseca, Paulo Abreu, Paulo Almeida, Paulo Miranda Simões, Paulo Pessanha Andrade, Pedro Miguel Coelho, Pedro Rigaud Abreu, Raúl Aníbal Carvalho, Raúl Chagas, Raúl Torres, Ricardo Moura, Rosa Fátima Ribeiro, Rui Cernadas, Rui Albuquerque Soares, Rui Gonçalves, Rui Bartolo Vaz, Rui Correia Costa, Rui Malheiro Santos, Rui Manuel Alves, Rui Pereira Neves, Rute Andrade Pereira, Sara Vasconcelos Zeferino, Serafim Rosas, Susana Cortez Almeida, Teotónio Silva Castro, Teresa Camurça, Vasco Manuel Carreira Silva, Victor Brandão, Virgílio Schneider, Virgínia Rodrigues, Vítor Pimpão.