Os disruptores endócrinos (DE) são substâncias exógenas ao corpo humano e que interferem na síntese, secreção, transporte, metabolismo ou eliminação das diferentes hormonas. Nele se inclui um grupo muito heterogéneo de compostos, que vão desde químicos sintéticos a alguns produtos constituintes naturais de algumas plantas. A avaliação do seu impacto na saúde é extremamente difícil, mas sabe‐se atualmente que existem diversas patologias em que estas substâncias podem ter um papel determinante, como causadoras ou amplificadoras das suas manifestações.
A exposição das crianças às ações dos disruptores endócrinos é particularmente preocupante. As crianças têm frequentemente contato com o solo e plantas, levando mãos e objetos à boca, bebem, comem e respiram proporcionalmente mais do que os adultos, e o seu metabolismo mais rápido torna‐as particularmente susceptíveis à ação tóxica destes produtos. A exposição durante a vida fetal e perinatal, em fases críticas do desenvolvimento pode ter múltiplas repercussões negativas a longo prazo. Os autores fazem uma breve revisão do atual conhecimento nesta área e das principais repercussões em patologias endócrinas que lhe estão associadas.
É necessário que a comunidade científica se mantenha empenhada neste tema e que a população se informe ativamente acerca do risco devido à presença destas substâncias, alterando comportamentos e promovendo medidas de evicção, sobretudo no feto e na criança
Endocrine disruptors (ED) are exogenous substances to the human body and that interfere with the synthesis, secretion, transport, metabolism or elimination of various hormones. These substances are a very heterogeneous group that includes multiple products, from synthetic chemicals to other substances which are present in some plants. The assessment of their impact on health is extremely difficult, but we know now that there are several diseases in which they have a decisive role, either causing the disease itself or aggravating it.
Exposure to endocrine disruptors in children is a major concern due to the frequent contact with potentially contaminated soil. Besides, children eat, drink and breathe more per body weight compared with adults, and their fast metabolism ensures a higher level of risk. Their exposure to these products ensues in the fetal and perinatal period, in a very important period of their development, unleashing negative consequences on the long run.
It is necessary that the scientific community studies this subject and that the people gets informed about the risks related to these substances, changing behaviors and promoting avoiding measures, mainly concerning the children. The authors review some of the current knowledge in this area, and the main endocrine pathologies associated, seeking to foster reflection on this subject.
No mundo industrializado em que vivemos, inebriados pelos avanços tecnológicos que aumentam o nosso conforto e bem‐estar, é relativamente fácil ignorar as consequências e repercussões negativa resultantes da grande utilização de produtos químicos que de forma intensiva são usados em vários setores industriais.
Nas últimas décadas temos assistido a um significativo aumento da prevalência de desvios do desenvolvimento fisiológico normal e na incidência de muitas patologias pediátricas anteriormente consideradas raras1. Em muitas destas situações a fisiopatologia não está esclarecida e esse desconhecimento permite especular que na sua génese possam estar envolvidos fenómenos de desregulação endócrina.
A tomada de consciência deste problema é, para além de uma preocupação da sociedade atual, um tema importante de debate na comunidade científica internacional que procura respostas sobre qual a repercussão e mecanismos de ação dos contaminantes ambientais na saúde infantil e juvenile, e suas consequências a longo prazo.
Por disruptores endócrinos (DE) designam‐se todas as substâncias exógenas ao corpo humano e que possam interferir na síntese, secreção, transporte, metabolismo ou eliminação das diferentes hormonas2.
Nelas se inclui um alargado e heterogéneo grupo de compostos, tais como químicos sintéticos usados em solventes industriais e os seus derivados (bifenilos policlorados – PCB, dioxinas), em plásticos (bisfenol A – BPA, ftalatos), nos pesticidas (metoxicloro, cloropirifos, diclorodifeniltricloroetano – DDT), em fungicidas (vinclozolina), em vários produtos farmacêuticos (dietilestilbestrol – DES) e em conservantes (parabenos).
Para além destes, também na nossa cadeia alimentar é possível encontrar disruptores endócrinos constituintes naturais de muitas plantas. São globalmente designados por fitoestrogénios, de que são exemplo as isoflavonas, que existem em quantidades consideráveis em certas plantas como a soja3.
Com este trabalho, os autores têm como objetivo fazer uma breve revisão do estado atual do conhecimento relativo a este tipo de substâncias e de qual o seu impato na saúde infantil e juvenil.
Como em muitas outras situações, também nesta em particular as crianças constituem um grupo de maior risco. No decurso das suas atividades lúdicas com facilidade contactam diretamente com o solo e plantas que os podem expor, de forma inadvertida, a doses elevadas de alguns destes produtos. As crianças, sobretudo as mais jovens, têm uma frequência respiratória mais elevada, o que condiciona a possibilidade de, em ambientes contaminados, terem uma maior inalação de eventuais produtos tóxicos. O facto de a relação entre o volume de líquidos e de alimentos ingeridos e o peso corporal ser superior ao verificado nos adultos, justifica que haja uma maior quantidade relativa de ingestão de substâncias tóxicas.
A exposição a substâncias com capacidade de disrupção endócrina pode começar muito cedo, mesmo in‐utero, através da passagem trans‐placentária, ou logo na fase perinatal.
A exposição muito precoce a estas substâncias comporta um risco imediato mais elevado devido à imaturidade de todos os sistemas fisiológicos do neurodesenvolvimento, mas implica também um maior risco ao longo da vida do individuo, pelas respostas adaptativas que condiciona e pelo aumento exponencial de exposição que condiciona a probabilidade de surgirem patologias.
MétodosOs autores efetuaram uma pesquisa bibliográfica extensa, a partir da base pubmed, utilizando como palavras‐chave: disruptores endócrinos, bisfenolA, parabenos, ftalatos e dioxinas.
Foram revistos artigos publicados desde 0 ano 2000 até à presente data, procurando incluir toda a bibliografia relevante. Excepcionalmente serão mencionados artigos anteriores a esta data, pela sua importância e impacto em investigação posterior.
RevisãoO mecanismo de ação dos DE é ainda em grande parte desconhecido. As ações dos DE podem ser mediadas pela ligação direta quer a sistemas enzimáticos quer a receptores nucleares ou de membrana, esteroides e não esteroides, incluindo neurotransmissores3.
A ligação a estes receptores resulta na estimulação ou inibição dos mecanismos de transcrição ou pós‐transcrição celular, interferindo com a atividade dos canais de iões ou de proteínas que actuam como segundos mensageiros4.
Há várias razões que justificam a dificuldade da avaliação do impacto das ações dos DE na saúde, nomeadamente em idades pediátricas. Algumas substâncias com capacidade de disrupção endócrina, embora actualmente de uso proibido, por serem de lenta degradação podem ainda ser detetadas no meio ambiente, sendo o seu impacto na saúde proporcional à anterior utilização. A migração das populações leva a exposição a diferentes substâncias que mesmo dentro da mesma área geográfica pode variar com o estilo de vida.
Por outro lado, embora do ponto de vista experimental, seja comum avaliar o efeito de cada uma destas substâncias isoladamente, a realidade é que no ambiente elas co‐existem, e é portanto expectável que possam interagir entre si, podendo o seu efeito ser aditivo, sinérgico ou de potenciação5.
Os DE encontram‐se em abundância na cadeia alimentar, pelo que o ser humano é o candidato prioritário para a potencial ingestão e acumulação de produtos tóxicos3. Em geral, os DE têm uma baixa solubilidade na água, mas como são lipossoluveis, acumulam‐se no tecido adiposo3.
A exposição a estas substâncias pode ocorrer também por inalação ou por contacto com a pele. Para qualquer tipo de exposição, as ações daí resultantes dependem da susceptibilidade individual, diferente e dependente das características genéticas de cada indivíduo.
Outras das dificuldades que se colocam ao investigar os efeitos da exposição a estes produtos tem a ver com o seu período de latência, que leva a que muitas manifestações só apareçam muito tardiamente.
É conhecido que existem determinadas fases na vida em que há uma maior vulnerabilidade à ação de mecanismos desreguladores cujos efeitos se podem manifestar muitos anos depois. É o que está implícito no conceito de “base fetal da doença adulta”, como foi sugerido por Barker em 1997, propondo que as fases de desenvolvimento fetal e neonatal são um período crítico de elevada susceptibilidade a fenómenos de desregulação que pode levar a mecanismos fisiopatológicos adaptativos que condicionam o futuro desenvolvimento6,7.
As substâncias com capacidade de disrupção endócrina existem no meio ambiente nos mais diversos contextos.
Os PCB (bifenilos policlorados) são compostos que foram intensamente utilizados na indústria até aos anos 70, data a partir da qual o seu uso foi proibido. Eram utilizados em óleos, lubrificantes e isolantes elétricos. Como resultado da sua utilização alargada e em quantidades maciças, ainda permanecem como um dos contaminantes ambientais mais importantes2.
As dioxinas são substâncias obtidas como subproduto de processamentos industriais, devido à combustão incompleta de compostos orgânicos. Provêm de incineradores, desperdícios de fábricas, combustão de petróleo e derivados. O ser humano está exposto às suas ações de modo direto através de emissões efetuadas para a atmosfera e de modo indireto, por contaminação da água, solo e alimentos8.
Os ftalatos são utilizados na manufatura de plásticos flexíveis, pavimentos, tintas plásticas, vernizes e instrumentos médicos, como os cateteres. Existem também em sabões e champôs9. A sua semi‐vida no organismo é de horas, sendo metabolizados rapidamente e excretados nas fezes e urina.
Os parabenos são substâncias usadas sobretudo em produtos de cosmética e alguns na indústria alimentar. A sua absorção por via cutânea é muito elevada, sendo metabolizados a nível hepático com os seus metabolitos a ser excretados na urina. Condicionam fenómenos de mimetismo estrogénico10.
Os compostos perfluorados são uma classe de substâncias que pelas suas propriedades são utilizadas na produção de materiais resistentes às manchas, óleos e água, sendo o constituinte de muitos produtos de combate ao fogo11. Um dos mais conhecidos destes compostos é o Teflon.
A genisteína é uma substância presente na soja e que tem ações idênticas às dos estrogénios.
O BPA é um monómero sintético utilizado na produção de plásticos policarbonados e é um dos produtos com maior utilização a nível mundial. Entra na composição de grande parte do plástico das garrafas de água que bebemos diariamente. Até muito recentemente, era também utilizado no fabrico dos biberões plásticos. É ainda um componente importante dos selantes dentários, assim como dos cateteres utilizados em medicina. A sua produção anual estima‐se que seja de 1,7 milhões de toneladas.
Em países industrializados, foi demonstrada a presença de BPA em mais de 95% das pesquisas efectuadas em amostras de urina. Este produto tem a característica de contaminar em grande escala o ambiente por facilmente se separar das estruturas em que se encontra, quando há alterações da temperatura ou após a lavagem com substâncias ácidas ou alcalinas12 (tabela 1).
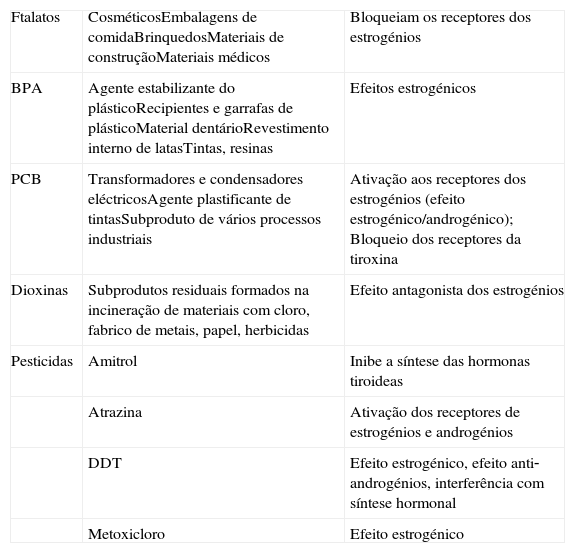
Disruptores Endócrinos ‐ Origem e efeitos hormonais
| Ftalatos | CosméticosEmbalagens de comidaBrinquedosMateriais de construçãoMateriais médicos | Bloqueiam os receptores dos estrogénios |
| BPA | Agente estabilizante do plásticoRecipientes e garrafas de plásticoMaterial dentárioRevestimento interno de latasTintas, resinas | Efeitos estrogénicos |
| PCB | Transformadores e condensadores eléctricosAgente plastificante de tintasSubproduto de vários processos industriais | Ativação aos receptores dos estrogénios (efeito estrogénico/androgénico); Bloqueio dos receptores da tiroxina |
| Dioxinas | Subprodutos residuais formados na incineração de materiais com cloro, fabrico de metais, papel, herbicidas | Efeito antagonista dos estrogénios |
| Pesticidas | Amitrol | Inibe a síntese das hormonas tiroideas |
| Atrazina | Ativação dos receptores de estrogénios e androgénios | |
| DDT | Efeito estrogénico, efeito anti‐androgénios, interferência com síntese hormonal | |
| Metoxicloro | Efeito estrogénico |
BPA: Bisfenol A; DDT: Diclorodifeniltricloroetano; PCB: Bifenilos Policlorados;
Em 2007, foi publicado o relatório do consenso obtido por um grupo de investigadores da área de toxicologia ambiental sobre as acções do BPA. Nele é relatado como evidente que o efeito do BPA no meio ambiente é detetado mesmo quando usado em doses muito baixas, que a sensibilidade a este agente varia ao longo da vida, que o BPA é capaz de induzir alterações epigenéticas e que está associado a alterações do sistema reprodutor e neuro‐comportamental12.
Em 2010, a FDA emitiu um aviso alertando para os potenciais riscos associados à utilização do BPA, sobretudo sobre a sua utilização no fabrico de biberões e no revestimento de latas de leite para lactentes13.
Quando as substâncias com capacidade de disrupção endócrina começaram a ser utilizadas em larga escala pela indústria, as empresas efetuaram vários estudos de segurança. Estes foram efetuados com base no conceito de dose‐efeito e pretendiam estabelecer um limite de dose para a sua utilização pelos seres humanos sem que houvesse o perigo de consequências nefastas. Verificou‐se no entanto que, relativamente aos DE, o seu efeito não é linearmente dependente da dose. Com algumas destas substâncias, verifica‐se que a curva dose‐efeito é similar à letra U, com doses muito pequenas a serem capazes de ter efeitos idênticos a doses mais elevadas em termos de disfunção endócrina12.
As alterações ao normal desenvolvimento neuro‐endócrino que se considera serem influenciadas pela presença de DE, podem ter nalguns casos um dimorfismo sexual mas em muitas situações não tem qualquer relação com o sexo do indivíduo.
Efeitos no sexo femininoPuberdade precoceNas últimas décadas, tem sido referido na literatura uma tendência crescente para o aparecimento precoce de sinais de desenvolvimento pubertário, sobretudo no sexo feminino14.
A idade média do aparecimento da menarca era de 17 anos no século XIX e estabilizou nos 12‐13 anos desde os anos 40 do século passado. Esta rápida evolução, ocorrida num tempo tão curto, seguramente que não tem a ver com modificações genéticas e estará provavelmente associada à modificação de factores ambientais e à melhoria das condições socioeconómicas.
Apesar da idade média do aparecimento da menarca se ter mantido estável ao longo das ultimas décadas, surgiram recentemente na literatura trabalhos referindo, na população americana, o aparecimento de telarca em idades bastante mais jovens levantando‐se a hipótese de haver uma “natural” antecipação do tempo da puberdade feminina.
Os mesmos resultados foram mais tarde referidos em estudos efectuados em alguns países europeus de certa forma confirmando que, actualmente, uma significativa parte das raparigas tem um desenvolvimento da glândula mamária em idades mais precoces. Como, apesar deste fenómeno, a idade média de aparecimento da menarca não se alterou de forma significativa é possível especular que este desenvolvimento mamário precoce possa traduzir apenas o prolongamento do tempo de desenvolvimento pubertário por variantes normais da puberdade15.
Os DE podem ser responsáveis pelo desenvolvimento precoce da glândula mamária através da sua capacidade de estimularem diretamente os receptores estrogénicos ou condicionarem um aumento da sua sensibilidade aos baixos níveis de estrogénios circulantes. Há também a possibilidade de os DE promoverem a nível do SNC um aumento da secreção de Hormona Libertadora de Gonadotrofinas (GnRH)16.
Foi através de estudos experimentais em animais no laboratório que primeiro se estabeleceu uma relação de causa e efeito entre a ação de substâncias DE e alterações pubertárias. Em ratos, a administração de metoxicloro (pesticida utilizado na agricultura) durante a gestação, provocou um desenvolvimento pubertário precoce nos descendnetes4. Este mesmo fenómeno foi obtido utilizando nas mesmas condições o BPA, as dioxinas e a genisteína.
Nos seres humanos a demonstração desta associação entre DE e alterações pubertárias resultaram de estudos após exposições acidentais a grandes quantidades destas substâncias. Em 1973, cerca de 4000 indivíduos estiveram expostos acidentalmente a grandes quantidades de compostos de Bifenilos Polibrominados (PBB). Verificou‐se que as suas filhas apresentaram uma idade mais precoce de aparecimento da menarca quando comparadas com as filhas de um grupo controlo que não tinha sofrido aquela exposição17.
Há vários artigos publicados na literatura demonstrando uma clara associação entre a ação de algumas substâncias com capacidade de DE, como por exemplo os ftalatos e o aumento da incidência de telarca precoce18,19.
Rasier et al.20 mostraram que os ratos submetidos in útero à exposição a DDT tinham precocidade sexual. Pode‐se especular que este mesmo fenómeno possa em parte ser observado no ser humano, onde se verifica um desenvolvimento sexual mais precoce nas meninas adoptadas em países desenvolvidos, mas provenientes de regiões em que a utilização do DDT como inseticida ainda é permitida. O mecanismo de ação do DDT que leva ao avanço da idade de início da puberdade ainda não é conhecido, mas pensa‐se que possa ser estabelecido precocemente verificando‐se mesmo quando se trata de uma exposição transitória20.
Síndroma de ovário poliquísticoA síndroma do ovário poliquístico, muito frequente nas adolescentes, caracteriza‐se por anovulação persistente, oligoamenorreia e hiperandrogenismo. Acompanha‐se por vezes de uma insensibilidade parcial à ação da LH (Hormona Luteinizante), com cerca de metade dos casos apresentando também obesidade e resistência à insulina, fatores que aumentam o risco futuro de patologia cardiovascular21. A SOP é a principal causa de diminuição da fertilidade.
Em estudos com animais, verifica‐se que os fetos submetidos in útero a elevadas concentrações de testosterona desenvolvem um fenótipo típico da SOP22. Pode‐se conceber que no ser humano, se durante a gestação ocorrer uma exposição fetal a DE com potente efeito androgénico isso possa resultar, mais tarde, no aparecimento durante a puberdade, de manifestações clínicas da SOP. Um estudo efetuado em mulheres com diagnóstico da SOP mostrou que estas tinham níveis plasmáticos mais elevados de BPA do que as de um grupo controlo sem doença23.
Cancro da mamaO cancro da mama é uma das patologias cuja incidência tem vindo a aumentar nos últimos anos. É possível que a exposição a múltiplas substâncias ambientais seja um fator a considerar na sua etiologia, pois não é de esperar que haja alterações genéticas na população que ocorram em tão curto espaço de tempo. Os DE com actividade xenoestrogénica, que têm um efeito indutor da proliferação celular, podem aumentar o período de crescimento dos ductos e dos alvéolos da glândula mamária que ocorre normalmente durante o ciclo menstrual e estar implicados no desenvolvimento desta patologia24,25.
Estudos efetuados em pacientes com cancro da mama, permitiram demonstrar que alguns DE podem modificar a atividade enzimática celular, provocando um aumento do número de células com maior capacidade de metastização26,27.
As filhas de mulheres tratadas com DES durante a gravidez, ao atingirem a 5a década de vida, apresentaram um risco 2,5 vezes superior de cancro da mama, fazendo pressupor que o efeito do DES se estabeleceu ainda in utero24. Em estudos de experimentação animal obtiveram‐se resultados idênticos como quando foram utilizadas as dioxinas26 ou BPA27.
Sexo masculinoInfertilidadeUm dos efeitos mais frequentemente associado à ação dos DE é o aparecimento de oligospermia e diminuição da fertilidade. Várias substâncias têm sido apontadas como responsáveis deste fenómeno, nomeadamente os ftalatos 12 e o PCB28,29. Na Dinamarca, em 2009, foi efetuado um estudo que envolveu 105 homens, com uma idade mediana de 19 anos, e que demonstrou a existência de uma associação entre os níveis séricos de compostos perfluorados e menor concentração de espermatozóides30.
Meeker et al. avaliaram, em 190 homens seguidos numa consulta de infertilidade, a relação existente entre a exposição ao BPA e a presença de oligospermia e/ou lesão do ADN dos espermatozóides, verificando que havia uma correlação positiva entre ambos31.
Alterações da genitáliaA criptorquidia e a hipospádias são alterações comuns do tracto genital masculino que afetam cerca de 2‐9 e 0,2‐1%, respetivamente, da população de recém‐nascidos do sexo masculino. A sua incidência apresenta uma marcada variação geográfica com um aumento significativo em algumas regiões, pensando‐se que possa ser devida à presença de ftalatos32.
A exposição prenatal a ftalatos e a BPA associa‐se a adrenarca mais tardia; se a exposição a estas substâncias ocorrer na infância, determina diminuição dos níveis de testosterona na puberdade33.
Hiperplasia e cancro da próstataO cancro da próstata é o tumor sólido mais frequente no sexo masculino. A hiperplasia benigna da próstata afeta cerca de 50% dos homens com mais de 50 anos34. Como a próstata possui receptores específicos para os estrogénios (ER alfa e beta) é provável que os estrogénios possam estar envolvidos na etiologia destas patologias.
A avaliação efetuada em mais de 55.000 agricultores que utilizavam correntemente pesticidas permitiu demonstrar a existência de uma correlação entre a taxa de incidência do cancro da próstata e a exposição a um fungicida (metilbrometo). Para além desta também foi encontrada a mesma correlação para outros 6 pesticidas dos 45 que foram usados. Todos os pesticidas eram metabolizados através do sistema do citocromo P450 que diminui a eliminação de compostos com efeito estrogénico35.
Um mecanismo similar foi demonstrado aquando da exposição a compostos da família dos PCB e hidrocarbonetos aromáticos polihalogenados (dioxinas, BPA e dibenzofuranos). Estes compostos inibem a atividade da sulfotransferase dos estrogénios, aumentando a sua biodisponibilidade para atuar nos órgãos alvo34.
Num trabalho publicado em 2006, Hardell et al. verificaram que no homem, os níveis de PCB no tecido adiposo se correlacionavam positivamente com a presença de cancro da próstata36.
Em vários estudos de experimentação animal foi encontrada uma relação positiva entre a exposição fetal a DES e o aparecimento de anomalias da próstata adulta, incluindo um risco aumentado de carcinogénese37.
As doses de BPA a que os seres humanos estão expostos regularmente em países desenvolvidos são capazes de induzir o crescimento celular em neoplasias prostáticas38. Em experimentação animal, a exposição fetal e/ou neonatal a doses baixas de BPA induz o aparecimento de atipia severa nas células prostáticas do adulto mesmo exposto a níveis normais de estrogénios e testosterona39. Há um mecanismo epigenético, com metilação anormal do genoma em áreas que induzem ou frenam a transcrição de determinados genes responsáveis pelo aumento da carcinogénese39.
Efeitos neuroendócrinosO sistema neuro‐endócrino que efectua a conexão entre o sistema nervoso central e os sistemas endócrinos, pode ser um dos alvos da ação disfuncional dos DE.
A influência da ação de PCB e pesticidas organoclorados a nível hipotalâmico provoca alterações da secreção da Hormona Libertadora de Gonadotrofinas (GnRH), sendo este efeito dependente da dose mas de resposta variável40.
Os DE podem atuar nos receptores hormonais presentes nas células hipotalâmicas e hipofisárias, que através de efeitos de retrocontrolo positivo ou negativo, modulam a atividade hormonal destas áreas.
Como foram identificados numerosos neurotransmissores que são sensíveis à ação de disruptores endócrinos, é possível conceber que da sua alteração resultem repercussões na capacidade cognitiva, de aprendizagem ou de memória40.
Como alguns xenoestrogénios interferem com a atividade do transportador da dopamina é possível colocar a hipótese de haver uma ligação entre o recente aumento das patologias neurodegenerativas e a presença de disruptores endócrinos41.
Efeitos sobre tiroideA ação dos DE pode interferir com a entrada do iodo na célula tiroidea impedindo a normal síntese de hormonas tiroideas. É o mecanismo de ação do perclorato, químico presente de modo disseminado na água. A capacidade de interferência na síntese de hormona tiroideia surge mesmo com doses muito baixas, estando a sua concentração muito aumentada no leite materno42. O seu efeito depende da quantidade de iodo presente no ambiente, sendo que em áreas com depleção de iodo, a exposição simultânea a este químico desencadeia hipotiroidismo.
As isoflavonas, presentes na soja têm capacidade para bloquear a enzima tireoperoxidase (TPO). Labib et al. e Chorazy et al. publicaram artigos onde são relatados casos de bócio desencadeados pela ingestão de produtos, destinados à alimentação de lactentes, mas contendo soja43,44.
Os compostos com BPA têm a capacidade para bloquear os receptores da tiroxina45, o que poderá resultar no aparecimento de hipotiroidismo.
A ingestão pelo lactente, de fórmulas à base de soja, implica um maior risco de tiroidite auto‐imune na segunda década de vida46. Os níveis séricos de PCB em jovens adolescentes estão também associados a um maior risco desenvolvimento de tiroidite auto‐imune47.
Obesidade e síndroma metabólicoTem havido um aumento explosivo da incidência de excesso de peso e obesidade em todas as faixas etárias, mas de forma preocupante nas idades mais jovens. Isto tem sucedido tanto nos países desenvolvidos como naqueles em vias de desenvolvimento, nestes frequentemente coexistindo com malnutrição. Este surto de obesidade tem sido atribuído a modificações do estilo de vida, com uma ingestão alimentar excessiva associada a diminuição da atividade física.
Um dos primeiros investigadores a colocar a hipótese de existir uma associação entre a obesidade e a ação dos DE foi Baillie‐Hamilton PF que, em 2002, publicou um trabalho sobre a associação entre a obesidade e o marcado aumento na utilização de produtos químicos, a partir dos anos 1940‐5048. Este autor cita numerosos estudos em que se relata a influência de vários produtos no desencadear de obesidade. A hipótese de explicação para este fenómeno então colocada passava pela alteração provocada no sistema hormonal, na sensibilidade aos neurotransmissores e na regulação do sistema nervoso simpático.
Existem alguns estudos epidemiológicos em que se refere que a exposição a DE durante algumas fases do desenvolvimento poderá estar associada ao aparecimento ulterior de excesso de peso e obesidade49.
Em experimentação animal, o aparecimento de obesidade na puberdade ou na idade adulta depende da quantidade, da duração e da idade da exposição fetal, a DES49.
A partir de 2006, foram publicados artigos que introduziram o conceito de “obesogénio” para caracterizar substâncias que regulam inapropriadamente o metabolismo lipídico promovendo a obesidade50.
Os níveis de BPA a que se encontra frequentemente exposto o ser humano, provocam um hiperinsulinismo transitório que se mantido ao longo do tempo, pode resultar em resistência à ação da insulina51. O BPA inibe a libertação de adiponectina, uma hormona libertada pelo adipócito e que promove uma melhor da resposta à insulina52.
O BPA tem capacidade para induzir a diferenciação de células 3T3‐L1 (fibroblastos do rato, com capacidade para se diferenciarem em adipócitos) em adipócitos, assim como aumentar a sua proliferação53.
Existem alguns estudos que procuram relacional a exposição prenatal a DE com o Índice de massa corporal (IMC), em crianças e adolescentes. Delvaux et al. investigaram a relação entre a exposição prenatal a algumas destas substâncias, nomeadamente cádmio, e a composição corporal de crianças entre os 7‐9 anos de idade, tendo encontrado uma relação negativa entre ambos, no sexo feminino. Ou seja, quanto maior a exposição prenatal a cádmio, menor o IMC e o perímetro abdominal. Isto demonstra a existência de uma relação entre a exposição prenatal a DE e a influência tardia destes sobre a composição corporal54.
Sabe‐se que a desregulação das hormonas com ação neuropeptídica interfere com a atividade neuronal hipotalâmica, podendo levar à obesidade. Este equilíbrio é facilmente alterado pela presença de DE que apresentem capacidade estrogénica, através de uma interferência a nível do comportamento alimentar e da própria taxa metabólica basal. Uma outra via de influência dos DE pende‐se com a sua ligação ao sistema de endocanabinoides, provocando um efeito orexigenico central52 (tabela 2).
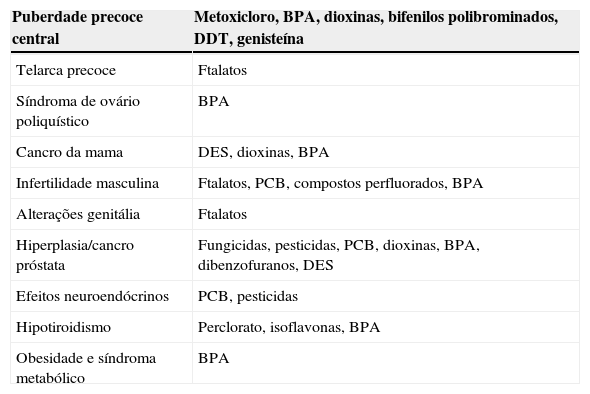
Disruptores endócrinos – Principais patologias associadas
| Puberdade precoce central | Metoxicloro, BPA, dioxinas, bifenilos polibrominados, DDT, genisteína |
|---|---|
| Telarca precoce | Ftalatos |
| Síndroma de ovário poliquístico | BPA |
| Cancro da mama | DES, dioxinas, BPA |
| Infertilidade masculina | Ftalatos, PCB, compostos perfluorados, BPA |
| Alterações genitália | Ftalatos |
| Hiperplasia/cancro próstata | Fungicidas, pesticidas, PCB, dioxinas, BPA, dibenzofuranos, DES |
| Efeitos neuroendócrinos | PCB, pesticidas |
| Hipotiroidismo | Perclorato, isoflavonas, BPA |
| Obesidade e síndroma metabólico | BPA |
BPA: Bisfenol A; DDT: Diclorodifeniltricloroetan.
Esta é uma área do conhecimento médico importante, atual e original e que se que se encontra em franca expansão. É um dado adquirido que existem substâncias que funcionam como contaminantes ambientais e que são susceptíveis de causarem doença.
Muitas das patologias implicadas têm mecanismos epigenéticos que se estabelecem precocemente “in utero” ou logo após o nascimento, sendo fundamental aplicar aquilo que é referido nos Consensos da “Endocrine Society”, como o princípio da precaução. As populações devem ser informadas acerca destes temas e tomadas medidas, quer a nível governamental quer individual de modo a tentar minimizar o efeito, ainda parcialmente desconhecido, da exposição a estas substâncias.
Em 2011 a European Society for Paediatric Endocrinology (ESPE) e a Pediatric Endocrine Society (PES) publicaram um “Call For Action Statement”com o objetivo de alertar os endocrinologistas pediátricos para o papel dos disruptores endócrinos na sua actividade clínica e de investigação55.
É imperioso aumentar o grau de conhecimento médico relativo à presença deste tipo de substâncias no nosso país. Na actividade clínica diária e perante algumas situações patológicas, é necessário considerar a influência de poluentes ambientais, e ponderar a sua pesquisa e doseamento.
Não é demais salientar o papel do Pediatra neste contexto, devendo assumir um papel ativo na sociedade, de modo a difundir estes conhecimentos no âmbito da saúde infantil e juvenil. A principal recomendação que emerge dos Consensos referidos anteriormente é a necessidade de informar a população acerca do risco devido à presença destas substâncias, implicando alterações de comportamentos e medidas de evicção, sobretudo no feto e na criança.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflitos de interessesOs autores declaram não haver conflito de interesses.