Estudar o uso de soluções e suspensões orais magistrais em recém‐nascidos e crianças de um hospital universitário.
MétodosFoi feito um estudo descritivo a partir da análise dos formulários de solicitação de manipulação do hospital estudado referentes aos pacientes da UTI‐neonatal, obstetrícia, pediatria e emergência pediátrica de janeiro de 2012 a dezembro de 2013. As frequências das solicitações e dispensações desses medicamentos foram avaliadas e o consumo de cada princípio ativo das preparações foram expressos sob a forma de número de infant defined daily dose (iDDD) e de iDDD/100 leitos‐dia.
ResultadosForam analisados 657 formulários – média mensal de 27 preparações pediátricas. A UTI‐neonatal foi responsável por 69,6% dessas solicitações. Foram usados 21 itens de medicamentos, destacou‐se o uso de ácido folínico (88 solicitações), sulfadiazina (85) e captopril (73). O consumo de princípio‐ativo nessas preparações variou, em número de iDDD, de 7,5 (hidralazina) a 16.520 (ácido fólico) e em número de iDDD/100 leitos‐dia da UTI‐neonatal, de 0,1 (sulfato de zinco) a 146,1 (ácido fólico).
ConclusõesO consumo constante das soluções e suspensões orais magistrais pelos recém‐nascidos e crianças do hospital estudado indica a necessidade dessas preparações como opção terapêutica pediátrica nesse hospital.
Study the use of magistral oral solutions and suspensions in infants and children at a university hospital.
MethodsThis is a descriptive study based on the analysis of the assessed hospital's magistral drug request forms regarding the patients in the neonatal ICU, Obstetrics, Pediatrics and Pediatric Emergency from January 2012 to December 2013. The frequency of drug requests and dispensation was evaluated and the consumption of each active ingredient of the preparations was expressed as number of “infant defined daily dose” (iDDD) and of iDDD/100 bed‐days.
ResultsA total of 657 forms were analyzed – a monthly average of 27 pediatric preparations. The neonatal ICU accounted for 69.6% of these requests. Twenty‐one drug items were used, of which the most common were folinic acid (88 requests), sulfadiazine (85) and captopril (73). The consumption of the active principle in these preparations varied in number of iDDD, from 7.5 (hydralazine) to 16,520.0 (folic acid), and in number of iDDD/100 bed‐days in the neonatal ICU, from 0.1 (zinc sulfate) to 146.1 (folic acid).
ConclusionsThe constant consumption of magistral oral solutions and suspensions by newborns and children of the assessed hospital indicates the need for such preparations as a pediatric therapeutic alternative in this hospital.
Os recém‐nascidos e crianças passam por mudanças fisiológicas ao longo do seu desenvolvimento que interferem na farmacocinética e, consequentemente, na segurança e efetividade do tratamento farmacológico na pediatria. Por isso, são necessários estudos em cada subpopulação pediátrica em que seu uso é pretendido para avaliação de segurança e eficácia dos medicamentos pediátricos.1
No entanto, existe uma escassez de medicamentos pediátricos na indústria farmacêutica, o que pode ser explicado por questões econômicas, éticas e técnicas. Isso faz com que as preparações magistrais sejam opções vantajosas para a obtenção de medicamentos com forma farmacêutica adequada para o uso pediátrico, pois permitem flexibilidade nas doses e facilidade na administração do medicamento.1,2
No Brasil, a preparação de medicamentos manipulados deve obedecer às normas da Resolução da Diretoria Colegiada (RDC) 67/2007, que dispõe sobre Boas Práticas de Manipulação de Preparações Magistrais e Oficinais para Uso Humano em farmácias.3 Para obtenção de soluções e suspensões orais magistrais, a primeira escolha é a manipulação a partir da substância ativa; no entanto, essas também podem ser obtidas por diluição de uma fórmula líquida (por exemplo, diluição de um injetável), desde que seja compatível com a administração oral, por pulverização de comprimidos e por retirada do pó do invólucro da cápsula.4
Este estudo tem o objetivo de avaliar o uso de soluções e suspensões orais magistrais em recém‐nascidos e crianças hospitalizados.
MétodoFoi feito um estudo descritivo, retrospectivo, a partir da análise documental dos formulários de solicitação de manipulação de preparações líquidas orais para recém‐nascidos e crianças do Hospital Universitário Antônio Pedro (Huap), da Universidade Federal Fluminense (UFF), referentes a janeiro de 2012 a dezembro de 2013. Esse hospital é de nível terciário e quaternário, tem 287 leitos e atende à população da Região Metropolitana II do Estado do Rio de Janeiro.
As preparações líquidas orais pediátricas mencionadas neste estudo foram produzidas na farmácia de manipulação da UFF, sob responsabilidade e orientação do farmacêutico, com formulações baseadas em literatura científica, prazo de validade e embalagem adequados, com indicações de armazenamento corretas e com procedimentos de controle de qualidade e de rastreabilidade do medicamento.
Foram calculadas as frequências das solicitações de manipulação das preparações líquidas orais pediátricas em relação: ao mês da solicitação; ao seu princípio ativo; à sua classificação Anatomical‐Therapeutic‐Chemical (ATC);5 e aos setores solicitantes.
As frequências da dispensação das soluções e suspensões orais magistrais foram analisadas em relação ao total de formas farmacêuticas líquidas de uso oral dispensadas pela Farmácia Hospitalar para a UTI‐Neonatal e para a Pediatria em 2013.
O consumo anual em número de infant defined daily dose (iDDD), que corresponde a 1/10da defined daily dose (DDD), foi calculado para cada princípio ativo dessas preparações, assumiu‐se o consumo total do produto manipulado. Foi também calculado, para os pacientes da UTI‐neonatal, o número de iDDD/100 leitos‐dia.6 Para o cálculo do número de leitos da UTI‐neonatal foi considerada a ocupação total dos leitos desse setor.
Ferramentas da estatística descritiva, tais como médias, desvio‐padrão, distribuições de frequências, foram empregadas para análise dos dados.
O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa da UFF (n° 765.880 de 08/08/2014).
ResultadosO estudo analisou 657 formulários de solicitação de manipulação de preparações líquidas orais destinadas a recém‐nascidos e crianças da UTI‐neonatal, obstetrícia (recém‐nascidos em alojamento conjunto), pediatria e emergência pediátrica.
Das clínicas de recém‐nascidos e crianças estudadas, a UTI‐neonatal foi o setor com o maior número de solicitações (457; 69,6%), seguida por pediatria (99; 15,1%), obstetrícia (71; 10,8%); emergência pediátrica (27; 4,1%) e setor não identificado (3; 0,4%).
Por mês foram solicitadas, em média, 27 soluções e suspensões orais magistrais (desvio‐padrão=9,8). Os meses com maior e menor número de solicitações foram março de 2013 (45 solicitações) e dezembro de 2012 e novembro de 2013 (ambos com 10 solicitações), respectivamente.
As classes mais solicitadas no período estudado de acordo com a classificação ATC foram: C – sistema cardiovascular (258 solicitações – principalmente de captopril, espironolactona e furosemina); J – anti‐infectivos de uso sistêmico (91 solicitações – principalmente de sulfadiazina) e V – variados (88 solicitações – correspondentes ao ácido folínico). E a classe menos solicitada foi a B – sangue e órgãos formadores de sangue (13 solicitações – correspondentes a ácido fólico e citrato de sódio).
Em 2013, 318 formas farmacêuticas líquidas de uso oral foram dispensadas para a UTI‐neonatal e 900 para a pediatria, das quais 209 (65,7%) e 40 (4,4%) eram soluções e suspensões orais magistrais, respectivamente.
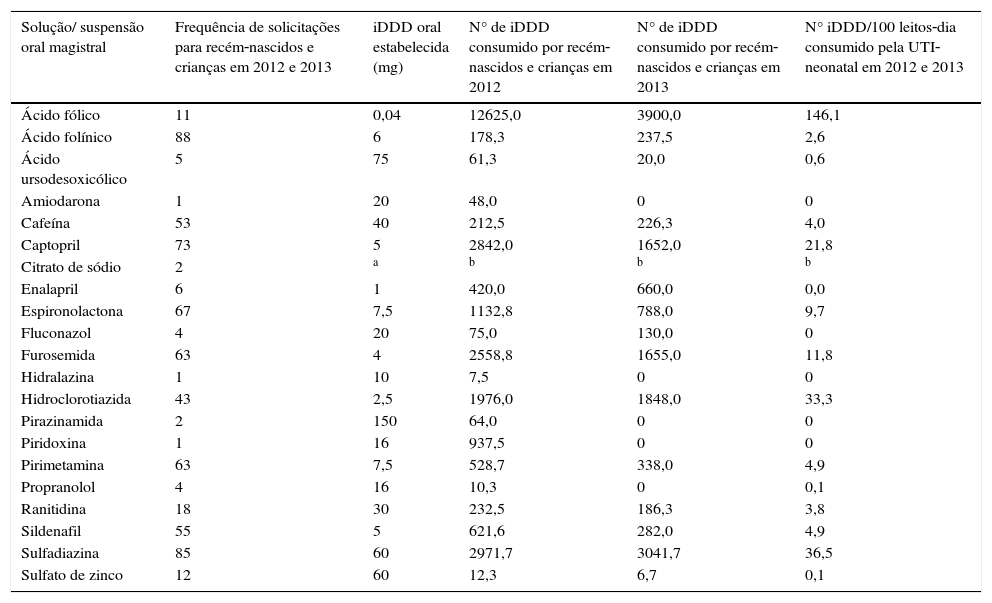
As frequências das solicitações de manipulação das soluções e suspensões orais pediátricas foram calculadas em relação ao princípio ativo solicitado dessas preparações usadas. Também foi calculado o consumo de princípio‐ativo pelo número de iDDD desses medicamentos nos recém‐nascidos e crianças e pelo número de iDDD/100 leitos‐dia dos pacientes da UTI‐neonatal (tabela 1).
Uso não‐licenciado das preparações orais líquidas manipuladas para os recém‐nascidos e crianças de um hospital em 2012 e 2013 (n=657)
| Solução/ suspensão oral magistral | Frequência de solicitações para recém‐nascidos e crianças em 2012 e 2013 | iDDD oral estabelecida (mg) | N° de iDDD consumido por recém‐nascidos e crianças em 2012 | N° de iDDD consumido por recém‐nascidos e crianças em 2013 | N° iDDD/100 leitos‐dia consumido pela UTI‐neonatal em 2012 e 2013 |
|---|---|---|---|---|---|
| Ácido fólico | 11 | 0,04 | 12625,0 | 3900,0 | 146,1 |
| Ácido folínico | 88 | 6 | 178,3 | 237,5 | 2,6 |
| Ácido ursodesoxicólico | 5 | 75 | 61,3 | 20,0 | 0,6 |
| Amiodarona | 1 | 20 | 48,0 | 0 | 0 |
| Cafeína | 53 | 40 | 212,5 | 226,3 | 4,0 |
| Captopril | 73 | 5 | 2842,0 | 1652,0 | 21,8 |
| Citrato de sódio | 2 | a | b | b | b |
| Enalapril | 6 | 1 | 420,0 | 660,0 | 0,0 |
| Espironolactona | 67 | 7,5 | 1132,8 | 788,0 | 9,7 |
| Fluconazol | 4 | 20 | 75,0 | 130,0 | 0 |
| Furosemida | 63 | 4 | 2558,8 | 1655,0 | 11,8 |
| Hidralazina | 1 | 10 | 7,5 | 0 | 0 |
| Hidroclorotiazida | 43 | 2,5 | 1976,0 | 1848,0 | 33,3 |
| Pirazinamida | 2 | 150 | 64,0 | 0 | 0 |
| Piridoxina | 1 | 16 | 937,5 | 0 | 0 |
| Pirimetamina | 63 | 7,5 | 528,7 | 338,0 | 4,9 |
| Propranolol | 4 | 16 | 10,3 | 0 | 0,1 |
| Ranitidina | 18 | 30 | 232,5 | 186,3 | 3,8 |
| Sildenafil | 55 | 5 | 621,6 | 282,0 | 4,9 |
| Sulfadiazina | 85 | 60 | 2971,7 | 3041,7 | 36,5 |
| Sulfato de zinco | 12 | 60 | 12,3 | 6,7 | 0,1 |
A necessidade do uso de preparações magistrais para lidar com a carência de formulações líquidas orais provenientes da indústria farmacêutica foi demonstrada neste estudo, que identificou 657 soluções e suspensões orais magistrais, relativas a 21 princípios ativos diferentes, que foram usadas no tratamento de recém‐nascidos e crianças do Huap em 2012 e 2013. Vale ressaltar que o hospital estudado tem como características principais: ser de natureza pública; prestar assistência de média e alta complexidade; fornecer atendimento ambulatorial especializado, urgência, emergência e internação hospitalar a pacientes do Sistema Único de Saúde; além de atividades de ensino (graduação, pós‐graduação, residência médica e multiprofissional) e pesquisa, perfil semelhante ao de outros hospitais universitários brasileiros.
Outros estudos também demonstram a necessidade dessas soluções e suspensões para a terapêutica pediátrica. Modificações de formas farmacêuticas foram relatadas por Oguz et al. e por Khdour et al., que identificaram, respectivamente, 20,5% e 5,8% de modificações em prescrições.7,8 Costa et al. verificaram 119 adaptações de medicamentos da forma sólida para a líquida e Gavrilov et al. identificaram duas modificações de formas farmacêuticas.9,10 Dos Santos e Heineck observaram que 79 itens de prescrição envolviam preparações extemporâneas.11 As preparações orais extemporâneas são medicamentos magistrais que devem ser usados em até 48 horas.3
Iniciativas regulamentares importantes foram desenvolvidas na Europa, nos Estados Unidos e na Austrália para aumentar o número de medicamentos pediátricos disponíveis, porém o Brasil ainda carece de uma regulação específica para registro e uso de medicamentos pediátricos e de uma política de incentivo à pesquisa em pediatria.9
As soluções e as suspensões orais manipuladas pela farmácia hospitalar ou originadas por modificação de forma farmacêutica feita pela enfermagem costumam ser estudadas na categoria de medicamentos de uso não licenciado. A definição de medicamentos de uso não licenciado em pediatria engloba os originados de modificações de medicamentos licenciados, como os modificados na forma farmacêutica, os sem autorização de órgão regulador para venda, os importados, os contraindicados e os que não têm informação para uso nessa população – embora haja divergências entre os especialistas.12,13
Os medicamentos de uso não licenciado e os de uso off label (uso não autorizado por uma agência reguladora) em pacientes pediátricos têm sido tema de vários estudos por ser frequentemente prescritos para essa população, principalmente para recém‐nascidos, apesar da alta frequência de reações adversas associadas a esses usos.13
Magalhães et al. verificaram que o uso não licenciado de medicamentos em pacientes pediátricos hospitalizados ocorre em diversos países, como: Brasil, Suécia, Croácia, Turquia, Estônia, Holanda, Palestina, França, Itália, Alemanha, Finlândia, Suíça, Sérvia, Espanha, Israel e Inglaterra.13 No Brasil, há poucos estudos sobre o uso de medicamentos magistrais em recém‐nascidos e crianças, concentram‐se em hospitais de apenas três cidades brasileiras: Fortaleza,9,14,15 Porto Alegre11,16 e Belo Horizonte.17,18
Observando o perfil das soluções e suspensões orais manipuladas para os recém‐nascidos e crianças do hospital estudado, verificou‐se que as soluções/suspensões desses princípios ativos também foram identificadas em outros estudos: ácido fólico,9,19 ácido folínico,9,20 ácido ursodesoxicólico,11,14 captopril,8,9,14,15,18,21 cafeína,12,16,19,22,23 espironolactona,9,24–28 fluconazol,17 furosemida,8,9,26 hidroclorotiazida,8,9,18,26,27 propranolol,10 ranitidina,9 pirimetamina17 e sulfadiazina.17 Portanto, observa‐se que a demanda das soluções e suspensões orais usadas nos recém‐nascidos e crianças deste estudo também foi verificada em outros trabalhos, constatou‐se que a manipulação de medicamentos é uma necessidade nacional e internacional devido à carência de formas farmacêuticas líquidas de uso oral provenientes da indústria farmacêutica.
No entanto, é importante ressaltar que alguns medicamentos que necessitam de manipulação para ser obtidos em formulação líquida oral em um determinado país podem ser disponíveis em outros. Nos Estados Unidos, por exemplo, são autorizados pelo FDA e vendidos em solução oral: cafeína, enalapril, fluconazol, furosemida, propranolol, ranitidina e sildenafil.29
Em relação aos destinatários das soluções e suspensões orais magistrais, observou‐se que, no hospital estudado, os recém‐nascidos são os principais destinatários dessas formulações e a UTI‐neonatal responsável por 70% dessas solicitações. Esse resultado está de acordo com o identificado por Magalhães et al., que apontam para o fato de que a maioria dos medicamentos de uso não licenciado é prescrita para recém‐nascidos e frequentemente para os nascidos pré‐termo.13
A comparação dos resultados de uso de medicamentos deste trabalho com os de outros estudos ficou prejudicada pelas divergências metodológicas. Outros autores escolheram analisar os medicamentos magistrais como um caso de medicamento de uso não licenciado e expressaram seus resultados como frequência relativa (%) de itens não licenciados nas prescrições, de prescrições que tinham itens não licenciados e/ou de pacientes que receberam medicamentos não licenciados. O presente estudo se fixou nas soluções e suspensões orais magistrais e expressou seus resultados, principalmente, por quantidade de princípio ativo consumida em miligramas, por número de iDDD e por número de iDDD/100 leitos‐dia. A opção pela apresentação dos resultados deste trabalho numa relação com iDDD foi baseada na recomendação feita pela OMS sobre o uso da DDD em estudos de uso de medicamentos.
Cabe ressaltar que o serviço de farmacotécnica, responsável por adequar princípios ativos e/ou medicamentos disponíveis no mercado para administração nos pacientes hospitalizados, é pouco presente em hospitais brasileiros,30 inclusive no hospital estudado. Desse modo, é de grande importância o convênio com a farmácia de manipulação para viabilizar a obtenção dos medicamentos magistrais necessários ao tratamento dos recém‐nascidos e crianças.
Costa et al. relataram que a ausência do medicamento em apresentação adequada para administração no paciente levou a equipe de enfermagem a fazer transformações de forma farmacêutica em seus postos.9,17 Das adaptações de forma farmacêutica, 75,63% apresentavam veículo inadequado e também houve casos de embalagem e conservação incorretos.9
Entre as limitações da pesquisa estão: ter sido estudada uma única unidade hospitalar, ter‐se assumido que cada preparação solicitada foi consumida totalmente e que a taxa de ocupação da UTI‐neonatal foi de 100% durante o período estudado. Contudo, ressalta‐se que o perfil do hospital estudado é semelhante ao de outros hospitais universitários. Além disso, o produto manipulado era destinado a um paciente específico e apresentava pequeno volume e data de validade estreita, tornava razoável supor que o consumo do produto manipulado tivesse sido total. Com relação à ocupação, o hospital estudado é uma unidade de saúde de referência, de natureza pública, que atende uma população de uma região populosa, é justificável a adoção de uma ocupação de 100% dos leitos. Dessa forma, a generalização dos resultados obtidos deve levar em consideração esses aspectos.
É importante ressaltar que o uso de medicamentos magistrais pode ser uma boa opção terapêutica para os recém‐nascidos e crianças. No entanto, incentivos regulamentares são necessários para que a indústria farmacêutica venha a produzir esses medicamentos em forma farmacêutica adequada para essa população.
FinanciamentoO estudo não recebeu financiamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.