Apresentar as bases conceituais que explicam como eventos na vida intrauterina podem influenciar o desenvolvimento corporal e enfatizar a interrelação entre baixo peso ao nascer e risco de obesidade ao longo da vida.
Fontes de dadosGoogle Scholar, Scientific Electronic Libraty Online (SciELO), EBSCO, Scopus e PubMed foram as bases de dados. “Catch‐up growth”, “lifecourse health”, “disease”, “child”, “development”, “early life”, “perinatal programming”, “epigenetics”, “breastfeeding”, “small baby syndrome”, “phenotype”, “micronutrients”, “maternal nutrition”, “obesity” e “adolescence” foram descritores isolados ou associados para localizar revisões, estudos epidemiológicos, de intervenção ou experimentais publicados entre 1934 e 2014, com textos integrais, em português e inglês. Excluíram‐se duplicidades, editoriais, resenhas e abordagens de doença diferente da obesidade.
Síntese dos dadosNos 47 artigos selecionados dentre 538 elegíveis, identificaram‐se as hipóteses do fenótipo poupador, dos mecanismos epigenéticos e da plasticidade do desenvolvimento como fundamentais para explicar mecanismos envolvidos na saúde e nas doenças durante a vida. Elas admitem a possibilidade de eventos cardiometabólicos e obesidade terem origem em deficiência intraútero de nutrientes que, associados a suprimento alimentar excessivo às necessidades metabólicas nas fases precoces da vida, provoca alterações endócrinas. Todavia pode haver reprogramação fenotípica que supere ambiente restritivo intrauterino para nascidos com baixo peso a partir de oferta nutricional adequada. Assim, o catch‐up growth indicaria recuperação da restrição intrauterina e se associaria a benefícios em curto prazo ou prejuízos no adulto.
ConclusõesNa dependência de adequação nutricional nos primeiros anos de vida, a plasticidade do desenvolvimento pode levar à reprogramação fenotípica e reduzir o risco de obesidade.
To present the conceptual foundations that explain how events occurring during intrauterine life may influence body development, emphasizing the interrelation between low birth weight and risk of obesity throughout life.
Data sourcesGoogle Scholar, Library Scientific Electronic Online (SciELO), EBSCO, Scopus, and PubMed were the databases. “Catch‐up growth”, “life course health”, “disease”, “child”, “development”, “early life”, “perinatal programming”, “epigenetics”, “breastfeeding”, “small baby syndrome”, “phenotype”, “micronutrients”, “maternal nutrition”, “obesity”, and “adolescence” were isolated or associated keywords for locating reviews and epidemiological, intervention and experimental studies published between 1934 and 2014, with complete texts in Portuguese and English. Duplicate articles, editorials and reviews were excluded, as well as approaches of diseases different from obesity.
Data synthesisWithin 47 selected articles among 538 eligible ones, the thrifty phenotype hypothesis, the epigenetic mechanisms and the development plasticity were identified as fundamental factors to explain the mechanisms involved in health and disease throughout life. They admit the possibility that both cardiometabolic events and obesity originate from intrauterine nutritional deficiency, which, associated with a food supply that is excessive to the metabolic needs of the organism in early life stages, causes endocrine changes. However, there may be phenotypic reprogramming for low birth weight newborns from adequate nutritional supply, thus overcoming a restrictive intrauterine environment. Therefore, catch‐up growth may indicate recovery from intrauterine constraint, which is associated with short‐term benefits or harms in adulthood.
ConclusionsDepending on the nutritional adequacy in the first years of life, developmental plasticity may lead to phenotype reprogramming and reduce the risk of obesity.
O conhecimento dos processos envolvidos no desenvolvimento humano contribui para melhor entendimento dos mecanismos associados à saúde e à doença ao longo da vida.1 Identificar quais são, quando e como atuam esses mecanismos é provavelmente o melhor meio para evitar que as doenças se instalem. Apenas nos últimos anos várias doenças que acometem adultos têm sido relacionadas a eventos do período intrauterino.2‐4
Embora exames complementares forneçam informações que possibilitam acompanhar o desenvolvimento fetal, a obtenção de dados ao nascimento proporciona melhores condições de avaliação. A adequação do peso à idade gestacional é a primeira medida capaz de fornecer informações sobre a interação fetal com o ambiente intrauterino.5
O feto reflete, por meio da nutrição, do crescimento e da composição corporal, os suprimentos e a energia que recebe da mãe e expressa igualmente sua dependência da função placentária.6 Também recebe um fluxo de mediadores químicos, os quais informam sobre o estado nutricional da mãe e possivelmente a qualidade do ambiente pós‐natal.3 Essas informações contribuem para moldar a composição e o tamanho do corpo, como também para a estruturação dos sistemas endócrino e metabólico.7
O Fundo das Nações Unidas para a Infância8 informa que a incidência mundial de baixo peso ao nascer se manteve em 15% de 2008 a 2012, apesar dos avanços no cuidado pré‐natal. A Organização Mundial de Saúde9 afirma que mais de 40 milhões de crianças com menos de cinco anos apresentam sobrepeso ou obesidade e, portanto, estão expostas a maior risco de doenças não transmissíveis. Essas estatísticas reforçam a relevância de abordar as interrelações entre baixo peso ao nascer e o risco de ocorrência da obesidade e suas comorbidades ao longo da vida, considerando que essa compreensão é a base para que se instituam precocemente intervenções que possam mudar a história natural desse processo.
Nesta revisão, objetivou‐se apresentar as bases conceituais e empíricas que embasam o entendimento sobre a interferência de eventos da vida intrauterina sobre o desenvolvimento corporal e enfatizar a interrelação entre baixo peso ao nascer e obesidade ao longo da vida.
MétodoProcedeu‐se à revisão do tipo narrativa, com o emprego dos descritores “catch‐up growth”, “lifecourse health”, “disease”, “child”, “development”, “human evolution”, “adaptative”, “infant”, “early life”, “birth”, “weight”, “perinatal programming”, “epigenetics”, “breastfeeding”, “small baby syndrome”, “phenotype”, “micronutrients”, “maternal nutrition”, “fetus”, “obesity” e “adolescence”, isolados ou associados, nas bases de dados Google Scholar, Scientific Electronic Library Online (SciELO), EBSCO, Scopus e PubMed, para localização de artigos publicados.
Os critérios de inclusão foram artigos de revisão, estudos epidemiológicos, de intervenção ou experimentais publicados entre 1934 e 2014, com textos integrais em português ou inglês, que abordassem aspectos do desenvolvimento intrauterino e sua relação com obesidade. Foram excluídos resumos ou artigos publicados em duplicidade, referentes a diagnóstico ou tratamento de doença específica diferente da obesidade, editoriais e resenhas.
Os resumos que obedeciam aos critérios de inclusão foram analisados por dois revisores independentes com conhecimento do tema central da revisão, para determinação consensual dos artigos que seriam lidos na íntegra.
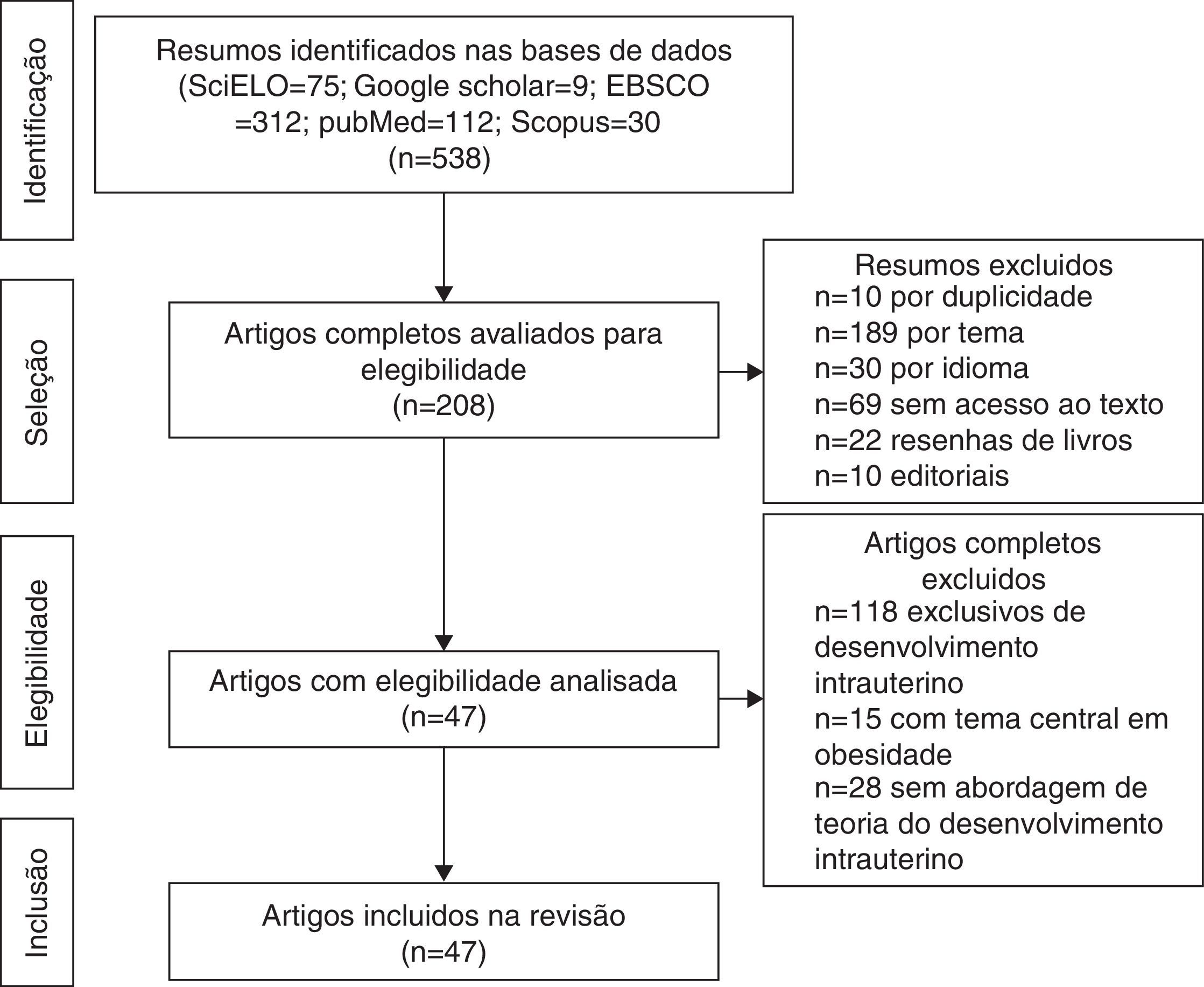
ResultadosForam localizados 538 resumos, dos quais 330 foram excluídos. Resultou‐se na análise de textos integrais de 208 artigos. Aplicados os critérios de inclusão e de exclusão, resultaram 47 artigos elegíveis que integraram a revisão (fig. 1) e com os quais se elaborou o glossário exposto na tabela 1.
Glossário de termos e conceitos adotados nesta revisão
| Termos | Conceitos |
|---|---|
| Catch‐up growth | Período de rápido ganho de peso e/ou de aceleração na velocidade de crescimento que ocorre após um período de desaceleração |
| Epigenética | Estudo das alterações na expressão do gene que podem ser transmitidas a prole e que não implicam alteração na sequência do DNA |
| Hipótese do fenótipo econômico (thrifty phenotype hypothesis) | Quando o ambiente fetal é pobre do ponto de vista nutricional o organismo fetal passa por um processo de programação no qual há uma proteção em relação ao desenvolvimento de alguns órgãos (cérebro, coração), mas leva a alterações metabólicas que podem repercutir em fases mais avançadas da vida |
| Plasticidade fenotípica | A capacidade do organismo a partir de um único genótipo desenvolver fenótipos variados em resposta a diferentes estímulos ambientais |
| Programação fetal | Alterações estruturais e funcionais que ocorrem no organismo fetal em resposta a estímulos ocorridos em períodos críticos do desenvolvimento |
| Respostas adaptativas preditivas | Um processo por meio do qual o organismo nas fases precoces do desenvolvimento a partir da percepção que tem dos estímulos ambientais prediz o ambiente ao qual será exposto no futuro e o modifica fenotipicamente |
A influência de fatores presentes no início da vida foi identificada em relatos que analisavam a taxa de mortalidade por todas as causas no Reino Unido e na Suécia, de 1845 a 1925, na faixa de 10 a 100 anos, do que derivou a hipótese de que uma modificação no meio ambiente poderia contribuir para reduzir a mortalidade.10,11 A não comprovação da hipótese motivou incluir no estudo de mortalidade a faixa de cinco a 10 anos. Dessa feita, foi evidenciada associação entre melhoria nas condições de vida das crianças e dos adolescentes e queda da taxa de mortalidade geral em ambos os países. Isso sugere que a melhoria das condições ambientais no período gestacional podia interferir diretamente sobre a saúde de crianças nas faixas etárias mais jovens.11
Estudos em equinos12 demonstraram a influência do organismo materno sobre o feto, independentemente do fator genético. Fetos de animais grandes implantados em útero de espécies pequenas resultavam em potros menores do que o esperado, assim como fetos gerados em equinos pequenos apresentavam desenvolvimento maior, quando implantados em éguas grandes.
No contexto dessas ideias, Neel13 publicou observações sobre os efeitos da privação nutricional materna sobre o feto. Teorizou que conceptos desenvolviam metabolismo direcionado a poupar energia e que era importante a resistência insulínica, a qual estaria relacionada à mutação genética aleatória.13 A preponderância desse “genótipo poupador” perduraria e seria transmitido a gerações futuras e, assim, o consumo de alimentos em abundância acarretaria obesidade por acúmulo excessivo de reservas.
O efeito da escassez alimentar durante o cerco alemão à Holanda na Segunda Guerra Mundial14 fez com que mulheres sofressem o impacto da desnutrição durante o período gestacional. A análise desse experimento natural pôs em dúvida a hipótese de Neel,13 pois a privação de nutrientes levou a efeitos diversos do esperado. Os fetos que sofreram desnutrição no primeiro trimestre desenvolveram obesidade na idade adulta, enquanto que a restrição após a fase inicial da gestação não se associou ao mesmo efeito. Ainda que se admitisse a importância dos estímulos ambientais na ocorrência da obesidade, o fator genético não podia ser desprezado.
Um estudo norueguês15 reforçou a importância das condições nutricionais na infância na gênese das doenças do adulto. Considerando a geração de indivíduos nascidos entre 1896 e 1925, foi constatado que maior mortalidade nos adultos ocorria nos condados com maior mortalidade infantil e tinha como fatores de risco o aumento do colesterol sanguíneo e o consumo de dieta rica em gordura, bem como a condição social dos indivíduos, o tabagismo e o tipo de nutrição. Em relação à contribuição da dieta rica em gordura para o aumento do colesterol, o estudo identificou comportamento distinto segundo a condição socioeconômica dos indivíduos. Aqueles que vivenciaram condição de pobreza anterior apresentavam aumento de colesterol relacionado à dieta rica em gordura, o que não ocorria naqueles com vida financeiramente estável.15 Essas constatações embasaram a hipótese de que o período de privação contribuiu para que os indivíduos desenvolvessem “intolerância à gordura” e ficassem expostos a um maior risco de morte quando recebiam dieta abundante.
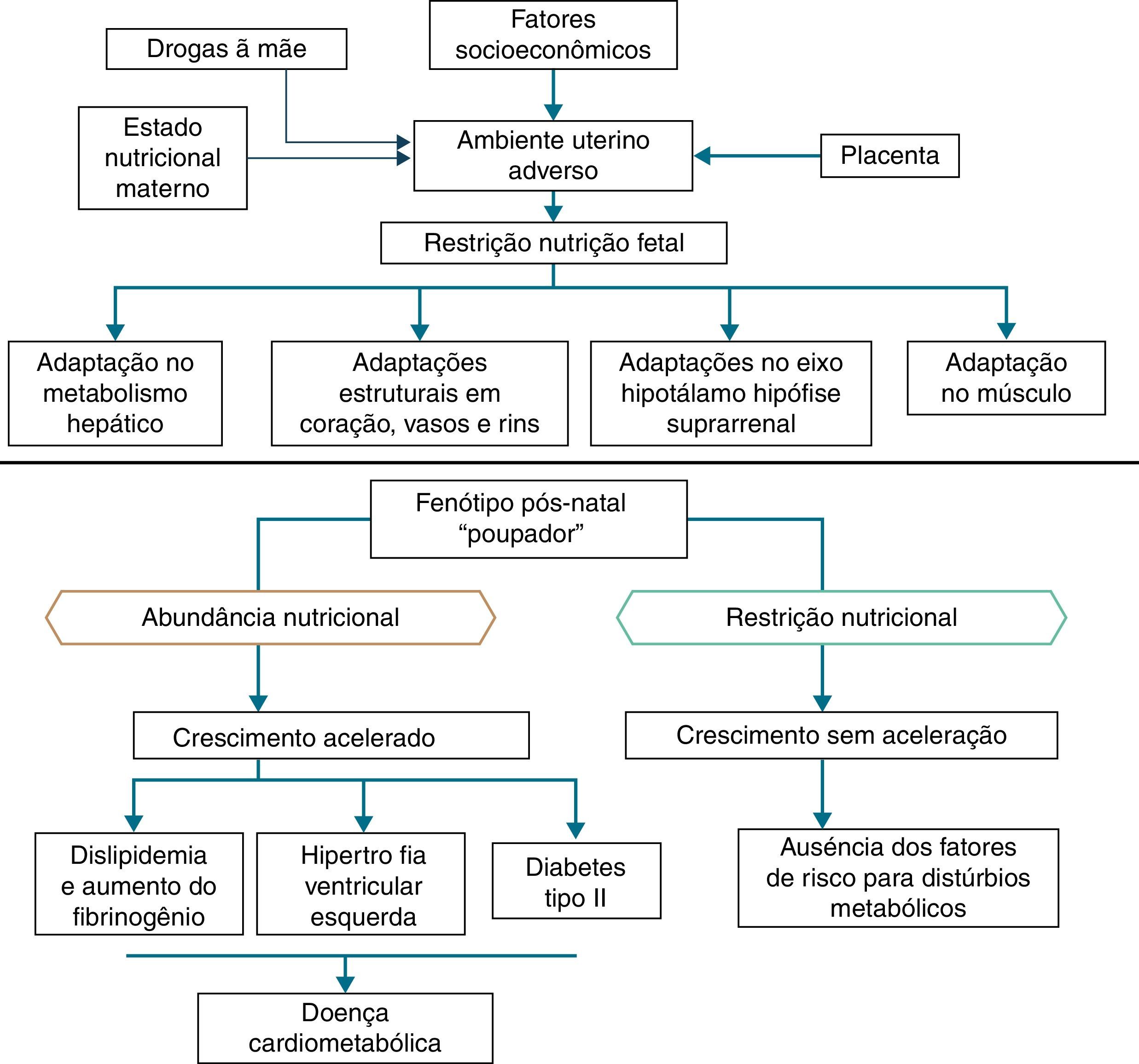
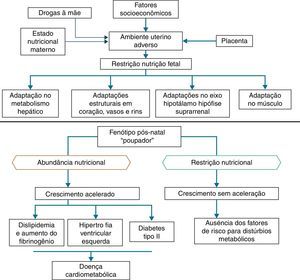
Além das hipóteses de intolerância à gordura e do genótipo poupador, uma coorte em Hertfordshire16,17 demonstrou a associação entre o baixo peso ao nascer e o óbito por doença coronariana na idade adulta. Dentre os nascidos com baixo peso, eram mais frequentes fatores de risco para doenças cardiovasculares e metabólicas.17 Adicionalmente, Barker16 propôs que o feto responde com retardo no crescimento quando há déficit de nutrientes em seu ambiente, o qual se associa à diminuição da sensibilidade à insulina e lhe proporcionam melhor condição de sobrevivência. Essa adaptação prediz, também na vida adulta, a manutenção de ambiente com pouca oferta de nutrientes. Caso tal situação não se concretize, a oferta abundante de alimentos gera um desequilíbrio que pode acarretar doenças cardiometabólicas. Esse contexto deu origem à hipótese do fenótipo poupador16 e, posteriormente, à resposta adaptativa preditiva,3 que estão representadas na figura 2.
Situações relativas a alterações do peso ao nascer reforçam sua importância como marco indicativo do ambiente intrauterino e preditor de doenças cardiometabólicas na adolescência e na fase adulta.18‐20 Assim sendo, o peso ao nascer pode ter origem constitucional ou ser secundário à privação nutricional intraútero, o que leva a uma restrição de crescimento fetal. Admite‐se que, em recém‐nascidos com baixo peso, atuam diferentes mecanismos de adaptação ao ambiente extrauterino, dentre os quais o aumento do metabolismo dos carboidratos e o consequente aumento da adiposidade, que aumenta o risco futuro de doenças crônicas, como resistência à insulina, obesidade e diabetes tipo 2.19 Esses mecanismos levam a níveis elevados de leptina, secundário a um aumento da resistência em nível dos seus receptores, relacionados à falta de saciedade no início da vida, a qual se associa à obesidade e aos distúrbios metabólicos na adolescência e na idade adulta, quando esses neonatos são expostos a ambiente nutricional com oferta excessiva de nutrientes, nos primeiros anos de vida.20
Ao sair de situação restritora de crescimento, por questões hormonais ou nutricionais, para outra com oferta adequada de nutrientes, pode ocorrer recuperação acelerada do crescimento para alcançar o potencial geneticamente determinado,21 denominado catch‐up growth.22
Catch‐up growth pode ser definido como a velocidade de ganho de peso e/ou de crescimento maior que os limites estatísticos de normalidade para idade e maturidade, durante um período de tempo definido, o qual se segue um período de inibição transitória do crescimento.21 O catch‐up growth é um processo fisiológico relativo à recuperação do tamanho de um organismo submetido à restrição, para que ele alcance o tamanho próprio para idade, sexo e grau de maturação, na dependência da ação do eixo somatotrófico, com aumento dos receptores hormonais.21
Essa recuperação, derivada de condições desfavoráveis ao crescimento durante o período pré‐natal e pós‐natal precoce, pode influenciar o risco de desenvolvimento de doenças cardiometabólicas ao longo da vida.23,24 No entanto, a recuperação do crescimento em curto prazo oferece vantagens para o neurodesenvolvimento, particularmente para crianças nascidas com muito baixo peso, assim como contribui para o aumento da resistência às infecções. Daí decorre a questão de identificar se os benefícios do aumento da velocidade do crescimento podem ocorrer sem consequências metabólicas adversas.18
Admite‐se que um catch‐up growth maior do que 0,67 desvio padrão estaria associado à obesidade central25 e ao desencadeamento da resistência insulínica, que leva a aumento compensatório da secreção de insulina, mesmo em recém‐nascidos com baixo peso que apresentaram aumento da velocidade de crescimento, mas permanecem pequenos durante a infância. Mesmo que essas crianças aumentem a velocidade de crescimento, elas apresentam hiperinsulinemia compensatória em maior grau do que crianças bem nutridas ou excessivamente alimentadas. Dessa forma, a hiperinsulinemia secundária à resistência à insulina poderia ser a explicação central da gênese da síndrome metabólica.26
A resistência à insulina nos nascidos pré‐termo se associa à hipersecreção do hormônio do crescimento e à redução da concentração do IGF‐1, as quais persistem por três meses após o nascimento na ausência de suprimento nutricional adequado. Esse estado endócrino alterado favorece redução do tecido adiposo subcutâneo, com relativa adiposidade visceral, um marcador de resistência insulínica, dislipidemia e presença de outros componentes da síndrome metabólica.27
Apesar dessas observações, ainda não está evidenciado se a deposição de obesidade central, mais do que adiposidade subcutânea, é função da prematuridade, do nascimento com tamanho pequeno para idade gestacional ou do catch‐up growth. Estudos demonstram que neonatos com crescimento restrito ao nascimento têm redução da gordura subcutânea, porém mantêm níveis de gordura abdominal similares aos de recém‐nascidos adequados para a idade gestacional.28 Estudo de coorte feito para investigar a associação entre crescimento fetal e pós‐natal precoce e modificações metabólicas e antropométricas comprovou que o catch‐up growth relacionou‐se ao padrão de crescimento fetal, independentemente do peso ao nascer, e se associou com maior sensibilidade insulínica e concentrações mais baixas de leptina ao nascimento. Dessa forma, o catch‐up growth promoveria a restauração do tamanho corporal e dos estoques de gordura sem consequências deletérias no perfil metabólico e na composição corporal, após um ano de idade.29
Recentemente, fez‐se uma revisão30 em busca das evidências sobre a relação entre baixo peso, resistência insulínica e diabete tipo 2 em adultos, à luz da composição corporal e das vias metabólicas. A base empírica mostra uma relação multifatorial e aponta que, em algumas crianças e adultos nascidos pré‐termo, a resistência insulínica e o aumento da adiposidade abdominal são derivados da variação do gene do receptor de glicocorticoide. Maiores concentrações de glicocorticoides ativam o eixo hipotálamo‐pituitária‐adrenal e promovem ingestão de alimentos palatáveis, os quais ativam os centros de prazer do cérebro e desencadeiam maior acúmulo de adipócitos. Assim, adultos nascidos pré‐termo podem ter sensibilidade aumentada a estressores, o que leva à superprodução de glicocorticoides e ao estímulo da população omental de pré‐adipócitos, com maior deposição de gordura abdominal.
Estudos experimentais trouxeram novas ideias para explicar a origem das doenças do adulto no início da vida, mas suscitaram novos questionamentos. As hipóteses não contribuíram para o entendimento da ocorrência dessas doenças em nascidos grandes para a idade gestacional, bem como em conceptos com peso adequado, mas que as desenvolveram na fase adulta. Não explicavam como fetos com restrição de crescimento intrauterino (RCIU), com sensibilidade diminuída à insulina no início da vida pós‐natal, desenvolviam resistência aumentada apenas na vida adulta, o que parecia indicar perda do continuum do processo metabólico, como se tivesse início apenas na fase adulta.
Para analisar a relação entre baixo peso ao nascer e desenvolvimento de hipertensão arterial no adulto, Huxley et al.,31 em metanálise, confrontaram 18 trabalhos apresentados por pesquisadores que corroboravam a hipótese do fenótipo poupador com 37 trabalhos de outros pesquisadores. Embora essa metanálise31 não tenha mostrado relação do baixo peso ao nascer com hipertensão arterial em adultos, não afastou as hipóteses adaptativas e outros aspectos da expressão tardia de determinações da vida intrauterina passaram a ser pesquisados. As hipóteses se baseavam na ideia de poupar, o que não parecia representar o processo geral. As observações desde o início da vida sugeriam um fenômeno muito mais amplo e generalizado. O padrão de desenvolvimento poderia ser modificado em qualquer direção a depender do estímulo.32,33
A explicação epigenética, o fenótipo poupador e as doenças cardiometabólicasA partir da possibilidade de o genótipo gerar diferentes fenótipos em diferentes condições ambientais, ou seja, da plasticidade fenotípica, Gluckman et al.34 enunciaram a hipótese de uma “resposta preditiva adaptativa” ao meio ambiente. A plasticidade do desenvolvimento seria evocada por alterações do meio ambiente no início da vida e geraria resposta fenotípica adaptativa cujas vantagens se manifestariam apenas em fases mais tardias. Dessa forma, a plasticidade fenotípica pode ter conferido vantagens à espécie humana para enfrentar ambientes com restrição nutricional ou alto gasto de energia. Todavia, quando submetidos a ambiente diferente em nutrientes do programado, os indivíduos teriam resposta exacerbada e desenvolveriam doenças na fase adulta.34 A “resposta adaptativa preditiva” significará uma vantagem adaptativa quando a “previsão” sobre o ambiente estiver correta (match) e poderá determinar desvantagem quando estiver errada (mismatch),34 o que caracteriza a plasticidade.
A plasticidade pode desencadear diversas respostas com expressão imediata, como nas restrições de nutrição ao feto, que reage com diminuição de suas reservas nutricionais, diminuição do anabolismo, da insulina plasmática, do fator de crescimento insulina‐like tipo 1 (IGF‐1) e desvio de fluxo sanguíneo para proteger coração e cérebro. Essas adaptações imediatas ao ambiente restritivo permitem a sobrevivência adequada, porém resultam em baixo peso ao nascer, maior risco de morbimortalidade, dificuldade cognitiva e déficit de crescimento persistente.35
Respostas que visam a assegurar a sobrevivência podem, entretanto, acarretar erros adaptativos. A hiperglicemia materna no início da gestação pode contribuir para embriopatia por levar à redução de mioinositol, essencial ao desenvolvimento embrionário durante a gastrulação e os estágios de neurulação. A deficiência de mionositol parece perturbar o sistema fosfoinositídeo que leva a anormalidades nas vias do ácido aracdônico‐prostaglandinas e aumento de substâncias oxigênio‐reativas.36 Essa cadeia de eventos é responsável por alterações cardiovasculares fetais, tais como transposição de grandes vasos, defeitos septais ventriculares, síndrome do coração esquerdo hipoplásico e dextrocardia.37 O aumento da hemoglobina glicada materna se associa a alterações embriológicas em 66% dos fetos, mas quando inferior a 9,5% não altera a embriogênese,36 o que caracteriza a disruptura,3 na qual um hormônio pode desencadear efeito indesejável no processo de resposta a uma adaptação ambiental.
Apesar de o organismo fetal e o pós‐natal apresentarem respostas adaptativas ao ambiente intrauterino restritivo de modo contínuo, seu desenvolvimento apresenta “janelas de plasticidade”, ou seja, a possibilidade de interferência na programação adaptativa que corrige respostas inadequadas.38 Essa hipótese é corroborada em estudo experimental que comparou filhotes com retardo de crescimento, nascidos de ratas desnutridas durante a gestação, com a prole de ratas nutridas, após a administração de dieta hipercalórica aos filhotes sem RCIU e leptina aos filhotes com RCIU. Os autores comprovaram que o crescimento dos dois grupos não diferiu e concluíram que o aumento da concentração de leptina sinalizou para o organismo dos filhotes a presença de tecido adiposo em quantidade adequada e, portanto, de reservas nutricionais.38
A continuidade adaptativa às modificações do ambiente e as “janelas de oportunidade” são explicadas pela teoria epigenética, ou seja, a possibilidade de fatores ambientais intervirem na expressão gênica. Respostas adaptativas preditivas são moduladas por modificações covalentes do ácido desoxirribonucleico e das histonas, necessárias ao fenômeno da transcrição gênica, ou seja, de síntese de ácido ribonucleico para a síntese proteica.39
Evidências sugerem que o período fetal é o mais sensível para o estabelecimento das variações epigenéticas que vão influenciar na expressão genética celular e tecidual, no dismorfismo sexual e no risco de iniciar distúrbios que irão se manifestar posteriormente.40 Exemplo da influência da epigênese no período neonatal precoce é o efeito de dietas ricas em gordura na gravidez,41 ou seja, excesso de alimentação na prole e expressão aumentada de peptídeos orexígenos promovem aumento e desregulação da leptina neonatal.
É importante a desregulação, porque a leptina é um dos primeiros hormônios sintetizados durante o desenvolvimento embriológico pela placenta, pelos adipócitos do tecido gorduroso branco, por células hepáticas, estruturas cartilaginosas e músculo cardíaco. Essa molécula atua na neurogênese, no crescimento axonal, na proliferação dendrítica, na formação de sinapses,23 no desenvolvimento das vias neurológicas para saciedade, fome e regulação térmica, a qual se inicia na vida intrauterina e se completa nos primeiros meses de vida, quando suprida pelo leite materno.42
Durante o primeiro trimestre gestacional, a síntese de leptina ocorre na placenta, desencadeia uma cascata de fatores de transcrição nos pré‐adipócitos e contribui para formação do tecido adiposo branco, que passa a ser a principal sede de síntese leptínica. Essa molécula, que cruza a barreira hematoencefálica, contribui para o desenvolvimento de diversas regiões cerebrais, dentre as quais o hipotálamo, no qual estão localizados seus receptores.23 A ligação leptina‐receptor é essencial para indicar necessidade de ingestão de nutrientes e de aumento das reservas energéticas no tecido adiposo. Quando a concentração de leptina no hipotálamo é reduzida, em virtude de ligação aos receptores, desencadeia‐se a sensação de saciedade pela ativação de neurônios anorexígenos. Assim, a alteração fenotípica dos receptores de leptina, que caracteriza resistência à leptina, acarreta a manutenção da sensação de fome e favorece ingestão de grandes quantidades de nutrientes e a hipertrofia do tecido adiposo.24
A epigênese da resistência leptínica explica o aumento do risco de obesidade em filhos de mães obesas e diabéticas, assim como em recém‐nascidos com RCIU submetidos à alimentação exagerada ou cujas mães foram alimentadas com dietas ricas em lipídeos. Em contraste, quando no período gestacional e de lactação as mães recebem dietas balanceadas ou quando conceptos com RCIU são submetidos a dietas restritivas no período lactacional, esses apresentam crescimento do tecido adiposo normal, mas desenvolvem hiperfagia pós‐desmame, atribuída à desregulação da fosforilação dos receptores hipotalâmicos da leptina, pela redução de receptores anorexígenos e pela redução da permeabilidade da barreira hematoencefálica a essa molécula.24
Pesquisas epidemiológicas18 têm corroborado a hipótese da resposta preditiva adaptativa,33 ao demonstrar que uma oferta alimentar abundante contribui para o catch‐up growth. Todavia, ela é confirmada também quando se verifica ausência de obesidade abdominal, com neurodesenvolvimento normal, em crianças que recebem nutrição adequada, porém não excessiva. Argumenta‐se43 sobre o valor da nutrição do recém‐nascido, especialmente quando pré‐termo, pois no início da vida há maior plasticidade orgânica. Assim, intervenções adequadas logo após o nascimento têm na plasticidade a possibilidade de correção de retardo de desenvolvimento e mantêm os benefícios por efeito cumulativo. À medida que a idade avança, com o declínio da plasticidade, a nutrição adequada às necessidades do organismo fará com que sua composição corporal atinja o nível de uma criança a termo, na mesma idade. Analogamente, nutrição demasiada, também pela plasticidade, fará com que efeitos deletérios se manifestem ao longo da vida.
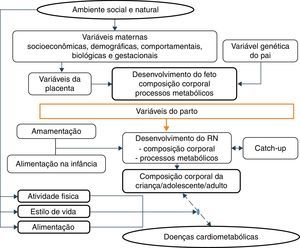
Há que se considerar4 os processos pelos quais são determinadas a quantidade e a qualidade dos nutrientes fornecidos ao feto e ao concepto, devido a seus efeitos permanentes sobre o desenvolvimento, processo denominado programação nutricional, que depende de características maternas antes, durante e após a gravidez, por um lado, e de condições nutricionais fetais, por outro.
Dentre as características maternas e de seu entorno que interferem sobre o desenvolvimento fetal e do recém‐nascido, estão as condições socioeconômicas e nutricionais, com efeito direto, e as educacionais, com efeito indireto. Neonatos nepalenses nascidos com baixo peso mais frequentemente tinham mães com nível socioeconômico baixo ou muito baixo, pouca escolaridade e nutrição inadequada, fatores aos quais se associavam a menor busca por assistência médica pré‐natal.44 Coorte de base populacional, com seguimento entre 1961 a 2000, revelou que, em quatro décadas, no Reino Unido, as desigualdades socioeconômicas ainda determinavam a maior frequência de nascimentos de baixo peso ou prematuros dentre mães de classes mais pobres, mesmo após ajuste para idade materna.44
Dentre os fatores demográficos e sociais, estão variáveis maternas, como: idade em extremos (<20 e >30 anos), baixa escolaridade, paridade, intervalo interpartal curto, uso de drogas45 e baixa estatura.46 Também se considera a amamentação, dado seu efeito protetor fraco a moderado sobre a obesidade no adulto. A amamentação, ao suprir as necessidades do neonato, reduz o risco de resistência à insulina e do aumento da adiposidade intra‐abdominal, bem como fornece concentrações de leptina capazes de modular o mecanismo de fome‐saciedade.47
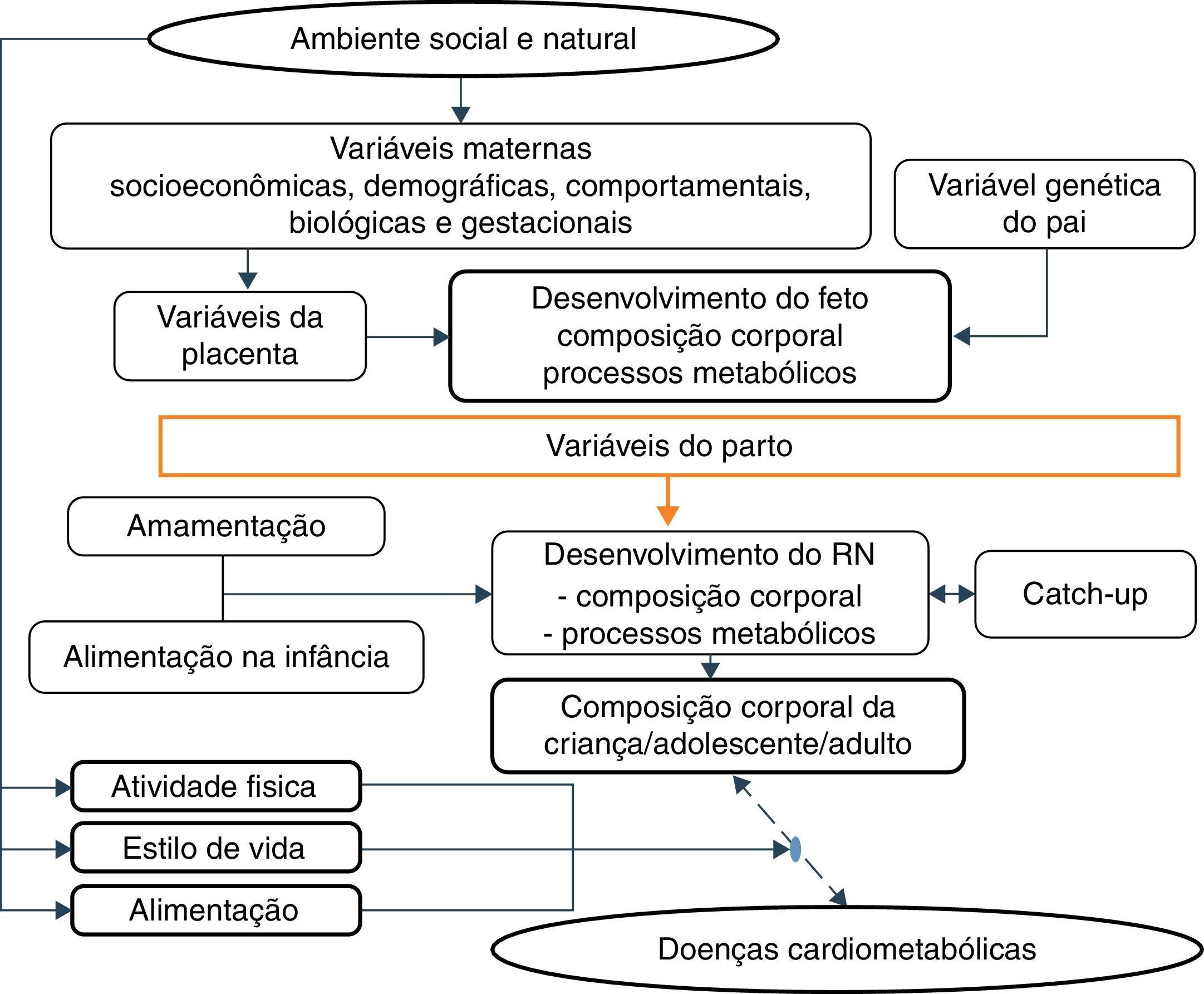
Essas evidências estão de acordo com a hipótese aceita por Gluckman et al.,3 segundo a qual a natureza direciona esforços para a reprodução. Assim, se há sinais de ambiente pós‐natal ameaçador, o feto nasce prematuro ou menor do que o esperado e, em um ambiente enriquecido, diferentemente da trajetória prevista, desenvolve doenças metabólicas num processo multifatorial em que os diversos fatores maternos e fetais interagem (fig. 3).
Hoje, o número considerável de estudos experimentais, epidemiológicos e clínicos que fornecem uma base empírica robusta contribui para uma mudança de paradigma em relação ao entendimento da origem precoce das doenças. Todo esse conhecimento tem uma implicação direta na formação dos profissionais na área da saúde e, de modo especial, na formação do médico. Mostra a necessidade de apropriação de diversos aspectos do conhecimento biológico, de modo especial da teoria evolucionista, pois é sob esse olhar que se apreende a importância da interação entre o genótipo e o ambiente e os vários mecanismos de que o organismo lança mão para se adaptar ao meio. O médico, de forma especial o pediatra, tem um papel fundamental, pois cuida do ser humano no período em que há as maiores oportunidades de atuar e provocar mudanças, por conta da plasticidade do desenvolvimento.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo financiamento de bolsas de auxílio fornecidos a Pedro Lira, Marília Lima e Giselia Alves.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.