¿ Introducción
La leucemia aguda linfoblástica (LAL) es una enfermedad maligna que se caracteriza por una tasa de proliferación descontrolada de células linfoides inmaduras con un potencial de replicación ilimitado.1 La aplicación de diversas combinaciones de agentes quimioterápicos, así como terapias con agentes anti-CD20+, anti-CD19+ o los inhibidores de tirosin-cinasa, han modificado el curso de la enfermedad.2-5 El objetivo de la etapa de inducción a la remisión es la reducción en promedio de 99% de la carga tumoral inicial,6 siendo los principales medicamentos los agentes antracíclicos, los alcaloides de la vinca y los corticoesteroides.7-10 Los corticoesteroides se han utilizado de forma amplia en el tratamiento de diversas neoplasias linfoides,11 su blanco es el bloqueo de la síntesis de proteínas por acción directa sobre el DNA.12,13 Gran parte de su mecanismo de acción está regulado por el papel de sus receptores, que muestran una localización intracelular,14 los que activan diversos factores de transcripción que modifican la expresión de proteínas asociadas con la apoptosis como lo son la molécula Bim, la granzima A, moléculas proapoptósicas como GPR65/TDAG8 y otras proteínas implicadas en la vías intrínseca y extrínseca de la apoptosis.15 En la LAL infantil se ha establecido el término pre-inducción con esteroides, estos se administran de forma progresiva durante siete días y al día +7, se verifica la cuenta de blastos en sangre periférica; si esta es menor de 1 x 103/μL, se considera como una respuesta favorable a esteroides (RFE), dicho hallazgo ha sido considerado de pronóstico favorable en diversas series pediátricas.16,17 En los adultos, dicha estrategia ha sido implementada por Annino y colaboradores en el protocolo GIMEMA ALL0288, siendo la RFE el principal factor independiente que influenció sobre la remisión completa (RC), remisión continua completa (RCC) y supervivencia global (SG).18 En el Hospital General de México, desde 2007, se estableció el protocolo institucional HGMLAL07/09 para el tratamiento de la LAL del adulto, el cual se basa en un ciclo de pre-inducción con corticoesteroides semejante a lo establecido por el grupo italiano GIMEMA. En este estudio se presentan los resultados del protocolo HGMLAL07 a 430 días de seguimiento y el valor de la RFE como marcador pronóstico.
¿ Métodos
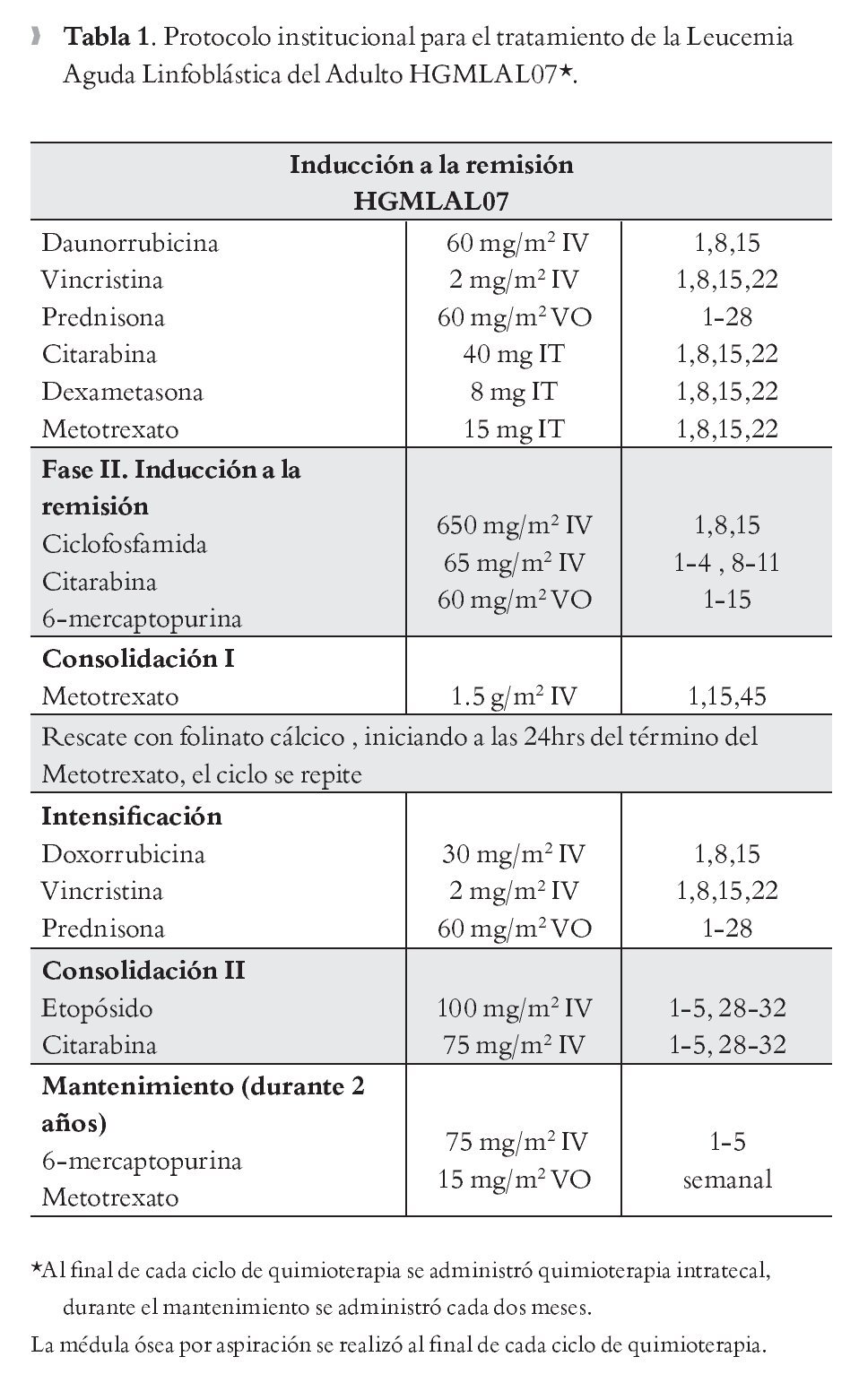
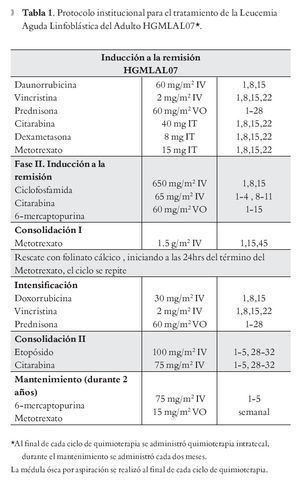
Protocolo de tratamiento: El diagrama general de la etapa de inducción a la remisión, se describe en la Tabla 1. De forma general se estableció un pre-tratamiento basado en prednisona (PDN) que se administró de forma progresiva durante siete días (día -7 al día -1): 25mg en el día -7 y -6, 50mg en los días -5 y -4, 75mg los días -3, -2 y 60mg/m2 el día -1, en el día 0 de tratamiento se toma citometría hemática con frotis de sangre periférica y se establece como una RTE si se cuenta con una cifra menor de 1 x 103/μl blastos en sangre periférica en el día cero de tratamiento.
La etapa de inducción a la remisión contó con una duración de cuatro semanas. La profilaxis a sistema nervioso central se realizó con base en quimioterapia intratecal, con triple droga (citarabina, dexametasona,metotrexato) por un número de cuatro dosis (una semanal). La remisión completa (RC) se evaluó en el día + 28. Todos los pacientes recibieron profilaxis antimicrobiana con base en ciprofloxacino, y el manejo de los episodios febriles fue basado acorde a las recomendaciones de las guías de fiebre y neutropenia.19
Criterios de respuesta: Posterior al esquema de inducción a la remisión, se considera en RC a aquellos pacientes los cuales cuenten en sangre periférica con una cifra >1.5 x 103/μl neutrófilos, Hb >10g/dL y plaquetas >100 x103/μl; sin la presencia de blastos circulantes en sangre periférica y menos de 5% de blastos en médula ósea. Los pacientes con más de 5% de blastos posterior a la inducción se les administró una quimioterapia de rescate; si no lograron obtener RC se les consideró resistentes. Se consideró como respuesta temprana a esteroides a aquellos pacientes en los cuales en el día 0 de tratamiento contaban con una cifra menor de 1.0 x 103/μl en sangre periférica.
Pacientes: Se analizó a 72 pacientes con el diagnóstico de LAL de novo desde diciembre de 2007 hasta febrero de 2009; se inscribió a los pacientes en el protocolo de tratamiento HGMLAL07. El diagnóstico se estableció con los criterios morfológicos establecidos por la clasificación Franco-Américo-Británica y se confirmó mediante el uso de inmunofenotipo. La infiltración a sistema nervioso central se corroboró con la punción lumbar diagnóstica acorde a los criterios establecidos.20 Todos los pacientes contaban con consentimiento informado a su ingreso al Hospital General de México.
Método estadístico: El principal objetivo del estudio fue evaluar si la RTE mostraba impacto sobre la supervivencia global. Las curvas de supervivencia se establecieron por el método de Kaplan-Meier y se realizó un análisis de Ji cuadrada para establecer el valor pronóstico de las diversas variables. La supervivencia global se definió como el tiempo desde el inicio de tratamiento al momento de muerte o última fecha registrada, la supervivencia libre de enfermedad se definió desde el tiempo de la RC hasta el momento de recaída, muerte o última fecha de seguimiento. Se consideró estadísticamente significativo si contaban con una p <0.05.
¿ Resultados
Características de los pacientes: Alrededor de 72 pacientes se consideraron elegibles para el protocolo de tratamiento en quienes se obtuvo el consentimiento informado de la institución. La media de edad de los casos fue de 37 años (17 a 63 años), 63% correspondieron a edades menores de 35 años y 37% a una edad mayor de 35 años. La cuenta promedio de leucocitos fue de 62 x 103/μL (rango de 0.7-790 x 103/μL), 53% contaban con una cifra mayor de 35 x 103/μL y un 47% contaron con una cifra menor de 35 x 103/μL, un 18% mostró cifras de leucocitos mayor de 100 x 103 /μL.
Acorde con el inmunofenotipo, se clasificó como LAL de estirpe B a 92% y a 8% como estirpe T. Mostró positividad 13% para el transcrito BCR/ ABL (BCR, Breakpoint Cluster Region / ABL, toma su nombre del virus Abelson causante de leucemia), originado de la t (9;22), (q34;q11) conocido como Cromosoma Philadelphia. De forma general, se clasificó como riesgo alto a 74% y como riesgo habitual a 26%. Se documentó infiltración a sistema nervioso central alrededor de 2% de los casos.
Resultados de la inducción a la remisión y la respuesta temprana a esteroides: Se registró una RC en alrededor de 68% de los casos; 22% presentaron falla en inducción por muerte y 10% de los pacientes presentaron una leucemia refractaria.
La RFE se presentó en 19 pacientes (27% de los casos). La RFE acorde a la cuenta de leucocitos inicial se describe en la Tabla 2.
Se analizó el valor pronóstico de la RFE sobre la supervivencia de los pacientes no encontrándose una diferencia estadísticamente significativa (p = 0.923).
Respuesta temprana a esteroides y recaídas: Se registraron siete recaídas tempranas (9.2%); 100% localizadas en médula ósea, sin registrarse alguna recaída a nivel de sistema nervioso central. Todos los pacientes que contaban con una recaída, no mostraron una RFE. El tiempo promedio de recaída fue de 55 días (rango de 27 a 170 días).
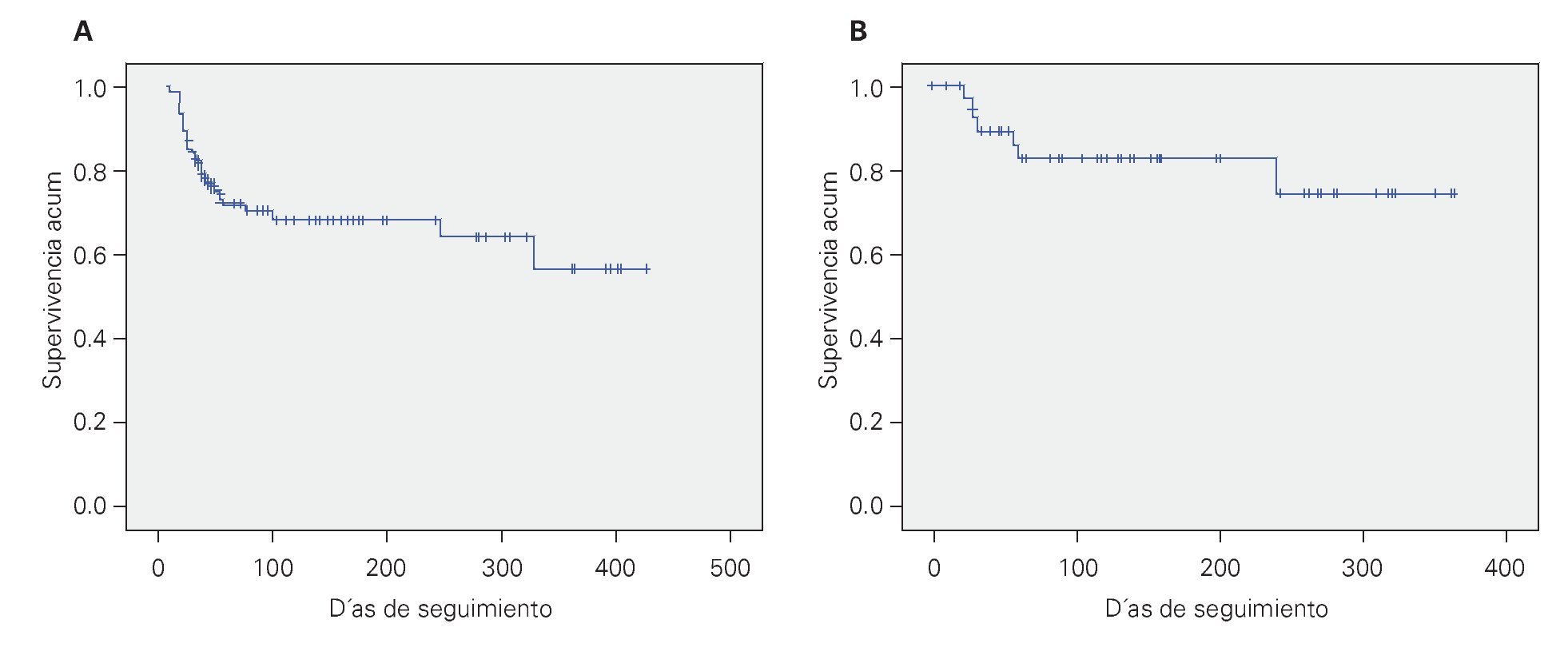
Factores pronósticos que influyeron sobre la supervivencia global: La supervivencia global a 430 días fue de 58%, con una supervivencia libre de evento de 76% (Figura 1). Las principales variables que influyeron sobre el pronóstico fueron; la edad (p = 0.022) y el tipo de riesgo (p = 0.048), entre las variables que no influyeron sobre el pronóstico destacaron la positividad para el transcrito BCR/ABL (p = 0.622), el inmunofenotipo (p = 0.990) y RTE (p = 0.923) (Tabla 3).
¿ Figura 1. Curvas de supervivencia (A) y supervivencia libre de enfermedad (B) realizada por el método de Kaplan y Meier.
¿ Discusión
Este estudio representa la experiencia del tratamiento de la leucemia linfoblástica aguda del adulto con un protocolo que se fundamenta en la pre-inducción con corticoesteroides semejante a lo realizado en el protocolo italiano GIMEMA 0288. En dicho protocolo, la RFE representó un factor independiente para el pronóstico, dicho hallazgo es semejante a lo demostrado en series pediátricas.18 Un punto importante a considerar de dicho estudio en cuanto a la supervivencia es que alrededor de 30% de los pacientes contaban con edades entre 12 a 20 años y al ser tratados con un protocolo muy semejante a los establecidos para población pediátrica, la supervivencia es mayor en comparación a si se utilizara un protocolo de tratamiento para población adulta. Esta estrategia ha sido abordada por Boissel y colaboradores en el estudio francés FRALLE vs. LALA.21
Uno de los principales objetivos de nuestro estudio fue determinar si la experiencia del protocolo italiano es reproducible y si la RFE impacta sobre la supervivencia. En la serie italiana la tasa de RTE fue cercana a 65%, siendo mayor en pacientes cuyas cuentas de leucocitos eran menores de 10x103/μL; en nuestra serie la RFE fue menor (27%), y mayor en pacientes con cifras iniciales de leucocitos menores a 30 x 103/μL. A diferencia de lo publicado en la literatura biomédica, en nuestra serie la RFE no mostró un impacto como factor único sobre la supervivencia global ni sobre la tasa de remisión continua completa. Dichos resultados pueden ser justificados debido a que la tasa de fallas al tratamiento por muerte fue mayor en comparación con otras series internacionales,22,23 pero semejante a lo informado por otros países en vías de desarrollo.24-25 Otro marcador pronóstico, como la presencia del transcrito BCR-ABL, tampoco mostró un impacto negativo sobre la supervivencia a diferencia de lo registrado en la bibliografía.26-31 En conclusión, en este estudio se muestra el seguimiento de los pacientes con leucemia aguda linfoblástica incluidos en el protocolo HGMLAL07, cuyo fundamento es la pre-inducción basada en corticoesteroides, semejante al protocolo del grupo italiano GIMEMA 0288. Por último, la RFE no mostró tener un peso estadístico sobre la tasa de supervivencia de los pacientes. Es necesario realizar un seguimiento de mayor tiempo de este grupo, para corroborar los resultados y concluir si el pre-tratamiento con corticoesteroides tiene un valor pronóstico. Se requiere también la búsqueda de nuevos marcadores pronósticos que puedan ser aplicados a nuestra población, que permita la identificación de poblaciones con un mayor riesgo de falla al tratamiento.
Correspondencia: Dr. Christian Omar Ramos Peñafiel.
Dr. Balmis N°148, Col.
Doctores, México D. F.
Correo electrónico:leukemiachop@hotmail.com