¿ Introducción
El Síndrome Metabólico (SM) se puede definir como un conjunto de factores tradicionales y no tradicionales que conllevan al desarrollo de Enfermedad Cardiovascular (ECV) y Diabetes.1,2 Entre estos factores se consideran la presencia de obesidad abdominal (determinada por el perímetro de cintura -PC-), alteraciones de la glucosa o resistencia a la insulina, dislipidemia aterogénica (expresada a través de los niveles elevados de c-HDL y triglicéridos) y elevación de las cifras de presión arterial, todos los que en su conjunto se utilizan para poder diagnosticar ésta entidad; sin embargo, existen factores emergentes que se encuentran ampliamente relacionados con las alteraciones metabólicas y que deberían formar parte delos criterios diagnósticos y que están asociados con el desarrollo de ECV como son la proteína C reactiva, micro-albuminuria, fibrinógeno y ácido úrico (AUr).3-5
La asociación entre SM y AUr ha despertado gran interés en cuanto a la fisiopatología y alteraciones metabólicas implicadas, además de considerar que cada uno de ellos, en forma individual, son indicadores de riesgo de ECV.5 En pacientes con SM, los niveles de urato promedio son 0.5 a 1 mg/dL mayores al compararlos con controles6 y se incrementan con el número de componentes del SM7 aún cuando es ajustado para factores de confusión como edad, sexo, depuración de creatinina, alcohol y uso de diuréticos. Los hombres tienen niveles mayores de ácido úrico respecto a las mujeres, quizá porque los estrógenos son uricosúricos. La diferencia de niveles de ácido úrico entre mujeres y hombres después de la menopausia se hace más pequeña; sin embargo, se mantiene en todas las edades, sugiriendo que otros factores más allá de los niveles de estrógeno son responsables para estas diferencias.8
En humanos, el ácido úrico es el producto final del metabolismo de las purinas y deriva de la conversión de hipoxantina a xantina y de esta a ácido úrico, ambas reacciones catalizadas por la enzima xantina oxireductasa.9 La hiperuricemia puede resultar de un incremento en su síntesis así como en disminución en su excreción o la combinación de ambos mecanismos. Está demostrado que la hiperinsulinemia modifica el manejo del ácido úrico a nivel renal, disminuyendo su excreción10,11 por el incremento en la reabsorción de sodio, condición que también se ha observado en pacientes con obesidad e hipertensión. Otros estudios apoyan la presencia de hiperuricemia secundario a que la síntesis de ácidos grasos a nivel hepático se encuentra incrementada durante la resistencia a la insulina y se relaciona con la síntesis de purinas de novo, lo cual conlleva a la aceleración en la producción de ácido úrico.11,12 Otro de los mecanismos implicados es el incremento en la ingesta de fructosa,13 ya que su fosforilación en el hígado da como resultado la descomposición de ATP y secundario un incremento de la producción de uratos.
Un segundo mecanismo que puede aumentar la síntesis de ácido úrico en pacientes con SM y daño orgánico es la isquemia local, en el cual se encuentra implicada la enzima xantina oxidoreductasa14 que bajo condiciones fisiológicas tiene mayor afinidad para el dinucleótido de nicotinamida adenina oxidado (NAD+) comparado con oxígeno como aceptor de electrones. Bajo condiciones de isquemia, se aumenta la degradación de ATP, iniciando un incremento en la síntesis de ácido úrico y adicionalmente la xantina deshidrogenasa es convertida a xantina oxidasa. Esta forma de enzima utiliza oxigeno molecular en lugar de NAD+ como aceptor de electrones, iniciando la formación de aniones superóxido y peróxido de hidrogeno (radicales libres de oxigeno).9,14,15
La relativa contribución de la sub-excreción y sobreproducción de ácido úrico a la hiperuricemia de pacientes con SM aún tiene muchas cuestiones para explicar sus diferentes interacciones; sin embargo, el considerar todos y cada uno de los mecanismos implicados como lo son los estados de isquemia, puede potenciar otros factores que promueven daño cardiovascular.16,17
En México no hay reportes previos sobre la prevalencia entre SM y ácido úrico, el objetivo de este estudio fue estimar no solo la prevalencia de hiperuricemia y SM en población aparentemente sana sino también determinar la relación entre el AUr y el SM, así como con cada uno de sus componentes.
¿ Objetivo
Determinar la asociación entre las variables de SM con el AUr en una población aparentemente sana.
¿ Métodos
Con la aprobación del Comité de Ética del Hospital General de México y después de obtener el consentimiento informado de los participantes, se realizó un estudio transversal comparativo de hombres y mujeres no embarazadas, aparentemente sanos, mayores de 18 años de edad, con o sin historia familiar de enfermedades crónicas no transmisibles.
La población en estudio fue seleccionada a través de una invitación a población abierta de la Ciudad de México. Para este propósito se colocaron avisos en sitios de reunión pública cercanos a las instalaciones del Hospital General de México, en los que se especificaban los objetivos y el sitio para el desarrollo del estudio. A los sujetos que atendieron la invitación se les realizó una historia clínica dirigida a detectar la presencia de antecedente personal de enfermedad crónica o aguda y la ingesta de medicamentos o cualquier otro tipo de tratamiento, considerando a un sujeto aparentemente sano a aquel individuo sin antecedente personal de enfermedad y que no recibieron en el último año ningún tipo de tratamiento. En los sujetos que cumplieron los criterios de inclusión al estudio, se llevó a cabo una historia médica detallada y exploración física completa para colectar información sobre antecedentes familiares, diversas variables clínicas, antropométricas y de laboratorio. La presión arterial sistólica (PAS) y diastólica (PAD) y las mediciones antropométricas (peso, talla y perímetro de cintura [PC]) fueron determinadas de forma estandarizada. Las mediciones las realizó personal médico previamente capacitado.
A todos los participantes se les extrajo una muestra sanguínea, después de 12 horas de ayuno, para la determinación basal de glucosa plasmática, AUr, triglicéridos, c-HDL. Dos horas posteriores a la carga oral de 75 gramos de glucosa, se extrajo otra muestra de sangre venosa para determinación de glucosa sérica.18 El perfil de lípidos fue determinado por fotometría (analizador Synthrom CX9 PRO). La glucosa plasmática fue medida por el método de la glucosa oxidasa con un analizador de glucosa (YSI, Yellow Spring, OH). La determinación de AUr se realizó a través de espectrofotometría, analizador Genesys-20, los niveles considerados para hiperuricemia fueron 6 mg/dL para mujeres y 7 mg/dL para hombres.19,20
La presencia de SM fue definida de acuerdo a los criterios modificados de la NHLBI-AHA/NCEPATPIII (National Heart, Lung and Blood Institutes, American Heart Association/ National Cholesterol Education Program- Adult Treatment Panel III).1
Análisis estadístico: Se utilizó estadística descriptiva con el software de análisis estadístico SPSS v15.0.0 de una base de datos previamente generada en Microsoft Excel 2007. Todos los análisis estadísticos fueron desarrollados de manera independiente por sexo. Se emplearon medidas de tendencia central y dispersión para las variables cuantitativas y para las cualitativas medidas de frecuencia y proporción. La búsqueda de relación entre los grupos se analizó mediante análisis bivariado con prueba Ji cuadrada o prueba exacta de Fisher para las variables cualitativas, cuyos resultados son mostrados en tablas de contingencia. En todos los casos se consideró un intervalo de confianza de 95% y un valor de p <0.05 para determinar significancia estadística.
¿ Resultados
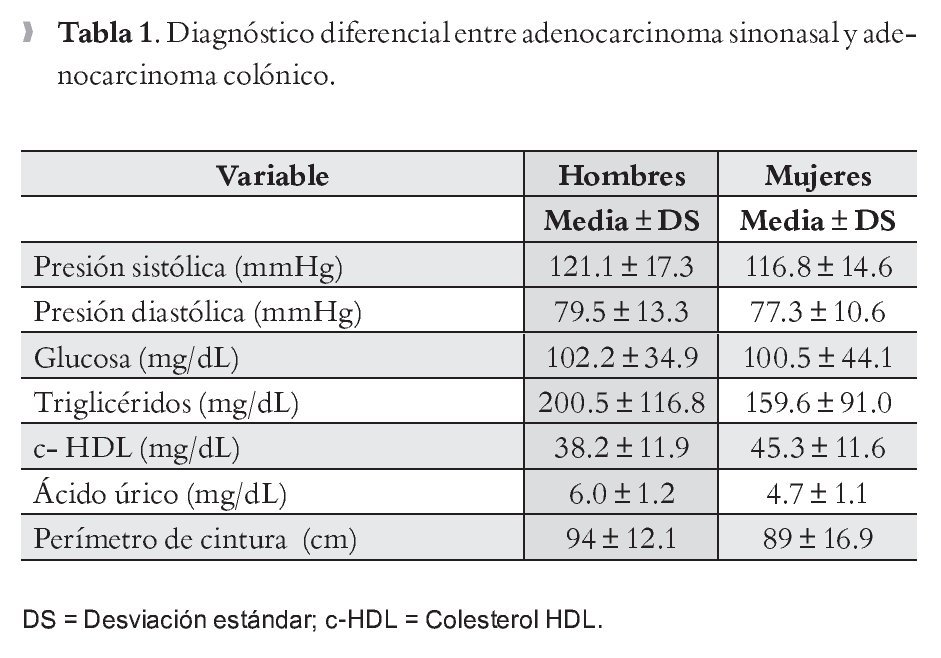
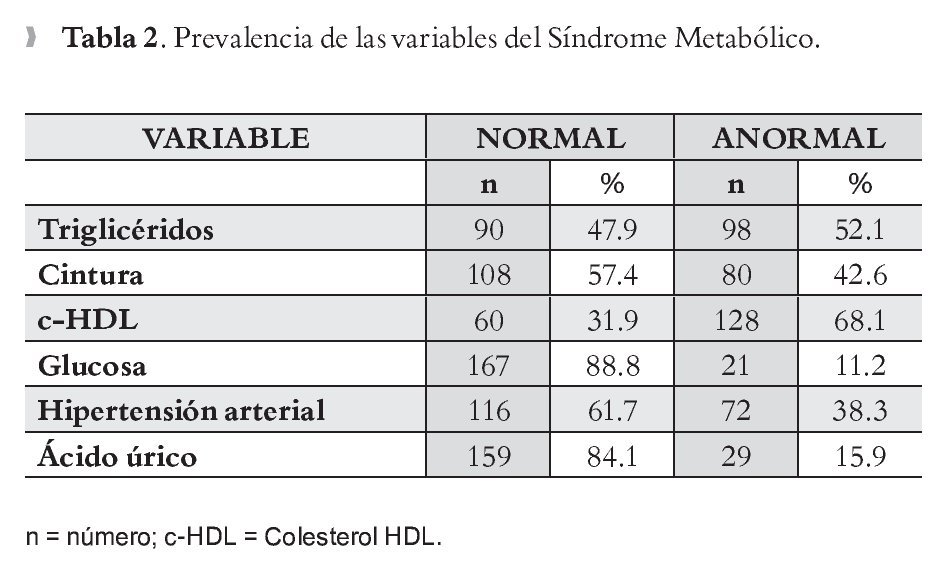
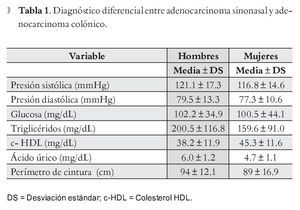
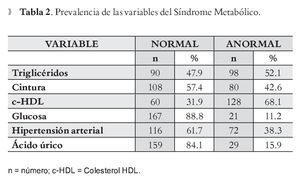
Se incluyó un total de 188 personas (mujeres 123, 65.4% y hombres 65, 34.6%), 53.2% tenían menos de 40 años. En la Tabla 1 se describen la media y desviación estándar (DS) así como el valor mínimo-máximo de cada una de las variables del SM en hombres y mujeres. En la Tabla 2 se muestra la prevalencia de las variables de SM, donde la alteración más frecuente fue parac-HDL (68.1%) y triglicéridos (52.1%), y la que registró menor anormalidad fue la glucosa (11.2%). La prevalencia de SM fue de 43.1% en el total de la muestra; para hombres de 52.3% en comparación con las mujeres 38.2% (p = 0.045); en cambio cuando se comparó la prevalencia de hiperuricemia entre hombres y mujeres no se observaron diferencias estadísticamente significativas (p <0.07) entre hombres (21.5%) y mujeres (15.4 %); aun cuando existe un ligero predominio en los hombres.
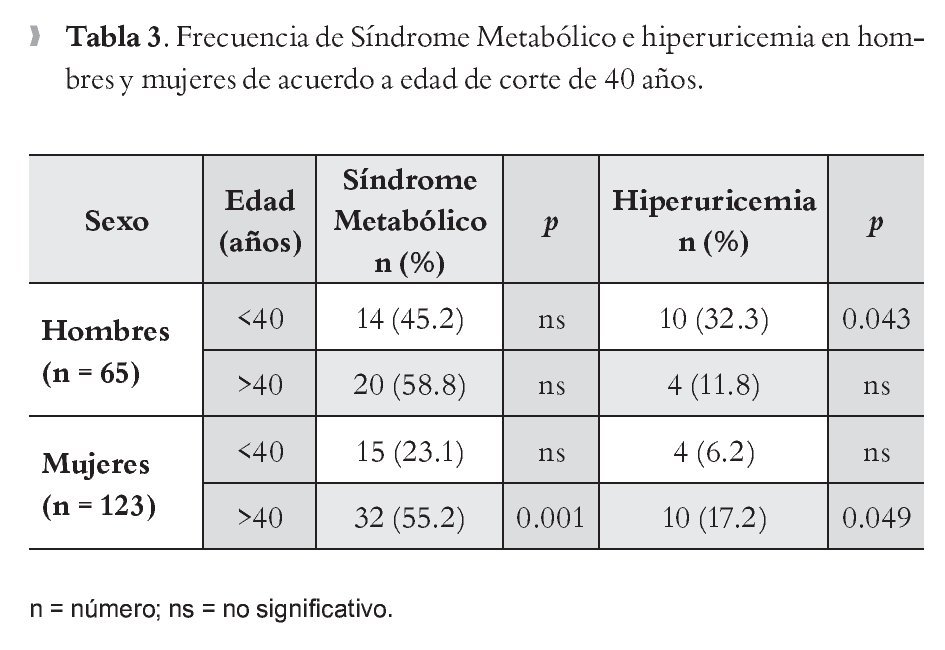
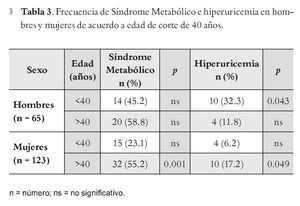
Se observó incremento en la prevalencia de SM en el grupo de pacientes con edad mayor de 40 años, con predominio en las mujeres (55.2%) (p <0.001). En ambos grupos (Tabla 3) se identificó que la frecuencia de hiperuricemia se modifica con respecto a la edad, en hombres es mayor en menores de 40 años (32.3 %), y en las mujeres es más frecuente en mayores de 40 años (17.2 %).
De acuerdo al análisis bivariado, la comparación entre las variables del SM con hiperuricemia en hombres, sólo se evidenció asociación estadísticamente significativa para triglicéridos y c-HDL (p = 0.043) para ambos factores; en el caso de mujeres sólo se observó asociación para triglicéridos y perímetro de cintura (p = 0.042 y 0.09, respectivamente).
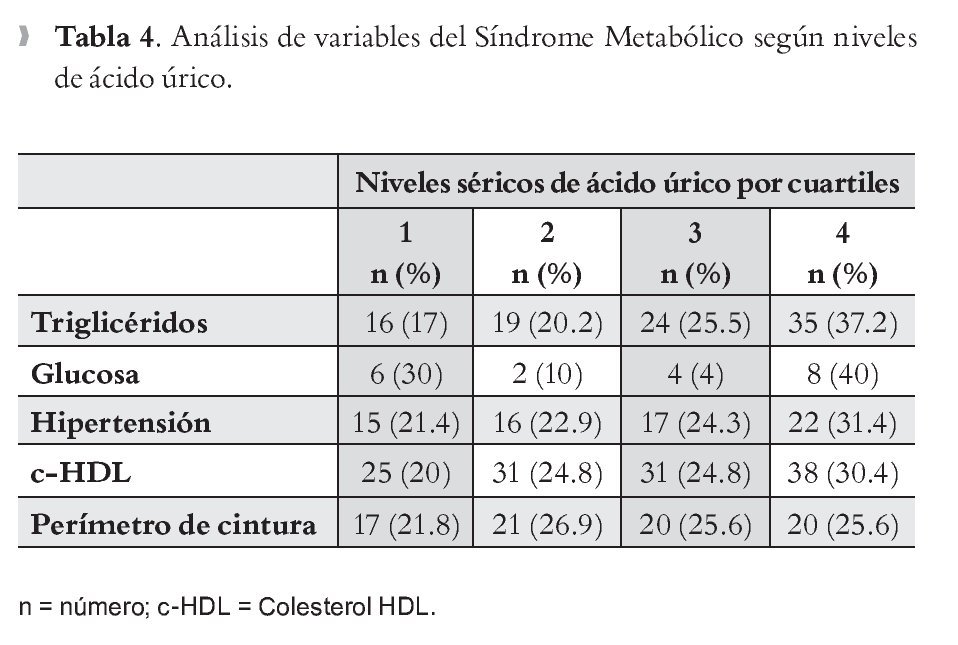
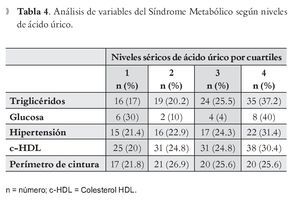
Se realizó el análisis de variables y su asociación con ácido úrico, fraccionando las concentraciones plasmáticas de éste último en cuartiles, para establecer que a mayor concentración de AUr, se modifican los parámetros que conforman el SM. En la Tabla 4, triglicéridos, hipertensión, c-HDL y PC, mostraron elevación proporcional a las cifras de AUr.
¿ Discusión
En estudios previos no realizados en México se ha demostrado la asociación de hiperuricemia con SM y se han especificado cuales son las principales variables que se asocian en forma proporcional aunque aún quedan incógnitas en cuanto al mecanismo fisiopatológico.8,13,14,
En los resultados de nuestro estudio se encontró una prevalencia de SM de 43.1% en hombres y 29.3% en mujeres, datos que no concuerdan con los resultados de la Encuesta Nacional de Salud y Nutrición 2006 (ENSANUT)20 en la que la prevalencia nacional de SM en adultos mayores de 20 años de edad, de acuerdo con los criterios del AHA/HLBI, fue de 41.6%, con predominio en las mujeres; la probable diferencia en nuestro trabajo es el tamaño de muestra.
Encontramos prevalencia de hiperuricemia de casi 16% de los pacientes estudiados. En México existen informes de prevalencia que van desde 2% a 8% de la población, pero generalmente hacen referencia al padecimiento de "gota" y no como tal a hiperuricemia; en nuestros resultados los hombres tuvieron valores medios significativamente más altos de AUr comparados con las mujeres, dato que se modifica cuando se establece la edad como variable, en tal situación se observa elevación del AUr con significancia estadística en hombres menores de 40 años y mujeres mayores de 40 años, datos que concuerdan con lo señalado en estudios en otras poblaciones, en los cuales se observa principalmente que a mayor edad en las mujeres existe incremento de los niveles de ácido úrico, así como mayor presencia de los componentes del SM, ésto relacionado con el estado posmenopáusico.8,21,22 En cuanto a los hombres, llama la atención y es un dato concordante con la bibliografía en que los hombres menores de 40 años, tienen niveles más altos de ácido úrico aunque no completen los criterios para diagnóstico de SM. En el estudio de Sui y colaboradores,8 observaron la misma situación, dato que concuerda con el considerar al AUr como uno de los componentes emergentes del SM y por lo cual se sugiere la introducción de este parámetro como criterio diagnóstico, no sin menospreciar la ya demostrada relevancia en cuanto a ser un factor de riesgo cardiovascular. De acuerdo con lo descrito en diferentes estudios, los pacientes con niveles de AUr que se encuentran en el cuarto cuartil presentan un riesgo para desarrollo de SM en hombres de 3.9 veces y para mujeres de dos veces.8,23-25 Esta observación coincide con nuestro resultado en el cual el incremento en los niveles de AUr fue proporcional principalmente con el incremento de colesterol y c-HDL en hombres y PC en mujeres.
Al hacer análisis de cuáles son los componentes del SM que se relacionan directamente con la presencia de niveles elevados de AUr, constatamos lo reportado en la bibliografía, observando relación directa con niveles de triglicéridos, c-HDL y PC, aunque en otros estudios también se señala la presencia de colesterol total.26-28 Datos que nos llevan a apoyar más aún la consideración del AUr como parte de los criterios diagnósticos de SM.
Cabe señalar que nuestro estudio tiene limitaciones de importancia, entre ellas el tamaño de la muestra, pero que al ser casos incidentales con SM e hiperuricemia que fueron pareados por edad, sexo y cada uno de los factores de SM, dan fortaleza al estudio.
¿ Conclusión
Los resultados del presente trabajo muestran mayor prevalencia del SM en hombres; sin embargo, ésta incrementa en mujeres mayores de 40 años, efecto relacionado probablemente con los cambios hormonales secundarios a la menopausia. Aunque el AUr no se relacionó con todos los componentes del SM, se observa principal correlación con triglicéridos, c-HDL y PC, observándose una correlación directa entre los niveles de éstos y los niveles de AUr. Lo cual hace de mayor relevancia su papel como factor de riesgo cardiovascular y más aún relacionado con factores de riesgo mayor como son la dislipidemia y la obesidad. Se requieren aún más estudios que demuestren en forma consistente esta asociación entre el AUr y las alteraciones metabólicas que conforman al SM, y tal vez así en un futuro poderlo considerarlo como parte de los criterios diagnósticos.
Correspondencia: Dr. Antonio González Chávez.
Dr. Balmis 148, Col. Doctores, Del. Cuauhtémoc, México D. F. 06726.
Teléfono: 2789 2000, ext: 1264.
Correo electrónico: antglez51@yahoo.com.mx.