Introducción: Son múltiples las indicaciones para el tratamiento de erradicación (TE) contra Helicobacter pylori (H. pylori). Los esquemas existentes presentan tasas de resistencia cada vez más altas.
Objetivo: Conocer las causas que motivan el TE y comparar los esquemas utilizados.
Material y métodos: Se revisaron expedientes de pacientes referidos por infección por H. pylori a Gastroenterología, entre enero del 2010 a enero del 2011. Se registraron datos demográficos, motivo por el que se indicó el TE, esquema empleado y duración del mismo, prueba de aliento posterior al tratamiento para confirmar la efectividad del mismo. Los datos se analizaron mediante estadística descriptiva y para comparar entre grupos se emplearon t de Student o U de Mann-Withney, ANOVA de una vía o prueba de Kruskall-Wallis, o ji cuadrada o prueba exacta de Fisher dependiendo del tipo de variable. Regresión logística para modelar la probabilidad de asociación entre falla a tratamiento y diversos factores.
Resultados: Las indicaciones más frecuentes de tratamiento fueron úlcera péptica (69.3%), metaplasia intestinal (10.7%) y gastritis folicular (9.8%). Se observaron tres esquemas de tratamiento: inhibidor de bomba de protones, claritromicina, amoxicilina (ICA) 66.3%; inhibidor de bomba de protones, levofloxacino, amoxicilina (ILA) 18.5%; e inhibidor de bomba de protones, metronidazol, amoxicilina (IMA) 15.1%.
Hubo efectividad similar entre ICA vs. ILA (p=1.0; RM=1.13; IC95%=0.30-4.22). La erradicación con ICA fue superior al comparar con IMA (p<0.001; RM=0.13; IC95%=0.05-0.31); así como ILA vs. IMA (p<0.001; RM=0.12; IC95%=0.03-0.47). El tratamiento < 10 días se asoció a falla en la erradicación (p<0.001; RM=26.0; IC95%=5.30-127.73).
Conclusiones: La úlcera péptica es la indicación más frecuente de TE. Los esquemas ICA e ILA son terapias aceptables. El diagnóstico que motiva el TE no influye en el éxito, pero si el esquema y duración del mismo.
Background: There are many indications for eradication therapy (ET) for Helicobacter pylori (H. pylori). Current therapeutic schemes show increasing resistance rates.
Objective: To find the indications for ET and compare the effectiveness of the different drug schemes used.
Material and methods: We reviewed the records of patients referred for H. pylori infection to The Gastroenterology Department of the Hospital General de México between January 2010 to January 2011. Demographics, indications for ET, scheme employed and duration, and results of breath test after therapy to confirm its effectiveness. Data were analyzed using descriptive statistics, comparison between groups with Student's t test or Mann-Whitney U, one-way ANOVA or Kruskal-Wallis test, or X2 or Fisher exact test depending on the type of variable. Logistic regression was performed to model the probability of association between therapeutic failure and several factors.
Results: Main indications for ET were peptic ulcer (69.3%), intestinal metaplasia (10.7%) and follicular gastritis (9.8%). Three drug plans were used: proton pump inhibitor, clarithromycin and amoxicillin (ICA) 66.3%; proton pump inhibitor, levofloxacin and amoxicillin (ILA) 18.5%; and proton pump inhibitor, metronidazole and amoxicillin (IMA) 15.1%.
There was similar effectiveness between ICA vs. ILA (OR 1.13; 95%CI=0.30-4.22; p=1.0). The ICA eradication was superior when compared with IMA (OR 0.13; 95%CI=0.05-0.31; p<0.001), and ILA vs. IMA (OR 0.12; 95%CI=0.03-0.47; p<0.001). Therapy < 10 days was associated with failure to eradicate (OR 26.0; 95%IC=5.30-127.73; p< 0.001).
Conclusions: Peptic ulcer is the most common indication for ET. ICA and ILA schemes are acceptable drug plans. The diagnosis that leads to eradication therapy does not influence treatment success, but scheme and duration do have influence.
Pagina nueva 1
¿ Introducción
Helicobacter pylori (H. pylori) es una bacteria Gram negativa, que se encuentra en la superficie luminal del epitelio gástrico, donde induce inflamación crónica de la mucosa subyacente.1
Se estima que al menos 50% de la población mundial está infectada por H. pylori.2 En México, una encuesta nacional que utilizó serología como método de escrutinio en población abierta, mostró una frecuencia global de 66%, incrementando a más de 80% en personas de 26 años o más.3
Diversos consensos y guías tanto nacionales como internacionales, recomiendan el tratamiento de erradicación (TE) en forma absoluta, en caso de úlcera péptica (UP), posterior a resección parcial por cáncer gástrico (CG), linfoma gástrico tipo B de la zona marginal (MALT), gastritis atrófica, metaplasia intestinal, pacientes con infección por H. pylori y antecedente de familiar de primer grado con CG, consumidores crónicos de inhibidores de bomba de protones (IBP), anemia ferropénica no explicable por otras causas, uso crónico de antiinflamatorios no esteroides (AINES) en pacientes con antecedente de UP y en casos de púrpura trombocitopénica idiopática e infección por H. pylori. Son indicaciones relativas para TE, el consumo crónico de AINES sin antecedente de UP y a petición expresa del paciente. El Consenso de Maastricht III, adicionalmente considera como indicación de TE, la dispepsia con evidencia de infección por H. pylori.3-6
Múltiples esquemas de TE han sido propuestos. Particularmente en México, la resistencia a metronidazol se ha reportado en hasta 80% de las cepas de H. pylori.7 Actualmente, la triple terapia a base de IBP más claritromicina y amoxicilina, es el esquema de erradicación de primera línea;3 sin embargo, algunos autores han reportado disminución en la efectividad de este esquema de TE, lo cual es atribuido a desarrollo de resistencia a claritromicina.8-14 Se recomienda que la tasa de resistencia a claritromicina no sea mayor a 20%, para poder mantener índices de erradicación mayores a 80%. En México, se ha estimado que la resistencia a claritromicina va de 8% a 25%;3 particularmente, un estudio reciente de Torres J y colaboradores estimó la resistencia a claritromicina en 24%.7 Publicaciones recientes han demostrado alta efectividad de TE a base de IBP, amoxicilina más levofloxacino, actualmente esquemas que incluyen quinolonas se recomiendan como alternativa de segunda línea o tratamiento de rescate.15-20
Los objetivos de este estudio fueron describir las causas principales que motivan el TE en pacientes con infección por H. pylori, y comparar la efectividad de tres esquemas de tratamiento que se identificaron en pacientes atendidos en la consulta de Gastroenterología del Hospital General de México.
¿ Material y métodos
Se realizó un estudio observacional, descriptivo, retrospectivo. Se solicitó autorización de las autoridades correspondientes para realizar la revisión de expedientes de pacientes atendidos en la consulta externa de Gastroenterología del Hospital General de México "Dr. Eduardo Liceaga". Se incluyeron aquellos con diagnóstico de infección por H. pylori, en el periodo comprendido de enero de 2010 a enero de 2011. Se excluyeron expedientes incompletos que carecían de datos demográficos del paciente (edad y sexo), que no especificaban el motivo por el cual se indicó el TE, cuál fue el esquema de TE empleado y la duración del mismo, y que carecían de prueba de aliento posterior al TE para confirmar la efectividad del mismo.
Procedimiento
Se revisaron datos demográficos (edad, sexo) de los pacientes referidos con diagnóstico de infección por H. pylori, cuál fue la indicación que motivó la prescripción del TE, cuál fue el esquema de TE indicado y por cuanto tiempo, así como apego del paciente al mismo, causas de descontinuación del TE por parte del paciente y si hubo efectos adversos relacionados o no con el TE, además verificación de la efectividad del TE mediante prueba confirmatoria de erradicación (prueba de aliento).
Definiciones operativas
• Infección por H. pylori: Se definió como caso positivo a pacientes con identificación de H. pylori a través de cualquiera de los siguientes estudios: en caso de haber existido indicación para realizar endoscopia, aquellos que cuenten con estudio endoscópico con toma de biopsia y resultado histopatológico confirmatorio. En caso de no existir indicación para realizar estudio endoscópico, aquellos pacientes que cuenten con prueba positiva de aliento.3
• Causa que motivo el TE: se consideró la referida en el expediente clínico por el médico tratante, y que fue el motivo por el cual el médico haya prescrito el TE.3
• Falla a tratamiento: Pacientes que posterior a cuatro a seis semanas al TE completo, presentaron prueba de aliento positiva o estudio histopatológico por toma de biopsia endoscópica, cuando ésta estuviera indicada, con presencia de H. pylori.
• Efecto adverso: cualquier reacción nociva no intencionada que aparece a dosis normalmente usadas en el ser humano para profilaxis, diagnóstico o tratamiento o para modificar funciones fisiológicas.21 Se consideró si venía referido por el médico tratante en el expediente clínico.
Análisis estadístico
Los datos se analizaron mediante estadística descriptiva; las frecuencias se expresaron en forma de porcentaje para las variables categóricas. Para evaluar el tipo de distribución de las variables continuas se utilizaron las pruebas de sesgo, curtosis y Kolmogorov-Smirnov. La frecuencia y dispersión en el caso de variables cuantitativas se expresó como media y desviación estándar (DE), o mediana y rango intercuartílico según correspondió. Para comparar entre grupos se emplearon t de Student o U de Mann-Withney, ANOVA de una vía o prueba de Kruskall-Wallis, o ji cuadrada o prueba exacta de Fisher, dependiendo del tipo de variable. Se empleó regresión logística para modelar la probabilidad de asociación entre falla a tratamiento y diversos factores. Se usaron los paquetes estadístico SPSS versión 19.0 y Epidat 3.1, se consideró estadísticamente significativo un valor de p<0.05 (dos colas).
¿ Resultados
Se encontraron 227 pacientes que fueron referidos con diagnóstico de infección por H. pylori documentada. De ellos, se excluyeron 22 pacientes por expediente incompleto. Se incluyeron en el análisis 205 pacientes, de los cuales 124 (60.5%) correspondieron al sexo femenino y 81 (39.5%) al sexo masculino. La media de edad fue de 42.7 años (DE + 13.9). Las indicaciones más frecuentes que motivaron la prescripción del TE se resumen en la Tabla 1.
Respecto al TE indicado, se identificaron tres esquemas; en todos ellos se empleó algún IBP a doble dosis, en caso de pantoprazol y omeprazol 20 mg cada 12 horas y en el caso de lanzoprazol 30 mg cada 12
horas. El más frecuente fue triple esquema con claritromicina 500 mg cada 12 horas más amoxicilina 1 g cada 12 horas más IBP a doble dosis (ICA); seguido de triple esquema a base de levofloxacino 500 mg cada 12 horas más amoxicilina 1 g cada 12 horas más IBP a doble dosis (ILA); y metronidazol 500 mg cada 12 horas más amoxicilina 1 g cada 12 horas más IBP a doble dosis (IMA) Tabla 2. En los casos que se emplearon esquemas de TE alternos (ILA, IMA) al tratamiento estándar (ICA), se detectaron las siguientes razones: intolerancia gastrointestinal a la combinación amoxicilina más claritromicina, alergia referida por el paciente a macrólidos, empleo como esquema alterno para retratamiento en caso de falla al tratamiento inicial (Tabla 3).
Respecto a la efectividad del TE contra H. pylori no se encontraron diferencias entre los esquemas de ICA y ILA (124, 91.2% vs. 35, 92.1%) (p=1.0; RM=1.13; IC95%=0.30-4.22). Sin embargo, se encontraron diferencias en cuanto a la efectividad de ICA con respecto a IMA (124, 91.2% vs. 18, 58.1%) (p<0.001; RM=0.13; IC95%=0.05-0.31); así como, en cuanto a la efectividad de ILA con respecto a IMA (35, 92.1% vs. 18, 58.1%) (p<0.001; RM=0.12; IC95%=0.03-0.47).
Respecto a la duración del tratamiento, del grupo que recibió ICA, 106 pacientes (77.9%) completaron 14 días de tratamiento y 30 (22.1%) recibieron tratamiento incompleto (< 10 días). En el grupo que recibió ILA, 28 pacientes (73.7%) completaron el esquema y 10 (26.3%) recibieron tratamiento incompleto. En el grupo que recibió IMA, 24 pacientes (77.4%) recibieron tratamiento completo y siete (22.6%) recibieron tratamiento incompleto. Cuando se evaluó si la duración del tratamiento influye en el éxito de erradicación postratamiento, encontramos que en los grupos que recibieron ICA y ILA, el tratamiento incompleto con duración < 10 días se asoció significativamente a la falla en la erradicación de H. pylori; así en el grupo que recibió ICA por 14 días, 104 (98.1%) lograron la erradicación vs. 20 (66.7%) de los que lo recibieron por menos de 10 días (p<0.001; RM=26.0; IC95%=5.30-127.73). En el grupo tratado con ILA por 14 días, 28 (100%) lograron la erradicación vs. siete (70%) de los que lo recibieron por menos de 10 días (p=0.01; RM=26.6; IC95%=1.23-573.25). En el grupo que recibió IMA, la duración del tratamiento no influyó en la efectividad de la erradicación; así, de los pacientes que recibieron el TE completo por 14 días, 15 pacientes (62.5%) lograron la erradicación, vs. tres (42.8%) de los que lo recibieron por menos de 10 días (p=0.41; RM=2.10; IC95%=0.42-10.53).
Los efectos adversos más frecuentes que presentaron los pacientes con los diferentes esquemas de tratamiento se resumen en la Tabla 4. Cuando se evaluó si la presencia de efectos adversos influyó en el éxito del TE, encontramos que estos se asociaron significativamente con la falla del TE en los grupos que recibieron ICA y ILA, pero no hubo relación entre efectos adversos y falla al TE en el grupo de IMA. Así, en el grupo de ICA, 97 pacientes (99%) de los que no presentaron ningún efecto adverso, lograron la erradicación vs. 27 (71%) de los que presentaron algún efecto adverso gastrointestinal (p<0.001; RM=27.19; IC95%=4.71-156.94). En el grupo de ILA, 31 pacientes (100%) de los que no presentaron ningún efecto adverso, lograron la erradicación, vs. cuatro (57.1%) de los que presentaron algún efecto adverso gastrointestinal (p=0.004; RM=49.0; IC95%=2.16-1113.53). En el grupo de IMA, nueve pacientes (56.3%) de los que no presentaron ningún efecto adverso, lograron la erradicación, vs. nueve (60%) de los que presentaron algún efecto adverso gastrointestinal (p=0.88; RM=0.87; IC95%=0.22-3.45).
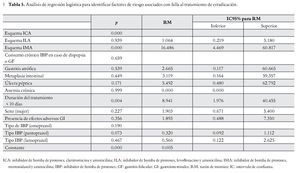
Para evaluar los principales factores asociados a falla en el TE, se consideraron al sexo, efectos adversos gastrointestinales, duración del TE, esquema de TE, tipo de IBP empleado, diagnóstico histopatológico, como variables independientes en el análisis de regresión logística multivariado. Encontramos que se asociaron positivamente como predictores de falla al TE, únicamente la duración y el esquema de TE empleado (Tabla 5).
¿ Discusión
La infección por H. pylori tiene una alta prevalencia en el mundo, principalmente en países en vías de desarrollo y conforme aumenta la edad. Torres J y colaboradores reportan una prevalencia de 70% en población mayor de 20 años de edad.22 Con respecto a las causas que motivaron el TE, nuestros resultados no difieren de lo indicado en guías tanto nacionales como internacionales, siendo la UP la indicación más frecuente. Aunque es bien sabido que la infección por H. pylori es un factor de riesgo para el desarrollo de UP, hay pocos estudios longitudinales donde se analiza su asociación. Un análisis transversal llevado a cabo en Alemania, que incluyó 9 953 adultos, entre 50-74 años, mostró que pacientes con cepas de H. pyloriCagA positivas presentaron un incremento en el riesgo de desarrollo de UP en 18.4 y 2.9 para úlcera duodenal y gástrica, respectivamente.23 La UP constituye el principal motivo por el cual se indica TE. En estudios recientes se ha planteado considerar otras entidades para indicar TE, se ha evidenciado que algunos tipos de gastritis como la gastritis nodular, gastritis hipertrófica, gastritis hemorrágica y la enfermedad de Menetrier, pueden tener un curso reversible tras la erradicación de H. pylori.24
Respecto al tipo de esquema utilizado para TE, se observó que el esquema que incluyó metronidazol presentó mayor riesgo de falla a tratamiento, comparado con los grupos que recibieron claritromicina o levofloxacino. En México, esto se puede explicar por la alta resistencia a metronidazol que existe. En el estudio de Torres J y colaboradores se encontró una resistencia a metronidazol de 76.9%, en cepas de H. pylori aisladas en niños y adultos mexicanos.7 Estos datos concuerdan con los hallazgos de otro estudio realizado en Asia, donde se han reportó resistencia a metronidazol en un 75.5%.25 El consenso de Maastricht III recomienda no utilizar metronidazol en países donde las tasas de resistencia sean mayores al 40%, aclarando que en el caso de metronidazol, la resistencia in vitro no necesariamente refleja la resistencia in vivo.4
El esquema ICA es actualmente la primera línea de tratamiento, siendo el que con más frecuencia se prescribió en los pacientes analizados en nuestro estudio. Por otro lado, cuando por alguna razón este esquema está contraindicado, o en regiones donde la resistencia a claritromicina es importante, el uso alternativo de quinolonas parece prometedor. Las quinolonas de nueva generación como levofloxacino y moxifloxacino, han probado ser eficaces en el tratamiento de erradicación como terapias de primera y segunda línea. Un estudio reciente comparó tres esquemas para la erradicación de H. pylori, en los que incluyó quinolonas como tratamiento de primera línea, todos los pacientes recibieron esomeprazol, además de antibióticos de la siguiente manera: levofloxacino-claritromicina (CLE), levofloxacinoamoxicilina (LAE) y claritromicina-amoxicilina (CAE), respectivamente, el TE se administró por siete días. En el análisis de intención a tratar, el porcentaje de erradicación fue significativamente mayor en los grupos que recibieron levofloxacino (CLE 90.6% y LAE 84.7%) en comparación con el grupo que no recibió quinolona (CAE 78.6%), no hubo diferencia en cuanto a los efectos adversos reportados en cada grupo.26
Otro ensayo clínico realizado en Taiwán, comparó levofloxacino contra claritromicina, en adición a lanzoprazol y amoxicilina, utilizados como esquemas de primera y segunda línea. Como primera línea de TE, el esquema a base de claritromicina resulto significativamente superior a levofloxacino. Sin embargo, en los pacientes que posterior a recibir el TE presentaron prueba de aliento positiva, se dio nuevamente TE de forma cruzada como tratamiento de segunda línea, en esta ocasión, el esquema que incluyó levofloxacino resultó superior. La tasa global de erradicación fue significativamente mayor en pacientes que recibieron claritromicina como primera línea, seguido de levofloxacino como segunda línea, comparado con el grupo que recibió levofloxacino como primera línea, seguido de claritromicina como segunda línea de tratamiento.27 Los resultados obtenidos en nuestro estudio no mostraron diferencias en relación a la efectividad del TE, entre los grupos que utilizaron esquema ICA y ILA. En términos generales, las quinolonas presentan tasas de resistencia bajas a nivel mundial. Sin embargo, presentan ciertos inconvenientes, como es su asociación a diarrea por Clostridium difficile. Los efectos adversos informados en nuestro estudio fueron predominantemente de tipo gastrointestinal, encabezado por los relacionados con náusea y vómito, no se detectaron efectos adversos mayores. Actualmente, sólo se recomienda su empleo como tratamiento de segunda línea.28-30
En el análisis de regresión logística para evaluar los factores que influyeron en la falla en el TE, encontramos que la duración del tratamiento menor a 10 días, se asocia a incremento en el riesgo de presentar falla en el TE. Esto ha sido demostrado en múltiples estudios en lo que se analizan los factores que influyen en la falla del TE, uno de los más destacables es el estudio de Karatapanis S y colaboradores, en el cual se incluyeron 307 pacientes que fueron aleatorizados a recibir TE con rabeprazol 20 mg más claritromicina 500 mg más amoxicilina 1 g con frecuencia de dos veces al día y duración de siete, 10 o 14 días, respectivamente; la efectividad del TE se valoró mediante CLO-test e histología. Las tasas de erradicación tanto en el análisis de intención a tratar como en el análisis por protocolo, fueron superiores a 80% en los grupos que recibieron TE por 10 y 14 días, no así en el grupo que recibió el TE por siete días. Los efectos adversos fueron similares en los tres grupos y en general, los fármacos fueron bien tolerados.31
Diversos ensayos han estudiado los factores que influyen en la falla del TE, dentro de los factores más importantes son la susceptibilidad bacteriana a los antibióticos, factores del hospedador, el hábito del tabaco, apego a tratamiento, la duración de la terapia y el vaciado gástrico. Los factores de virulencia de H. pylori (CagA y vacA), también juegan un papel importante en la lesión de la mucosa gástrica, desde la inducción de inflamación hasta la malignidad. Se sabe que las cepas CagA positivas expresan interleucina 8, siendo un potente quimiotáctico para los neutrófilos, así como estas cepas inducen mayor atrofia gástrica. Estos factores de virulencia son también un factor para el éxito de la erradicación, cuando se tiene cepas de H. pylori CagA negativo y genotipo vacA s2 se necesitarán dosis altas de inhibidores de la bomba de protones y/o antihistamínicos H2. Un meta-análisis que incluyó 14 estudios de todo el mundo, confirmó que la presencia de cepas de CagA positivo, es un predictor para el éxito en la erradicación de H. pylori.32-34
La principal limitante de nuestro estudio es que su carácter es retrospectivo. Para validar nuestros hallazgos respecto de la efectividad de los diferentes esquemas de TE evaluados, es necesario realizar ensayos clínicos prospectivos que además de evaluar la efectividad clínica, permitan simultáneamente establecer las tasas de resistencia a los antimicrobianos y su relación con la falla al TE.
¿ Conclusiones
La UP es la principal causa de indicación de tratamiento de erradicación en nuestro medio. Los esquemas de tratamiento que incluyen claritromicina o levofloxacino, junto con IBP y amoxicilina, son efectivos para la erradicación de H. pylori, sin embargo, en nuestro medio se requieren ensayos clínicos que validen nuestros hallazgos. El diagnóstico por el que se indica el TE, así como el tipo de IBP empleado no influyen en el éxito del tratamiento, sin embargo, si son factores determinantes del éxito terapéutico, el tipo de esquema antibiótico utilizado, así como, la duración del tratamiento. El metronidazol presenta elevada resistencia, por lo cual la tasa de erradicación es pobre en México y por tanto, no es recomendable.
¿ Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
¿ Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este estudio.
Correspondencia:
Dra. María de Fátima Higuera de la Tijera.
Hospital General de México "Dr. Eduardo Liceaga",
Servicio de Gastroenterología, Unidad 107.
Dr. Balmis N° 148, Colonia Doctores, Delegación Cuauhtémoc,
C.P. 06726, México D.F., México.
Teléfono: 2789 2000, ext. 1048.
Correo electrónico: fatimahiguera@hotmail.com