Las infecciones por hongos mucorales, con una incidencia en aumento tras las candidiasis y las aspergilosis, se caracterizan por la rápida invasión de los vasos sanguíneos y de otros órganos o estructuras adyacentes. Los mucorales suelen producir infección orbitorrinocerebral, pulmonar, cutánea, digestiva o diseminada, y su desarrollo se ve favorecido por ciertas enfermedades de base (diabetes, insuficiencia renal) o factores de riesgo (neutropenia, inmunosupresión, sobrecarga de hierro). Se asocian a una elevada mortalidad, superior al 40% en muchas series, y la clave de su curación reside en el diagnóstico y tratamiento antifúngico precoces, asociado este en la mayoría de los casos a un desbridamiento quirúrgico amplio y otras terapias adyuvantes. En la actualidad se dispone de guías internacionales, no solo locales, para el manejo de las mucormicosis, en las que el tratamiento de primera línea con anfotericina B liposomal a dosis altas es considerado, de forma consensuada y con una fuerte recomendación, como la mejor opción. Permanecen en debate abierto las opciones de tratamiento antifúngico combinado de los agentes polienos con triazoles o candinas.
Infections caused by mucorales, with an increasing incidence after candidiasis and aspergillosis, are characterized by the fast angioinvasion of blood vessels and invasion of neighboring organs or structures. Mucorales most commonly cause rhinocerebral, pulmonary, cutaneous, digestive or disseminated infections, and their spread is favored by certain underlying diseases (diabetes, kidney failure) and risk factors (neutropenia, immunosuppression, iron overload). These infections have a high mortality rate, over 40% in many series, and the key to their cure depends on both an early diagnosis and an antifungal treatment, associated in most cases with extensive surgical debridement and other adjunctive therapies. Currently, there are international guidelines, not only local ones, for the management of mucormycosis, in which it is considered by consensus and with a strong recommendation that first-line treatment with high-dose liposomal amphotericin B is the best choice. The combined antifungal treatment of polyene agents with triazoles or candins remains in open debate.
El término mucormicosis (antes zigomicosis) engloba un amplio espectro de infecciones oportunistas graves causadas por hongos que se reproducen sexualmente mediante zigosporas y que, morfológicamente, se caracterizan por presentar hifas hialinas, anchas y escasamente tabicadas. Aunque las infecciones por mucormicetos se conocen desde hace mucho tiempo, con descripciones publicadas a finales del siglo xix, el progresivo aumento de casos observado en las últimas décadas63 ha hecho que se renueve el interés que generan50. Actualmente son la tercera causa de infección fúngica invasiva (IFI), después de la candidiasis y la aspergilosis25. En nuestro medio las mucormicosis se presentan en nuevos grupos de riesgo, en los que la forma clínica clásica con afectación rinosinusal ligada a la cetoacidosis diabética (enfermos trasplantados, enfermos oncohematológicos, enfermos críticos, grandes quemados, consumidores de drogas)49 ha dejado paso a presentaciones clínicas más variadas. Asimismo, la literatura reciente refleja la más que justificada inquietud que generan dos puntos clave para reducir una morbimortalidad que puede aproximarse al 90%: la dificultad para lograr un diagnóstico precoz y su manejo terapéutico eficaz e inmediato en estas nuevas poblaciones tan complejas.
Desde hace ya unos años las mucormicosis se consideran entidades patológicas bien diferenciadas de las entomoftoromicosis, tanto por su comportamiento clínico y distribución ecológica como por la posición taxonómica de las especies que las ocasionan (tabla 1). Mientras las mucormicosis son causadas por hongos pertenecientes al filo Zygomycota, de amplia distribución y que se caracterizan por su tendencia a la angioinvasión, progresión rápida y por ser causantes de una alta mortalidad63, las entomoftoromicosis son propias de climas tropicales y subtropicales, y están causadas por hongos entomopatógenos encuadrados en el filo Zoopagomycota. Cuando estos hongos afectan al ser humano suelen producir infecciones subcutáneas crónicas que permanecen localizadas en el punto de inoculación. Esta revisión se dirigirá exclusivamente hacia las mucormicosis, que son las infecciones fúngicas que habitualmente afrontamos en nuestro entorno sanitario en salud humana.
Clasificación taxonómica de los agentes causales de mucormicosis (zigomicosis)
| Filo | Subfilo | Orden | Familia | Principales géneros patógenos para el ser humano |
|---|---|---|---|---|
| Zygomycota | Mucoromycotina | Mucorales | Mucoraceae | Absidia |
| Actinomucor | ||||
| Apophysomyces | ||||
| Chlamydoabsidia | ||||
| Mucor | ||||
| Rhizomucor | ||||
| Rhizopus | ||||
| Lichtheimiaceae | Lichtheimia | |||
| Thamnidiaceae | Cokeromyces | |||
| Cunninghamellaceae | Cunninghamella | |||
| Syncephalastraceae | Syncephalastrum | |||
| Radiomycetaceae | Apophysomyces | |||
| Saksenaea |
Adaptada de Hoog GS, Guarro J, Gene J, Ahmed SA, Al-Hatmi A, Figueras MJ, et al. Atlas of Clinical Fungi. The ultimate benchtool for diagnostics. 4th ed. Utrecht/Reus: Westerdijk Institute/Universitat Rovira i Virgili; 2019.
Aunque las esporangiosporas son las formas infectivas típicas de la mucormicosis, las hifas angioinvasivas son las causantes de la invasión tisular y de la diseminación en condiciones favorables de pH, concentración de hierro y defectos en la inmunidad celular47. La mayoría de las mucormicosis son esporádicas y se adquieren en la comunidad; sin embargo, infecciones nosocomiales y algunos seudobrotes hospitalarios han sido relacionados con vendajes, agujas o depresores linguales contaminados. Los factores de riesgo subyacentes más frecuentemente relacionados con el desarrollo de mucormicosis invasiva se enumeran en la tabla 2. Los mucorales suelen producir infección orbitorrinocerebral, pulmonar, cutánea, digestiva o diseminada, y su desarrollo se ve favorecido por ciertas enfermedades de base (diabetes mal controlada, insuficiencia renal crónica) o factores de riesgo (neutropenia, inmunosupresión, estados de sobrecarga de hierro, acidosis metabólica). Aproximadamente el 40-100% de los pacientes con enfermedades hematológicas malignas que desarrollan mucormicosis presentan neutropenia, que precede en un mínimo de 10 días a la infección47,49.
Relación entre las condiciones predisponentes y las formas clínicas de mucormicosis
| Factor predisponente | Lugar de la infección (en orden de frecuencia) |
|---|---|
| Diabetes/cetoacidosis diabética | Orbitorrinocerebral, broncopulmonar, cutánea |
| Neoplasia/neutropenia | Broncopulmonar, formas diseminadas, orbitosinusal |
| Trasplante de progenitores hematopoyéticos | Broncopulmonar, formas diseminadas y rinocerebrales |
| Trasplante de órgano sólido | Sinusal, cutánea, broncopulmonar |
| Corticoides | Pulmonar, rinocerebral y formas diseminadas |
| Terapia con desferroxiamina | Formas diseminadas, broncopulmonar |
| Malnutrición | Gastrointestinal, formas diseminadas |
| Consumo de drogas por vía parenteral | Cerebral, endocarditis, cutánea |
| Traumatismo, quemadura, catéter, punto de inyección, maceración cutánea | Cutánea, subcutánea y tejidos blandos |
| Sin condición subyacente | Cutánea, broncopulmonar, orbitorrinocerebral |
En un estudio epidemiológico francés sobre mucormicosis38, los pacientes oncohematológicos representaron el 50% de los casos, seguidos de pacientes con diabetes mellitus (23%) y traumatismos (18%). Los hongos mucorales también pueden causar IFI en adictos a drogas por vía parenteral debido a la parafernalia de la propia drogadicción. Además, en un número no despreciable de casos la mucormicosis cutánea o postraumática se desarrolla en pacientes sin enfermedad subyacente, o asociada a catástrofes naturales como tornados, inundaciones o tsunamis69. La epidemiología y manifestaciones clínicas de la mucormicosis han sido actualizadas recientemente en un metaanálisis que incluye 851 casos (periodo 2010-2017)29. La diabetes mellitus fue la comorbilidad subyacente más frecuente y un factor de riesgo independiente para la mucormicosis orbitorrinocerebral; la neoplasia hematológica se asoció a la infección diseminada y el trasplante de órgano sólido previo lo hizo con la localización pulmonar o la gastrointestinal29.
La verdadera incidencia de la mucormicosis invasiva no es conocida. Se vislumbra que la India es el país con la incidencia más alta de mucormicosis en todo el planeta, alcanzando los 140 casos por millón de habitantes. En los países occidentales esta incidencia, aunque parece haber ido en aumento en las últimas tres décadas, es notablemente inferior. Así, en estudios poblacionales en EE. UU. se estimó en 1,7 casos por 1.000.000 habitantes-año entre 1992 y 1993, lo que supone unos 500 casos por año48. En uno de los primeros estudios que incluyó un amplio número de pacientes, hasta el año 2003, el factor de riesgo más frecuente era la diabetes mellitus (36%), seguida de las hemopatías malignas (17%)55. En estudios posteriores, antes mencionados, las enfermedades hematológicas constituían ya el factor de riesgo más importante para la mucormicosis en la mitad de los episodios, seguidas de la diabetes y los traumatismos38. En los últimos años se ha descrito en Europa y América un incremento importante en la incidencia de esta enfermedad en grupos de enfermos en situaciones particulares, alcanzando un 8% en pacientes con leucemia, un 2-3% en receptores de trasplante de progenitores hematopoyéticos (TPH) y un 13% en pacientes oncológicos47,48. En un estudio poblacional de nuestro país (en 2005), la incidencia fue baja, cercana a 0,43 casos por 1.000.000 habitantes-año y de 0,62 casos por 100.000 ingresos67. En otro estudio español más reciente, con 557 pacientes sometidos a un trasplante alogénico, únicamente cinco presentaron una mucormicosis (0,89%)18.
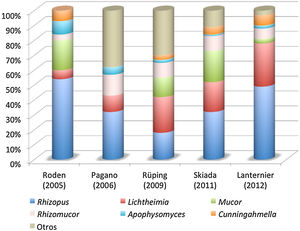
Agentes causalesEl orden Mucorales es muy extenso. Comprende 55 géneros y 260 especies, pero solo se ha descrito la implicación en enfermedad humana de unas 40 de estas especies, las cuales además presentan una frecuencia y distribución muy irregular. En la figura 1 se ilustra la distribución de las especies causales de mucormicosis en los últimos estudios epidemiológicos publicados.
Los mucormicetos son hongos cosmopolitas cuyo hábitat natural es el suelo, la madera y otros restos orgánicos48. Rhizopus arrhizus (nombre actualmente aceptado de Rhizopus oryzae) y Rhizopus microsporus son las especies que con más frecuencia se asocian a infecciones humanas en todo el mundo. Producen, sobre todo, infecciones rinocerebrales, orbitosinusales o pulmonares, secundarias a la inhalación de esporas, aunque también se han descrito infecciones locales por inoculación percutánea o del tracto digestivo por ingestión repetida de esporas53. El género Lichtheimia, en el que destaca la especie Lichtheimia corymbifera (antes Absidia corymbifera), es el segundo más frecuente después de Rhizopus y se ha asociado mayoritariamente a infecciones descritas en Europa. Se aísla habitualmente del suelo y detritus vegetales, y puede causar infecciones cerebrales, pulmonares o renales, así como infecciones cutáneas, previa inhalación o implantación traumática de las esporas. Cunninghamella bertholletiae es una especie cosmopolita aislada en el suelo y en materia orgánica animal y vegetal. Produce infecciones diseminadas, sobre todo en pacientes oncohematológicos, previa inhalación de sus esporas29,47. Saksenaea vasiformis se aísla en suelos tropicales y es causa de infecciones subcutáneas, óseas y diseminadas en esas latitudes. Afectan tanto a personas inmunodeprimidas como a inmunocompetentes.
Otras especies comúnmente recogidas en la literatura, como Apophysomyces variabilis, Mucor irregularis o Rhizopus homothallicus, son más propias del continente asiático. El resto de los mucormicetos implicados en enfermedad humana son menos frecuentes, por lo que resulta difícil asignarles un vínculo con regiones específicas. La verdadera implicación de las especies de mucormicetos en la infección humana, no obstante, es difícil de trazar a partir de lo publicado en la literatura debido, por una parte, a los cambios taxonómicos y de nomenclatura, y, por otro lado, a la identificación imprecisa o basada únicamente en la observación de características morfológicas que hoy sabemos que son equívocas e imprecisas.
Formas de presentación clínica y evoluciónComo se ha comentado, los mucormicetos son hongos saprófitos, ubicuos y ampliamente diseminados en la naturaleza y el entorno medioambiental48 que producen abundantes esporas que se dispersan con facilidad, pero solo causarán infección en condiciones favorables. Así, en huéspedes inmunocompetentes y sin otros factores de riesgo adicionales, la puerta de entrada es generalmente una disrupción de la barrera cutánea por traumatismo, lo que deriva en infecciones del tejido celular subcutáneo que pueden progresar rápidamente hacia planos profundos. En huéspedes con alteraciones inmunitarias, incluidas las causadas por la diabetes mellitus mal controlada, la puerta de entrada más habitual son los orificios del macizo facial, dando lugar a cuadros orbitorrinocerebrales que progresan velozmente hacia las estructuras intracraneales a través de planos contiguos, o bien desencadenan una enfermedad sinopulmonar, traqueobronquial o pleuropulmonar tras la inhalación de las esporangiosporas. Con menos frecuencia la exposición se puede producir por la ingesta de las esporas, lo que da lugar a formas digestivas53 que afectan a estómago, intestino delgado y colon en pacientes con un sistema inmunitario inmaduro (neonatos) o debilitado (malnutrición). Raramente las mucormicosis causan infecciones localizadas de forma aislada en órganos profundos sin afectación de otras regiones anatómicas ni evidencia de diseminación. Entre ellas cabe destacar las formas aisladas de sistema nervioso central, que se localizan preferentemente en los ganglios basales y que afectan fundamentalmente a varones jóvenes con historia de consumo de drogas por vía parenteral. O bien las formas nefrourológicas focales, causantes de infartos en el parénquima renal que se manifiestan como hematuria o pielonefritis refractaria a tratamiento antibacteriano, y que se han descrito en pacientes infectados por el VIH y en receptores de trasplante renal. Las distintas formas de presentación clínica de la mucormicosis y su localización anatómica se relacionan con ciertos factores de riesgo, cada uno de los cuales parece promover un tropismo predeterminado de asentamiento de la infección31, como se resume en la tabla 2. En el paciente oncohematológico o receptor de TPH, al coincidir varios de estos mismos factores simultáneamente, pueden presentarse formas especialmente diseminadas49,61.
En la mayor serie de pacientes (929 casos), antes comentada55, la distribución de formas clínicas fue la siguiente: sinusal 39%, pulmonar 24%, cutánea 19%, cerebral 9%, gastrointestinal 7%, diseminada 6% y una miscelánea de varias formas 6%. Sin embargo, la localización pulmonar fue la forma de presentación clínica más frecuente en los pacientes oncohematológicos (60%) y en los receptores de TPH (52%), a diferencia de aquellos con diabetes (16%). Las formas rinocerebrales, sinusales y orbitosinusales son menos frecuentes en los pacientes con neoplasias o trasplantados49,61.
La mortalidad global de los pacientes con mucormicosis es de aproximadamente el 40%, aunque en pacientes oncohematológicos supera el 60%45. La tasa de mortalidad varía según el género y la especie del hongo, la forma de presentación clínica, la enfermedad de base y su estadio clínico (descompensación metabólica, recurrencia o si es refractaria la neoplasia), el tipo y momento de la cirugía, y la extensión de la enfermedad26,49,61. La supervivencia depende del lugar de localización de la infección: 90% en las formas cutáneas aisladas, 87% en la sinusitis sin afectación cerebral, 45% en las formas rinocerebrales, 36% en las pulmonares, 33% en la enfermedad cerebral focal, 16% en las formas diseminadas y 10% en las gastrointestinales26,49. En series amplias, la mortalidad global de la mucormicosis cerebral en pacientes diabéticos es de un 46% pese al tratamiento neuroquirúrgico (practicado en el 91% de los episodios), con el 64% de las muertes en situación de cetoacidosis diabética9. En el reciente metaanálisis de Jeong et al. la mortalidad global fue del 46% (389/851 casos), siendo la mortalidad asociada a Cunninghamella significativamente más alta que la asociada a otros mucorales (71 vs. 44%; p<0,001)29. En una reciente serie española de 12 casos, la mortalidad global fue del 41%, elevándose al 71% en los casos de localización pulmonar y hasta el 100% en la enfermedad diseminada; ningún paciente con afectación únicamente musculoesquelética falleció70.
Diagnóstico clínico-micológicoLos requisitos para el diagnóstico son un alto índice de sospecha, el reconocimiento de los factores de riesgo y la rápida evaluación de la sintomatología clínica. La úlcera necrótica con escara negruzca (cutánea o mucosa) es la lesión característica de la mucormicosis y debe alertar sobre esta en todo paciente con factores de riesgo48,61. Para valorar la extensión de la lesión a tejidos adyacentes son útiles la tomografía computarizada y la resonancia magnética, que además permiten la identificación de trombos intravasculares y lesiones profundas en el sistema nervioso central. No obstante, ninguna de estas técnicas proporciona imágenes específicas de mucormicosis, aunque algunos autores proponen que el denominado «signo del halo inverso» o un recuento elevado del número de lesiones nodulares pulmonares (superior a 10) podría asociarse con mucormicosis, especialmente en pacientes oncohematológicos38,48. Con todo ello, el diagnóstico definitivo se basa en la observación microscópica y el aislamiento del agente causal mediante el cultivo microbiológico de las lesiones biopsiadas48,61. Su rapidez para invadir tejidos y diseminarse por los vasos sanguíneos (angioinvasión) a otros órganos y estructuras adyacentes o a distancia obliga a realizar una biopsia ante la mínima sospecha de cualquier lesión sospechosa y enviar urgentemente la muestra al laboratorio de microbiología para su examen microscópico directo y posterior cultivo micológico. Los mucorales son ubicuos y pueden contaminar los cultivos micológicos. Por lo tanto, su observación al microscopio en las biopsias de los tejidos infectados (hifas anchas, sin tabiques y ramificadas en ángulo recto) tiene un valor diagnóstico mucho mayor que su aislamiento en el cultivo. Sin embargo, el aislamiento es imprescindible para corroborar los hallazgos anatomopatológicos, conocer la identidad del agente etiológico y estudiar su sensibilidad in vitro a los antifúngicos47. A pesar de la gran angioinvasividad que caracteriza las infecciones por mucorales, los hemocultivos de los pacientes con mucormicosis son habitualmente negativos. Para mejorar el rendimiento de las muestras clínicas cultivadas en el laboratorio, estas se deben desmenuzar y cortar con un bisturí con sumo cuidado. No deben triturarse ni homogeneizarse, ya que al carecer sus hifas de septos los mucorales pierden viabilidad.
A diferencia de otras IFI no se han encontrado biomarcadores útiles que ayuden al diagnóstico de la mucormicosis. Los mucorales carecen tanto de galactomanano como de β-glucano en su pared celular, por lo que no pueden utilizarse como biomarcadores en las muestras clínicas de los pacientes con mucormicosis5. Actualmente se están evaluando métodos basados en técnicas de amplificación mediante PCR en tiempo real y de hibridación in situ empleando sondas de ADN específicas, además de técnicas proteómicas y metabolómicas, con resultados esperanzadores4,60. Las técnicas de PCR podrían llegar a ser claves en el diagnóstico, ya que las concentraciones de ácidos nucleicos detectables en sangre de pacientes con mucormicosis son más de 100 veces superiores a las que se encuentran en casos de aspergilosis. La capacidad para diagnosticar la mucormicosis depende de la disponibilidad de técnicas de imagen, de personal entrenado y de métodos de estudio micológicos e histológicos. El grado de evidencia y la fuerza de las recomendaciones asignados a cada metodología diagnóstica han quedado reflejados y valorados en las recientes guías internacionales sobre diagnóstico y manejo de las mucormicosis10. Si se dispone de varias o todas las opciones metodológicas de diagnóstico, se aconseja seguir los algoritmos de decisión que se incluyen en esta reciente guía.
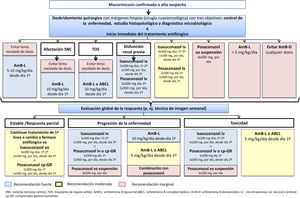
Manejo de la mucormicosisLos pacientes con una mucormicosis confirmada o bajo sospecha requieren de una rápida y contundente actuación multidisciplinar y deberían ser derivados inmediatamente a un centro con el más alto nivel de atención y experiencia en estas IFI. La mayoría de las recomendaciones de manejo de la mucormicosis se basaban hasta ahora en consensos de expertos, en estudios con escasa potencia o evidencia11,42,66, o en estudios con sesgo de selección geográfica, como era el caso de las diferentes guías europeas previamente disponibles (tabla 3). La principal novedad respecto a las revisiones de las últimas dos décadas sobre el manejo de las mucormicosis31,47,57,59,70 radica en la disponibilidad de una guía internacional para el diagnóstico y manejo de las mucormicosis, gracias a una iniciativa de la European Confederation of Medical Mycology en colaboración con el Mycoses Study Group Education and Research Consortium. El lema y objetivo de estas recomendaciones ha sido «One world, one guideline», sobrepasando las diferencias entre las distintas regiones del mundo10. En ella, la afirmación principal de los expertos de 33 países es clara y directa: «Ante la sospecha de mucormicosis se recomienda fuertemente llevar a cabo las técnicas de imagen apropiadas para documentar la extensión de la IFI y, seguidamente, considerar la opción de intervención quirúrgica; el tratamiento de primera línea con anfotericina B liposomal a dosis altas es fuertemente recomendado, mientras que el posaconazol (intravenoso o en comprimidos de liberación retardada) y el isavuconazol (intravenoso) tienen una recomendación de fuerza moderada (fig. 2). Ambos triazoles son recomendados más fuertemente como tratamientos de rescate»10.
Algoritmo de tratamiento óptimo de la mucormicosis en pacientes adultos en localizaciones geográficas con disponibilidad de todas las modalidades terapéuticas
| ECIL-666 | ESCMID*11 | Guías alemanas42 | |
|---|---|---|---|
| Tratamiento antifúngico+ cirugía+control causas subyacentes | AII | AIIu | |
| Antifúngico | |||
| • AmB-D | CII | DIu | (--) |
| • AmB- L | BII | AIIu | AII |
| • AmB-CL | BII | BIIu | BII |
| • AmB-DC | CII | (--) | (--) |
| • Posaconazol | CIII | BIIu | BII |
| • Terapia combinada | CIII | (--) | (--) |
| • AmB-L+ CAS | (--) | CIIIu | CIII |
| • AmB-L+ Posaconazol | (--)& | (--) | (--) |
| Control causas subyacentes | AII | ||
| Cirugía | AIIu | AII | |
| Órbito-rino-cerebral | AII | ||
| Tejido blando | AII | ||
| Pulmonar localizada | BIII | ||
| Infección diseminada | CIII | ||
| Oxígeno hiperbárico | CIII | ||
| Recomendación en contra del uso de deferasirox | AII | ||
| Tratamiento segunda línea | |||
| • Posaconazol | BII | AIIu | AII |
| • AmB-L | BIIu | BII | |
| • AmB-CL | BIIu | BII | |
| • AmB-L+CAS | BIII | ||
| • AmB-L+posaconazol | BIII |
ECIL-6: European Conference on Leukemia and Lymphoma; ESCMID: European Society of Clinical Microbiology and Infectious diseases; AmB: anfotericina B; AmB-L: anfotericina B liposomal; AmB-CL: anfotericina B complejo lipídico; AmB-DC: anfotericina B dispersión coloidal; CAS: caspofungina
Algoritmo de tratamiento óptimo de la mucormicosis en pacientes adultos en localizaciones geográficas con disponibilidad de todas las modalidades terapéuticas. Adaptada de Cornely et al.10.
La anfotericina B (AmB) se considera el fármaco de elección para el tratamiento primario de la mucormicosis. Su eficacia se ha demostrado en estudios in vitro e in vivo19. Aunque no se dispone de puntos de corte interpretativos para este fármaco antifúngico, se han observado valores de concentración mínima inhibitoria (CMI) elevados en aislamientos clínicos de especies de Cunninghamella14. Sin embargo, en un pequeño estudio de IFI por hongos filamentosos diferentes de Aspergillus, una CMI de 0,5 μg/ml de AmB se asoció con mejores resultados36. Las formulaciones lipídicas de AmB (AmB liposomal [AmB-L] y AmB complejo lipídico) tienen un mejor índice terapéutico que la AmB desoxicolato (AmB-D) y se consideran la terapia de primera línea de la mucormicosis11,58,59,66. Al igual que muchos agentes antifúngicos y micosis, la dosis óptima de AmB y sus formulaciones contra la mucormicosis no está definitivamente determinada10,57,59.
Actualmente, las formulaciones lipídicas de AmB son el pilar del tratamiento de las mucormicosis. Este tratamiento antifúngico es una columna básica en la estrategia de manejo de cualquier mucormicosis, donde otras opciones intervencionistas y quirúrgicas son complementarias y necesarias, además de una serie de terapias adyuvantes37. La terapia con AmB-L se ha asociado con tasas de mortalidad más bajas en comparación con otros regímenes antifúngicos y constituye un factor significativo asociado con la supervivencia en grandes cohortes46,62. Por otro lado, el potencial beneficio de administrar dosis altas de AmB-L (10 mg/kg) ha sido objeto de debate y no ha podido ser demostrado hasta ahora; sin embargo, las dosis altas se han asociado con una mayor incidencia de nefrotoxicidad39 y una mayor tasa de reacciones relacionadas con la perfusión. La experiencia con AmB complejo lipídico es más limitada, siendo comparativamente menos eficaz y peor tolerada por el enfermo37,62. Debido a su considerable toxicidad no se recomienda el empleo de AmB-D, aunque podría ser la única opción en países de recursos limitados10.
Entre los azoles con actividad in vitro frente a los mucorales, el posaconazol se ha utilizado principalmente como terapia de segunda línea en casos de enfermedad refractaria o de intolerancia a la AmB, con una tasa de éxito del 60%6. Su uso como tratamiento de primera línea está limitado por la biodisponibilidad variable de las suspensiones orales, aunque con la llegada de la nueva formulación intravenosa y los comprimidos gastrorresistentes más estables se alcanzan mayores y más sostenidas concentraciones. Por ello este fármaco se considera una opción para tratamientos prolongados tras un periodo inicial de inducción con AmB-L. En su ficha técnica el posaconazol está indicado en la profilaxis antifúngica en pacientes oncohematológicos de alto riesgo de IFI37. Sin embargo, su eficacia se ha demostrado especialmente en la prevención de la aspergilosis invasiva, y no tanto para evitar el desarrollo de IFI de brecha, normalmente causadas por especies de mucorales, Fusarium o Scedosporium. Tanto es así que los estudios informaron de un predominio de mucormicosis entre las IFI de brecha por hongos filamentosos estando bajo profilaxis con posaconazol2.
Más recientemente, el isavuconazol ha sido aprobado como tratamiento de primera línea para la mucormicosis con base en un ensayo abierto de rama única de tratamiento que mostró una tasa de supervivencia del 65% en el día 42 con este fármaco antifúngico, similar a la del grupo de controles tratados con formulaciones de AmB provenientes de un registro internacional40. La experiencia con isavuconazol para la profilaxis antifúngica es actualmente limitada y se han documentado mucormicosis progresivas, especialmente en el contexto de la leucemia refractaria con neutropenia persistente52. La correlación entre las CMI in vitro y la eficacia clínica sigue siendo una cuestión abierta respecto a los triazoles activos frente a los mucorales. A pesar de la ausencia de mecanismos conocidos de resistencia, los mucorales exhiben un amplio intervalo de CMI entre los distintos géneros y especies, tanto para posaconazol como para isavuconazol. Así, en algunas especies patógenas, como Mucor circinelloides, las CMI son más elevadas37,57. En modelos murinos de IFI por Rhizopus oryzae o M. circinelloides, el posaconazol mostró escasa eficacia independientemente de los valores de CMI37,57. Si bien no hay puntos de corte clínicos, los resultados de las pruebas de sensibilidad antifúngica recomiendan tener cierta precaución en el uso de cualquier triazol en monoterapia como tratamiento inicial de la mucormicosis, sobre todo en el caso de CMI elevadas. Para la AmB, las CMI se distribuyen en un intervalo más estrecho, con valores que rara vez superan los 4 μg/ml16. En un pequeño estudio retrospectivo, las CMI de 0,5 μg/ml para la AmB se asociaron con una mejor respuesta terapéutica36. Más importante aún, el inicio rápido del tratamiento con AmB fue crucial para el resultado, con una tasa de mortalidad dos veces mayor entre los pacientes con retraso de la terapia (en una media de 6 días desde el diagnóstico)7. Una máxima universal del tratamiento antifúngico es su inicio lo más precozmente posible ante cualquier IFI, pero especialmente para las mucormicosis.
No existe una duración estándar del tratamiento antifúngico para la mucormicosis. El tratamiento debe continuarse hasta la resolución de la semiología clínica, de los biomarcadores y de los signos radiológicos de la infección aguda, y si es posible, hasta la reversión de la causa condicionante de la inmunosupresión, hecho que implica una duración prolongada, a veces meses, del tratamiento57,59. Las formulaciones orales de posaconazol e isavuconazol tienen un papel importante en la transición del tratamiento intravenoso inicial de la mucormicosis a largo plazo. En pacientes seleccionados la tomografía por emisión de positrones/tomografía computarizada podría tener un papel en la distinción entre los signos radiológicos de una enfermedad activa y cicatrices inactivas, facilitando así la interrupción del tratamiento8,32.
Tratamiento antimicótico combinadoLos pobres resultados del tratamiento de la mucormicosis con las actuales monoterapias disponibles han promovido el interés en la terapia combinada65. A pesar de la falta de datos clínicos sólidos, la terapia de la mucormicosis en pacientes muy inmunodeprimidos con una combinación de fármacos antifúngicos se ha convertido en una práctica cada vez más común. Las ventajas de este enfoque terapéutico son el efecto sinérgico y una cobertura más amplia, y las desventajas, posibles antagonismos, interacciones farmacológicas, toxicidad y coste32,48,57,65.
Aunque las candinas por sí mismas no muestran una actividad antifúngica significativa contra los mucorales, pueden ofrecer en algunos casos y ante determinadas especies una actuación sinérgica con la AmB. Este efecto puede estar relacionado con una activación del sistema inmunitario. De hecho, aunque solo una pequeña cantidad de β-glucano está presente en la pared celular de los mucorales, las candinas pueden inducir la degradación y el desenmascaramiento de las moléculas de β-glucano, cuya exposición como epítopos inmunógenos puede activar los neutrófilos polimorfonucleares contra los hongos filamentosos35 y facilitar su fagocitosis37,59. Tanto Aspergillus como Rhizopus han mostrado su capacidad para desencadenar la producción de interleucina-23 por las células dendríticas después de la activación de la dectina-1 por el β-glucano desenmascarado. La sinergia entre la AmB (con ambas formulaciones lipídicas) y las candinas se describió por primera vez en modelos murinos de mucormicosis, con una mejor supervivencia en el grupo de terapia combinada en comparación con el tratamiento con solo AmB28. Sin embargo, son pocos los datos clínicos que apoyan el beneficio de esta combinación, la cual tal vez se limita a pacientes diabéticos54 y no a otros pacientes con inmunodeficiencias.
En un estudio retrospectivo entre pacientes diabéticos con mucormicosis rinoorbitaria o rinocerebral, la combinación de formulaciones lipídicas de AmB con una equinocandina (caspofungina) fue exitosa en seis de siete pacientes tratados, en comparación con solo siete de 22 pacientes tratados en monoterapia con AmB complejo lipídico (p=0,02)54. Sin embargo, en pacientes con neoplasias hematológicas, la combinación no parece tan eficaz, y en un estudio de 106 pacientes oncohematológicos con mucormicosis el tratamiento combinado no mostró ningún beneficio en comparación con la monoterapia con AmB23.
Los datos sobre la eficacia de la combinación de AmB con un triazol para el tratamiento de la mucormicosis son contradictorios. Se ha planteado el tratamiento combinado de AmB con posaconazol, dado que en estudios in vitro habían mostrado sinergia, pero en un modelo murino no se observó la superioridad o beneficio de esta combinación sobre las monoterapias. De manera similar, un estudio en ratones neutropénicos infectados con R. oryzae encontró que la combinación de AmB-D y posaconazol no prolongaba de manera significativa la supervivencia ni disminuía la carga fúngica en mayor medida que la monoterapia con AmB-D56. También existe una falta de evidencia clínica importante44, ya que los estudios en humanos son limitados19,23,37,57.
El beneficio potencial de cualquier combinación de fármacos antifúngicos para el tratamiento de la mucormicosis sigue siendo dudoso y dos grandes estudios retrospectivos de más de 100 casos no demostraron una mejora significativa en la supervivencia1,34. Los modestos datos preclínicos y clínicos existentes no apoyan el uso de la terapia combinada, con la posible excepción de la mucormicosis del sistema nervioso central, donde podría considerarse una combinación de AmB-L en dosis altas más posaconazol o isavuconazol.
Tratamiento quirúrgicoAdemás del inicio temprano de la terapia antifúngica, el desbridamiento quirúrgico es otra piedra angular en el tratamiento de la mucormicosis. En varios estudios la resección quirúrgica drástica, a veces mutiladora, se ha mostrado como un predictor significativo de mejor supervivencia38,57,60,62. La selección de pacientes es clave para mejorar los resultados, dado que las enfermedades subyacentes (neoplasias hematológicas, neutropenia y tumores activos), la edad, las comorbilidades, la localización y la extensión de la IFI son otros importantes factores asociados con la mortalidad34,38,57,60,62.
La resección quirúrgica de los tejidos necróticos y desvitalizados es el núcleo del tratamiento de muchas mucormicosis11,57,66. En la mucormicosis pulmonar se ha demostrado que la intervención quirúrgica junto con la terapia antifúngica adecuada mejora significativamente la supervivencia en comparación con la terapia antifúngica sola44,59. Los episodios de hemoptisis debidos a la cavitación de lesiones cerca de los vasos hiliares son una indicación de resección urgente de la lesión31. En ciertos casos de enfermedad localizada la cirugía puede ser curativa. En pacientes con mucormicosis rinoorbitaria, la resonancia magnética podría tener un papel en la evaluación y la estadificación de las lesiones17.
De manera similar, la extirpación quirúrgica de los tejidos infectados es de suma importancia en el tratamiento de la enfermedad orbitorrinocerebral19. Sin embargo, el efecto de la cirugía es difícil de valorar debido a los sesgos de selección. Se prefiere un abordaje endoscópico a la cirugía abierta en pacientes con enfermedad temprana limitada o con comorbilidades médicas importantes37,57,59. Aunque para enfermedades extensas las cirugías abiertas (maxilectomía, exenteración orbitaria y/o resección craneofacial) son las habituales, no se ha observado una mayor supervivencia con un enfoque tan radical, especialmente en pacientes con una esperanza de vida limitada59,65. En un estudio con 22 pacientes con mucormicosis orbitorrinocerebral que fueron sometidos a intervención quirúrgica, el control local de la enfermedad con desbridamiento quirúrgico amplio y repetido (realizado en el 45% de los pacientes) se asoció con mejores resultados (90 vs. 41,6% en los pacientes con cirugía limitada)68. Finalmente, en un estudio retrospectivo con 44 pacientes diagnosticados de neoplasia hematológica y/o TPH con sinusitis fúngica invasiva, debida a mucorales en 13 casos, la cirugía endoscópica temprana no mejoró el resultado general15.
Tratamientos adyuvantes y estrategias de futuroDebido a la eficacia limitada de los fármacos antifúngicos frente a los mucorales, se han propuesto diversas terapias adyuvantes para favorecer la actividad de los fármacos antifúngicos mediante su acción sobre las condiciones biológicas de infección en el huésped. Estos enfoques pueden consistir en: a) modulación del microambiente tisular (hipoxia, pH, hierro, glucosa o disponibilidad de nutrientes) en detrimento del hongo y/o en favor de la inmunidad del huésped, y b) estimulación inespecífica o mejora específica de la respuesta inmunitaria del huésped.
A pesar de la falta de actividad en modelos murinos, el uso de oxigenoterapia hiperbárica se ha utilizado de forma anecdótica en el tratamiento de la mucormicosis para combatir la hipoxia asociada con la necrosis tisular extensa11,30. Este enfoque parece ser más beneficioso en los pacientes diabéticos con cetoacidosis, ya que el entorno ácido contribuye al crecimiento fúngico30,48,57, pero podría no ser trasladable a los pacientes oncohematológicos o trasplantados sin acidosis metabólica.
Mantener la homeostasis del hierro es crucial para la supervivencia y la virulencia de los hongos en un entorno con baja disponibilidad de hierro, como el cuerpo humano. El quelante de hierro deferasirox fue eficaz en el tratamiento de la mucormicosis murina en ratones cetoacidóticos diabéticos37. Debido a que deferasirox mostró un efecto sinérgico con la AmB-L, esta combinación se probó en un pequeño ensayo controlado con placebo de pacientes neutropénicos y muy inmunodeprimidos64. Los pacientes tratados con deferasirox mostraron una mayor tasa de mortalidad en comparación con los tratados únicamente con AmB-L, pero también presentaban otros factores de mal pronóstico (neoplasia activa, neutropenia persistente, tratamiento con corticosteroides). Es posible que deferasirox sea más eficaz en el contexto de la cetoacidosis diabética, donde hay un exceso de hierro tisular libre27.
La diabetes mellitus descompensada con hiperglucemia y cetoacidosis son factores de riesgo bien conocidos de mucormicosis. La glucosilación de proteínas (por ejemplo, ferritina, transferrina) y las condiciones de pH alteradas pueden afectar el metabolismo del hierro. De hecho, los cuerpos cetónicos (β-hidroxibutirato), la glucosa y el hierro favorecen el crecimiento de los mucorales y también mejoran la expresión del receptor del huésped GRP78 de las células endoteliales, que facilitan la angioinvasión37. La hiperglucemia también se asocia con fusariosis invasiva en pacientes oncohematológicos. Por tanto, el control de la glucemia y la prevención de la sobrecarga de hierro siguen siendo medidas importantes en pacientes de riesgo con mucormicosis o fusariosis.
La reversión de la inmunosupresión es otro pilar importante del tratamiento de la mucormicosis. La calidad de la respuesta inmunitaria es crucial para la contención y resolución de las IFI. Por tanto, los pacientes con inmunosupresión por corticosteroides o con enfermedades autoinmunes deben reducir, si es posible, la dosis de estos fármacos a la mínima necesaria o pasar a una terapia alternativa no esteroidea37,57,59. Los pacientes con VIH/sida deben iniciar la terapia antirretroviral para restaurar su inmunidad y conseguir unos valores adecuados de linfocitos CD4+ que conlleven una aceptable reconstitución inmunitaria. Cualquier esfuerzo para revertir la neutropenia en pacientes oncohematológicos es clave. Debido a que la recuperación de neutrófilos es un factor de mejor pronóstico en la mucormicosis32,37,59, la estimulación de la respuesta del huésped con la administración de factores estimulantes del crecimiento hematopoyético de colonias de granulocitos/macrófagos o de colonias de granulocitos (GM-CSF o G-CSF) es recomendada ocasionalmente, pero su eficacia aún no se ha demostrado. La terapia adyuvante con G-CSF no ha mostrado ningún beneficio para el tratamiento de la mucormicosis murina en comparación con la monoterapia con posaconazol. Un estudio prospectivo no aleatorizado evidenció una buena eficacia de las transfusiones de granulocitos para el control o la prevención de la recurrencia de IFI en casos seleccionados43. Sin embargo, esta estrategia no mostró ningún beneficio para el tratamiento de la aspergilosis invasiva en un estudio clínico retrospectivo51. La adición de interferón-γ1b recombinante a las transfusiones de granulocitos tampoco ha mostrado beneficio. Sin embargo, una combinación de interferón-γ y nivolumab (anti-PD1) tuvo éxito para el tratamiento de la mucormicosis refractaria en un caso comunicado24. GM-CSF podría ser más potente que G-CSF, ya que su uso como terapia adyuvante tuvo éxito en una pequeña serie de casos de mucormicosis rinocerebral20.
Además de estas terapias adyuvantes se está investigando potenciar la respuesta inmunitaria del huésped dirigida selectivamente contra el patógeno fúngico41. Algunas nuevas estrategias utilizadas contra el cáncer, que se fundamentan en la bioingeniería de la respuesta T citotóxica modificada genéticamente mediante células ex vivo para expresar receptores de antígenos quiméricos específicos de CD19 contra tumores, también se pueden aplicar para el tratamiento de las IFI. Mediante el uso de la dectina-1 como receptor de reconocimiento de patrones se pueden generar estas células T para ser dirigidas específicamente hacia el componente β-glucano de los hongos33. Este enfoque ha sido eficaz para reducir la carga fúngica en modelos murinos de aspergilosis pulmonar y cutánea, y tal vez sea trasladable a las mucormicosis, si bien la presencia de β-glucano en la pared de los mucorales es mucho menor.
También se ha propuesto secuestrar el sistema inmunitario del huésped para la administración dirigida de fármacos. En esta línea, el posaconazol es un fármaco lipófilo que se acumula dentro de la membrana celular de las células humanas. La transfusión de leucocitos cargados ex vivo con posaconazol puede conseguir administrar concentraciones muy altas de fármaco directamente sobre las hifas, lo que se ha demostrado in vitro y en un modelo murino de aspergilosis invasiva3.
Otro enfoque específico es interrumpir la interacción entre el hongo y las células huésped. La patogenia de la mucormicosis se caracteriza por la angioinvasión tisular, e incluso las hifas fúngicas muertas pueden inducir daños vasculares. Los mucorales exhiben homólogos de la proteína de la cubierta de las esporas, que están ausentes en los hongos no invasivos22. La unión de los homólogos de la proteína de la cubierta de las esporas a la proteína 78 regulada por glucosa del endotelio humano permite la angioinvasión. El tratamiento con anticuerpos antihomólogos de la proteína de la cubierta de las esporas pudo prevenir la mucormicosis en ratones diabéticos cetoacidóticos21.
Por último, una mejor comprensión de los mecanismos de la inmunidad innata contra los hongos también puede aportar perspectivas interesantes para mejorar las estrategias preventivas. Se contempla para el futuro un enfoque individualizado de la profilaxis antifúngica con estratificación de los factores de riesgo de infecciones invasivas por estos hongos filamentosos basado en análisis genéticos. Varios polimorfismos de un solo nucleótido en los receptores de reconocimiento de patrones de las células inmunitarias del huésped, como el receptor Toll-like 4, la dectina-1 y la pentraxina-3, se han asociado con un mayor riesgo de aspergilosis invasiva12,13, aunque se desconoce su asociación con la mucormicosis y otras IFI por hongos filamentosos emergentes.
ConclusionesAunque en alza, las mucormicosis siguen siendo enfermedades fúngicas poco comunes que todavía se asocian con tasas de mortalidad muy elevadas a pesar de los avances en los procedimientos diagnósticos y terapéuticos. Estas infecciones deben manejarse con un enfoque multidisciplinar y transversal entre distintos niveles asistenciales. Además de la actividad inherente de los fármacos antimicóticos, el potencial de recuperación del sistema inmunitario del huésped y la evolución de la enfermedad médica subyacente son determinantes clave del pronóstico. La cirugía también juega un papel importante en algunas formas de presentación con localización o extensión especiales. El médico asistencial debe tener en cuenta que el resultado dependerá principalmente de estos factores no farmacológicos y solo estará modestamente influido por la elección del fármaco antifúngico. Por tanto, es el momento de incorporar un nuevo concepto de enfoque terapéutico antifúngico que incluya las interacciones dinámicas entre el fármaco, el propio hongo y el huésped, y considerar el sistema inmunológico del paciente como un aliado primordial que conviene utilizar para estrategias terapéuticas más eficientes y específicas.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesMS ha participado en asesorías o dictado conferencias en reuniones científicas promovidas por MSD, Pfizer, Gilead, Shionogi y Janssen. MTM declara no tener ningún conflicto de intereses en el momento presente.